Что такое гомогенная реакция что такое гетерогенная реакция
Классификация реакций
Существует несколько классификаций реакций, протекающих в неорганической и органической химии.
По характеру процесса
Так называют химические реакции, где из нескольких простых или сложных веществ получается одно сложное вещество. Примеры:
В результате реакции разложения сложное вещество распадается на несколько сложных или простых веществ. Примеры:
В ходе реакций замещения атом или группа атомов в молекуле замещаются на другой атом или группу атомов. Примеры:
К реакциям обмена относятся те, которые протекают без изменения степеней окисления и выражаются в обмене компонентов между веществами. Часто обмен происходит анионами/катионами:
AgF + NaCl = AgCl↓ + NaF
Окислительно-восстановительные реакции (ОВР)
Замечу, что окислителем и восстановителем могут являться только исходные вещества (а не продукты!) Окислитель всегда понижает свою СО, принимая электроны в процессе восстановления. Восстановитель всегда повышает свою СО, отдавая электроны в процессе окисления.
ОВР уравнивают методом электронного баланса, с которым мы подробно познакомимся в разделе «Решения задач».
Обратимые и необратимые реакции
Классическим примером обратимой реакции является синтез аммиака и реакция этерификации (из органической химии):
Необратимые реакции протекают только в одном направлении, до полного расходования одного из исходных веществ. Главное отличие их от обратимых реакций в том, что образовавшиеся продукты реакции не взаимодействуют между собой с образованием исходных веществ.
Примеры необратимых реакций:
NaOH + HCl = NaCl + H2O (образуется вода)
2Na + 2H2O = 2NaOH + H2 (сопровождается выделением большого количества тепла)
Реакции и агрегатное состояние фаз
Фазой в химии называют часть объема равновесной системы, однородную во всех своих точках по химическому составу и физическим свойствам и отделенную от других частей того же объема поверхностью раздела. Фаза бывает жидкой, твердой и газообразной.
К гетерогенным реакциям относятся следующие реакции (примеры): жидкость + газ, газ + твердое вещество, твердое вещество + жидкость. Примером такой реакции может послужить взаимодействие твердого цинка и раствора соляной кислоты:
К гомогенным реакциям относятся (примеры): жидкость + жидкость, газ + газ. Примером такой реакции может служить взаимодействие между растворами уксусной кислоты и едкого натра.
Реакции и их тепловой эффект
NaOH + HCl = NaCl + H2O + 56 кДж
К экзотермическим реакциям часто относятся реакции горения, соединения.
Исключением является взаимодействие азота и кислорода, при котором тепло поглощается:
Как уже было отмечено выше, если тепло выделяется во внешнюю среду, значит, система реагирующих веществ потеряло это тепло. Поэтому не должно казаться противоречием, что внутренняя энергия веществ в результате экзотермической реакции уменьшается.
Энтальпией называют (обозначение Н), количество термодинамической (тепловой) энергии, содержащееся в веществе. Иногда с целью «запутывания» в реакции вместо явного +Q при экзотермической реакции могут написать ΔH 0, так как внутренняя энергия веществ увеличивается. Например:
CaCO3 = CaO + CO2↑ ; ΔH > 0 (значит реакция эндотермическая, так как внутренняя энергия увеличивается)
Замечу, что не все реакции разложения являются эндотермическими. Широко известная реакция разложения дихромата аммония («вулканчик») является примером экзотермического разложения, при котором тепло выделяется.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
В химии существуют такие термины как гетерогенная реакция и гомогенная реакция. Для понимания этих явлений, нужно обратиться к значению слов.
«Гетерогенность» трактуется как разнородность по структуре. Гомогенные вещества наоборот составляют единое целое, то есть однородность.
Примером гетерогенной смеси является вода и жир, а раствор поваренной соли относится к гомогенному соединению.
Что такое гетерогенные реакции
Гетерогенными реакциями ученые называют взаимодействия разнородных составляющих, то есть находящихся в различных фазах.
где известняк (карбонат кальция) разлагается на оксид кальция и углекислый газ.
Другие примеры: восстановление оксидов металлов при помощи углерода или водорода:
Растворение в кислоте металла записана формулой:
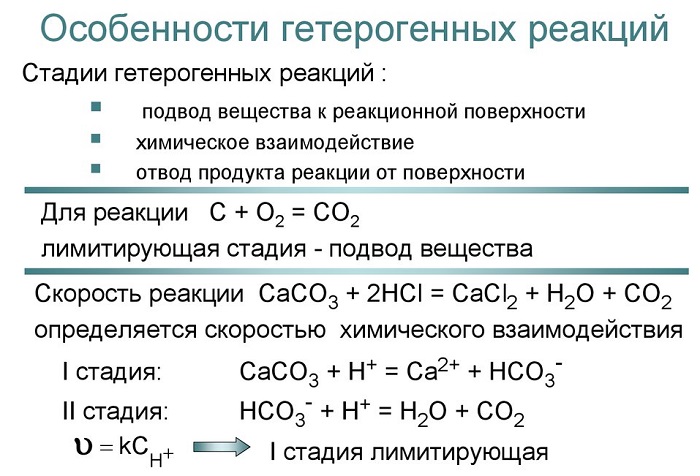
Для гетерогенных реакций характерным моментом является участие конденсированных фаз (то есть образований, которые, в зависимости от входящих в состав атомов или молекул, можно смоделировать разными способами).
Это создает трудности перемешивания и кинетики полученных продуктов. При этом возможно получение такого состояния, когда молекулы реагентов активируются на границе раздела фаз.
Одним из примеров гетерогенных процессов – разложение паров этилового спирта. Это первая реакция из органической химии, которая была изучена.
Как отличить гомогенную от гетерогенной реакции
Для гетерогенной реакции характерно следующее явление: реагенты, участвующие в процессе, состоят в разных фазах.
Это значит что в объеме, где находятся две или несколько фаз, взаимодействие протекает на границе раздела.
В гомогенном процессе вещества находятся в одной из фаз (жидкой, твердой либо газообразной), и зоной протекания служит весь объем.
Гетерогенные реакции, в зависимости от агрегатного состояния исходных веществ, бывают следующих типов:
Скорость гетерогенной реакции и влияющие на нее факторы
На скорость гетерогенных химических процессов влияют разные факторы.
Рассмотрим их подробнее.
Концентрация реагентов
С повышением концентрации веществ они сильнее взаимодействуют. Концентрированная кислота реагирует с цинком намного быстрее, чем разбавленная.
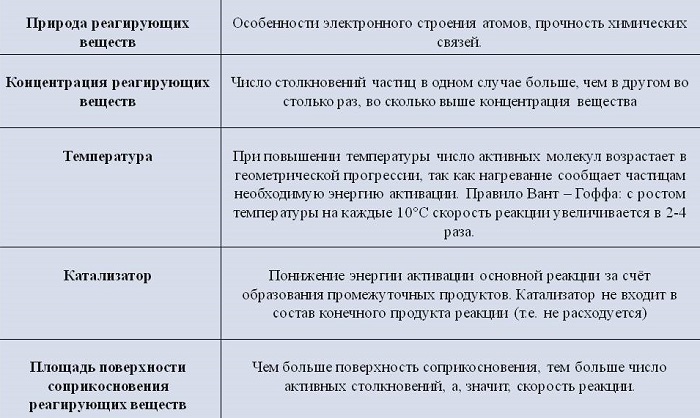
Природа реагирующих веществ
Скорость протекания химических процессов зависит от природы реагентов. По-другому можно сказать, что разные вещества взаимодействуют между собой с разной скоростью.
К примеру, цинк мгновенно вступает в реакцию с соляной кислотой, а железо будет реагировать с ней гораздо медленнее.
Увеличение поверхности реагентов повышает скорость гетерогенных реакций. Для этого твердые элементы измельчают. Пример: чтобы железо и сера вступили во взаимодействие, железо превращают в опилки.
Температура исходных веществ
Температура существенно повышает скорость реакции. Некоторые вещества при повышении температуры всего на 10 градусов начинают вступать в реакцию быстрее от 2 до 4 раз.
Наличие катализатора
Для повышения скорости протекания процессов применяют катализаторы. При этом они сами не расходуются.
Например, при добавлении оксида марганца происходит бурный распад перекиси водорода 2H2O2 = 2H2O + O2↑
Остающийся на дне оксид марганца можно использовать еще раз.
Ингибиторами называются вещества, которые, в отличие от катализаторов, замедляют скорость взаимодействия.
Катализаторами биологических процессов являются белки. Их еще называют энзимами.
Примеры решения задач
Задача 1
Твердый малорастворимый электролит, растворяясь, устанавливает равновесие:
По закону действующих масс, для этого состояния составляется уравнение, чтобы найти произведение растворимости (ПР):
Задача 2
Определить процессы, происходящие в растворе с ионами Cl, Br, J при добавлении катиона Ag.
Гетерогенные реакции — формулы, особенности протекания и примеры задач
В химии существуют такие термины как гетерогенная реакция и гомогенная реакция. Для понимания этих явлений, нужно обратиться к значению слов.
«Гетерогенность» трактуется как разнородность по структуре. Гомогенные вещества наоборот составляют единое целое, то есть однородность.
Примером гетерогенной смеси является вода и жир, а раствор поваренной соли относится к гомогенному соединению.
Что такое гетерогенные реакции
Гетерогенными реакциями ученые называют взаимодействия разнородных составляющих, то есть находящихся в различных фазах.
Термическое разложение солей на газообразные и твердые продукты — типичный пример гетерогенной реакции:
где известняк (карбонат кальция) разлагается на оксид кальция и углекислый газ.
Другие примеры: восстановление оксидов металлов при помощи углерода или водорода:
Растворение в кислоте металла записана формулой:
Для гетерогенных реакций характерным моментом является участие конденсированных фаз (то есть образований, которые, в зависимости от входящих в состав атомов или молекул, можно смоделировать разными способами).
Это создает трудности перемешивания и кинетики полученных продуктов. При этом возможно получение такого состояния, когда молекулы реагентов активируются на границе раздела фаз.
Одним из примеров гетерогенных процессов – разложение паров этилового спирта. Это первая реакция из органической химии, которая была изучена.
Как отличить гомогенную от гетерогенной реакции
Для гетерогенной реакции характерно следующее явление: реагенты, участвующие в процессе, состоят в разных фазах.
Это значит что в объеме, где находятся две или несколько фаз, взаимодействие протекает на границе раздела.
В гомогенном процессе вещества находятся в одной из фаз (жидкой, твердой либо газообразной), и зоной протекания служит весь объем.
Гетерогенные реакции, в зависимости от агрегатного состояния исходных веществ, бывают следующих типов:
Скорость гетерогенной реакции и влияющие на нее факторы
На скорость гетерогенных химических процессов влияют разные факторы.
Рассмотрим их подробнее.
Концентрация реагентов
С повышением концентрации веществ они сильнее взаимодействуют. Концентрированная кислота реагирует с цинком намного быстрее, чем разбавленная.
Природа реагирующих веществ
Скорость протекания химических процессов зависит от природы реагентов. По-другому можно сказать, что разные вещества взаимодействуют между собой с разной скоростью.
К примеру, цинк мгновенно вступает в реакцию с соляной кислотой, а железо будет реагировать с ней гораздо медленнее.
Увеличение поверхности реагентов повышает скорость гетерогенных реакций. Для этого твердые элементы измельчают. Пример: чтобы железо и сера вступили во взаимодействие, железо превращают в опилки.
Температура исходных веществ
Температура существенно повышает скорость реакции. Некоторые вещества при повышении температуры всего на 10 градусов начинают вступать в реакцию быстрее от 2 до 4 раз.
Наличие катализатора
Для повышения скорости протекания процессов применяют катализаторы. При этом они сами не расходуются.
Например, при добавлении оксида марганца происходит бурный распад перекиси водорода 2H2O2 = 2H2O + O2↑
Остающийся на дне оксид марганца можно использовать еще раз.
Ингибиторами называются вещества, которые, в отличие от катализаторов, замедляют скорость взаимодействия.
Катализаторами биологических процессов являются белки. Их еще называют энзимами.
Примеры решения задач
Задача 1
Твердый малорастворимый электролит, растворяясь, устанавливает равновесие:
По закону действующих масс, для этого состояния составляется уравнение, чтобы найти произведение растворимости (ПР):
ПР = [Са 2+ ] 3 [PO4 3- ] 2 / [Са3(РО4)2 ].
Задача 2
Определить процессы, происходящие в растворе с ионами Cl, Br, J при добавлении катиона Ag.
Урок 19 Бесплатно Скорость химической реакции
Понятие о скорости химической реакции
Химические реакции протекают с различными скоростями.
Конечно же, человек захотел иметь власть над этими процессами: ускорять и замедлять реакции, исходя из необходимости.
Ржавление железа протекает медленно, но с тех самых пор, когда человек открыл для себя железо, этот процесс хочется ещё более замедлить или вообще остановить.
В промышленности при производстве каких-либо полезных веществ человек стремится ускорить реакции, ведь чем быстрее они проходят, тем больше продукции вырабатывает производство.
Для контроля всех этих процессов нужно знать, от чего зависит скорость химических реакций и понимать, можно ли на эти процессы воздействовать и каким образом.
Количественной характеристикой быстроты течения химической реакции является её скорость.
О скорости химической реакции судят по изменению концентрации исходного вещества или продукта реакции в единицу времени.
Концентрацию вещества выражают числом молей в единице массы или объма: моль/л, моль/г, моль/кг.
По мере протекания реакции концентрации исходных веществ уменьшается, а концентрация продуктов реакции увеличивается.
Скорость реакции выражается в моль/л х сек.
Вместо литра может стоять грамм или килограмм, а вместо секунды – другая единица времени.
Пройти тест и получить оценку можно после входа или регистрации
Гомогенные и гетерогенные реакции
Характер взаимодействия веществ зависит от их агрегатного состояния.
По этому признаку различают гомогенные и гетерогенные химические реакции.
Гомогенными называют реакции, в которых отсутствует поверхность раздела между реагирующими веществами, то есть все вещества образуют однородную среду.
Такие реакции протекают во всём объёме.
Это реакции между газами, между жидкостями или протекающие в растворах.
Например, если химик сливает растворы йодида калия и нитрата серебра, происходит реакция обмена с образованием йодида серебра, который выпадает в осадок; причем осадок выпадает не на стенках сосуда и не на дне, а во всём объеме раствора.
Или, например, когда хозяйка печёт пироги, она добавляет в тесто дрожжи и соду, и тесто поднимается во всём объёме, а не только у краёв посуды.
Сгорание топливно-воздушной смеси в двигателе, горение природного газа, образование осадка при приготовлении бордосской смеси, образование озона во время грозы – всё это гомогенные химические реакции.
Гетерогенными называют реакции, в которых реагирующие вещества отделены друг от друга поверхностью раздела фаз: они протекают на поверхности соприкосновения твёрдого вещества и газа, твёрдого вещества и жидкости, двух твёрдых веществ или двух несмешивающихся жидкостей.
Примером таких реакций может служить горение твёрдого топлива, взаимодействие металлов с кислотами.
Так, взаимодействие цинка с соляной кислотой происходит только на поверхности металла:
Горение дров в костре, растворение накипи в чайнике под воздействием уксуса, образование ржавчины, осаждение металла при гальванопластике – всё это гетерогенные химические реакции.
Пройти тест и получить оценку можно после входа или регистрации
Условия, влияющие на скорость химической реакции
Чтобы управлять химической реакцией, надо знать условия, влияющие на скорость её протекания.
Это позволит замедлить скорость нежелательной реакции (например, ржавления железа, порчи пищевых продуктов) и увеличить скорость полезных для человека реакций (например, получение водорода, выплавка металла из руды).
Факторы, влияющие на скорость химической реакции:
Давайте поподробнее рассмотрим влияние этих факторов на скорость реакции.
1) Природа реагирующих веществ.
Например, скорость взаимодействия металлов с водой различна и зависит от активности металла.
Натрий бурно реагирует с водой, однако калий при контакте с водой ещё и воспламеняется, а рубидий взрывается.
В свою очередь, скорость взаимодействия одного и того же металла с разными веществами также зависит от природы этих веществ.
Натрий, который бурно реагирует с водой, с этиловым спиртом реагирует более спокойно.
2) Концентрация реагирующих веществ
Чтобы произошло взаимодействие, частицы (атомы, молекулы, ионы) реагирующих веществ должны столкнуться.
И чем больше столкновений происходит в единицу времени, тем быстрее протекает химическая реакция.
Гомогенные реакции протекают во всём объёме, и чем больше частиц в единице объёма, тем чаше они сталкиваются.
Следовательно, с повышением концентрации реагирующих веществ происходит увеличение скорости реакции.
Если реакция гетерогенная, то взаимодействие частиц происходит лишь на поверхности твёрдого вещества, поэтому в данном случае говорят не о концентрации, а о площади соприкосновения веществ.
По сути, это понятие аналогично концентрации, ведь чем больше площадь поверхности, тем больше частиц вещества способны вступить в реакцию.
Мелкие щепки горят в костре гораздо быстрее крупных поленьев.
Можно даже поставить «чистый» эксперимент: взять одинаковое количество (по массе) дерева, только в одном случае в виде мелких веток и щепок, а в другом в виде более крупных поленцев.
Мелкие щепки всё равно сгорят быстрее.
Происходит это именно из-за того, что в данном случае площадь поверхности дерева больше.
То же происходит и в лаборатории или в школьном кабинете химии: цинк или магний выпускают в виде маленьких гранул специально для того, чтобы скорость их взаимодействия с кислотами была больше.
3) Температура
С повышением температуры скорость химических реакций, как правило, возрастает, так как при нагревании реагирующие частицы становятся более активными и способными к взаимодействию.
Если нам нужно почистить чайник от накипи, то мы заливаем в него уксусную или лимонную кислоту и кипятим.
Можно, конечно, оставить чайник и так, но при нагревании накипь растворяется быстрее.
Экспериментально установлено, что при повышении температуры на каждые десять градусов скорость большинства реакций увеличивается в 2-4 раза.
Эту закономерность называют правилом Вант-Гоффа по имени голландского учёного, который впервые её сформулировал.
4) Действие катализаторов
Ещё алхимики заметили, что существуют такие вещества, при воздействии которых реакции идут намного быстрее.
Такие вещества называются катализаторами, а увеличение скорости реакции – катализ.
Важно то, что сам катализатор в реакции не участвует.
Природа катализа различна. Иногда катализатор служит концентратором, то есть «собирает» на себе реагенты, увеличивая концентрацию, как например, при разложении перекиси водорода: в обычном состоянии она разлагается очень медленно, а при добавлении к ней оксида марганца очень быстро с образованием большого количества пены.
Или при синтезе аммиака – скорость реакции увеличивается при введении в область реакции губчатой платины: она имеет очень неровную поверхность, которая, как активированный уголь, собирает на себе молекулы водорода и азота, увеличивая их концентрацию в несколько раз.
Иногда катализатор вступает в реакцию с одним из веществ, но в конце всей цепочки высвобождается в исходном виде.
Например, сухой хлор можно хранить в стальных баллонах длительное время.
Но если в хлоре есть примесь влаги, баллон может очень быстро разрушиться. Вода является катализатором взаимодействия хлора с железом. Сначала происходит реакция хлора и воды с образованием хлороводорода, который легко реагирует с железом:
Эти реакции происходят почти моментально, и поэтому образующийся атомарный кислород не успевает образовать двухатомные молекулы.
В итоге всю цепочку можно записать одной реакцией:
Большую часть продукции, вырабатываемой химической промышленностью, получают с использованием катализаторов.
Каталитическими являются процессы производства кислот, удобрений, резины, пластмасс, лекарств, процессы переработки нефти.
Особую роль играют биологические катализаторы – ферменты.
Они участвуют в сложных химических процессах, протекающих в живых организмах.
Слюна содержит фермент птиалин, который катализирует превращение крахмала в сахар, – переваривание пищи начинается уже во рту! Желудочный сок содержит пепсин, который катализирует расщепление белков.
В случае, когда у человека имеются серьезные нарушения пищеварения, ему прописывают медицинские препараты, содержащие пищеварительные ферменты.
В организме человека около 30 000 различных ферментов, каждый из них — катализатор какой-либо одной реакции.
5) Давление
Как правило, с повышением давления скорость химической реакции возрастает.
Пройти тест и получить оценку можно после входа или регистрации