Что такое гомогенная реакция в химии
Гомогенные реакции: описание и примеры
Для правильного проведения химических реакций важно знать, в каких условиях они протекают. Гомогенная среда реагентов позволяет определять скорость их взаимодействия. Существуют особые факторы, которые могут замедлять или ускорять гомогенные реакции.
Классификация
Химические взаимодействия можно разделить на разные группы, благодаря присутствию большого числа критериев.
Существуют следующие признаки:
Гомогенная среда
Это однородная система, в которой химические и физические характеристики компонентов в любой ее точке постоянны, а если они изменяются, то в непрерывном темпе, без проявления резких скачков. Все ее части не имеют поверхностного разделения. Так протекают гомогенные химические реакции.
Наличие нескольких реагентов в однородной фазе нельзя визуально определить или отделить их механическим способом. Такая особенность возможна благодаря равномерному распределению составных частиц одного компонента в другом.
К примерам однородных фаз следует отнести газовые смеси, замерзшую воду, растворы в жидкой или твердой форме.
Определение гомогенных взаимодействий
Их еще называют гомофазными реакциями. Это процессы, протекающие в области одной однородной среды, а реагирующие компоненты и получаемые продукты находятся в неизменном состоянии.
Гомогенные реакции имеют величины, которые остаются в одинаковых показателях, а если они меняются, то с непрерывной скоростью.
Когда процессы проходят в области разделения двух фаз, то их называют гетерогенными.
Если реакции многостадийные, то они могут быть смешанного типа. В них начальные этапы протекают в гомогенной среде, а конечные процессы в гетерогенной фазе. Такие взаимодействия чаще всего происходят в природе.
Гомогенные реакции, примеры уравнений
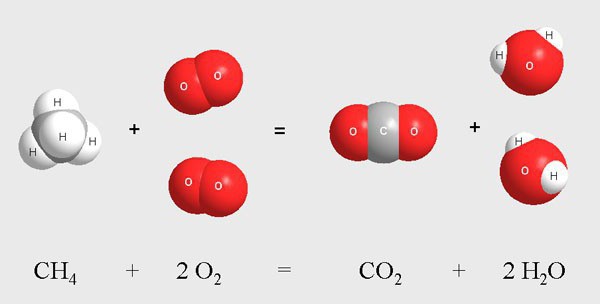
К ним относят процесс хлорирования молекул метана в газовой среде. Данная реакция протекает при высокой температуре или при воздействии ультрафиолета. В результате смешивания метана и хлора происходит поэтапное взаимодействие экзотермического типа.
Промежуточными продуктами являются газообразные вещества, к которым относят молекулы хлорметана, дихлорметана, трихлорметана, хлороводорода. Во время реакции происходит постепенное замещение атомов водорода в метане на атомы хлора. Конечным веществом служит четыреххлористый углерод.
Существуют и одноэтапные гомогенные реакции. Примеры таких взаимодействий указаны ниже.
К гомофазным процессам можно отнести:
Гомогенные реакции достаточно часто протекают в жидкой среде. К ним причисляют процессы галоидирования, расщепления всевозможных сложных соединений на более простые или на радикалы, замещение одних атомов другими по нуклеофильному или электрофильному типу, отщепление частей молекулы или их перегруппировка, удлинение цепочки за счет полимеризации, окислительное взаимодействие. В результате образуются жидкие продукты.
Скорость реакций гомогенных
Протекание того или иного процесса может занимать разные временные промежутки. Важной характеристикой такого взаимодействия является скорость гомогенной реакции. Представляет она числовую величину, которая определяет изменение концентрации любого реагента за временной промежуток.
Ее можно охарактеризовать по-другому: как значение, устанавливающее перемену количества взаимодействующего компонента в заданном объеме за определенное время. Главным условием является отсутствие изменения массы в системе.
При расчете скорости реакции в гомогенной среде (обозначают как Vi) используют убыль или прирост молярного количества реагирующего вещества (Ci) за определенное время (t). Существует специальная формула расчета:
Для химического процесса HCl + NaOH → NaCl + H2O быстроту протекания можно определить по уменьшению концентрации каждого реагента (соляной кислоты или натрия гидроксида) или по увеличению количества продуктов превращения (натрия хлорида или воды) за временной промежуток при постоянных температурных условиях.
Для определения скорости гомогенных реакций концентрацию берут в молях на литр, а время измеряют в секундах. Расчет производится следующим образом:
Vi = ± Ci / t = − [HCl] / t = − [NaOH] / t = [NaCl] / t = [H2O] / t.
Факторы, влияющие на скорость
Гомогенной является реакция, у которой быстрота протекания данного процесса прямо пропорциональна заданному веществу в единице объема. Чем больше молекул задействовано, тем быстрее осуществляется взаимодействие.
Основными факторами, влияющими на скорость процессов в однородной среде, являются концентрация реагентов и продуктов реакции, их химическая природа, температурные условия, давление в реакционном объеме, а также наличие ускорителей, катализирующих изменения.
Зависимость быстроты протекания реакций от нагревания была установлена ученым Вант-Гоффом. Согласно его утверждению, каждое температурное повышение на 10° увеличивает в гомогенных реакциях скорость в 2 или 4 раза. В более теплой среде молекулы начинают активнее двигаться, сталкиваться друг с другом, что приводит к их взаимодействию.
Гомогенные реакции со временем протекают с разной интенсивностью, поэтому их скорости могут быть истинными (в определенный момент) и средними, что следует учитывать при расчетах.
ГОМОГЕННЫЕ РЕАКЦИИ
Кинетич. особенности и механизм Г. р. определяются условиями взаимод. реагентов в данной фазе. Важный тип Г. р.-цепные реакции.
Смотреть что такое «ГОМОГЕННЫЕ РЕАКЦИИ» в других словарях:
ГОМОГЕННЫЕ РЕАКЦИИ — (от греч. «homogenes» однородный), химические реакции между веществами, находящимися в одной фазе. Параметры гомогенных реакций имеют одинаковые значения или изменяются непрерывно. Их скорость определяется изменением концентрации одного из… … Энциклопедический словарь
гомогенные реакции — – химические реакции, реализующиеся полностью в одной фазе. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
РЕАКЦИИ ХИМИЧЕСКИЕ — (от лат. re приставка, означающая обратное действие, и actio действие), превращения одних в в (исходных соед.) в другие (продукты р ции) при неизменяемости ядер атомов (в отличие от ядерных реакций). Исходные соединения в Р. х. иногда наз.… … Химическая энциклопедия
РЕАКЦИИ — (1) связей силы воздействия тел на точки механической системы, в которых стесняется свобода её движения. Р. связей возникают (согласно закону Ньютона) как пассивные силы противодействия при наличии активных сил, действующих на механические связи… … Большая политехническая энциклопедия
РЕАКЦИИ ХИМИЧЕСКИЕ — превращения одних веществ в другие, отличные по химическому составу и (или) строению. Характеризуются стехиометрическим соотношением участвующих в них веществ, степенью превращения, константами скорости и равновесия, энергией активации, тепловым… … Большой Энциклопедический словарь
Реакции химические — Химическая реакция превращение одного или нескольких исходных веществ (реагентов) в отличающиеся от них по химическому составу или строению вещества (продукты реакции). В отличие от ядерных реакций, при химических реакциях ядра атомов не меняются … Википедия
реакции химические — превращения одних веществ в другие, отличные по химическому составу и (или) строению. Характеризуются стехиометрическим соотношением участвующих в них веществ, степенью превращения, константами скорости и равновесия, энергией активации, тепловым… … Энциклопедический словарь
Реакции химические — превращения одних веществ в другие, отличные от исходных по химическому составу или строению. Общее число атомов каждого данного элемента, а также сами химические элементы, составляющие вещества, остаются в Р. х. неизмененными; этим Р. х … Большая советская энциклопедия
РЕАКЦИИ ХИМИЧЕСКИЕ — превращения одних в в в другие, отличные по хим. составу и (или) строению. Характеризуются стехиометрич. соотношением участвующих в них в в, степенью превращения, константами скорости и равновесия, энергией активации, тепловым эффектом. Р. х.… … Естествознание. Энциклопедический словарь
КАТАЛИТИЧЕСКИЕ РЕАКЦИИ — (от греч. «katalysis» разрушение), гомогенные (см. ГОМОГЕННЫЕ РЕАКЦИИ) и гетерогенные (см. ГЕТЕРОГЕННЫЕ РЕАКЦИИ) химические реакции, протекающие с участием катализатора (см. КАТАЛИЗАТОРЫ). В зависимости от положительного или отрицательного… … Энциклопедический словарь
Классификация реакций
Существует несколько классификаций реакций, протекающих в неорганической и органической химии.
По характеру процесса
Так называют химические реакции, где из нескольких простых или сложных веществ получается одно сложное вещество. Примеры:
В результате реакции разложения сложное вещество распадается на несколько сложных или простых веществ. Примеры:
В ходе реакций замещения атом или группа атомов в молекуле замещаются на другой атом или группу атомов. Примеры:
К реакциям обмена относятся те, которые протекают без изменения степеней окисления и выражаются в обмене компонентов между веществами. Часто обмен происходит анионами/катионами:
AgF + NaCl = AgCl↓ + NaF
Окислительно-восстановительные реакции (ОВР)
Замечу, что окислителем и восстановителем могут являться только исходные вещества (а не продукты!) Окислитель всегда понижает свою СО, принимая электроны в процессе восстановления. Восстановитель всегда повышает свою СО, отдавая электроны в процессе окисления.
ОВР уравнивают методом электронного баланса, с которым мы подробно познакомимся в разделе «Решения задач».
Обратимые и необратимые реакции
Классическим примером обратимой реакции является синтез аммиака и реакция этерификации (из органической химии):
Необратимые реакции протекают только в одном направлении, до полного расходования одного из исходных веществ. Главное отличие их от обратимых реакций в том, что образовавшиеся продукты реакции не взаимодействуют между собой с образованием исходных веществ.
Примеры необратимых реакций:
NaOH + HCl = NaCl + H2O (образуется вода)
2Na + 2H2O = 2NaOH + H2 (сопровождается выделением большого количества тепла)
Реакции и агрегатное состояние фаз
Фазой в химии называют часть объема равновесной системы, однородную во всех своих точках по химическому составу и физическим свойствам и отделенную от других частей того же объема поверхностью раздела. Фаза бывает жидкой, твердой и газообразной.
К гетерогенным реакциям относятся следующие реакции (примеры): жидкость + газ, газ + твердое вещество, твердое вещество + жидкость. Примером такой реакции может послужить взаимодействие твердого цинка и раствора соляной кислоты:
К гомогенным реакциям относятся (примеры): жидкость + жидкость, газ + газ. Примером такой реакции может служить взаимодействие между растворами уксусной кислоты и едкого натра.
Реакции и их тепловой эффект
NaOH + HCl = NaCl + H2O + 56 кДж
К экзотермическим реакциям часто относятся реакции горения, соединения.
Исключением является взаимодействие азота и кислорода, при котором тепло поглощается:
Как уже было отмечено выше, если тепло выделяется во внешнюю среду, значит, система реагирующих веществ потеряло это тепло. Поэтому не должно казаться противоречием, что внутренняя энергия веществ в результате экзотермической реакции уменьшается.
Энтальпией называют (обозначение Н), количество термодинамической (тепловой) энергии, содержащееся в веществе. Иногда с целью «запутывания» в реакции вместо явного +Q при экзотермической реакции могут написать ΔH 0, так как внутренняя энергия веществ увеличивается. Например:
CaCO3 = CaO + CO2↑ ; ΔH > 0 (значит реакция эндотермическая, так как внутренняя энергия увеличивается)
Замечу, что не все реакции разложения являются эндотермическими. Широко известная реакция разложения дихромата аммония («вулканчик») является примером экзотермического разложения, при котором тепло выделяется.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
ГОМОГЕННЫЕ РЕАКЦИИ
Смотреть что такое «ГОМОГЕННЫЕ РЕАКЦИИ» в других словарях:
гомогенные реакции — – химические реакции, реализующиеся полностью в одной фазе. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
ГОМОГЕННЫЕ РЕАКЦИИ — хим. р ции, протекающие полностью в одной фазе. Примеры Г. р. в газовой фазе: термич. разложение оксида азота 2N2O5 > 4NO2 + О 2; хлорирование метана СН 4 + С12 > СН 3 С1 + НС1; горение этана 2С 2 Н б + 7О 2 > 4СО 2 + 6Н 2 О; образование озона в… … Химическая энциклопедия
РЕАКЦИИ ХИМИЧЕСКИЕ — (от лат. re приставка, означающая обратное действие, и actio действие), превращения одних в в (исходных соед.) в другие (продукты р ции) при неизменяемости ядер атомов (в отличие от ядерных реакций). Исходные соединения в Р. х. иногда наз.… … Химическая энциклопедия
РЕАКЦИИ — (1) связей силы воздействия тел на точки механической системы, в которых стесняется свобода её движения. Р. связей возникают (согласно закону Ньютона) как пассивные силы противодействия при наличии активных сил, действующих на механические связи… … Большая политехническая энциклопедия
РЕАКЦИИ ХИМИЧЕСКИЕ — превращения одних веществ в другие, отличные по химическому составу и (или) строению. Характеризуются стехиометрическим соотношением участвующих в них веществ, степенью превращения, константами скорости и равновесия, энергией активации, тепловым… … Большой Энциклопедический словарь
Реакции химические — Химическая реакция превращение одного или нескольких исходных веществ (реагентов) в отличающиеся от них по химическому составу или строению вещества (продукты реакции). В отличие от ядерных реакций, при химических реакциях ядра атомов не меняются … Википедия
реакции химические — превращения одних веществ в другие, отличные по химическому составу и (или) строению. Характеризуются стехиометрическим соотношением участвующих в них веществ, степенью превращения, константами скорости и равновесия, энергией активации, тепловым… … Энциклопедический словарь
Реакции химические — превращения одних веществ в другие, отличные от исходных по химическому составу или строению. Общее число атомов каждого данного элемента, а также сами химические элементы, составляющие вещества, остаются в Р. х. неизмененными; этим Р. х … Большая советская энциклопедия
РЕАКЦИИ ХИМИЧЕСКИЕ — превращения одних в в в другие, отличные по хим. составу и (или) строению. Характеризуются стехиометрич. соотношением участвующих в них в в, степенью превращения, константами скорости и равновесия, энергией активации, тепловым эффектом. Р. х.… … Естествознание. Энциклопедический словарь
КАТАЛИТИЧЕСКИЕ РЕАКЦИИ — (от греч. «katalysis» разрушение), гомогенные (см. ГОМОГЕННЫЕ РЕАКЦИИ) и гетерогенные (см. ГЕТЕРОГЕННЫЕ РЕАКЦИИ) химические реакции, протекающие с участием катализатора (см. КАТАЛИЗАТОРЫ). В зависимости от положительного или отрицательного… … Энциклопедический словарь
Что такое гомогенная реакция в химии
§9.5 Реакции гомогенные и гетерогенные. Факторы, влияющие на скорость химической реакции.
Кинетические уравнения, рассмотренные в предыдущем параграфе, справедливы только для гомогенных реакций, т.е. для таких реакций, которые идут в какой-нибудь одной фазе – газовой или жидкой. Например, это могут быть реакции между двумя газами, либо реакции, протекающие при сливании растворов:
NaOH(р-р) + HCl(р-р) = NaCl(р-р) + H2O.
Но существует и множество других реакций, происходящих на границах раздела фаз – между газообразным веществом и раствором, между раствором и твердым веществом, между твердым и газообразным веществами. Такие реакции называются гетерогенными. В качестве типичного примера гетерогенной реакции рассмотрим лабораторный метод получения водорода из металлического цинка и разбавленной серной кислоты:
Рис. 9-11. Разная скорость реакции в опытах с одной крупной или несколькими мелкими гранулами цинка в серной кислоте.
Цинк в виде гранул (кусочки металла неправильной формы и разной величины) помещают в разбавленный раствор серной кислоты и собирают выделяющийся газообразный водород. В пробирке с одной крупной гранулой реакция идет заметно медленнее (рис. 9-11). При одинаковой массе цинка в пробирках количество выделившегося водорода в обоих опытах будет одинаковым, но в пробирке с мелкими гранулами реакция закончится быстрее. Причина в том, что реакция между цинком и раствором серной кислоты идет только на поверхности контакта гранул с раствором (граница раздела фаз), а общая поверхность у нескольких мелких гранул больше, чем у одной крупной гранулы той же массы. Цинк в виде порошка для этой реакции использовать просто опасно – реакция начинает идти настолько быстро, что смесь выплескивается из пробирки.
Для такой гетерогенной реакции уже нельзя записать кинетическое уравнение вида:
** Но и такое уравнение не сможет достаточно хорошо описывать скорость нашей реакции. Во-первых, в ходе реакции гранулы постепенно уменьшаются в размерах, площадь их поверхности меняется и константа скорости реакции k уже не может учитывать это изменение. Если использовать гранулы из очень чистого цинка, то к ним «прилипает» образующийся водород (как это ни удивительно) и площадь контакта реагентов меняется непредсказуемо. Во-вторых, на поверхности раздела фаз концентрация серной кислоты совсем не такая, как в верхних слоях раствора. В зоне реакции активно образуется раствор соли ZnSO4, который вытесняет раствор серной кислоты с поверхности гранул.
Итак, мы видим, что в общем случае скорость гетерогенной реакции зависит от:
а) скорости подвода реагентов к границе раздела фаз;
б) скорости реакции на поверхности раздела фаз, которая зависит от площади этой поверхности;
в) скорости отвода продуктов реакции от границы раздела фаз.
Стадии (а) и (в) называются диффузионными, (см. словарь терминов) а стадия (б) – кинетической. Та стадия, которая протекает наиболее медленно, называется лимитирующей – именно она определяет скорость реакции в целом.
Универсального выражения для скорости гетерогенных реакций не существует, поскольку каждая из стадий (а-в) при определенных условиях может быть лимитирующей. Но в некоторых случаях, когда диффузионные стадии заведомо не являются лимитирующими из-за активного перемешивания реагентов, а площадь поверхности раздела фаз меняется медленно, можно экспериментально получить кинетические уравнения типа (2), удовлетворительно описывающие протекание гетерогенных реакций. Это имеет важное значение для химического производства, где большинство используемых реакций – гетерогенные.
Когда на экзамене абитуриента просят перечислить факторы, влияющие на скорость химической реакции, то обычно ожидают такого ответа:
— природа реагирующих веществ,
— концентрация реагентов,
— температура,
— наличие катализатора.
** На самом деле этот перечень шире: мы уже знаем, что на скорость гетерогенных реакций сильное влияние оказывает площадь поверхности раздела фаз и диффузия. Однако полезно обобщить перечисленные выше четыре фактора, понимая при этом, что они имеют отношение главным образом к гомогенным реакциям.
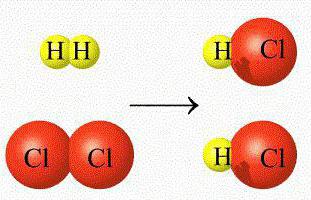
Под влиянием природы реагирующих веществ обычно подразумевают то простое обстоятельство, что разные вещества реагируют по-разному. Это тривиальное наблюдение можно сделать более ценным, если анализировать примеры разной реакционной способности сходных по строению веществ в однотипных реакциях. Например, реакция газообразного иодистого водорода с кислородом при комнатной температуре идет с заметной скоростью:
Аналогичная реакция газообразных HCl и O2 с образованием хлора и воды при комнатной температуре идет очень медленно. Обе реакции – окислительно-восстановительные и для их протекания атом галогена в молекулах HCl или HI должен передать электрон кислороду (убедитесь в этом, расставив степени окисления над атомами в уравнении реакции). Иод в молекуле HI – более подходящий донор электрона, т.к. его валентная оболочка находится существенно дальше от ядра, чем у атома хлора в молекуле HCl. Таким образом, знание электронного строения атомов и молекул реагирующих веществ часто позволяет качественно оценить относительные скорости некоторых реакций. Также под природой реагирующих веществ иногда могут подразумевать степень их раздробленности в гетерогенных реакциях.
Влияние концентрации реагентов на скорость реакций мы уже достаточно подробно обсудили – кинетические уравнения количественно учитывают этот фактор.
Что касается влияния температуры, то этот фактор действует одинаково как на скорость реакции v, так и на константу скорости k – обе эти величины быстро возрастают с повышением температуры. Полезно рассмотреть влияние температуры именно на константу скорости – в этом случае нашу задачу не осложняют постоянно меняющиеся в ходе реакции концентрации реагирующих веществ.
Еще в XIX веке голландский физикохимик Вант-Гофф опытным путем обнаружил, что при повышении температуры на 10 о С скорости многих реакций возрастают в 2-4 раза. На языке химической кинетики правило Вант-Гоффа можно выразить следующим соотношением:
Температурные коэффициенты используют главным образом в учебной литературе – для нужд химической кинетики они мало пригодны, поскольку не сохраняют строго постоянных значений в разных интервалах температур. Но нам с вами температурные коэффициенты позволят наглядно разобраться в характере зависимости скорости реакции от температуры. Эта зависимость нелинейная, т.е. скорость реакции возрастает гораздо быстрее, чем температура.
Где n – число 10-градусных интервалов в заданном интервале повышения температуры. В нашем примере при повышении температуры от 50 о до 100 о таких интервалов 5. При этом мгновенная скорость реакции и константа скорости реакции возрастут примерно в 595 раз:
** Правило Вант-Гоффа используется для приближенной оценки изменения константы скорости реакции при повышении или понижении температуры. Более точное соотношение между константой скорости и температурой установил шведский химик Сванте Аррениус:
Здесь k – константа скорости, e – важное в математике число (равное приблизительно 2,71 и возникающее во многих математических преобразованиях), R – газовая постоянная, T – абсолютная температура в Кельвинах (об R и T см. в §5.6 книги 1), Ea – энергия активации. Еще одна постоянная А – «константа Аррениуса» или «предэкспонента» определяется для каждой конкретной реакции и имеет ту же размерность, что и константа скорости k.
Многие наши читатели пока не знакомы с логарифмами, поэтому здесь мы не будем приводить способ решения такого уравнения. Для нас сейчас важен общий нелинейный характер зависимости константы скорости k от температуры, а также характер связи между скоростью реакции и энергией активации. Если левую и правую части уравнения Аррениуса разделить на постоянную А и записать число e его приближенным численным значением, то уравнение примет вид:
Напомним, что Ea – величина примерно постоянная для каждой реакции, не зависящая от температуры. В полученном выражении она входит в показатель степени при 2,71. Чем больше Ea конкретной реакции, тем больше будет знаменатель дроби и тем меньше (при данной температуре) будет константа скорости k (и скорость) этой реакции. Если же рассматривать какую-нибудь одну реакцию (с фиксированной Ea) при разных температурах, то повышение Т быстро уменьшает нижнюю часть дроби и, следовательно, измеряемая k будет быстро расти.
9.21 (ФМШ). Температурный коэффициент газовой реакции 2А + В = С равен 3. Как изменится константа скорости реакции при повышении температуры от 20 о С до 80 о С и одновременном увеличении давления в 2 раза?