Для чего колят фраксипарин после кесарева сечения
Для чего колят фраксипарин после кесарева сечения
д.м.н., проф. А.Л.Тихомиров, к.м.н. Ч.Г.Олейник
Несмотря на возросшее за последние два десятилетия качество оперативной гинекологической помощи, тромбоз глубоких вен (ТГВ) нижних конечностей и порождаемая им тромбоэмболия лёгочной артерии (ТЭЛА) занимают ведущее место среди послеоперационных осложнений и являются важными проблемами современной медицины. Более 25% случаев ТГВ и ТЭЛА связаны именно с хирургическими вмешательствами. Более того, за последние десятилетия в связи с постоянным увеличением числа оперативных вмешательств отмечается тенденция к росту заболеваемости и смертности, связанные с развитием послеоперационного ТГВ и его последствий. А ТЭЛА становится 3-ей причиной внезапной смерти после инфаркта миокарда и острого нарушения мозгового кровообращения.
Опасность ТЭЛА заключается не только в причинно-следственной связи ее с летальными ис ходами. Известно, что у части больных, перенесших массивную эмболию (преимущественно с окклюзи ей главных ветвей легочной артерии), тромбы не лизируются. Организация и реканализация их при водят к сужению, либо к окклюзии сосудов легких и в следствие этого к развитию хронической по стэмболической легочной гипертензии. Если больной переживает острый эпизод ТЭЛА, ему угрожает развитие тяжёлой хронической гипертензии малого круга кровообращения с прогрессирующей сердечно-лёгочной недостаточностью. Распространённый тромбоз глубоких вен нижних конечностей и таза в перспективе ведёт к формированию посттромботической болезни, проявляющейся клиникой хронической венозной недостаточности вплоть до развития трофических язв, что существенно влияет на трудоспособность и качество жизни пациентов.
Факторами, инициирующими возникнове ние ТГВ, являются, прежде всего, оперативное вмешательство (хирургическая агрессия активирует свертывающую систему крови), наркоз (миорелаксанты вызывают дилатацию внутримышечных вен и замедление оттока крови из нижних конеч ностей). Интересны те факты, что в половине случаев ТГВ начинает формироваться на операционном столе ( Российским консенсусом «Профилактика послеоперационных венозных тромбоэмболических осложнений» (2000)), а частота ТГВ при эпидуральной анестезии ниже, чем при общем наркозе.
Этой патологии подвержены преимуществен но больные в возрасте старше 40 лет, у которых хи рургическое вмешательство, производимое в усло виях общей анестезии с применением миорелаксан тов, длится 1 ч и более. При этом 80-85% ТГВ протекают клинически бессимптомно. В целом ряде случаев ТЭЛА развивается после выписки из стационара. Всё это может создать впечатление об относительно низкой частоте послеоперационных тромбоэмболических осложнений, однако они оправдано признаются одной из главных причин послеоперационной летальности.
Еще более тревожна статистика летальных исходов, обусловленных эмболией легочной арте рии, развивающейся в результате миграции тромботических масс из притоков нижней полой вены в систему малого круга кровообращения. Сегодня это осложнение ТГВ становится одной из наиболее частых причин смерти оперированных больных.
Общая частота тромбоэмболических осложнений после гинекологических вмешательств такая же, как в общей хирургии. По данным Савельева В.С. массивная ТЭЛА обнаруживается во время аутопсии у 7,1% умерших в урологическом, 8,3% — в хирургическом и 11,2% в гинекологическом отделениях. У гинекологических больных ТЭЛА является ведущей причиной летальности после операций по поводу злокачественных новообразований.
Больные с тяжелой сердечно-легочной недо статочностью этого генеза, как правило, нетрудоспособны. Часть из них, несмотря на частые курсы реабилитационной терапии с применением современных лекарственных препаратов (тромболитики, вазодилятаторы, антикоагулянты), умирает.
Можно ли предвидеть развитие послеоперационных тромбоэмболических осложнений? Сегодня мы можем с уверенностью говорить, что у пациентов старше 40 лет, ранее перенесших венозный тромбоз или ТЭЛА, при варикозной болезни вен и онкологических заболеваниях, ожирении, получающих эстрогенотерапию, страдающих полицитемией и тромбофилией, перенесших продолжительное оперативное вмешательство и длительный постельный режим, угроза развития тромбоэмболических осложнений многократно возрастает.
Для практических целей обычно выделяют 3 степени риска послеоперационных венозных тромбоэмболических осложнений – низкую, умеренную и высокую. В настоящее время наибольшей популярностью пользуется схема прогнозирования степени риска послеоперационных тромбоэмболических осложнений, предложенная французскими анестезиологами и одобренная Российским консенсусом «Профилактика послеоперационных венозных тромбоэмболических осложнений» (2000). Согласно данной схеме при больших гинекологических операциях степень риска послеоперационных венозных тромбоэмболических осложнений – умеренная.
Проблема эффективности проводимой тромбопрофилактики остаётся актуальной по сегодняшний день. Задачей профилактики ТГВ и ТЭЛА является предупреждение или хотя бы уменьшение риска развития ТГВ и его последствий путём воздействия на патогенетические механизмы тромбообразования.
Профилактике венозного тромбоза следует уделять столь же серьёзное внимание, как и выполнению самого оперативного вмешательства. Уменьшение частоты этого послеоперационного осложнения позволит снизить не только связанную с ним заболеваемость и смертность, но и сократить расходы на лечение больных с этой патологией и её последствиями в острой стадии и в периоды рецидивов.
Следует отметить, что у больных умеренного и высокого риска стоимость диагностического скрининга ТГВ с использованием специальных инструментальных методов (тест с меченым фибриногеном, компрессионное дуплексное сканирование или флебография) и последующего лечения уже развившихся осложнений настолько высоки, что предлагаемые в настоящее время методы первичной профилактики ТГВ (назначение низкомолекулярных или нефракционированных гепаринов, прерывистая пневмокомпрессия или методы ускорения кровотока) являются как клинически, так и экономически оправданными.
Как же реально предотвратить возникновение венозных тромботических и эмболических осложнений? В соответствии с основными механизмами этиопатогенеза тромбоза принято делить все методы профилактики этой патологии на три основные группы – медикаментозные, физические или механические и комбинированные.
В широкой практике реально осуществима и наиболее эффек тивна лишь медикаментозная профилактика. Однако традиционно используемый для этой цели нефракционированный гепарин (НФГ) обладает слабой антитромботической активностью, несмотря на выраженную антикоагуляционную. Причина низкой эффективности НФГ кроется в его антифибринолитическом и проагрегационном действии. Механические методы тромбопрофилактики также малоэффективны, к тому же – неудобны в применении и противопоказаны при тяжёлых поражениях сосудов ног, осложнённых развитием трофической язвы, дерматита. Декстраны и антиагреганты при высокой степени тромбоэмболического риска могут использоваться только в комбинации с препаратами гепарина, так как сами по себе не обеспечивают эффективной тромбопрофилактики. Появившиеся в последние годы низкомолекулярные гепарины (НМГ) имеют существенные преимущества перед НФГ в профилактике послеоперационных тромбогенных осложнений благодаря хорошему соотношению эффективности и безопасности, удобству и простоте применения.
В результате исследований проводимых последние 20 лет, посвя щенных поиску форм гепарина, которые бы наилучшим образом от вечали соотношению структура-активность, был синтезирован низ комолекулярный гепарин, который включал фракции с более корот кими молекулярными цепями с лучшим аититромботическим эффектом.
НМГ получают путем деполимеризации НГ, молекулярная мас са их колеблется в пределах от 4 до 8кДа. Деполимеризация может быть осуществлена химическим, энзиматическим и физическим ме тодом (излучение). На сегодняшний день существует множество НМГ, производимых разными странами и различными методами, что обус лавливает и некоторые отличия в биологической активности этих препаратов.
Изменение структуры молекулы гепарина, то есть уменьшение молекулярной массы почти в 3 раза, повлекло за собой и изменения в фармакодинамике и фармакокинетике.
Так в чем же основные преимущества НМГ перед НГ? Благодаря меньшей молекулярной массе и большей биодоступности они доль ше циркулируют в крови и обеспечивают продолжительный проти вотромботический эффект в значительно меньших суточных дозах. Поэтому возможно однократное подкожное введение препарата в сут ки; препараты (в частности фраксипарин) не вызывают образование гематом в области инъекций.
Важнейшим преимуществом НМГ по сравнению с НФГ является более предсказуемый антикоагулянтный эффект, что свя зано с большей биодоступностью.
Одно из важнейших качественных отличий НМГ от НФГ — спо собность существенно не удлинять такие показатели, как АЧТВ, ТВ и др., что связано преимущественно с воздействием на фактор Ха и ингибицией внешнего пути свертывания.
НМГ в гораздо меньшей мере подвержены влиянию антигепа ринового фактора 4 тромбоцитов, соответственно крайне редко вы зывают тромбоцитопению и не вызывают гепарин-индуцированные тромбозы.
Основное отличие механизма действия НМГ на систему гемостаза от НГ состоит в том, что НМГ обладают, в основном, анти Ха- активностью (то-есть антитромбиновой).
Учитывая механизмы действия НМГ и результаты применения их в широкой клинической практике, большинство исследователей склоняются к мысли, что нет необходимости в лабораторном контро ле при использовании НМГ в терапевтических и, тем более, в профи лактических целях. Тем не менее оценку их антикоагулянтного эф фекта можно проводить по определению анти- Ха-активности (эф фект предотвращения образования Ха-фактора). С ним соприкасается и другой чрезвычайно важный эффект ингибиции внешнего пути свер тывания, опосредованный высвобождением TFPI (ингибитор внешнего пути свёртывания).
Однако весьма актуальным является контроль эффективности терапии. Для этой цели могут быть исполь зованы такие маркеры внутрисосудистого свертывания крови, как комплекс тромбин-антитромбин (ТАТ), фрагменты 1+2 протромбина и особенно продукты деградации фибрина/фибриногена.
В настоящее время НМГ широко применяется в клинической практике для профилактики венозных тромбозов и тромбоэмболии.
Идеальный тромбопрофилактический препарат должен эффек тивно предотвращать развитие тромбоза, не иметь серьезных побоч ных эффектов, быть достаточно простым в применении и не требовать лабораторного мониторинга. НМГ обладает многими качества ми из перечисленных выше.
Поскольку НМГ лишен большинства побочных эффектов, свой ственных НФГ, а также его антикоагулянтный эффект в ответ на фик сированную дозу более предсказуем, без сомнения НМГ является пре паратом выбора при профилактике ТГВ и ТЭЛА.
При этом профилактические дозы НМГ обычно не превышают 3400 анти-Ха ME и вводятся подкожно один-два раза в сутки. Длительность профилактики в разных клинических ситуациях различная, и прежде всего зависит от причины, повышенного риска тромбоза.
Таким образом, НМГ эффективно снижают частоту послеоперационных тромбозов (почти на 70%) и не повышают риск серьезных геморрагических осложнений при преоперативном назначении. В случаях, когда НМГ назначаются в послеоперационном периоде, они не повышают риск геморрагии.
Большинство исследований свидетельствует, что НМГ почти на 50% эффективнее снижают риск развития ТГВ в послеоперационном периоде у хирургических больных, чем НФГ.
В настоящее время наиболее перспективным препаратом для тромбопрофилактики среди НМГ считается фраксипарин. Это признание фраксипарин получил и от European Collaborative Study (1991).
Анти-Ха-активность фраксипарина чаще измеряется в анти-Ха единицах Института ШОЭ. 1 единица института ШОЭ ( ICU ) соот ветствует 0,41 международной единице ( IU ) анти-Ха.
Многолетнее применение фраксипарина в каждодневной практике позволило нам составить благоприятное мнение об этом препарате. Полученные нами результаты являются иллюстрацией эффективности и безопасности фраксипарина. В тех случаях, в которых необходимо провести профилактику тромботических осложнений, сделать это «прицельно», щадя систему гемостаза и одновременно не увеличивая величину кровопотери, фраксипарин является препаратом оптимального выбора.
Для практических целей можно использовать следующие режи мы применения фраксипарина:
Профилактические дозы в зависимости от массы тела:
меньше 50кг-0,3мл; 50-70кг-0,4мл; больше 70кг- 0,6мл.
Длительность применения фраксипарина в профилактических целях:
при гинекологических операциях — 1-я инъекция за 12 часов до опер ации, 2-я инъекция — через 8 часов после операции, затем I раз в
с утки в течение 10 дней.
Большая распространенность ТГВ и его по следствий в послеоперационном периоде в гинекологии, а также связанные с ними смертность, инвалидизация и колоссальные эконо мические расходы, затрачиваемые на лечение этих больных, дают основание считать тромбоз глубоких вен нижних конечностей заболеванием, имеющим большое социальное значение, а профилактику его чрезвычайно важной.
Игнорирование профилактики ТГВ при водит не только к увеличению в общей популяции больных, страдающих хронической веноз ной недостаточностью нижних конечностей пост тромботического генеза, но и к росту числа леталь ных исходов от ТЭЛА.
В течение последних 10—20 лет в профилак тике венозных тромбоэмболических осложнений достигнуты значительные успехи. Вместе с тем, следует признать, что, несмотря на то, что существует несколько возможных путей предупреждения этого вида послеоперационных осложнений, в широкой практике реально осуществима и эффек тивна лишь медикаментозная профилактика, прежде всего с применением низкомолекулярного гепарина, в частности фраксипарина. Применение фраксипарина с профилактической целью позволяет уменьшить послеоперационную летальность, снизить частоту тяжёлых форм хронической венозной недостаточности и получить ощутимый экономический эффект.
Причины и правила для введения Фраксипарина после кесарева
Фраксипарин после кесарева нужен для предупреждения венозного тромбоза. Этот препарат относится к группе низкомолекулярных гепаринов и имеет преимущества: доказанная эффективность, реже вызывает кровотечения, можно вводить 1 раз в сутки, не нужно ежедневно контролировать свертываемость крови. Назначается при экстренной операции, а при плановом кесаревом учитывают факторы риска (ранее перенесенный тромбоз, сопутствующие болезни, токсикоз и другие).
Вводят подкожно 0,3 мл в сутки для профилактики 7-10 дней, если ранее были случаи закупорки вен голени, тазовых, легочных артерий, то используют 2 укола в день, а курс продлевается до 1-2 месяцев. При процедурах ЭКО (экстракорпорального оплодотворения) препарат может быть рекомендован еще на этапе подготовки к беременности. Женщинам со склонностью к тромбозу он применяется и при вынашивании ребенка со 2 триместра и до родов.
Как работает Фраксипарин после кесарева, особенности препарата
Фраксипарин после кесарева сечения уменьшает свертываемость крови и предотвращает формирование сгустков (тромбов) в венозной сети. В результате улучшается кровоток и снижается риск очень опасного осложнения – легочной тромбоэмболии, она является причиной 20% случаев материнской смертности.
К особенностям этого препарата из группы низкомолекулярных гепаринов относятся:
Зачем назначают
Фраксипарин назначается для того, чтобы избежать закупорки венозных сосудов – глубоких вен голени, таза, легочных артерий. Такие последствия возникают после кесарева сечения из-за повышенной свертываемости крови у беременных (естественный процесс), а также сама операция кесарева становится дополнительным фактором риска.
А здесь подробнее о том, почему возникают отеки после кесарева.
Кому необходимо применение
Фраксипарин назначается после экстренной операции кесарева сечения вне зависимости от сопутствующих и перенесенных ранее болезней. Это объясняется:
При плановом кесаревом сечении применение Фраксипарина нужно женщинам, которые входят в группу риска венозных тромбозов, при назначении учитывают:
Риск тромботических осложнений возрастает и при особенностях течения текущей беременности:
Противопоказания
Фраксипарин запрещен при наличии:
Нужна осторожность (врачебный контроль, анализы), если у женщины обнаружены:
Влияет ли на ребенка
Фраксипарин в незначительном количестве выделяется с грудным молоком. При этом его всасывание из желудочно-кишечного тракта в кровь ребенка не происходит. Нет оснований предполагать отрицательное влияние препарата на младенца, поэтому его назначают кормящим женщинам. При лактации и необходимости длительного применения больших доз рекомендуется новорожденному раз в месяц проверять общий анализ крови.
Дозировка и длительность лечения Фраксипарином после кесарева сечения
Введение Фраксипарина в дозе 0,3 мл после кесарева сечения считается профилактической дозировкой, укол делается под кожу 1 раз в сутки. Если необходимо лечение уже возникшего тромбоза, или риск осложнений высокий, то суточная доза повышается до 0,6 мл (две подкожные инъекции в день).
Продолжительность терапии может быть 7-10 дней, если нет оснований предполагать развитие тромбоза. При ранее перенесенной закупорке вен конечностей курс продлевают до 2-3 недель, а при легочной тромбоэмболии в прошлом – до 1,5-2 месяцев.
Как делать уколы Фраксипарина в живот после кесарева сечения
Уколы Фраксипарина нужно делать под кожу, для этого после кесарева сечения выбирают участок по боковой поверхности живота на расстоянии не менее 5 см от пупка. В зоне инъекции не должно быть болезненности, нарушений целостности, уплотнений, кожных заболеваний. Женщина может делать уколы самостоятельно, для этого нужно:
Причины для терапии при беременности, после ЭКО
Введение Фраксипарина беременным рекомендуется для предупреждения тромбоза в таких случаях:
Повышенная свертываемость крови нередко бывает причиной неудачного проведения экстракорпорального оплодотворения. Гормональная подготовка к ЭКО также усугубляет склонность к тромбообразованию. Из-за нарушения кровотока в стенке матки затрудняется прикреплении плодного яйца, питание зародыша, формирование плаценты. Это приводит к выкидышам на ранних сроках.
Для профилактики отторжения эмбриона и осложнений в виде закупорки вен Фраксипарин вводят в период подготовки беременности. Это увеличивает шансы на зачатие почти на 25%. После его наступления в первом триместре препарат чаще всего отменяют, а с конца 3 месяца и вплоть до самых родов женщине назначают профилактические дозы медикамента.
Смотрите в этом видео о том, в каких случаях во время беременности назначают низкомолекулярный гепарин:
Обследование перед введением препарата
Для того чтобы определить необходимость применения Фраксипарина при вынашивании ребенка, сдают анализ крови на такие показатели:
При подозрении на наследственную тромбофилию исследуют генные мутации, наиболее важные тесты:
В ходе лечения Фраксипарином достаточно 1 раз в месяц контролировать уровень тромбоцитов крови, анти-Ха фактор, печеночные и почечные пробы.
Смотрите в этом видео о целесообразности проведения генетических тестов на риск развития тромбофилии во время вынашивания плода:
Стоимость препарата
Одна упаковка Фраксипарина (10 шприцов по 0,3 мл) стоит около 2200 рублей (диапазон цен – 1800-2400 рублей). Если необходимы большие дозы, то их можно приобрести по таким средним ценам:
Действующее вещество – надропарин, представлено в аптечной сети только Фраксипарином, поэтому при необходимости замена может быть на групповые аналоги (низкомолекулярные гепарины) – Клексан, Цибор, Фрагмин. Все эти препараты рецептурные и применяются строго по назначению врача.
А здесь подробнее о том, что нужно знать об операции кесарево сечение.
Фраксипарин назначается после экстренной операции кесарева сечения для предупреждения тромбоза вен и легочной тромбоэмболии. При плановом оперативном родоразрешении перед применением учитывают факторы риска (тромбофилия, преэклампсия, ранее перенесенная закупорка вен).
Применение низкомолекулярных гепаринов в акушерской практике
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
ММА имени И.М. Сеченова
Д о настоящего времени тромбозы и тромбоэмболические осложнения остаются основной причиной смерти в большинстве развитых стран. Только в США от артериальных и венозных тромбозов ежегодно погибает около 2 млн человек и приблизительно такому же числу больных ежегодно удается пережить эпизоды глубоких венозных тромбозов, тромбоэмболий, цереброваскулярных тромбозов, транзиторных ишемических атак, коронарных тромбозов, тромбозов сетчатки и т.д. Даже от злокачественных новообразований погибает приблизительно в четыре раза меньше больных. Это свидетельствует о том, что тромбозы являются экстраординарной причиной заболеваемости и смертности населения, в том числе и материнской. По обобщенным данным мировой литературы, на 1000 родов приходится 2-5 тромботических осложнений. 50% всех венозных тробмоэмболических осложнений возникают у женщин в возрасте до 40 лет и, как правило, они связаны с беременностью.
| На 1000 родов приходится 2-5 случаев тромботических осложнений. |
Таким образом, тенденция к стазу крови в сочетании с гиперкоагуляцией создает условия, благоприятствующие повышенному риску тромбообразования.
Дополнительными факторами риска по тромботическим осложнениям могут служить возраст (старше 35 лет), сердечно-сосудистая патология, эндокринные нарушения, гестоз, заболевания почек, гнойно-септические заболевания, а также ряд острых состояний (отслойка плаценты, эмболия околоплодными водами, длительная задержка мертвого плода в матке и др.). Гиперкоагуляция сменяется внутрисосудистым свертыванием крови, проявляющимся различными формами синдрома диссеминированного внутрисосудистого свертывания (ДВС).
Следует отметить, что расширение показаний к кесареву сечению также сопряжено с повышенным риском тромбоза вследствие хирургического вмешательства, значительного изменения метаболизма, травмы, попадания тромбопластических субстанций в кровоток, иммобилизации, замедления венозного кровотока и пр.
Особое место среди факторов риска по тромбоэмболическим осложнениям занимают гнойно-септические процессы в области малого таза, так как в патологический процесс вовлекаются подвздошные, яичниковые, маточные вены, что может осложниться бактериальной легочной эмболией. При этом повышенная концентрация высокодисперсных белков плазмы (в частности, фибриногена) дополнительно опосредует повышенную структурную гиперкоагуляцию.
За последнее десятилетие клиническая картина обогатилась возможностями выяснения ряда ранее не известных патогенетических форм тромбоза: иммунных, а также генетических или так называемых наследственных дефектов гемостаза, предрасполагающих к тромбозу.
К иммунным формам относят тромбоз, обусловленный гепарин-индуцированной тромбоцитопенией (ГИТ), тромбоз, связанный с циркуляцией антифосфолипидных антител при антифосфолипидном синдроме, а также сравнительно недавно открытую новую форму иммунного тромбоза, обусловленного аутоантителами к фактору Виллебранда. При всех иммунных тромбозах независимо от генеза происходит внутрисосудистая агрегация тромбоцитов.
В последние годы значительно изменился взгляд на патогенез иммунных тромбозов. Если предыдущие концепции сводились к ингибиции патофизиологически важных естественных антитромботических агентов (антигенов) антителами, то в настоящее время основную роль отводят связыванию антител через различные протеины с клетками крови (тромбоциты и др.) или мембраной эндотелиальных клеток с последующей активацией протромботических механизмов этими клетками через их FcgRII-рецепторы или через комплементарный каскад.
Наиболее изученными на сегодняшний день считаются механизмы возникновения гепарининдуцированной тромбоцитопении и тромбоза, обусловленного ГИТ.
Различают 2 типа ГИТ: наиболее частый I тип имеет раннее начало, сопровождается легкой тромбоцитопенией, возможно, связанной со способностью фракций гепарина (в основном нефракционированного), не обладающих антикоагулянтной активностью, усиливать небольшую активность тромбоцитов; тип II обусловливает спорадические, изолированные случаи тяжелой тромбоцитопении с поздним началом, иммуноспровоцированные и часто ассоциирующиеся с катастрофическим тромбозом.
В основе лечения тромбофилических состояний и ДВС-синдрома лежит устранение непосредственной причины их возникновения (например, антибиотикотерапия при гнойно-септических процессах), а также воздействие на основные звенья патогенеза. Целый ряд состояний в акушерстве диктует необходимость проведения профилактических мер.
Показания к профилактике тромбоэмболических осложнений во время беременности и в послеродовом периоде:
• беременные в возрасте старше 35–40 лет
• беременные с экстрагенитальной патологией, особенно с заболеваниями сердечно-сосудистой системы и почек
• повторнобеременные с отягощенным акушерским анамнезом (гнойно-септические заболевания, антенатальная гибель плода, задержка развития плода, нефропатия, преждевременная отслойка нормально расположенной плаценты)
• наличие в анамнезе тромбозов и тромбоэмболий
• беременные, которым показана операция при беременности
• осложненное течение беременности, родов и послеродового периода: (нефропатия, преждевременная отслойка нормально расположенной плаценты, эмболия околоплодными водами, гнойно-септические заболевания, массивные гемотрансфузии)
• острые тромбозы и тромбоэмболии
• генетические формы тромбофилии.
Критериями противотромботической терапии в акушерской практике являются ее эффективность и безопасность для матери и плода. Из всего арсенала противотромботических средств (непрямые и прямые антикоагулянты, антиагреганты, тромболитики) препаратами выбора были и остаются гепарин натрий и его производные. В акушерской практике гепарин натрий занимает особое место в связи с немедленным антикоагулянтным эффектом, существованием антидота, легкостью управления дозой, отсутствием тератогенного и эмбриотоксического эффектов. Непрямые антикоагулянты проходят через плаценту и обладают тератогенным и эмбриотоксическим эффектами. В исключительных случаях их применение ограничено II триместром беременности, когда органогенез завершен.
Однако, несмотря на множество преимуществ, обычный нефракционированный или высокомолекулярный гепарин обладает рядом нежелательных побочных свойств, которые в основном предопределены его структурой. Нефракционированный гепарин (НГ) представляет собой смесь кислых макромолекулярных цепей сульфатированных анионов мукополисахаридов с высоковариабельной молекулярной массой от 4000 до 40 000 Д.
Вследствие гетерогенности структуры НГ имеет биодоступность лишь 30%, так как связывается с множеством белков, клеток (макрофаги, клетки эндотелия и т.д.). Кроме того, НГ подвержен влиянию антигепаринового фактора тромбоцитов (фактор IV), образуя комплекс гепарин-фактор. Это чревато возникновением гепариновой иммунной тромбоцитопении в результате образования антител к этому комплексу (наиболее опасная форма тромбоза).
Одним из нежелательных эффектов гепарина натрия является истощение АТ III при длительном его применении в больших дозах, что также может вызвать состояние гиперкоагуляции и стать причиной тромбоза. Понятно, что увеличение дозы гепарина натрия в такой ситуации не приводит к антикоагулянтному эффекту.
Последние 5-7 лет в клиническую медицину активно внедряются низкомолекулярные гепарины (НМГ), зарекомендовавшие себя с лучшей стороны, так как в большинстве случаев проявляют большую противотромботическую активность и достоверно гораздо более низкую выраженность геморрагических осложнений и других побочных эффектов.
НМГ получают путем деполимеризации НГ, их молекулярная масса колеблется в пределах от 4 до 8 кД. Деполимеризацию можно осуществить химическим, ферментным и физическим методом (g-излучение).
Изменение структуры молекулы гепарина, т.е. уменьшение молекулярной массы почти в 3 раза, повлекло за собой и изменения фармакодинамики и фармакокинетики. НМГ имеют более высокую биодоступность, чем НГ (около 98%), больший период полужизни. НМГ меньше связываются с различными белками, клетками. В отличие от НГ их почечный клиренс значительно преобладает над клеточным (что важно учитывать у больных с почечной недостаточностью). Кроме того, НМГ в гораздо меньшей степени, чем НГ, связываются с клетками эндотелия, что также обеспечивает длительную циркуляцию в плазме (в 2-4 раза дольше).
НМГ не обладают антитромбиновым свойством и, следовательно, не вызывают гипокоагуляции. Противотромботический эффект НМГ в основном зависит от его влияния на фактор Ха.
Однако если в состав НМГ входят фракции с молекулярной массой более 5400 Д, что эквивалентно более чем 18 дисахаридным остаткам, то также проявляется анти-IIa-активность. Так, у одного из наиболее ранних НМГ, надропарина кальция, молекулярная масса которого в среднем 4500 Д, благодаря фракциям с молекулярной массой больше 5400 Д соотношение анти-IIa- и анти-Ха-активности равно 1:4.
НМГ способствуют также активации фибринолиза путем освобождения из эндотелия тканевого активатора плазминогена t-PA; кроме того, они меньше подвержены действию антигепаринового фактора IV тромбоцитов и, соответственно, реже вызывают гепариновую иммунную тромбоцитопению.
Прогресс в области гемостазиологии показал, что в генезе большинства тромботических явлений огромную роль играют активация внешнего пути свертывания и выделение в кровь тканевого фактора (ТФ). Этот механизм преобладает во время беременности, в перинатальном, послеоперационном периодах, при гнойно-септических заболеваниях, антифосфолипидном синдроме (АФС), ожирении, онкологических и множестве сердечно-сосудистых заболеваний, а также при ряде связанных с ними состояний: пороках сердца, кава-фильтре, чрескожной транслюминальной коронарной ангиопластике, тромбоэмболии легочной артерии, дистресс-синдроме легких, отслойке плаценты, эмболии околоплодными водами и др.
TFPI-фактор, или липопротеин-ассоциированный ингибитор коагуляции (LACI-фактор), является мощным естественным ингибитором внешнего пути свертывания. НМГ способны значительно повышать его уровень в крови. TFPI-фактор контролирует обусловленный фактором Ха механизм отрицательной обратной связи и ингибирует ряд комплексов, которые через образование протромбиназы ведут к генерации тромбина и затем фибрина.
TFPI имеет и другие фармакологические свойства, как потенциальное антитромботическое средство: это ингибитор образования протеаз, прямой ингибитор фактора Ха и эластазы, ингибитор, обусловленный ТФ активации тромбоцитов и макрофагов; он взаимодействует с липопротеинами низкой плотности с изменением их патогенетической роли (особенно при атеросклерозе), взаимодействует с эндотелием сосудов, обеспечивает модуляцию эндогенных гликозаминогликанов, нейтрализует эндогенно образующийся ТФ.
В нормальных физиологических условиях TFPI синтезируется в микроваскулярном эндотелии и в небольших количествах мегакариоцитами и макрофагами и не синтезируется нормальными гепатоцитами или эндотелием крупных сосудов. Незначительные количества TFPI исходят из фибробластов, но при активации этих клеток уровнь TFPI повышается в 6-8 раз.
Возвращаясь к эффектам НМГ, следует отметить, что независимо от патогенетического механизма тромбозов общим для них является активация тромбинового пути, и преимуществом НМГ является их способность препятствовать образованию тромбина. Если учесть меньшую зависимость противотромботического эффекта НМГ от уровня АТ III, чем у НГ, то можно думать о применении НМГ у больных с дефицитом АТ III.
В отличие от НГ, благодаря меньшей молекулярной массе и большей биодоступности, НМГ дольше циркулируют в крови и обеспечивают продолжительный противотромботический эффект в значительно меньших суточных дозах. Возможно однократное подкожное введение препарата в сутки: препараты не вызывают образования гематом в области инъекций.
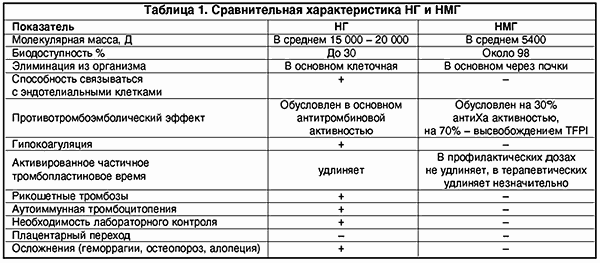
НМГ не вызывают гипокоагуляции, поскольку противотромботический эффект направлен на ингибцию Ха-фактора и внешнего пути свертывания крови; в гораздо меньшей мере подвержены влиянию антигепаринового фактора 4 тромбоцитов, соответственно крайне редко вызывают тромбоцитопению и не обусловливают иммунных тромбозов (табл. 1).
Учитывая механизм действия НМГ и результаты их применения в широкой клинической практике, большинство исследователей считают, что нет необходимости в лабораторном контроле при использовании НМГ в профилактических целях. Тем не менее оценку их антикоагулянтного эффекта можно проводить по анти-Ха-активности. Биологические методы контроля терапии НГ и НМГ с учетом их действия на различные компоненты системы гемостаза представлены в таблице 2.
До появления НМГ контроль терапии преследовал цель обеспечения адекватной дозы НГ во избежание опасных геморрагических осложнений. При применении НМГ практически не существует проблемы гипокоагуляционных эффектов. Однако, весьма актуален контроль эффективности препарата. Для этой цели можно использовать такие маркеры тромбофилии, как комплекс тромбин-антитробмин, фрагмены F1+2 протромбина и особенно продукты деградации фибрина-фибриногена. Маркеры внутрисосудистого свертывания крови и тромбофилии представлены в таблице 3.
Установление отсутствия трансплацентарного перехода НМГ открыло большие возможности широкого применения его в акушерской практике, особенно у беременных с заболеваниями сердечно-сосудистой системы, с АФС и при ряде состояний, сопровождающихся тромбофилией и внутрисосудистым свертыванием крови. Преимущественное воздействие НМГ на внешний путь свертывания крови открывает заманчивую перспективу лечения эндотелиальных изменений при гестозах.
Положительным свойством НМГ (в частности, надропарина кальция) является купирование в течение 2-3 дней ДВС-синдрома у беременных с гестозами. Как правило, это сопровождается и регрессом заболевания. Однако если основные проявления гестоза не исчезают, то терапия НМГ более 1 нед нецелесообразна. Возможно, наблюдаемый положительный эффект НМГ у беременных с начальными формами гестоза обусловлен воздействием на эндотелий. Помимо стабилизирующего влияния антиагрегантов и антикоагулянтов, НМГ препятствуют экспрессии фактора Виллебранда на эндотелии.
Раствор Фраксипарина выпускается в одноразовых шприцах по 0,3, 0,4, 0,6, 1 мл. Это удобно в применении, инъекции безболезненны и не оставляют гематом. Препарат вводят под кожу брюшной стенки, что делает возможным его применение в амбулаторных условиях.
Таким образом, применение НМГ в акушерской практике открывает новые перспективы для эффективной профилактики и лечения тромбоэмболических осложнений, заболеваний, протекающих с ДВС-синдромом, а также шока и шокоподобных состояний.