Для чего азот в атмосфере
Новости
Время работы: с 10:00 до 21:00,
Выходной день: вторник
«Ретро-кафе»: в дни работы Планетария с 10:00 до 20:00.
Музей «Лунариум» временно закрыт
+7 (495) 221-76-90
АО «Планетарий» © 2017 г. Москва, ул.Садовая-Кудринская, д. 5, стр. 1
Элементы: азот – основной компонент воздуха
Азот – элемент необычный и противоречивый. Эти характеристики элемента № 7 Таблицы Менделеева отразились и в его названии. Великий французский химик Антуан Лавуазье в конце 18 века предложил назвать этот элемент азотом после того, как он далеко не первым выделил и исследовал не поддерживающую дыхания и горения часть воздуха, назвав её «азотом», что означает «безжизненный». Хотя позже выяснилось, что азот, наоборот, крайне необходим для всех живых существ. Тем не менее, термин «азот» укоренился в русском, французском, итальянском и турецком языках. В английском и других языках прижились производные от латинского nitrogenium – селитру рождающий. Открытие азота приписывают шотландскому ученому Даниелю Резерфорду после публикации в 1772 г. его диссертации «О так называемом фиксируемом и мефитическом воздухе».
Азот в жидком состоянии — бесцветная, подвижная, как вода, жидкость.

Слоистая дымка атмосферы Плутона, состоящей в основном из азота. Снимок КА «Новые горизонты» (НАСА), 2015 г.
Применение азота в промышленности обусловлено такими его свойствами, как инертность и низкая температура перехода в жидкое состояние. Поэтому азот и его соединения очень широко применяется в различных сферах деятельности: сельском хозяйстве, нефтегазовой, металлургической и горнодобывающей отраслях, пищевой и целлюлозно-бумажной промышленности, медицине и других областях.
LiveInternetLiveInternet
—Метки
—Рубрики
—Подписка по e-mail
—Постоянные читатели
—Статистика
Азот в составе атмосферы – содержание в атмосфере 78%.
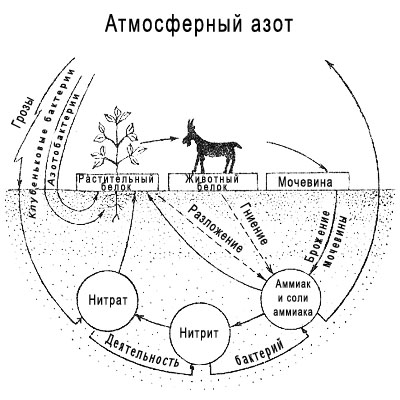
Роль Азота в атмосфере
Азот – главный элемент атмосферы Земли. Основная его роль – регулировка темпов окисления путем разбавления кислорода. Таким образом азот влияет на скорость и напряженность биологических процессов.
Существует два взаимосвязанных между собой пути извлечения азота из атмосферы:
Рисунок 1. Геохимический круговорот азота (В.А. Вронский, Г.В. Войткевич)
Неорганическое извлечение азота из атмосферы
В атмосфере под действием электрических разрядов (во время грозы) или в процессе фотохимических реакций (солнечная радиация) образуются соединения азота (N2O, N2O5, NO2, NH3 и др.). Эти соединения, растворяясь в дождевой воде, вместе с осадками выпадают на землю, попадая в почву и воду океанов.
Биологическое связывание азота
Биологическое связывание атмосферного азота осуществляется:
Количество биологически связанного азота значительно больше неорганически зафиксированного.
Как азот попадает обратно в атмосферу?
Остатки живых организмов разлагаются в результате воздействия многочисленных микроорганизмов. В процессе этого азот, входящий в состав белков организмов, претерпевает ряд превращений:
Где содержится азот?
Азот в атмосферу поступает в процессе извержения вулканов в виде аммиака. Попадая в верхние слои атмосферы аммиак (NH3) окисляется и высвобождает азот (N2).
Азот также захороняется в осадочных горных породах и содержится в больших количествах в битуминозных отложениях. Однако этот азот также попадает в атмосферу в процессе регионального метаморфизма этих пород.
Статьи по теме «Атмосфера»:
Все, что Вы хотели знать об атмосфере Земли: высота, границы, свойства, воздействие на организм человека, образование, состав, части атмосферы, слои и многое-многое другое.
Азот — «безжизненный» газ, крайне важный для всего живого
Азот — газ, простое химическое вещество, неметалл, элемент 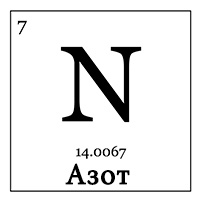
Название «азот» и созвучные ему используются во многих странах: во Франции, Италии, России, Турции, в некоторых восточнославянских и в странах бывшего СССР. По основной версии, название «азот» происходит от греческого слова azoos — «безжизненный», так как не пригоден для дыхания.
Азот в основном встречается как газ — в воздухе его около 78% (по объему). Месторождения полезных ископаемых, а которых он содержится — например, чилийской селитры (нитрат натрия), индийской селитры (нитрат калия) большей частью уже истощены, поэтому в промышленных масштабах реактив добывают химическим синтезом прямо из атмосферы.
Свойства

Элемент крайне важен для жизни всего живого. Он является неотъемлемой частью белков, нуклеиновых кислот, гемоглобина, хлорофилла и многих других биологически важных соединений. Играет основную роль в обмене веществ живых клеток и организмов.
Азот выпускается в виде сжатого при 150 атмосфер газа, поставляется в баллонах черного цвета с крупной и четкой надписью желтого цвета. Жидкий реагент хранят в сосудах Дьюара (термос с двойными стенками, с серебрением изнутри и вакуумом между стенок).
Опасность азота
В обычных условиях азот не вреден для человека и животных, но при повышенном давлении вызывает наркотическое опьянение, а при нехватке кислорода — удушье. С азотом и его воздействием на кровь человека при резком снижении давления связана очень опасная кессонная болезнь.
Это интересно
Вероятно, все хотя бы однажды видели в фильмах или сериалах, 
Азот относится к пниктогенам — химическим элементам той же подгруппы таблицы Менделеева, что и он сам. Кроме азота к пниктогенам относят фосфор, мышьяк, сурьму, висмут и искусственно полученный московий.
Жидкий азот — идеальный материал для тушения пожаров, особенно с ценными объектами. После тушения азотом не остается ни воды, ни пены, ни порошка, а газ просто выветривается.
Применение
— Три четверти всего выпускаемого в мире азота идет на производство аммиака, из которого, в свою очередь, производят широко использующуюся в разных сферах промышленности азотную кислоту.
— В сельском хозяйстве соединения азота используются как удобрения, а сам азот — для лучшей сохранности овощей в овощехранилищах.
— Для производства взрывчатых веществ, детонаторов, топлива для космических аппаратов (гидразина).
— Для изготовления красителей, медикаментов.
— При перекачке горючих веществ по трубам, в шахтах, в электронных приборах.
— Для тушения кокса в металлургии, для создания нейтральной атмосферы в промышленных процессах.
— Для продувки труб и резервуаров; распирания пластов в горнодобыче; прокачки топлива в ракетах.
— Для закачки в самолетные шины, иногда — в автомобильные.
— Для производства особой керамики — нитрида кремния, обладающего повышенной механической, термической, химической стойкостью и многими другими полезными характеристиками.
— Пищевую добавку Е941 используют для создания в упаковках консервирующей среды, исключающей окисление и развитие микроорганизмов. Жидкий азот используют при разливе напитков и масел.
Жидкий азот применяется как:
— Хладагент в криостатах, вакуумных установках и т. п.
— В криогенной терапии в косметологии и медицине, для проведения некоторых видов диагностики, для хранения образцов биоматериалов, спермы, яйцеклеток.
— В криогенной резке.
— Для тушения пожаров. Испаряясь, реагент образует массу газа в 700 раз большую, чем объем жидкости. Этот газ оттесняет кислород от пламени, и оно тухнет.
 masterok
masterok
Мастерок.жж.рф
Хочу все знать
Почитайте некоторые интересные факты про него:
1. Впервые газ был обнаружен в конце 1777 года тремя химиками – Дэниэлом Резерфордом, Генри Кавендиш и Джозефом Пристли. Однако ни один из них не смог открыть свойства азота, что не позволило полноценно открыть его как новый газ. Первоначало Пристли подумал, что это кислород. Дэниэл Резерфорд последовательно открывал свойства газа, который не реагирует с другими веществами и не горит. Именно поэтому считается, что азот был открыт именно этим ученым.
2. Название «Азот» происходит от древнегреческого слова «безжизненный». Так назвал газ Антуан Лавуазье.
4. В состав массы живых организмов входит азот в процентном отношении 2,5%.
6. Первоначально рассматриваемый газ получали из различных природных объектов с определенным химическим составом и кристаллической структурой, однако, на сегодняшний день его добывают напрямую из атмосферы Земли.
7. Во второй части киноленты «Терминатор» он замерз в жидком азоте. Это является чистой выдумкой – даже на замораживание предмета, имеющего малую площадь, потребуется не менее 10-15 минут, что и говорить о Терминаторе.
8. Благодаря своим уникальным свойствам, жидкий азот можно использовать в качестве хладагента в специальных охлаждающих приборах, а также применять его в криотерапии. Лечение холодом активно используется при травме спортсменов.
9. Азот также широко применяется в пищевой промышленности. Поместив продукты питания в атмосферу из жидкого азота, можно надолго сохранить свежеть продуктов.
10. В некоторых случаях при производстве пива применяется азот. Его редкое использование в пивной промышленности связано с тем, что пузырьки газа подходят не для всех сортов этого напитка.
11. В колеса авиалайнеров помещают азот, что необходимо для обеспечения пожарной безопасности.
12. Рассматриваемый газ эффективен при тушении пожаров. В стандартных условиях при возгорании его не применяют, так как он быстро улетучивается на открытых пространствах. Однако в шахтах при возникновении пожара азот используется довольно часто.
13. В медицинской сфере закись азота, или по-другому оксид азота I, применяется в качестве наркоза при проведении оперативного вмешательства. Также закись азота применяется в автомобильной сфере – улучшение работы мотора. Сам по себе газ не горит, однако, хорошо поддерживает процесс возгорания.
14. Оксид азота II является опасным для человека. В каждом организме он содержится в малых количествах. В человеческом теле его называют окись азота. Она необходима для поддержания нормального функционирования сердца, что предохраняет от повышенного давления и инфаркта. Если у пациента обнаружены проблемы с сердцем, ему назначают продукты, богатые окисью азота – шпинат, свекла.
15. Соединение глицерина и азотной кислоты носит название нитроглицерин. Это вещество входит в состав не только таблеток от стенокардии, но и в состав взрывоопасного вещества.
16. Практически все взрывоопасные вещества изготавливаются с азотом.
17. Немаловажную роль азот играет в сельскохозяйственной сфере. Из него изготавливают удобрения, что во многом повышает урожайность.
18. В состав градусника для измерения температуры входит не только ртуть, но и азот.
19. Рассматриваемый газ входит не только в состав атмосферы Земли. Практически все планетные системы имеют в своем составе большое количество азота.
20. В начале 2017 года в Америке женщине подсадили эмбриона, который 24 года хранился в жидком азоте. Беременность и роды прошли успешно.
Дальнейшее исследование азота специалистами идет быстрыми темпами. Не исключено, что в дальнейшем, сфера его применения значительно расширится.
Содержание
История открытия азота
Окончательное имя «азот» дал французский ученый Антуан Лоран Лавуазье (Antoine Laurent de Lavoisier).
Слово «азот» греческого происхождения и означает «безжизненный».
Способы получения азота
Получение N2 в промышленных масштабах основано на производстве его из воздуха путем фракционной перегонки (см. получение азота).
Виды азота
Закись азота (N2O) не может быть получена из газообразного кислорода и N2, она образуется из азотнокислой соли аммония, которая при осторожном нагревании разлагается на закись азота и воду по реакции:
Газообразный азот относительно инертный по своим свойствам газ без цвета и запаха плотностью 1,25046 кг/м 3 при 0°C и давлении 101,3 кПа. Удельный объем газообразного азота равен 860,4 дм 3 /кг при давлении около 105 Па и температуре 20°C.
Но при высоких температурах ряд металлов (титан, молибден и др.) с азотом образуют нитриды, снижающие механические свойства и поэтому его концентрацию в зоне плавления стремятся ограничить.
Применение азота
Азот нашел применение во многих отраслях промышленности и ниже приведен небольшой список :
Применение азота в сварке
N2 является инертным по отношению к меди и ее сплавам (не растворяется в меди и не реагирует с ней) даже при высоких температурах. Азот применяют, как в чистом виде, так и в составе защитного газовой смеси с аргоном Ar (70-90%) + N2 (30-10%) для сварки меди и ее сплавов.
Возникает логичный вопрос: «Если он образует карбиды, какой смысл его использовать для сварки нержавеющих сталей, в составе которых есть карбидообразующие элементы?»
Все дело в том, что даже сравнительно небольшое содержание N2 увеличивает тепловую мощность дуги. Именно из-за этого свойства, его чаще всего используют не для сварки, а для плазменной резки.
При сварке полуавтоматом нержавейки добавление небольшого количества азота к смеси аргона с кислородом (95-97,5% Ar, 1% O2, 1,5-3% N2) позволяет добиться равномерной аустенитной структуры в сварных швах. При добавлении азота более 10% начинается обильное выделение дыма, но это не оказывает какого-либо негативного влияния на качество сварного шва нержавеющей стали.
При сварке полуавтоматом малоуглеродистых сталей содержание N2 в газовой смеси более 2% вызывает пористость при сварке в один проход. Концентрация N2 менее 0,5% вызывает пористость в сварном шве при многопроходной сварке.
Применение смеси Ar c высоким содержанием N2 для сварки меди и ее сплавов вызывает большое разбрызгивание металла сварочной ванны.
Вредность и опасность азота
Азот относится к нетоксичным газам, но может действовать как простой асфиксант (удушающий газ). Удушье наступает тогда, когда уровень кислорода в воздухе сокращается на 75% или становится ниже нормальной концентрации.
В больших количествах он очень вреден и опасен для организма человека.
Хранение и транспортировка азота
Выпускают азот по ГОСТ 9293 газообразным и жидким. Для сварки и плазменной резки применяют газообразный 1-го (99,6% N2) и 2-го (99,0% N2) сортов.
Хранят и транспортируют его в сжатом состоянии в стальных баллонах по ГОСТ 949.
Баллоны окрашены в черный цвет и надписью желтыми буквами «АЗОТ» на верхней цилиндрической части.
Характеристики азота
Характеристики N2 указаны в таблицах ниже:

 masterok
masterok