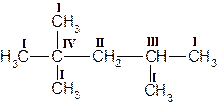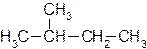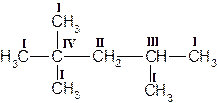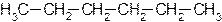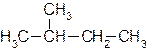Что такое вторичные атомы углерода
Приложение 1. Первичные, вторичные, третичные и четвертичные атомы углерода. Нормальная и разветвленная углеродная цепь.
В молекулах гомологов метана принято различать первичные, вторичные, третичные и четвертичные атомы углерода в зависимости от числа связей, направленных данным атомом на связь с другими атомами углерода. Первичным называется атом углерода, связанный непосредственно с одним атомом углерода (три оставшиеся валентности направлены на связь с атомами водорода); вторичным – с двумя атомами углерода. Третичный атом углерода связан непосредственно с тремя, а четвертичный – с четырьмя атомами углерода (рис. 1).
Рисунок 1. Структурная формула молекулы 2,2,4-триметилпентана. Первичные, вторичные, третичные и четвертичные атомы углерода обозначены соответственно цифрами I, II, III, IV.
Углеродную цепь относят к нормальной (неразветвленной), если она содержит только первичные и вторичные атомы углерода, например:
Соответствующий углеводород называют алканом нормального строения или просто нормальным алканом.
Если же в углеродной цепи содержатся третичные или четвертичные атомы углерода, то ее называют разветвленной. Алкан с такой цепью называют разветвленным, например:
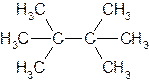
Алканы
Органическая химия
По мере изучения вы поймете, что свойства вещества определяются его строением, и научитесь легко предсказывать ход реакций 😉
Номенклатура алканов
Гомологами называют вещества, сходные по строению и свойствам, отличающиеся на одну или более групп CH2
Названия алканов формируются по нескольким правилам. Если вы знаете их, можете пропустить этот пункт, однако я должен познакомить читателя с ними. Итак, алгоритм составления названий следующий:
Внимательно изучите составленные для различных веществ названия ниже.
В углеводородной цепочке различают несколько типов атомов углерода, в зависимости от того, с каким числом других атомов углерода соединен данный атом. Различают первичные, вторичные, третичные и четвертичные атомы углерода.
Изомерия бывает структурной (межклассовая, углеродного скелета, положения функциональной группы или связи) и пространственной (геометрической, оптической). По мере изучения классов органических веществ вы узнаете о всех этих видах.
В молекулах алканов отсутствуют функциональные группы, кратные связи. Для алканов возможна изомерия только углеродного скелета. Так у пентана C5H12 существует 3 структурных изомера.
Природный газ и нефть
В состав нефти входят алканы с длинными углеродными цепочками, например: C8H18, C12H26. Путем крекинга из нефти получают алканы.
Получение алканов
В ходе крекинга нефти получается один алкан и один алкен.
Данный синтез заключается в сплавлении соли карбоновой кислоты с щелочью, в результате образуется алкан.
Эта реакция заключается во взаимодействии галогеналкана с металлическим натрием, калием или литием. В результате происходит удвоение углеводородного радикала, рост цепи осуществляется зеркально: в том месте, где находился атом галогена.
В ходе синтеза Гриньяра с помощью реактива Гриньяра (алкилмагнийгалогенида) получают различные органические соединения, в том числе несимметричные (в отличие от реакции Вюрца).
На схеме выше мы сначала получили реактив Гриньяра, а потом использовали его для синтеза. Однако можно записать получение реактива Гриньяра и сам синтез в одну реакцию, как показано на примерах ниже.
В результате электролиза солей карбоновых кислот может происходить образование алканов.
Химические свойства алканов
Реакции с хлором на свету происходят по свободнорадикальному механизму. На свету молекула хлора распадается на свободные радикалы, которые и осуществляют атаку на молекулу углеводорода.
Реакция Коновалова заключается в нитровании алифатических (а также ароматических) соединений разбавленной азотной кислотой. Реакция идет при повышенном давлении, по свободнорадикальному механизму.
Все органические вещества, в их числе алканы, сгорают с образованием углекислого газа и воды.
В ходе каталитического, управляемого окисления, возможна остановка на стадии спирта, альдегида, кислоты.
В реакциях, по итогам которых образуются изомеры, используется характерный катализатор AlCl3.
Вам уже известно, что в результате крекинга образуется один алкан и один алкен. Это не только способ получения алканов, но и их химическое свойство.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Приложение 1. Первичные, вторичные, третичные и четвертичные атомы углерода. Нормальная и разветвленная углеродная цепь.
В молекулах гомологов метана принято различать первичные, вторичные, третичные и четвертичные атомы углерода в зависимости от числа связей, направленных данным атомом на связь с другими атомами углерода. Первичным называется атом углерода, связанный непосредственно с одним атомом углерода (три оставшиеся валентности направлены на связь с атомами водорода); вторичным – с двумя атомами углерода. Третичный атом углерода связан непосредственно с тремя, а четвертичный – с четырьмя атомами углерода (рис. 1).
Рисунок 1. Структурная формула молекулы 2,2,4-триметилпентана. Первичные, вторичные, третичные и четвертичные атомы углерода обозначены соответственно цифрами I, II, III, IV.
Углеродную цепь относят к нормальной (неразветвленной), если она содержит только первичные и вторичные атомы углерода, например:
Соответствующий углеводород называют алканом нормального строения или просто нормальным алканом.
Если же в углеродной цепи содержатся третичные или четвертичные атомы углерода, то ее называют разветвленной. Алкан с такой цепью называют разветвленным, например:
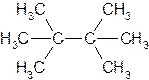
Что такое вторичные атомы углерода
Тема 2. Углеводороды
Соединения углерода с водородом, имеющие нормальные (неразветвленные) и разветвленные цепи, носят название «алканы» (синонимы – парафины (устар.), алифатические углеводороды, насыщенные углеводороды).
2.1.1. Физические свойства
Метан, этан, пропан, бутан в нормальных условиях – газы; пентан, гексан, гептан – жидкости и т.д.
С увеличением числа атомов углерода температура кипения возрастает. При одинаковом количестве атомов углерода в молекулах изомеров алканов температура кипения падает с увеличением степени разветвленности молекулы, а температура плавления, напротив, возрастает (вследствие более компактной упаковки «сферических» молекул разветвленных алканов в кристаллической решетке). Чем симметричнее построена молекула, тем легче и прочнее ее упаковка в кристалл и тем выше температура плавления. Факторы, влияющие на температуру кипения, меньше сказываются на температуре плавления, так как при плавлении силы Ван-дер-Ваальса лишь незначительно ослабляются.
Алканы нерастворимы в воде, ограниченно смешиваются с метанолом и этанолом. Чистые алканы не обладают запахом. Специфический запах бензину, керосину и дизельному топливу придают примеси. Характерный запах природного и сжиженного газов обусловлен тем, что в них специально добавляют примеси сернистых соединений углеводородов (тиоспирты и тиоэфиры), чтобы облегчить определение утечек газа без специальных приборов, т.е. органолептически. Запах сернистых соединений ощущается уже при очень малых их количествах.
Для наименования алканов используется как тривиальные названия, так и систематическая (IUPAC) и рациональная (заместительная) номенклатуры.
Первые четыре члена гомологического ряда алканов (метан, этан, пропан и бутан) имеют тривиальные названия. Тривиальные названия имеют и некоторые другие соединения, например, изооктан (2,2,4-триметилпентан) и неопентан (2,2-диметилпропан).
Наименования линейных молекул алканов с числом атомов углерода 5 и более образуются от имен греческих числительных (пентан, гексан, гептан, октан, нонан и декан – соответственно С5, С6, С7, С8, С9 и С10). Алканы с числом атомов углерода от 11 до 19 носят наименования с приставкой декан (соответственно, ундекан С11, додекан С12, тридекан С13, тетрадекан С14, пентадекан С15, гексадекан С16 и т.д.), а начиная с 20 атомов углерода – козаны (эйкозан С20, генэйкозан С21, докозан С22, трикозан С23, тетракозан С24, пентакозан С25, гексакозан и т.д.).
Углеводороды с числом атомов углерода в молекуле 30–39 называют триаконтанами (триаконтан С30, гентриаконтан С31, дотриаконтан С32, тритриаконтан С33, тетратриаконтан С34 и т.д.).
2.1.2.1. Правила наименования по номенклатуре IUPAC
1. В молекуле отыскивается наиболее длинная цепь из углеродных атомов, вне зависимости от того, в каком направлении она располагается, куда «поворачивает» и т.д. Если таких самых длинных цепей (путей) окажется два варианта, выбирают тот, который включает максимальное число заместителей:
2. Цепь нумеруют с того края, куда ближе заместитель. Поскольку определение этого условия «на глаз» достаточно субъективно, следует пользоваться простым правилом – верным следует считать тот порядок нумерации атомов углерода цепи, который приводит к минимальной сумме номеров заместителей. Если цепь имеет два разных заместителя, каждый из которых равноудален от «своего» края цепи, цепь нумеруют от заместителя, чье название по алфавиту начинается раньше. При этом приставки изо-, втор- и трет- не учитываются:
4. Заместители перечисляют в алфавитном порядке (бутил, метил, пропил, этил и т.д.). Название формируется перечислением номеров заместителей, их наименований и завершается названием углеводорода, образующего самую длинную выделенную цепь.
2.1.2.2. Рациональная (заместительная) номенклатура
По этой номенклатуре выделяют метановое (или этановое) звено в структуре соединения и перечисляют заместители, дополняющие структуру:
Ясно, что применение рациональной номенклатуры ограничено сравнительно несложными по структуре соединениями.
2.1.2.3. Классификация заместителей
В ссылку – таблицу, в отдельное окно
Разница между первичными вторичными и третичными галогеноалканами
В ключевое отличие Между первичным вторичным и третичным галогеноалканами находится положение атома углерода, который несет атом галогена. В первичных галогеналканах атом углерода, который несет атом
Содержание:
В ключевое отличие Между первичным вторичным и третичным галогеноалканами находится положение атома углерода, который несет атом галогена. В первичных галогеналканах атом углерода, который несет атом галогена, присоединен только к одной алкильной группе. Но во вторичных галогеноалканах этот атом углерода присоединен к двум алкильным группам. Тогда как в третичных галогеналканах этот атом углерода присоединен к трем алкильным группам.
Что такое первичные галогеноалканы?
Первичные галогеноалканы представляют собой органические соединения, у которых есть атом углерода, присоединенный к одной алкильной группе и одному атому галогена. Следовательно, общая структура первичных галогеноалканов представляет собой R-CH2-ИКС; R представляет собой алкильную группу, а X представляет собой галоген. Мы можем обозначить их как 1 0 галогеналканы. Типичным примером является галотан, который содержит этильную группу в качестве группы R и атом хлора в качестве группы X или галогена. Однако метилгалогениды являются исключением из этих первичных галогеналкановых структур, поскольку они имеют три атома водорода, присоединенные к атому углерода, который несет атом галогена. Это означает, что к этим соединениям не присоединены алкильные группы. Но они считаются первичными галогеналканами.
Более того, если мы рассмотрим реакционную способность первичных галогеноалканов, атом углерода, который присоединен к атому галогена, является реакционным центром, потому что галоген более электроотрицателен, чем углерод; таким образом, он придает частичный положительный заряд атому углерода, притягивая к себе электроны связи. Кроме того, эти соединения могут быть атакованы нуклеофильными реагентами, которые ищут положительные заряды. Итак, это приводит к реакции нуклеофильного замещения. И эта реакция имеет высокий энергетический барьер активации. Это реакция типа SN2, и мы называем ее бимолекулярной реакцией.
Что такое вторичные галогеноалканы?
Реакционная способность вторичного галогеналкана находится между реакционными способностями первичного и третичного галогеналканов, потому что присутствие двух алкильных групп снижает положительный заряд на атоме углерода, поскольку алкильные группы являются электроноакцепторными частицами.
Что такое третичные галогеноалканы?
Атом углерода, который несет атом галогена, имеет очень низкий положительный заряд, потому что к этому атому углерода присоединены три электроноакцепторные группы. Следовательно, это не требует образования высокоэнергетических промежуточных продуктов, и нуклеофил может напрямую атаковать ион карбония, как только он образуется. Вот почему мы называем это мономолекулярной реакцией.
В чем разница между первичными вторичными и третичными галогеноалканами?
Галогеноалканы бывают трех типов в зависимости от структуры; первичные, вторичные и третичные галогеноалканы. В первичных галогеноалканах атом углерода, который несет атом галогена, присоединен только к одной алкильной группе, а во вторичных галогеноалканах этот атом углерода присоединен к двум алкильным группам, тогда как в третичных галогеналканах этот атом углерода присоединен к трем алкильным группам. Итак, это ключевое различие между первичными вторичными и третичными галогеноалканами.
Следующая инфографика суммирует разницу между первичными вторичными и третичными галогеноалканами.
В зависимости от структуры существует три типа галогеноалканов; первичные, вторичные и третичные галогеноалканы. Ключевое различие между первичными вторичными и третичными галогеноалканами заключается в том, что в первичных галогеноалканах атом углерода, который несет атом галогена, присоединен только к одной алкильной группе. А во вторичных галогеноалканах этот атом углерода присоединен к двум алкильным группам. Между тем, в третичных галогеноалканах этот атом углерода присоединен к трем алкильным группам.