Что такое валентность видео
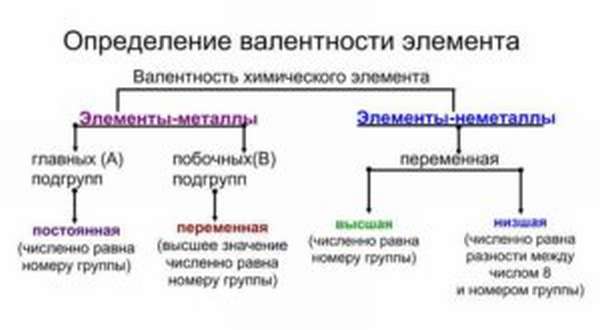
Как определить валентность химического элемента по таблице
Когда мы говорим о химии, мы подразумеваем строительные блоки Вселенной. Все элементы действуют как кирпичи конструктора Лего, присоединяясь друг к другу, пока не создадут нечто большее, например, металлы, воду, химические соединения и даже живых существ. Иногда они не стыкуются и разваливаются или взрываются, ухудшая свои основные формы. Именно эти связи и реакции составляют Вселенную, какой мы ее знаем и видим.
Хотя все вещи на нашей планете состоят из отдельных атомов и элементов, различия между объектами и видами заключаются в способности элементов сочетаться с другими элементами. Как вы, наверное, уже знаете, валентность элемента измеряет его способность сочетаться с другими, а число электронов внутри внешней оболочки элемента называется валентностью.
Как определить валентность элемента
Второй метод — посмотреть на общее количество электронов, а затем вычислить их число по атомному номеру. Как только вы узнаете количество электронов, вы можете легко вычислить валентность. Все атомы, кроме водорода, имеют два электрона в первой электронной оболочке и до восьми в каждой последующей. Например, атомный номер хлора равен 17, что делает конфигурацию электронов равной:
То есть валентность хлора равна 7. Кислород имеет восемь электронов, два в первой оболочке и шесть во внешних оболочках, давая ему число 2. Вы можете рассчитать многоэлементные молекулы таким же образом. Например, чтобы определить тетраоксид фосфора, вы должны умножить атомы кислорода (валентность 2) и вычесть из валентности фосфора 5, получив число 3.
Ознакомьтесь с электронной конфигурацией каждого уровня оболочки. Каждый атом имеет два электрона на своей внутренней оболочке и до восьми электронов на каждой оболочке. Например, поскольку литий имеет три электрона, он будет иметь два внутри и один электрон на своей внешней оболочке.
Правило октета
При определении атома или молекулы (для которой вы не можете использовать периодическую таблицу), химики используют правило октета. Согласно этому правилу, атомы и химические вещества объединяются таким образом, чтобы образовать восемь электронов во внешней оболочке любого соединения, которое они образуют. Когда атом или молекула имеет от одного до четырех электронов в своей внешней оболочке, он имеет положительную валентность, то есть он жертвует свои свободные электроны. Когда число электронов составляет:
— вы определяете его способности путем вычитания электронного числа из 8. Это потому, что атом или молекула легче принимает электроны для достижения стабильности.
Определение по таблице Менделеева
С помощью этого метода вы не можете найти валентность меди, золота или железа, потому что у них много активных электронных оболочек. Это справедливо для всех переходных металлов в колонках 3–10, более тяжелых элементов в колонках с 11 по 14, лантаноидов (элементы 57–71) и актинидов (элементы 89–103).
Определение зависимости от химических формул
Вы можете определить переходный элемент или радикал в конкретном соединении, заметив, как он сочетается с элементами известной валентности. Эта стратегия основана на правиле октета, которое говорит нам о том, что элементы и радикалы объединяются, чтобы создать стабильную внешнюю оболочку из восьми электронов.
Например, железо (Fe) представляет собой переходный металл, который может проявлять множественные валентности. Когда он сочетается с сульфатным радикалом с образованием сульфата железа, FeSO4, он должен иметь +2 поскольку сульфатный радикал, определяется по связи, которую он образует с водородом.
Видео
Из этого видео вы узнаете, как определять валентность элементов по формулам.
Видеоурок по химии «Валентные возможности атомов. Степень окисления»
Цель урока: повторить и углубить знания учащихся о валентности и степени окисления атомов, познакомить с понятием валентные возможности атомов.
Задачи урока:
Данный материал будет полезен учащимся 11 классов при подготовке к ЕГЭ, при закреплении и повторении изученного материала в предыдущих классах.
Как вы знаете, атомы большинства химических элементов взаимодействуют с другими атомами и образуют множество соединений. Но почему так происходит? Ответ на этот вопрос долгое время оставался неизвестен.
Первой попыткой объяснить химическое взаимодействие была теория Бертолле. Атомы должны притягиваться друг к другу тем сильнее, чем больше их массы. А по электрохимической теории Берцелиуса, каждый атом имеет два противоположно заряженных полюса. Теория делила все элементы на два класса — металлы с преобладанием положительного заряженного полюса и металлоиды с отрицательным заряженным полюсом. Причём считалось, что соединяться друг с другом могли лишь атомы противоположной электрической природы.
Эта теория была отвергнута, когда выяснилось, что элементы одного и того же класса также могут соединяться друг с другом. И только лишь в 20 столетии возникли два направления теории химического взаимодействия на основе электронных представлений, основные положения которых были сформулированы Косселем и Льюисом. С точки зрения Косселя, движущей причиной химического взаимодействия является «стремление» атомов к достижению наиболее устойчивых электронных конфигураций. Основной недостаток теории Косселя в том, что не все соединения могут рассматриваться с ионной точки зрения. Между тем идея Льюиса об образовании электронной пары позволяет охватить самые разнообразные случаи валентной связи и сохраняет свое значение до сих пор.
Впервые понятие «валентности» как соединительной силы ввел Э. Франкланд. Он считал, что взаимодействие разнообразных атомов происходит благодаря валентным силам.
Из всего вышесказанного приходим к выводу, валентность — это мера способности атомов притягиваться друг к другу посредством общих электронных пар. Валентность, как правило, обозначается римской цифрой. Рассмотрим электронные конфигурации атомов, чтобы разобраться, как возникают валентные взаимодействия между атомами.
В основном состоянии на внешних энергетических уровнях, а иногда и на предвнешних уровнях атомов, могут находиться спаренные и неспаренные электроны. Валентность атома определяется числом неспаренных электронов, принимающих участие в образовании химической связи.
У s- и p-элементов валентные электроны расположены на s- и p-подуровнях внешнего энергетического уровня.
Например, литий, у которого заряд ядра +3, 3 электрона, это s-элемент, атом имеет один неспаренный s-электрон, значит валентность лития I.
Рассмотрим другой пример, азот. Заряд его атома +7, у него 7 электронов. Это p-элемент. Соответственно, азот имеет 5 валентных электронов — два спаренных s- электрона и 3 неспаренных p-электрона.
У d-элементов валентные электроны находятся на s-подуровне последнего энергетического уровня и d-подуровне предвнешнего энергического уровня.
Например, у атома титана заряд ядра +22, соответственно столько же электронов — 22. Титан имеет 4 валентных электрона, 2 спаренных s-электронов и два неспаренных d-электронов.
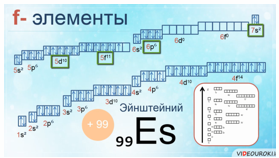
У f-элементов валентные электроны располагаются на s-подуровне последнего энергетического уровня и d-подуровне предпоследнего энергетического уровня и f- подуровня, третьего с края энергетического уровня.
Например, у атома эйнштейния заряд ядра +99, столько же у него и электронов. Эйнштейний имеет 13 валентных электронов, 12 спаренных и 1 неспаренный на 5f-подуровне. Этому элементу было присвоено название эйнштейний в честь выдающегося ученого двадцатого столетия Альберта Эйнштейна, внесшего большой вклад в науку об атоме и атомном ядре.
Следует усвоить, что основные свойства элементов определяются валентными электронами, а уровни, подуровни, на которых располагаются валентные электроны, называются валентными. Самыми первыми вступают в реакцию неспаренные электроны, расположенные на внешнем энергетическом уровне. Количеством этих неспаренных электронов и определяет валентность. Если на спаренные электроны, при имеющейся свободной орбитали в атоме, подействует энергия извне, эти электроны распариваются и атом переходит из основного состояния в возбужденное. Энергия, затраченная на переход электронов, компенсируется при образовании новых связей.
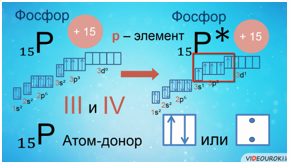
Валентные возможности атомов также определяются числом пустых орбиталей и числом неподеленных электронных пар. Атом-донор предоставляет неподеленную электронную пару атому-акцептору, который имеет свободные орбитали.
Например, заряд ядра атома фосфора +15, число электронов 15. В основном состоянии атом фосфора, который относится к p-элементам, на внешнем уровне содержит 1 пару спаренных электронов и 3 неспаренных электрона. Поэтому, он проявляет валентность III, так как у него 3 неспаренных p-электрона. Валентность азота IV, так как атом фосфора это атом-донор, который может предоставить пару электронов для образования химической связи.
При имеющихся вакантных орбиталях на 3d-подуровне и паре спаренных электронов на 3s-подуровне атом фосфора может переходить в возбужденное состояние. Это происходит за счёт распаривания и перехода электрона на свободную орбиталь другого подуровня. В атоме появляется 5 неспаренных электронов, что и обеспечивает возможность существования валентности атома фосфора — V.
Поэтому, если у элементов на внешнем энергетическом уровне есть неспаренные электроны, то они являются активными элементами или реакционноспособными. А если на внешнем уровне электроны находятся только в спаренном состоянии, тогда эти элементы относят к малоактивным.
Например, к малоактивным химическим элементам относят VIIIA группу химических элементов Периодической системы. Их так и называют — благородные или инертные (малоактивные) химические элементы — так как на внешнем слое этих элементов все электроны находятся в спаренном состоянии. Нет свободных или неспаренных электронов, которые образовывали связи с электронами других химических элементов.
Следует запомнить, что s-, d-, f-элементы — это металлические элементы, кроме некоторых исключений. Так как на последнем уровне у них электронов меньше, чем 3; у неметаллических элементов, наоборот, на последнем уровне электронов больше, чем 4.
P-элементы могут быть металлические и неметаллические. Рассмотрим Периодическую систему химических элементов. По диагонали от бора к астату все p-элементы выше диагонали — неметаллические, ниже — металлические. По строению элементы, у которых на внешнем энергетическом уровне 3 или 4 электрона, считаются переходными элементами; многие d-элементы — металлические с переходными свойствами.
У элементов в соединении можно определить не только валентность, но и степень окисления. Степень окисления — это условный заряд атома — положительный или отрицательный, в зависимости от смещения электронов от атома или к нему, если считать все связи в веществе ионными. Степень окисления и валентность это не одно и тоже понятие. Например, атом углерода в органических соединениях четырёхвалентен, однако степени окисления имеет различные.
Степень окисления может быть минимальной, промежуточной и максимальной.
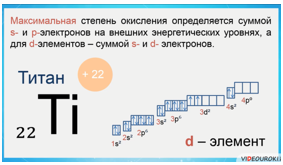
Максимальная степень окисления определяется суммой s- и p-электронов на внешних энергетических уровнях, а для d-элементов — суммой s- и d-электронов.
Например, атом титана — это d-элемент, металлический. На внешнем электронном слое у него находится 4 электрона. Значит, максимальная степень окисления титана +4.
Промежуточными степенями окисления считаются значения между минимальной и максимальной степенями окисления в атомах химических элементов.
В соединениях более сложного состава необходимо расставить известные степени окисления химических элементов, а неизвестную степень окисления обозначить, например, за «x». Далее так же, как и в бинарных соединениях решаем уравнение с одной неизвестной и получаем ответ по абсолютной величине.
В простых веществах с неполярной ковалентной связью степень окисления равна 0. Степень окисления углерода в органических соединениях определяется у каждого в отдельности, учитывая степень окисления элементов, связанных с ним.
Как самостоятельно определить валентность по таблице Менделеева
Различные химические элементы отличаются по своей способности создавать химические связи, то есть соединяться с другими атомами. Поэтому в сложных веществах они могут находиться только в определенных соотношениях. Разберемся, как определить валентность по таблице Менделеева.
Что такое валентность?
В качестве единицы используется эта характеристика для водорода, которая принята равной I. Это свойство показывает, с каким числом одновалентных атомов может соединиться данный элемент. Для кислорода эта величина всегда равна II.
Знать эту характеристику необходимо, чтобы верно записывать химические формулы веществ и уравнения реакций. Знание этой величины поможет установить соотношение между числом атомов различных типов в молекуле.
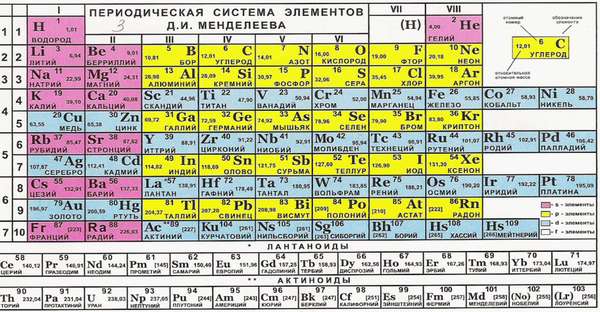
Чем поможет периодическая таблица?

Такие свойства имеют металлы главных подгрупп. Почему? Номер группы соответствует числу электронов на внешней оболочке. Эти электроны называются валентными. Именно они отвечают за возможность соединяться с другими атомами.
Группу составляют элементы с похожим устройством электронной оболочки, а сверху вниз возрастает заряд ядра. В короткопериодной форме каждая группа делится на главную и побочную подгруппы. Представители главных подгрупп — это s и p-элементы, представители побочных подгрупп имеют электроны на d и f-орбиталях.
Как определить валентность химических элементов, если она меняется? Она может совпадать с номером группы или равняться номеру группы минус восемь, а также принимать другие значения.
Важно! Чем выше и правее элемент, тем его свойство образовывать взаимосвязи меньше. Чем он более смещен вниз и влево, тем она больше.

В основном (невозбужденном) состоянии у серы два неспаренных электрона находятся на подуровне 3р. В таком состоянии она может соединиться с двумя атомами водорода и образовать сероводород. Если сера перейдет в более возбужденное состояние, то один электрон перейдет на свободный 3d-подуровень, и неспаренных электронов станет 4.
Сера станет четырехвалентной. Если сообщить ей еще больше энергии, то еще один электрон перейдет с подуровня 3s на 3d. Сера перейдет в еще более возбужденное состояние и станет шестивалентной.
Постоянная и переменная
Иногда способность к образованию химических связей может меняться. Она зависит от того, в какое соединение входит элемент. Например, сера в составе H2S двухвалентна, в составе SO2 четырехвалентна, а в SO3 — шестивалентна. Наибольшее из этих значений называется высшим, а наименьшая — низшим. Высшую и низшую валентности по таблице Менделеева можно установить так: высшая совпадает с номером группы, а низшая равняется 8 минус номер группы.

Это интересно! Что такое алканы: строение и химические свойства
В соединениях низшую валентность проявляет тот элемент, который находится выше и правее в периодической таблице, соответственно, высшую — тот, который левее и ниже.
Часто способность образовывать химические связи принимает больше двух значений. Тогда по таблице узнать их не получится, а нужно будет выучить. Примеры таких веществ:
Как определить валентность элемента в формуле соединения? Если она известна для других составляющих вещества, это несложно. Например, требуется рассчитать это свойство для хлора в NaCl. Натрий — элемент главной подгруппы первой группы, поэтому он одновалентен. Следовательно, хлор в этом веществе тоже может создать только одну связь и тоже одновалентен.
Важно! Однако так не всегда можно узнать это свойство для всех атомов в сложном веществе. Для примера возьмем HClO4. Зная свойства водорода, можно только установить, что ClO4 — одновалентный остаток.
Как еще узнать эту величину?
Способность образовывать определенное количество связей не всегда совпадает с номером группы, и в некоторых случаях ее придется просто заучить. Здесь на помощь придет таблица валентности химических элементов, где приведены значения этой величины. В учебнике химии за 8 класс приведены значения способности соединяться с другими атомами наиболее распространенных видов атомов.
| Н, F, Li, Na, K | 1 |
| O, Mg, Ca, Ba, Sr, Zn | 2 |
| B, Al | 3 |
| C, Si | 4 |
| Cu | 1, 2 |
| Fe | 2, 3 |
| Cr | 2, 3, 6 |
| S | 2, 4, 6 |
| N | 3, 4 |
| P | 3, 5 |
| Sn, Pb | 2, 4 |
| Cl, Br, I | 1, 3, 5, 7 |
Применение

Однако рассматриваемое понятие применяют в методических целях. С его помощью легко объяснить, почему атомы разных видов соединяются в тех соотношениях, которые мы наблюдаем, и почему эти соотношения для разных соединений различны.
На данный момент подход, согласно которому соединение элементов в новые вещества всегда объяснялось с помощью валентности по таблице Менделеева независимо от типа связи в соединении, устарел. Сейчас мы знаем, что для ионной, ковалентной, металлической связей существуют разные механизмы объединения атомов в молекулы.
Полезное видео
Подведем итоги
По таблице Менделеева определить способность к образованию химических связей возможно не для всех элементов. Для тех, которые проявляют одну валентность по таблице Менделеева, она в большинстве случаев равна номеру группы. Если есть два варианта этой величины, то она может быть равна номеру группы или восемь минус номер группы. Существуют также специальные таблицы, по которым можно узнать эту характеристику.
Как определить валентность.
В этой статье рассмотрим способы и поймем, как определить валентность элементов таблицы Менделеева.
В химии принято, что валентность химических элементов можно узнать по группе (колонке) в таблице Менделеева. В действительности не всегда валентность элемента соответствует номеру группы, но в большинстве случаев определенная валентность по такому методу даст правильный результат часто элементы, в зависимости от разных факторов, имеют не одну валентность.
За единицу валентности принята валентность атома водорода, равная 1, то есть водород одновалентен. Поэтому валентность элемента указывает на то, со сколькими атомами водорода соединён один атом рассматриваемого элемента. Например, HCl, где хлор – одновалентен; H2O, где кислород – двухвалентен; NH3, где азот – трёхвалентен.
Как определить валентность по таблице Менделеева.
Таблица Менделеева содержит в себе химические элементы, которые размещены в ней по определенным принципам и законам. Каждый элемент стоит на месте, который определяется его характеристиками и свойствами и каждый элемент имеет свой номер. Горизонтальные линии называются периодами, которые возрастают от первой строки вниз. Если период состоит из двух рядов (что указано сбоку нумерацией), то такой период называется большим. Если он имеет только один ряд, то называется малым.
Валентностью называют способность атома образовывать некоторое количество химических связей с атомами других элементов. Как определить валентность по таблице Менделеева поможет понять знание видов валентности.
Виды валентности
Постоянная (у металлов главных подгрупп)
Переменная (у неметаллов и металлов побочных подгрупп)
Высшая (равна номеру группы)
Низшая (равна разности между числом 8 и номером группы)
Для элементов побочных подгрупп (а к ним относятся только металлы) валентность нужно запоминать, тем более что в большинстве случае она равна I, II, реже III. Также придется заучить валентности химических элементов, которые имеют более двух значений. Или постоянно держать под рукой таблицу валентности элементов.
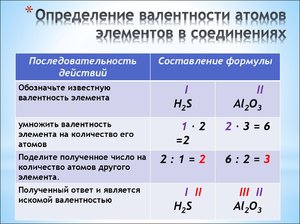
Алгоритм определения валентности по формулам химических элементов.
1. Записать формулу химического соединения.
2. Обозначить известную валентность элементов.
3. Найти наименьшее общее кратное валентности и индекса.
4. Найти соотношение наименьшего общего кратного к количеству атомов второго элемента. Это и есть искомая валентность.
5. Сделать проверку путём перемножения валентности и индекса каждого элемента. Их произведения должны быть равны.
Пример: определим валентность элементов сульфида водорода.
2. Обозначим известную валентность:
3. Найдём наименьшее общее кратное:
4. Найдём соотношение наименьшего общего кратного к количеству атомов серы:
Таблица валентности химических элементов
Таблица валентности химических элементов.
Таблица валентности химических элементов:
Ниже приводится таблица валентности химических элементов с примерами соединений.
Валентность (от лат. valēns – «имеющий силу») – способность атомов химических элементов образовывать определённое число химических связей.
Валентность – это мера (численная характеристика) способности химических элементов образовывать определённое число химических связей.
Значения валентности записывают римскими цифрами I, II, III, IV, V, VI, VII, VIII.
Валентность определяют по числу химических связей, которые один атом образует с другими.
Таблица валентности химических элементов:
Первоначально за единицу валентности была принята валентность атома водорода. Валентность другого элемента можно при этом выразить числом атомов водорода, которое присоединяет к себе или замещает один атом этого другого элемента. Определенная таким образом валентность называется валентностью в водородных соединениях или валентностью по водороду: так, в соединениях HCl, H2O, NH3, CH4 валентность по водороду хлора равна единице, кислорода – двум, азота – трём, углерода – четырём.
Валентность кислорода, как правило, равна двум. Поэтому, зная состав или формулу кислородного соединения того или иного элемента, можно определить его валентность как удвоенное число атомов кислорода, которое может присоединять один атом данного элемента. Определенная таким образом валентность называется валентностью элемента в кислородных соединениях или валентностью по кислороду: так, в соединениях K2O, CO, N2O3, SiO2, SO3 валентность по кислороду калия равна единице, углерода – двум, азота – трём, кремния – четырём, серы – шести.
С точки зрения электронной теории валентность определяется числом неспаренных (валентных) электронов в основном или возбужденном состоянии.
Известны элементы, которые проявляют постоянную валентность. У большинства химических элементов валентность переменная.