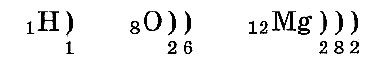Что такое валентная оболочка
Электронная оболочка
Электронная оболочка атома — область пространства вероятного местонахождения электронов, характеризующихся одинаковым значением главного квантового числа n и, как следствие, располагающихся на близких энергетических уровнях. Число электронов в каждой электронной оболочке не превышает определенного максимального значения.
Порядок заполнения электронных оболочек (орбиталей с одинаковым значением главного квантового числа n) определяется правилом Клечковского, порядок заполнения электронами орбиталей в пределах одного подуровня (орбиталей с одинаковыми значениями главного квантового числа n и орбитального квантового числа l) определяется Правилом Хунда.
Содержание
Оболочки
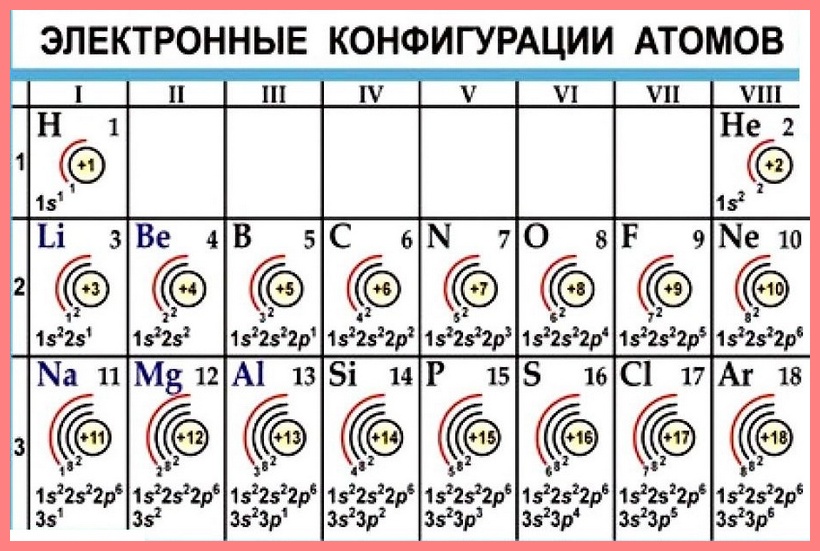
Электронные оболочки обозначаются буквами K, L, M, N, O, P, Q или цифрами от 1 до 7. Подуровни оболочек обозначаются буквами s, p, d, f, g, h, i или цифрами от 0 до 6. Электроны внешних оболочек обладают большей энергией, и, по сравнению с электронами внутренних оболочек, находятся дальше от ядра, что делает их более важными в анализе поведения атома в химических реакциях и в роли проводника, так как их связь с ядром слабее и легче разрывается.
Количество электронов в каждой оболочке
Данное количество вычисляется по формуле:
| 1 | 2 | 3 | 4 | 5 | 6 | Итого |
|---|---|---|---|---|---|---|
| 1 (K) | 2 | 2 | ||||
| 2 (L) | 2 | 6 | 8 | |||
| 3 (M) | 2 | 6 | 10 | 18 | ||
| 4 (N) | 2 | 6 | 10 | 14 | 32 | |
| 5 (O) | 2 | 6 | 10 | 14 | 18 | 50 |
Подуровни оболочек
Каждая оболочка состоит из одного или нескольких подуровней, каждый из которых состоит из атомных орбиталей. К примеру, первая оболочка (K) состоит из одного подуровня «1s». Вторая оболочка (L) состоит из двух подуровней, 2s и 2p. Третья оболочка — из «3s», «3p» и «3d». Возможные варианты подуровней оболочек приведены в следующей таблице:
| Обозначение подуровня | l | Макс. кол-во электронов | Содержание в оболочках | Историческое наименование |
|---|---|---|---|---|
| s | 0 | 2 | В каждой | sharp |
| p | 1 | 6 | Во всех, начиная со 2 | principal |
| d | 2 | 10 | Во всех, начиная с 3 | diffuse |
| f | 3 | 14 | Во всех, начиная с 4 | fundamental |
| g | 4 | 18 | Во всех, начиная с 5 | |
| h | 5 | 22 | Во всех, начиная с 6 | |
| i | 6 | 26 | Во всех, начиная с 7 |
Валентные оболочки
Валентная оболочка — самая внешняя оболочка атома. Электроны этой оболочки зачастую неверно называют валентными электронами, то есть электронами, определяющими поведение атома в химических реакциях. С точки зрения химической активности, наименее активными считаются атомы, в которых валентная оболочка окончательно заполнена (инертные газы). Наибольшей химической активностью обладают атомы, в которых валентная оболочка состоит всего из одного электрона (щелочные металлы), и атомы, в которых одного электрона не хватает для окончательного заполнения оболочки (галогены).
На самом деле всё немного иначе. Поведение атома в химических реакциях определяют электроны, обладающие большей энергией, то есть те электроны, которые расположены дальше от ядра. Электроны внутренних подуровней оболочек имеют меньшую энергию, чем электроны внешних подуровней. Несмотря на то, что электроны подуровня оболочки 3d могут не принадлежать к т. н. валентной оболочке, они могут иметь энергию большую, чем электроны подуровня оболочки 4s, что делает их валентными электронами.
Что такое валентная оболочка
Ключевые слова конспекта: строение электронных оболочек атомов первых 20 элементов Периодической системы Д.И. Менделеева, завершенный электронный слой, валентный слой, энергетические уровни, правило октета, орбиталь,
Электронная оболочка атома — это все электроны атома. Электроны в электронной оболочке атома расположены слоями. Электроны в разных слоях различаются энергией взаимодействия с ядром атома. Чем дальше от ядра находится электрон, тем меньше энергия его взаимодействия с ядром.
Вместимость электронных слоев различная. В слое № 1, или в первом слое, у всех элементов, кроме водорода, находится 2 электрона. (В атоме водорода всего 1. электрон, и он — в первом слое.) Во втором слое может находиться не больше восьми электронов. В третьем слое максимально может расположиться 18 электронов. В четвертом слое максимально бывает 32 электрона.
Завершенный электронный слой — это слой в атоме, содержащий максимально возможное для него число электронов.
Электронные слои заполняются так: сначала первый, потом второй и последующие — по мере уменьшения энергии их взаимодействия с ядром. Расположение по слоям электронов в атомах водорода, кислорода и магния:
Число электронных слоев атома равно номеру периода химического элемента в таблице Менделеева. Поэтому у атома водорода один электронный слой, у кислорода — два слоя, а у магния — три слоя.
Валентный слой — это внешний электронный слой. У водорода это 1-й слой, у кислорода — 2-й слой, у магния — 3-й слой. Валентные электроны — это электроны внешнего слоя. Внешний слой всегда содержит не больше восьми электронов. Восьми-электронный внешний слой характеризуется повышенной устойчивостью. (Это — «правило октета».)
Зная максимальное число электронов в каждом электронном слое атома, можно составить схему расположения электронов по слоям в заданном элементе. Электронные слои атомов называют энергетическими уровнями.
Химические свойства атомов определяются свойствами их электронов. Движение электронов в атоме описывают с привлечением понятия орбитали. Каждый электрон в атоме находится на своей орбитали.
Орбиталь — это часть электронного облака, создаваемого электронами при движении в атоме. Орбиталь — это пространство около ядра, где чаще всего находится электрон.
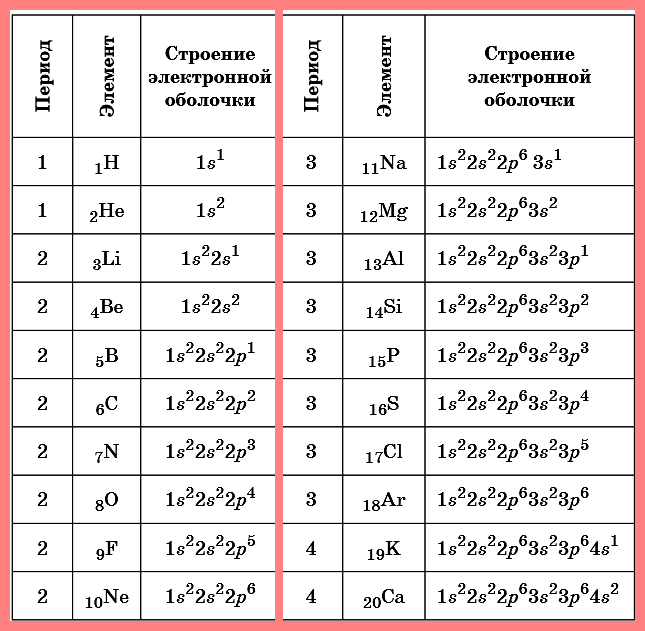
Таблица. Строение электронных оболочек атомов
первых 20 элементов Периодической системы Д.И. Менделеева
Фтор — элемент 2-го периода, т.к. в его электронной формуле два электронных слоя. Сумма всех надстрочных индексов — 9 (общее число электронов), это и атомный номер фтора. Элементы, у которых очередные электроны помещаются на s- и р-орбиталях, относятся к главным подгруппам таблицы Менделеева. Сумма электронов 2-го внешнего слоя дает номер группы — VII.
Конспект урока «Строение электронных оболочек атомов».
Атомы и электроны
Атомно-молекулярное учение
Описываемая модель атома называется «планетарной» и была предложена в 1913 году великими физиками: Нильсом Бором и Эрнестом Резерфордом
Запомните, что в невозбужденном состоянии атом содержит одинаковое число электронов и протонов. Так у кальция (порядковый номер 20) в ядре находится 20 протонов, а вокруг ядра на электронных орбиталях 20 электронов.
Я еще раз подчеркну эту важную деталь. На данном этапе будет отлично, если вы запомните простое правило: порядковый номер элемента = числу электронов. Это наиболее важно для практического применения и изучения следующей темы.
Электронная конфигурация атома
Электроны атома находятся в непрерывном движении вокруг ядра. Энергия электронов отличается друг от друга, в соответствии с этим электроны занимают различные энергетические уровни.
Состоит из s-подуровня: одной «s» ячейки (2s 2 ) и p-подуровня: трех «p» ячеек (2p 6 ), на которых помещается 6 электронов
Состоит из s-подуровня: одной «s» ячейки (3s 2 ), p-подуровня: трех «p» ячеек (3p 6 ) и d-подуровня: пяти «d» ячеек (3d 10 ), в которых помещается 10 электронов
Состоит из s-подуровня: одной «s» ячейки (4s 2 ), p-подуровня: трех «p» ячеек (4p 6 ), d-подуровня: пяти «d» ячеек (4d 10 ) и f-подуровня: семи «f» ячеек (4f 14 ), на которых помещается 14 электронов
Зная теорию об энергетических уровнях и порядковый номер элемента из таблицы Менделеева, вы должны расположить определенное число электронов, начиная от уровня с наименьшей энергией и заканчивая к уровнем с наибольшей. Чуть ниже вы увидите несколько примеров, а также узнаете об исключении, которое только подтверждает данные правила.
Подуровни: «s», «p» и «d», которые мы только что обсудили, имеют в определенную конфигурацию в пространстве. По этим подуровням, или атомным орбиталям, движутся электроны, создавая определенный «рисунок».
Правила заполнения электронных орбиталей и примеры
Должно быть, вы обратили внимание на некоторое несоответствие: после 3p подуровня следует переход к 4s, хотя логично было бы заполнить до конца 4s подуровень. Однако природа распорядилась иначе.
Запомните, что, только заполнив 4s подуровень двумя электронами, можно переходить к 3d подуровню.
Теперь мы располагаем указанное количество электронов на энергетических уровнях, руководствуясь правилами заполнения.
Обращаю ваше особе внимание: на 2p-подуровне углерода мы расположили 2 электрона в разные ячейки, следуя одному из правил. А на 3p-подуровне у серы электронов оказалось много, поэтому сначала мы расположили 3 электрона по отдельным ячейкам, а оставшимся одним электроном дополнили первую ячейку.
Внешний уровень и валентные электроны
Тренировка
Потренируйтесь и сами составьте электронную конфигурацию для магния и скандия. Определите число электронов на внешнем (валентном) уровне и число неспаренных электронов. Ниже будет дано наглядное объяснение этой задаче.
валентный электрон
СОДЕРЖАНИЕ
Обзор [ править ]
Электронная конфигурация [ править ]
Чем дальше вправо в каждой серии переходных металлов, тем ниже энергия электрона в подоболочке и тем меньше у такого электрона валентных свойств. Таким образом, хотя атом никеля в принципе имеет десять валентных электронов (4s 2 3d 8 ), его степень окисления никогда не превышает четырех. Для цинка подоболочка 3d является полной во всех известных соединениях, хотя она вносит вклад в валентную зону в некоторых соединениях. [4]
Подсчет д электронов является альтернативным инструментом для понимания химии переходного металла.
Число валентных электронов [ править ]
Количество валентных электронов элемента может быть определено группой периодической таблицы (вертикальный столбец), в которой этот элемент отнесен к категории. За исключением групп 3–12 ( переходные металлы ), цифра единиц номера группы указывает, сколько валентных электронов связано с нейтральным атомом элемента, указанного в этом конкретном столбце.
| Блок периодической таблицы | Группа периодической таблицы | Валентные электроны |
|---|---|---|
| s | Группа 1 (I) ( щелочные металлы ) | 1 |
| Группа 2 (II) ( щелочноземельные металлы ) и гелий | 2 | |
| ж | Лантаноиды и актиниды | 3–16 [а] |
| d | Группы 3-12 ( переходные металлы ) | 3–12 [b] |
| п | Группа 13 (III) ( группа бора ) | 3 |
| Группа 14 (IV) ( углеродная группа ) | 4 | |
| Группа 15 (V) ( пниктогены или азотная группа) | 5 | |
| Группа 16 (VI) ( халькогены или кислородная группа) | 6 | |
| Группа 17 (VII) ( галогены ) | 7 | |
| Группа 18 (VIII или 0) ( благородные газы ), кроме гелия | 8 |
Оболочка валентности [ править ]
Химические реакции [ править ]
Количество валентных электронов в атоме определяет его связывающее поведение. Следовательно, элементы, атомы которых могут иметь одинаковое количество валентных электронов, сгруппированы вместе в периодической таблице элементов.
Внутри каждой группы (каждого столбца периодической таблицы) металлов реакционная способность увеличивается с каждой нижней строкой таблицы (от легкого элемента к более тяжелому), потому что более тяжелый элемент имеет больше электронных оболочек, чем более легкий элемент; валентные электроны более тяжелого элемента существуют с более высокими главными квантовыми числами (они находятся дальше от ядра атома и, таким образом, имеют более высокие потенциальные энергии, что означает, что они менее тесно связаны).
Внутри каждой группы неметаллов реакционная способность уменьшается с каждой нижней строкой таблицы (от легкого элемента к тяжелому) в периодической таблице, потому что валентные электроны имеют все более высокие энергии и, таким образом, все менее прочно связаны. Фактически, кислород (самый легкий элемент в группе 16) является наиболее реакционноспособным неметаллом после фтора, хотя он и не является галогеном, потому что валентная оболочка галогена имеет более высокое главное квантовое число.
В этих простых случаях, когда соблюдается правило октета, валентность атома равна количеству электронов, полученных, потерянных или разделенных для формирования стабильного октета. Однако есть также много молекул, которые являются исключениями и для которых валентность менее четко определена.
Электропроводность [ править ]
Металл Металлоид Неметалл Неизвестные свойства Цвет фона показывает тенденцию металл – металлоид – неметалл в периодической таблице.