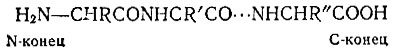Что такое n и с концы белков
Что такое n и с концы белков
Белок белку рознь
Вернемся, однако, к белкам.
Как ни велика, как ни длинна молекула белка, у нее есть два конца. На одном конце цепи находится аминокислота, в которой свободной является аминогруппа. Это N-концевая аминокислота. С другого конца цепи расположена аминокислота, в которой аминогруппа соединена связью со всей молекулой, а карбоксильная группа свободна. Это С-концевая аминокислота:
Первичная структура белка записывается как последовательность аминокислот, причем перечисление аминокислот начинают с N-конца и заканчивают С-концом. Для обозначения аминокислот в формулах белков часто пользуются сокращенными названиями (они приведены в сводной таблице на с. 76-78).
В 1958 г. Нобелевской премии по химии был удостоен английский ученый Сэнгер. Высшей наградой была увенчана многолетняя работа «по определению структуры белков, особенно инсулина». Первым белком, чью структуру удалось разгадать, стал инсулин. И сегодня химики используют принципы и методы расшифровки первичной структуры белков, впервые разработанные Сэнгером и его сотрудниками.
Сэнгер, который исследовал описанным методом инсулин, обнаружил, что на одну молекулу белка приходилась одна молекула N-концевого глицина и одна молекула N-концевого фенилаланина. Отсюда был сделан вывод, что молекула инсулина состоит из двух цепей (цепи А и В).
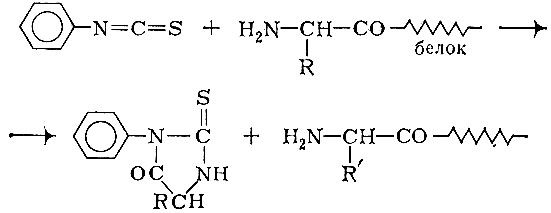
Метод Сэнгера позволяет определить, какие кислоты находятся в белке на N-конце. Но как узнать расположение других аминокислот? Для этого существуют другие методы, один из них предложен Эдманом. Аминокислоты последовательно отщепляют, начиная с N-конца, для чего проводят реакцию с фенилизотиоцианатом. Образуется циклический продукт. При этом обнажается следующая аминокислота, с которой поступают аналогичным образом. Вот так, «отщепляя» аминокислоты одну за другой, узнают первичную структуру полипептидов:
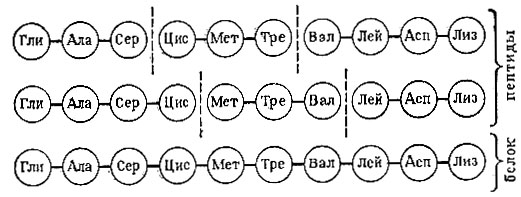
Однако исследователи не отщепляют по методу Эдмана аминокислоты от целой белковой цепи. Перед анализом длиннейшую цепь расщепляют при помощи ферментов на отдельные полипептидные куски, после чего определяют последовательность аминокислот в каждом куске и, наконец, составляют так называемую карту с перекрывающимися аминокислотными остатками.
Мы имеем шесть кусков, в каждом по три или четыре аминокислоты. Записав одинаковые аминокислоты (и одинаковые фрагменты) одну под другой, можно собрать последовательность всех десяти аминокислот. Нужно ли говорить, насколько сложнее приведенной схемы определение структуры реальных белков?!
Есть и другие способы установления структуры белков. Созданы полуавтоматические приборы, в которых осуществляется последовательное отщепление аминокислот и на этой основе определяется их последовательность. С такими приборами расшифровка структуры белка существенно упрощается.
В C-конец (также известный как карбоксильный конец, карбокси-конец, С-концевой хвост, С-концевой конец, или же COOH-конец) является концом аминокислота цепь (белок или же полипептид), прекращенная свободным карбоксильная группа (-COOH). Когда белок транслируется с информационной РНК, он создается из N-конец к C-концу. При записи пептидных последовательностей принято помещать C-конец справа и записывать последовательность от N- до C-конца.
Содержание
Химия
Каждая аминокислота имеет карбоксильную группу и амин группа. Аминокислоты соединяются друг с другом, образуя цепочку реакция дегидратации который соединяет аминогруппу одной аминокислоты с карбоксильной группой следующей. Таким образом, полипептидные цепи имеют конец с несвязанной карбоксильной группой, С-конец, и конец с несвязанной аминогруппой, N-конец. Белки синтезируются естественным путем, начиная с N-конца и заканчивая C-концом.
Функция
Сигналы удержания С-конца
C-терминальные модификации
С-конец белков можно модифицировать посттрансляционно, чаще всего путем добавления липид якорь к С-концу, который позволяет белку быть вставленным в мембрану без наличия трансмембранный домен.
Пренилирование
Одной из форм модификации C-терминала является пренилирование. Во время пренилирования фарнезил- или же геранилгеранил-изопреноидный мембранный якорь добавляется к остатку цистеина около С-конца. Маленький, мембранный G белки часто модифицируются таким образом.
Якоря GPI
Другой формой модификации С-конца является добавление фосфогликана, гликозилфосфатидилинозитол (GPI), как мембранный якорь. Якорь GPI прикрепляется к С-концу после протеолитического расщепления С-концевого пропептида. Наиболее ярким примером этого типа модификации является прион белок.
С-концевой домен
С-концевой домен некоторых белков выполняет специализированные функции. У людей CTD РНК-полимераза II обычно состоит из 52 повторов последовательности Tyr-Ser-Pro-Thr-Ser-Pro-Ser. [1] Это позволяет другим белкам связываться с С-концевым доменом РНК-полимеразы, чтобы активировать активность полимеразы. Эти домены затем участвуют в инициация транскрипции ДНК, укупорка из Транскрипт РНК, и привязанность к сплайсосома за Сплайсинг РНК. [2]
Что такое n и с концы белков
• Адресование белка на ЭПР обеспечивается сигнальной последовательностью, представляющей собой короткую цепочку остатков аминокислот, расположенную обычно с N-концевой стороны
• Единственной особенностью, общей для всех сигнальных последовательностей, является наличие центрального гидрофобного внутреннего участка. Обычно этого участка оказывается достаточно для транслокации любого белка
Все белки, структура которых закодирована в ядре, начинают свой биогенез в цитозоле. Первым этапом транслокации белков через мембрану ЭПР, который необходимо преодолеть, является адресование. Он заключается в том, чтобы доставить секреторные и мембранные белки, но не белки цитозоля, к местам их транслокации на ЭПР. В клетке эти белки узнаются по последовательности, присутствующей во вновь синтезированном белке.
Эта последовательность направляет белок к мембране ЭПР и обычно удаляется после того, как он позиционировался.
Представление о том, что белок может позиционироваться на ЭПР за счет последовательности аминокислот, получило название сигнальной гипотезы. Эта гипотеза была предложена в середине 1970-х гг. в результате проведения классических экспериментов, которые впервые продемонстрировали, как клетки направляют белки к специфическим компартментам. Было показано, что синтез секреторного белка начинается в цитозоле с наращивания аминокислот на N-конце.

При этом образовывались более крупные белки, которые при гель-электрофорезе мигрировали с меньшей скоростью (дорожка 1).
В клетке синтезировались белки меньшего размера (дорожка 2).
Если белки синтезировались в присутствии очищенных препаратов ЭПР in vitro,
то они обладали меньшими размерами (дорожка 3) и были способны к переносу через очищенные препараты ЭПР.
Отщепление этого участка от белка происходит только после того, как белок связался с ЭПР, но до окончания его синтеза. Эти аминокислоты удаляются при транспорте белка через мембрану, поскольку не содержащий их белок обнаруживается только внутри ЭПР и не присутствует в цитозоле.
Напротив, как показывают результаты другого эксперимента, если секретируемый белок синтезируется in vitro, в отсутствие ЭПР, то такие аминокислоты не удаляются. Таким образом, согласно представлениям сигнальной гипотезы, наращивание аминокислот позволяет насцентным белкам позиционироваться на ЭПР, а после начала транслокации эти аминокислоты удаляются. Гипотеза также предполагала, что дополнительные аминокислоты находятся в структуре всех секреторных и мембранных белков, но отсутствуют в белках цитозоля. В дальнейшем все эти предположения подтвердились.
Дополнительные аминокислоты, находящиеся в составе первичной структуры белка, сейчас называются сигнальными последовательностями, и их существование, действительно, представляет собой универсальный механизм адресования новообразующихся секреторных и мембранных белков. В большинстве случаев сигнальные последовательности отщепляются от пребелков, давая зрелые белки, которые транспортируются по секреторному пути.
К числу наиболее удивительных особенностей сигнальных последовательностей относится их разнообразие. Единственный для них общий элемент представляет собой центральный участок, состоящий из 6-20 гидрофобных аминокислот, состав которого для разных белков различен. Большинство сигнальных последовательностей на N-конце также содержат несколько полярных аминокислот. Обычно за гидрофобным доменом расположена С-терминальная область полярных аминокислот, где отщепляется сигнальная последовательность. Однако, строго говоря, ни один из этих полярных доменов не является абсолютно необходимым в адресовании.
В качестве сигнальных могут выступать различные последовательности аминокислот, удовлетворяющие вышеприведенным характеристикам. Тем не менее, несмотря на разнообразие, по способности позиционировать белки на ЭПР и обеспечивать их транлокацию, сигнальные последовательности более или менее взаимозаменяемы. Так, сигнальная последовательность одного белка обычно может быть заменена последовательностью другого, причем это не сказывается на способности белка к адресованию и переносу. Аналогичным образом, присоединение к обычно цитозольному белку сигнальной последовательности вызывает его транслокацию.
Удивительно, что такая кажущаяся неспецифической последовательность аминокислот обеспечивает высокую специфичность процесса адресования.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
— Вернуться в содержание раздела «генетика» на нашем сайте
Что такое n и с концы белков
• Адресование белка на ЭПР обеспечивается сигнальной последовательностью, представляющей собой короткую цепочку остатков аминокислот, расположенную обычно с N-концевой стороны
• Единственной особенностью, общей для всех сигнальных последовательностей, является наличие центрального гидрофобного внутреннего участка. Обычно этого участка оказывается достаточно для транслокации любого белка
Все белки, структура которых закодирована в ядре, начинают свой биогенез в цитозоле. Первым этапом транслокации белков через мембрану ЭПР, который необходимо преодолеть, является адресование. Он заключается в том, чтобы доставить секреторные и мембранные белки, но не белки цитозоля, к местам их транслокации на ЭПР. В клетке эти белки узнаются по последовательности, присутствующей во вновь синтезированном белке.
Эта последовательность направляет белок к мембране ЭПР и обычно удаляется после того, как он позиционировался.
Представление о том, что белок может позиционироваться на ЭПР за счет последовательности аминокислот, получило название сигнальной гипотезы. Эта гипотеза была предложена в середине 1970-х гг. в результате проведения классических экспериментов, которые впервые продемонстрировали, как клетки направляют белки к специфическим компартментам. Было показано, что синтез секреторного белка начинается в цитозоле с наращивания аминокислот на N-конце.

При этом образовывались более крупные белки, которые при гель-электрофорезе мигрировали с меньшей скоростью (дорожка 1).
В клетке синтезировались белки меньшего размера (дорожка 2).
Если белки синтезировались в присутствии очищенных препаратов ЭПР in vitro,
то они обладали меньшими размерами (дорожка 3) и были способны к переносу через очищенные препараты ЭПР.
Отщепление этого участка от белка происходит только после того, как белок связался с ЭПР, но до окончания его синтеза. Эти аминокислоты удаляются при транспорте белка через мембрану, поскольку не содержащий их белок обнаруживается только внутри ЭПР и не присутствует в цитозоле.
Напротив, как показывают результаты другого эксперимента, если секретируемый белок синтезируется in vitro, в отсутствие ЭПР, то такие аминокислоты не удаляются. Таким образом, согласно представлениям сигнальной гипотезы, наращивание аминокислот позволяет насцентным белкам позиционироваться на ЭПР, а после начала транслокации эти аминокислоты удаляются. Гипотеза также предполагала, что дополнительные аминокислоты находятся в структуре всех секреторных и мембранных белков, но отсутствуют в белках цитозоля. В дальнейшем все эти предположения подтвердились.
Дополнительные аминокислоты, находящиеся в составе первичной структуры белка, сейчас называются сигнальными последовательностями, и их существование, действительно, представляет собой универсальный механизм адресования новообразующихся секреторных и мембранных белков. В большинстве случаев сигнальные последовательности отщепляются от пребелков, давая зрелые белки, которые транспортируются по секреторному пути.
К числу наиболее удивительных особенностей сигнальных последовательностей относится их разнообразие. Единственный для них общий элемент представляет собой центральный участок, состоящий из 6-20 гидрофобных аминокислот, состав которого для разных белков различен. Большинство сигнальных последовательностей на N-конце также содержат несколько полярных аминокислот. Обычно за гидрофобным доменом расположена С-терминальная область полярных аминокислот, где отщепляется сигнальная последовательность. Однако, строго говоря, ни один из этих полярных доменов не является абсолютно необходимым в адресовании.
В качестве сигнальных могут выступать различные последовательности аминокислот, удовлетворяющие вышеприведенным характеристикам. Тем не менее, несмотря на разнообразие, по способности позиционировать белки на ЭПР и обеспечивать их транлокацию, сигнальные последовательности более или менее взаимозаменяемы. Так, сигнальная последовательность одного белка обычно может быть заменена последовательностью другого, причем это не сказывается на способности белка к адресованию и переносу. Аналогичным образом, присоединение к обычно цитозольному белку сигнальной последовательности вызывает его транслокацию.
Удивительно, что такая кажущаяся неспецифической последовательность аминокислот обеспечивает высокую специфичность процесса адресования.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
— Вернуться в содержание раздела «генетика» на нашем сайте
Что такое n и с концы белков
• Адресование белка на ЭПР обеспечивается сигнальной последовательностью, представляющей собой короткую цепочку остатков аминокислот, расположенную обычно с N-концевой стороны
• Единственной особенностью, общей для всех сигнальных последовательностей, является наличие центрального гидрофобного внутреннего участка. Обычно этого участка оказывается достаточно для транслокации любого белка
Все белки, структура которых закодирована в ядре, начинают свой биогенез в цитозоле. Первым этапом транслокации белков через мембрану ЭПР, который необходимо преодолеть, является адресование. Он заключается в том, чтобы доставить секреторные и мембранные белки, но не белки цитозоля, к местам их транслокации на ЭПР. В клетке эти белки узнаются по последовательности, присутствующей во вновь синтезированном белке.
Эта последовательность направляет белок к мембране ЭПР и обычно удаляется после того, как он позиционировался.
Представление о том, что белок может позиционироваться на ЭПР за счет последовательности аминокислот, получило название сигнальной гипотезы. Эта гипотеза была предложена в середине 1970-х гг. в результате проведения классических экспериментов, которые впервые продемонстрировали, как клетки направляют белки к специфическим компартментам. Было показано, что синтез секреторного белка начинается в цитозоле с наращивания аминокислот на N-конце.

При этом образовывались более крупные белки, которые при гель-электрофорезе мигрировали с меньшей скоростью (дорожка 1).
В клетке синтезировались белки меньшего размера (дорожка 2).
Если белки синтезировались в присутствии очищенных препаратов ЭПР in vitro,
то они обладали меньшими размерами (дорожка 3) и были способны к переносу через очищенные препараты ЭПР.
Отщепление этого участка от белка происходит только после того, как белок связался с ЭПР, но до окончания его синтеза. Эти аминокислоты удаляются при транспорте белка через мембрану, поскольку не содержащий их белок обнаруживается только внутри ЭПР и не присутствует в цитозоле.
Напротив, как показывают результаты другого эксперимента, если секретируемый белок синтезируется in vitro, в отсутствие ЭПР, то такие аминокислоты не удаляются. Таким образом, согласно представлениям сигнальной гипотезы, наращивание аминокислот позволяет насцентным белкам позиционироваться на ЭПР, а после начала транслокации эти аминокислоты удаляются. Гипотеза также предполагала, что дополнительные аминокислоты находятся в структуре всех секреторных и мембранных белков, но отсутствуют в белках цитозоля. В дальнейшем все эти предположения подтвердились.
Дополнительные аминокислоты, находящиеся в составе первичной структуры белка, сейчас называются сигнальными последовательностями, и их существование, действительно, представляет собой универсальный механизм адресования новообразующихся секреторных и мембранных белков. В большинстве случаев сигнальные последовательности отщепляются от пребелков, давая зрелые белки, которые транспортируются по секреторному пути.
К числу наиболее удивительных особенностей сигнальных последовательностей относится их разнообразие. Единственный для них общий элемент представляет собой центральный участок, состоящий из 6-20 гидрофобных аминокислот, состав которого для разных белков различен. Большинство сигнальных последовательностей на N-конце также содержат несколько полярных аминокислот. Обычно за гидрофобным доменом расположена С-терминальная область полярных аминокислот, где отщепляется сигнальная последовательность. Однако, строго говоря, ни один из этих полярных доменов не является абсолютно необходимым в адресовании.
В качестве сигнальных могут выступать различные последовательности аминокислот, удовлетворяющие вышеприведенным характеристикам. Тем не менее, несмотря на разнообразие, по способности позиционировать белки на ЭПР и обеспечивать их транлокацию, сигнальные последовательности более или менее взаимозаменяемы. Так, сигнальная последовательность одного белка обычно может быть заменена последовательностью другого, причем это не сказывается на способности белка к адресованию и переносу. Аналогичным образом, присоединение к обычно цитозольному белку сигнальной последовательности вызывает его транслокацию.
Удивительно, что такая кажущаяся неспецифической последовательность аминокислот обеспечивает высокую специфичность процесса адресования.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
— Вернуться в содержание раздела «генетика» на нашем сайте