Что такое гомологи примеры
Гомологический ряд — определение, общая формула и примеры для разных классов соединений
При изучении органической химии, отличающейся сложностью своих закономерностей, первое и основное, что следует понять — свойства и законы гомологических рядов.
Гомология, гомологи, гомологический ряд — определения и примеры
Гомология — химическое явление, при котором соединения отличаются друг от друга на определённое количество групп, обладают сходной характеристикой и проявляют похожие свойства.
Гомологический ряд — последовательность однотипных органических соединений, каждое из последующих имеет с предыдущим определённую гомологическую разность. При этом свойства веществ, состоящих в рядах, то есть гомологов, изменяются с определённой закономерностью.
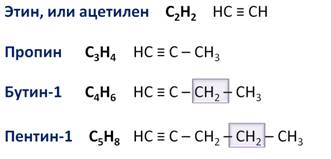
Например, если говорить о гомологическом ряде алкинов, он состоит из следующих гомологов:
пентин — C5H8 и т. д.
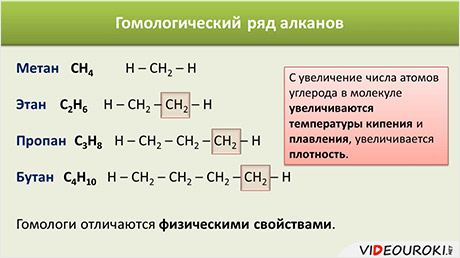
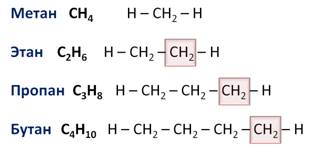
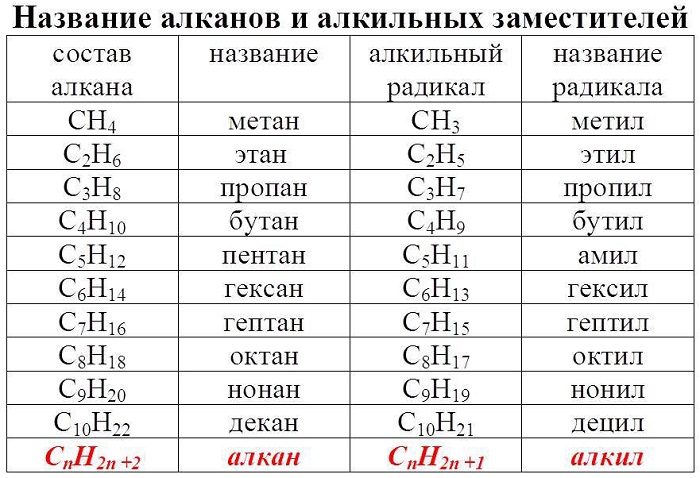
Гомологический ряд алканов в таблице
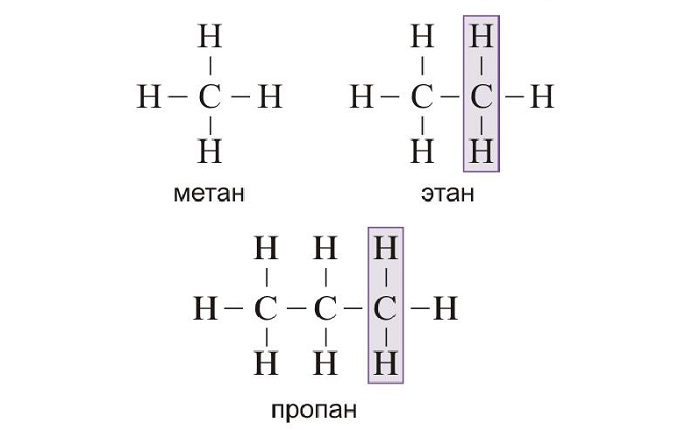
Алканы — ациклические предельные углеводороды:
всеобщая формула алканов — СnH2n+2;

Алканы обладают следующими свойствами:
в последовательности гомологического ряда происходят изменения агрегатных состояний веществ с газообразного на жидкое и на твёрдое;
нерастворимы в воде, но могут растворяться в неполярных растворителях;
используются в промышленности (метан — топливо, пропан — автомобильное топливо, бутан — сырье для производства каучука, пропан и бутан — балонные газы).
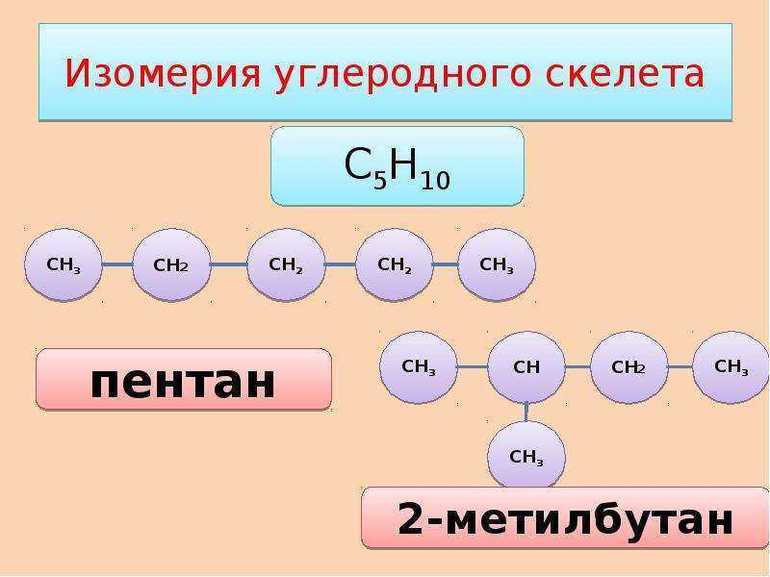
При изучении алканов стоит обращать внимание на их изомеры. Например, структурным изомером бутана является метилпропан, а пентана — метилбутан.
Алканы могут вступать в следующие реакции:
Горение в кислороде: СН4 + 2О2 = СО2 + 2Н2О.
Замещение с галогенами: CH4 + Cl2 = CH3Cl + HСl.
Разложение при высокой температуре: СН4 = C + 2H2.
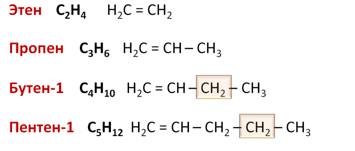
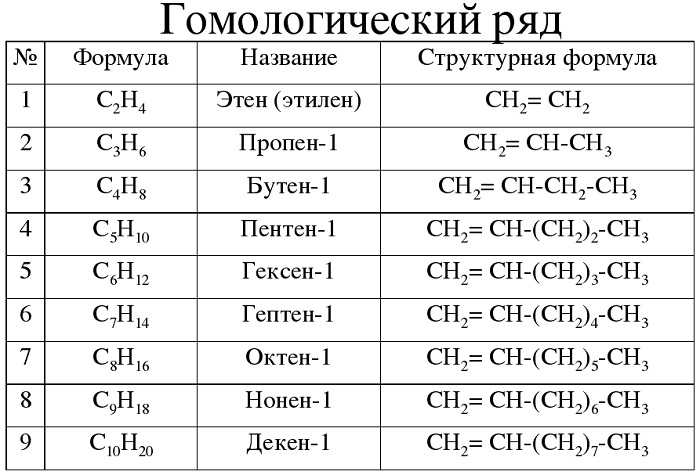
Гомологический ряд алкенов в таблице
Алкены — углеводороды, имеющие ациклический непредельный характер.
Алкены обладают следующими свойствами:
не способны растворяться в воде, но полностью растворяются при взаимодействии с органическими растворителями;
имеют очень высокую температуру плавления и кипения;
применяются в промышленности для синтеза таких важных соединений, как фенола, полипропилена, стирола, ацетона, глицерина и других.
Алкены участвуют в следующих химических реакциях:
Горение в кислороде: C2H4 + 3O2 = 2CO2 + H2O.
Галогенирование (присоединение к галогенам): CH2=CH2 + Cl2 = Cl-CH2-CH2-Cl.
Присоединение к водороду (гидрирование): CH2=CH-CH3 + H2 = CH3-CH2-CH3.
Гидратация (присоединение к воде): CH2=CH2 + H2O = CH3-CH2OH.
Полимеризация: nCH2=CH2 = (-CH2-CH2-) * n.
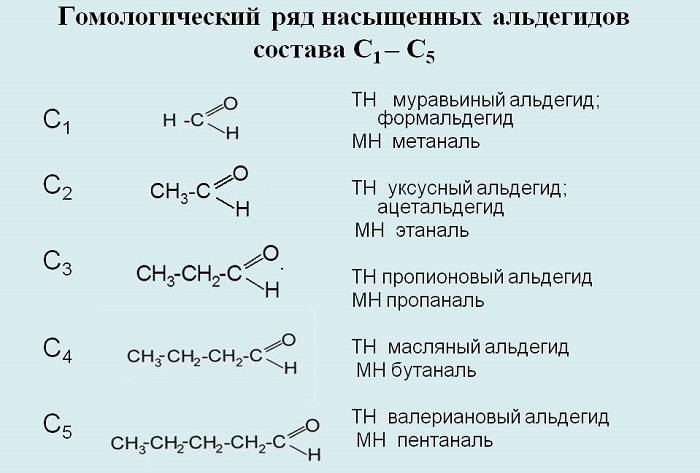
Гомологический ряд альдегидов
Делятся на насыщенные и алифатические насыщенные, общая молекулярная формула первых — СnH2nO, вторых — СnH2n+1CHO соответственно.
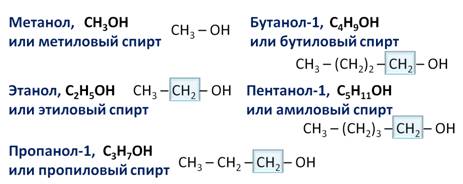
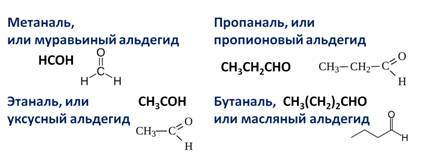
К примерам альдегидов относятся метаналь, этаналь, пропаналь, бутаналь, пентаналь, гексаналь и так далее.
Альдегиды принимают участие в следующих реакциях:
Присоединение воды: R-CH = O + H2O = R-CH(OH)-OH.
Присоединение спиртов: CH3-CH = O + C2H5OH = CH3-CH(OH)-O-C2H5.
Присоединение аминов: C6H5CH = O + H2NC6H5 = C6H5CH = NC6H5 + H2O.
Восстановление водородом: R-CH = O + H2 = R—CH2-OH.
Альдегиды обладают следующими свойствами:
низшие представители класса имеют резкий запах;
в гомологическом ряду происходит изменение агрегатных состояний от жидкого до твёрдого;
используются в лекарственной промышленности, парфюмерии и т. д.
Хоть органическая химия и требует внимательного изучения, совсем необязательно полностью зазубривать все классы веществ. Намного проще для понимания и качественного запоминания обращать внимание именно на закономерности изменения свойств и характеристик ближайших соединений, следуя плану.
Гомологи. Гомологический ряд
Урок 5. Химия 10 класс (ФГОС)
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобрев в каталоге.
Получите невероятные возможности
Конспект урока «Гомологи. Гомологический ряд»
Гомологи – это вещества близкие по строению и свойствам, которые отличаются на одну или несколько групп – СН2.
Каждый класс органических соединений имеет свою общую формулу и для каждого класса органических соединений можно составить их гомологический ряд.
Например, алканы имеют общую формулу CnH2n+2, где n – число атомов углерода, причём каждый член гомологического ряда будет отличаться от предыдущего на группу – СН2. Такая последовательность соединений называется гомологическим рядом (от греческого homolog – «сходный»), отдельные члены этого ряда называются гомологами, а группа атомов, на которую отличаются соседние гомологи (группа – СН2) – гомологической разностью.
Понятно, что гомологи отличаются молярной массой, а значит физическими свойствами. Как правило, с увеличение числа атомов углерода в молекуле увеличиваются температуры кипения и плавления, увеличивается плотность.
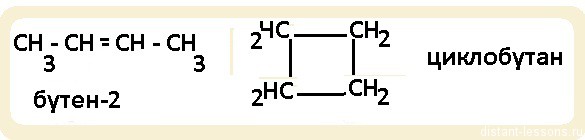
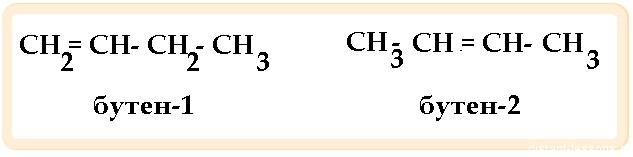
Для алкенов характерна общая формула СnH2n. Первый член гомологического ряда имеет формулу С2Н4 и называется этен, второй представитель алкенов – пропен – С3Н6, третий – бутен-1,четвёртый – пентен-1. И так далее, то есть в данном гомологическом ряду также каждый последующий член гомологического ряда отличается от предыдущего на группу – СН2.
Для алкинов также можно составить гомологический ряд. Общая формула алкинов – СnH2n-2, поэтому первым представителем этого ряда будет этин, али ацетилен – С2Н2, вторым членом ряда является пропин – С3Н4, третим – бутин-1 – С4Н6, четвёртым – пентин-1 – С5Н8.
Составим гомологический ряд альдегидов. Учитывая, что общая формула альдегидов СnH2n+1CHO, то первым представителем данного гомологического ряда будет метаналь, или муравьиный альдегид – НСОН, вторым членом ряда – этаналь, или уксусный альдегид – СН3СНО, третьим – пропаналь, или пропионовый альдегид – СН3СН2СНО, четвёртым – бутаналь, или масляный альдегид – СН3СН2СН2СНО и так далее.
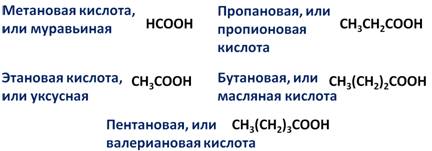
Аналогично и для карбоновых кислот. Так, общая формула насыщенных одноосновных карбоновых кислот – CnH2n+1COOH. Поэтому первым представителем данного гомологического ряда является метановая кислота, или муравьиная – НСООН, вторым – этановая кислота, или уксусная – СН3СООН, третьим – пропановая, или пропионовая кислота – СН3СН2СООН, четвёртым – бутановая, или масляная кислота – СН3СН2СН2СООН, пятым – пентановая, или валериановая кислота – СН3СН2СН2СН2СООН.
Таким образом, для каждого класса органических соединений можно составить гомологический ряд, учитывая общую формулу данного класса. Каждый последующий член гомологического ряда отличается от предыдущего на группу – СН2, которую называют гомологической разность. А сами вещества этого ряда называются гомологами. Как правило, с увеличением числа атомов углерода в гомологическом ряду увеличиваются температуры плавления и кипения, увеличивается плотность.
Например, если говорить о гомологическом ряде алкинов, он состоит из следующих гомологов:
Гомологический ряд алканов в таблице
Алканы обладают следующими свойствами:
в последовательности гомологического ряда происходят изменения агрегатных состояний веществ с газообразного на жидкое и на твёрдое;
нерастворимы в воде, но могут растворяться в неполярных растворителях;
Алканы могут вступать в следующие реакции:
Замещение с галогенами: CH4 + Cl2 = CH3Cl + HСl.
Разложение при высокой температуре: СН4 = C + 2H2.
Гомологический ряд алкенов в таблице
Алкены обладают следующими свойствами:
не способны растворяться в воде, но полностью растворяются при взаимодействии с органическими растворителями;
имеют очень высокую температуру плавления и кипения;
применяются в промышленности для синтеза таких важных соединений, как фенола, полипропилена, стирола, ацетона, глицерина и других.
Алкены участвуют в следующих химических реакциях:
Галогенирование (присоединение к галогенам): CH2=CH2 + Cl2 = Cl-CH2-CH2-Cl.
Гомологический ряд альдегидов
К примерам альдегидов относятся метаналь, этаналь, пропаналь, бутаналь, пентаналь, гексаналь и так далее.
Альдегиды принимают участие в следующих реакциях:
Присоединение воды: R-CH = O + H2O = R-CH(OH)-OH.
Восстановление водородом: R-CH = O + H2 = R—CH2-OH.
Альдегиды обладают следующими свойствами:
низшие представители класса имеют резкий запах;
в гомологическом ряду происходит изменение агрегатных состояний от жидкого до твёрдого;
используются в лекарственной промышленности, парфюмерии и т. д.
Хоть органическая химия и требует внимательного изучения, совсем необязательно полностью зазубривать все классы веществ. Намного проще для понимания и качественного запоминания обращать внимание именно на закономерности изменения свойств и характеристик ближайших соединений, следуя плану.
Определение и группы
Все вещества имеют разную молярную массу и структуру молекулы, следовательно, их физические свойства, такие как температуры изменения агрегатного состояния, плотность, прочность и т. д. будут различаться. Наиболее похожими будут свойства ближайших друг к другу веществ.
Свойства изменяются от начальных веществ к высшим, это можно увидеть на примере гомологического ряда алканов:
Есть определенные правила, по которым проходит систематизация органических соединений.
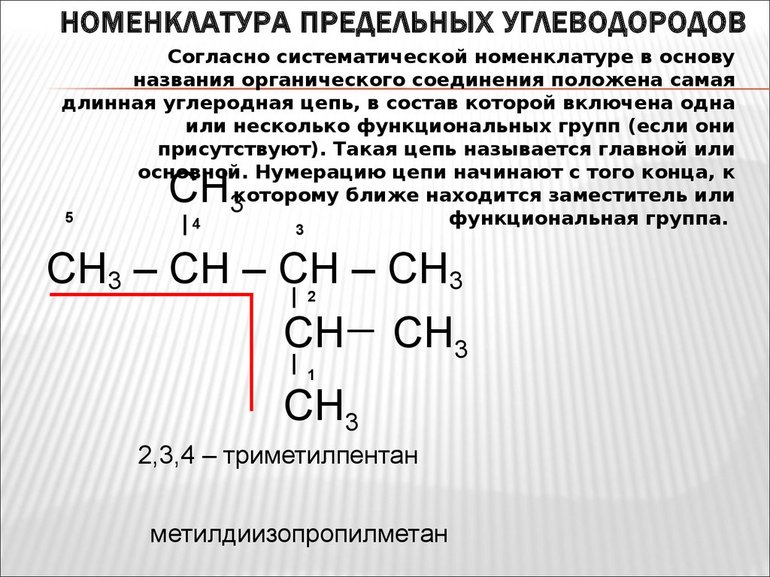
Номенклатура углеводородов
Согласно ИЮПАК (Международного союза теоретической и прикладной химии), первые четыре углеводорода имеют стандартные, сложившиеся с годами приставки: мет-, эт-, проп, — бут-. В зависимости от гомологического ряда (алканы, алкены, алкины и т. д. ), к этой приставке добавляется суффикс. Начиная с пятого наименование основано на греческих цифрах, соответствующих числу атомов углерода. Для углеводородов с разветвлённой структурной формулы существует определенная система наименования:
Называя соединение, для начала нужно перечислить в алфавитном порядке радикалы, перед названием которых ставится цифра, соответствующая номеру главного атома углеродной цепи, где этот заместитель расположен. Далее указывают главный углеводород. Следует помнить, что слова от цифр отделяют дефисом. Например: 3-метилпентанол, 2,3-диметилпентадиол и т. д.
Следует помнить, что существует еще один вид химических соединений, противоположный гомологам.
Изомерия вещества
Изомеры, в отличие от гомологов, имеют одинаковую структурную формулу и молярную массу.
Отличие состоит в строении или расположении самого атома в пространстве, вследствие чего различаются и свойства. Так, различают структурную и стереоизомерию.
Первый вид соединений отличается по химическому строению:
При стереоизомерии различия возникают в пространственной конфигурации молекулы.
Эти соединения составляют очень большой перечень неорганических веществ. У многих из них существует два, или более изомеров. Подсчитать же точное количество подобных веществ в органической химии не представляется возможным, поскольку даже в одном гомологическом ряду может существовать несколько миллионов изомеров без учета стереоизомерии.
Химия, Биология, подготовка к ГИА и ЕГЭ
Вопрос A13 ЕГЭ по химии —
Теория строения органических соединений: гомология и изомерия. Взаимное влияние атомов в молекулах. Типы связей в молекулах органических веществ. Гибридизация атомных орбиталей углерода. Радикал. Функциональная группа.
Темы, которые нужно знать:
Эти вопросы входят в анализ строения каждого класса веществ в органической химии, но в данном вопросе нам нужно свести все эти знания воедино. Давайте рассмотрим каждое определение, каждый пункт этого вопроса, исходя из знаний строения всех органических веществ.
Изомеры и гомологи
Не вдаваясь в сложные формулировки, давайте определим, что такое гомологи и изомеры.
Гомологи — относятся к одному классу веществ (например, алканы). Это значит, что у них:
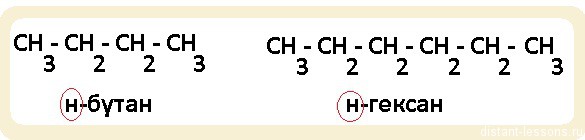
Обратите внимание, именно н-бутан и н-гексан будут относится к гомологам. Если мы возьмем н-алкан (линейная молекула) и разветвленный алкан, то, хотя у них будет одна и та же общая формула (СnH2n+2), по химическим свойствам они будут несколько различаться, т.к. разветвленное строение этих органических соединений будет оказывать влияние на направление протекания реакций.
Изомеры —химические соединения, одинаковые по составу и молекулярной массе, но различающиеся по строению и свойствам (химическим и физическим)
Виды изомерии:
Виды химической связи в органической химии
Т.к. органическая химия — это химия соединений углерода, то основным видом химической связи является ковалентная химическая связь.
Как и в неорганических соединениях, в органических вид химической связи определяют исходя из строения вещества.
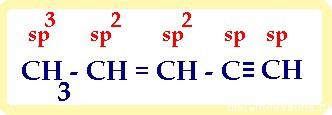
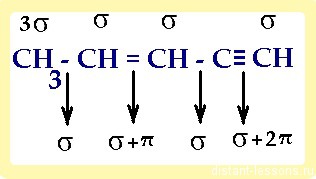
Тип гибридизации атомов в органических соединениях
Как образуется гибридизация атомных орбиталей в молекуле мы подробно рассматривали при изучении каждого класса органических соединений, здесь мы рассмотрим практическое применение этих знаний.
На что нужно обратить внимание:
1) в молекуле, имеющей не только один вид связи, каждый атом имеет свой тип гибридизации :
итого: 10 сигма- и 3 π-связей
Давайте систематизируем все эти вопросы по классам углеводородов