Что такое гипоплазия аорты у плода
Что такое гипоплазия аорты у плода
Коарктация может представлять собой истинный порок, обусловленный генетическими нарушенияими, или являться следствием наличия аберрантной ткани протока в стенке аорты, что приводит к сужению перешейка в период закрытия протока (так называемая теория Skodaic). Третья гипотеза предполагает, что коарктация является морфологическим результатом нарушения гемодинамики во внутриутробном периоде, которая обусловлена внутрисердечными аномалиями, приводящими к перераспределению кровотока из аорты в легочную артерию и артериальный проток. В пользу, по крайней мере, двух последних гипотез имеются клинические и анатомические данные.
Тубулярная гипоплазия аорты выражается в генерализованном сужении проксимального отдела дуги аорты, при этом чаще всего страдает сегмент между левой общей сонной артерией и левой подключичной артерией или перешейком. В этот процесс, кроме того, могут вовлекаться брахиоцефальные сосуды.
Видео ЭхоКГ при коарктации аорты у плода
При эхокардиографическом обследовании плодов с коарктацией аорты характерным признаком является гиперэхогенное утолщение, выступающее в просвет аорты. Однако данная особенность обычно обнаруживается менее чем у половины плодов. Формирование коарктации может происходить в постнатальном периоде, что во многих случаях ограничивает возможности пренатальной диагностики. Тем не менее, эта аномалия уже описана у плодов, хотя была диагностирована только на поздних сроках беременности.
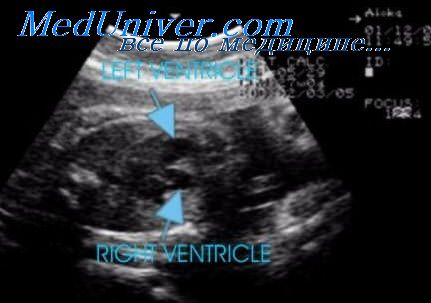
В этой ситуации в 50% наблюдений обнаруживается увеличение правого предсердия и желудочка (когда правый желудочек превосходит по размерам левый в 1,3 раза) в сочетании с расширением ствола легочной артерии и повышением скорости кровотока через трикуспиданый клапан (более чем в два раза по сравнению с кровотоком через митральный клапан). При тубулярной гипоплазии аорта становится тонкой и имеет малый диаметр просвета. Диагноз в таких ситуациях, по-видимому, бывает не очень надежен из-за трудностей, возникающих при ультразвуковом осмотре.
Известно, что во внутриутробном периоде кровоток через перешеек аорты минимален, и нисходящая аорта получает кровь преимущественно из артериального протока, поэтому изолированная коарктация аорты не будет существенно нарушать сердечную гемодинамику. Тем не менее тубулярная гипоплазия дуги аорты способна приводить к увеличению гемодинамической нагрузки, что может объяснять расширение правых отделов сердца, которое выявляется при эхокардиографии в антенатальном периоде.
Что такое гипоплазия аорты у плода
Перерыв дуги аорты может быть полным или (реже) сегментарным, когда между дугой и нисходящей аортой выявляется атрезированный сегмент в виде фиброзного тяжа. Данная форма порока может рассматриваться как крайняя степень коарктации. Его классифицируют в зависимости от уровня относительно брахиоцефальных артерий. При типе А (42%) аорта снабжает кровью три брахиоцефальных сосуда, а нисходящая аорта получает кровь из ствола легочной артерии через артериальный проток.
Сопутствующие аномалии сердца в этих случаях могут быть представлены такими пороками, как дефекты межпредсердной перегородки, субаортальный стеноз, гипоплазия восходящей аорты, двустворчатый аортальный и/или легочный клапан, аномальное отхождение правой подключичной артерии и дефекты межжелудочковой перегородки.
К сопутствующим экстракардиалыным аномалиям относятся синдром ДиДжорджи (DiGeorge) (аплазия тимуса, перерыв дуги аорты (типа В) и гипоплазия нижней челюсти), голопрозенцефалия, расщелины верхней губы и/или неба, атрезия пищевода, удвоение желудка, диафрагмальная грыжа, подковообразная почка, двусторонняя агенезия почек, олигодактилия, кисть в виде «клешни краба» (claw hand) и сиреномелия.
Характерные изменения дуги аорты в верхних отделах грудной клетки, от которой не отходят сосуды, или отходит слишком мало сосудов, позволят предположить данный диагноз. При продольной плоскости сканирования плода аорту можно будет проследить только до сонных артерий, но не удастся выявить ее переход в нисходящую аорту. Другим признаком будет различие в размерах желудочков сердца, с преобладанием объема правого.
Видео ЭхоКГ при критическом стенозе аортального клапана у плода
Гипоплазия левых отделов сердца
Синдром гипоплазии левых отделов сердца (ГЛОС) характеризуается очень малыми размерами левого желудочка в сочетании с атрезией митрального и/или аортального клапана. В этих случаях приток крови к сосудам головы и шеи осуществляется ретроградным путем через артериальный проток.
Эхографическая диагностика синдрома ГЛОС у плода основывается на выявлении уменьшения размеров левого желудочка и диаметра восходящей аорты. В большинстве случаев эхографическая картина говорит сама за себя и установление диагноза не представляет трудности. Однако степень гипоплазии левого желудочка может широко варьировать. Мы наблюдали случаи, когда его полость была почти нормальных размеров, что может представлять диагностические трудности, особенно на ранних сроках беременности.
Такие изменения зачастую могут быть легко пропущены при обычном ультразвуковом исследовании анатомии плода, поскольку изображение четырехкамерного среза сердца будет почти аналогично нормальному. Однако при более тщательном осмотре обнаруживается, что движения створок митрального клапана значительно ограничены или отсутствуют, сократимость левого желудочка явно снижена, а также выявляется гиперэхогенность внутреннего контура его полости, что, вероятно, связано с фиброэластозом эндокарда.
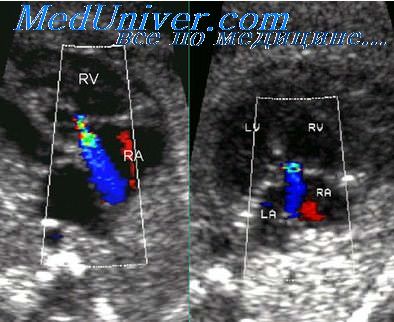
Окончательному установлению диагноза синдрома ГЛОС способствует выявление гипоплазии восходящей аорты и атрезии аортального клапана. Цветовое картирование кровотока в этой ситуации является чрезвычайно полезной дополнительной методикой при исследовании в режиме «реального времени», так как оно позволяет визуализировать ретроградный поток крови в просвете восходящей аорты и ее дуги, а для выявления недостаточности атриовентрикулярных клапанов может помочь импульсно-волновая допплерометрия.
Прогноз для новорожденных с синдромом ГЛОС чрезвычайно неблагоприятен. Именно этим пороком обусловливается 25% летальности на первой неделе жизни среди тех, у кого имеются сердечные аномалии. Почти все дети с синдромом ГЛОС, если их не лечить, умирают в течение первых 6 недель жизни. В современной литературе имеются данные о предлагаемых паллиативных вмешательствах и сведения об отдаленных исходах при лечении этого вида пороков. Не так давно стали предприниматься попытки трансплантации сердца в неонатальном периоде.
Во внутриутробном периоде при гипоплазии левых отделов сердца гемодинамика плода хорошо компенсирована. Нормальное функционирование артериального протока обеспечивает адекватную перфузию сосудов головы и шеи. Размеры плода могут оставаться нормальными, и первые клинические симптомы наиболее часто возникают после рождения. Застойная сердечная недостаточность наблюдается только в тех случаях, когда имеется недостаточность атриовентрикулярных клапанов и встречается достаточно редко.
Другие врожденные аномалии аорты (Q25.4)
Версия: Справочник заболеваний MedElement
Общая информация
Краткое описание
Другие врожденные аномалии аорты
Отсутствие >
Аплазия >
Врожденное(ая): > аорты
• аневризма >
• расширение >
Аневризма синуса Вальсальвы (разорванная)
Двойная дуга аорты [сосудистое кольцо аорты]
Гипоплазия аорты
Сохранение:
• витков дуги аорты
• правой дуги аорты
Исключена: гипоплазия аорты при синдроме левосторонней гипоплазии сердца (Q23.4)
Аномалия дуги аорты и главных ее ветвей, которые окружают трахею и пищевод, могут приводить к их сдавлению и сужению. Эти аномалии очень разнообразны и называются сосудистыми кольцами. Одним из наиболее часто встречающихся видов данной патологии является двойная дуга аорты (ДДА). ДДА представляет собой одновременное существование правой и левой аортальных дуг
Под аневризмами аорты понимают локальное или диффузное расширение ее просвета, превышающего нормальный диаметр аорты в 2 раза и более.
Перерыв дуги аорты может быть полным или (реже) сегментарным, когда между дугой и нисходящей аортой выявляется атрезированный сегмент в виде фиброзного тяжа. Данная форма порока может рассматриваться как крайняя степень коарктации. Его классифицируют в зависимости от уровня относительно брахиоцефальных артерий. При типе А (42%) аорта снабжает кровью три брахиоцефальных сосуда, а нисходящая аорта получает кровь из ствола легочной артерии через артериальный проток.
Сопутствующие аномалии сердца в этих случаях могут быть представлены такими пороками, как дефекты межпредсердной перегородки, субаортальный стеноз, гипоплазия восходящей аорты, двустворчатый аортальный и/или легочный клапан, аномальное отхождение правой подключичной артерии и дефекты межжелудочковой перегородки.
К сопутствующим экстракардиалыным аномалиям относятся синдром ДиДжорджи (DiGeorge) (аплазия тимуса, перерыв дуги аорты (типа В) и гипоплазия нижней челюсти), голопрозенцефалия, расщелины верхней губы и/или неба, атрезия пищевода, удвоение желудка, диафрагмальная грыжа, подковообразная почка, двусторонняя агенезия почек, олигодактилия, кисть в виде «клешни краба» (claw hand) и сиреномелия.
Характерные изменения дуги аорты в верхних отделах грудной клетки, от которой не отходят сосуды, или отходит слишком мало сосудов, позволят предположить данный диагноз. При продольной плоскости сканирования плода аорту можно будет проследить только до сонных артерий, но не удастся выявить ее переход в нисходящую аорту. Другим признаком будет различие в размерах желудочков сердца, с преобладанием объема правого.
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
Целесообразно разделить возможные варианты аномалии на сосудистые кольца и сосудистые петли. При сосудистом кольце трахея и пищевод оказываются со всех сторон окруженными сосудистыми образованиями. При сосудистых петлях трахеопищеводная компрессия вызывается аномальным отхождением одного из сосудов дуги аорты или одной из ветвей легочной артерии, охватывающей пищевод и трахею сдавливающей петлей.
Сосудистые кольца:
Этиология и патогенез
Аномалия дуги аорты
В процессе эмбриогенеза у плода имеются две и дорсальная, соединенные между собой 8 парами сосудистых дуг. При окончательном формировании сосудов часть дуг остается, образуя дугу аорты и легочные артерии, другие, напротив, регрессируют и исчезают. При любом нарушении этого процесса могут развиться аномалии дуги аорты и ее ветвей.
Аневризма аорты
Развивается на фоне врожденных заболеваний стенки аорты (болезнь Марфана, синдром Элерса—Данлоса, фиброзная дисплазия); При синдроме Марфана основные изменения отмечаются в соединительной ткани, что связано с врожденными нарушениями метаболизма хондроитинсерной кислоты и основной субстанции соединительной ткани. Для этого заболевания характерны дегенерация эластических волокон и дезорганизация средней оболочки сосудов эластического типа.
Перерыв дуги аорты:
Причина порока неизвестна, но некоторый прогресс достигнут в понимании этиологии синдрома DiGeorge, который часто встречается при перерыве дуги аорты. Приблизительно у 90% пациентов с синдромом DiGeorge имеется делеция 22q11.
Эмбриология данного порока остается невыясненной. Приблизительно половина пациентов с перерывом дуги аорты имеют делецию 1,5-3 МБ участка хромосомы 22q11.2. В пределах делеции участка 3 МБ находятся 30 генов, но все еще неизвестно, какие из них вносят вклад в фенотип порока.
При полном перерыве дуги аорты кровь поступает в нисходящую аорту только через открытый артериальный проток. При гипоплазии дуги аорты кровоток в ней частично сохраняется, его величина зависит от выраженности обструкции и способности левого желудочка справляться с повышенной посленагрузкой. Большой сброс крови слева направо через дефект межжелудочковой перегородки ведет к увеличению легочного кровотока, что задерживает падение легочного сосудистого сопротивления, происходящее вскоре после рождения. Высокое легочное сосудистое сопротивление ведет к сбросу крови справа налево через открытый артериальный проток в нисходящую аорту и поддерживает кровоснабжение нижней половины тела.
Вначале, при широком артериальном протоке, АД в сосудах нижней и верхней частей тела может быть одинаковым. Сброс венозной крови справа налево через открытый артериальный проток приводит к цианозу ног при нормальном цвете рук (дифференцированный цианоз). Со временем, однако, артериальный проток сужается, что ведет к падению АД в сосудах нижней половины тела и уменьшению пульсового АД. При падении легочного сосудистого сопротивления усиливается легочный кровоток, а ток крови через открытый артериальный проток в нисходящую аорту падает еше ниже. В результате увеличивается наполнение левого желудочка, которому помимо перегрузки давлением теперь приходится справляться с перегрузкой объемом; это часто ведет к левожелудочковой недостаточности. Скорость развития всех этих нарушений может варьировать. По мере снижения кровотока в сосудах нижней половины тела развивается метаболический ацидоз, а снижение почечного кровотока приводит к олигурии и анурии.
Эпидемиология
Перерыв дуги аорты
Данный синдром является редким заболеванием; встречается в 0,03 на 1000 рожденных детей. В литературе отсутсвтвуют указания на семейный характер этой аномалии. Установлена делеция 22q11. Почти все случаи порока выявляются в первые 2 недели жизни, как только происходит закрытие артериального протока. У большинства пациентов диагностика происходит на первом дне жизни.
Факторы и группы риска
Факторы риска, влияющие на формирование врожденных пороков сердца у плода
Семейные факторы риска:
— наличие детей с врожденными пороками сердца (ВПС);
— наличие ВПС у отца или ближайших родственников;
— наследственные заболевания в семье.
Клиническая картина
Cимптомы, течение
Аневризма аорты
Систолический шум, который выслушивается над аневризматически расширенными участками аорты, обычно достаточно мягок. Если во втором межреберье справа (в проекции восходящей части аорты) выслушивается выраженный систолический шум, следует думать в первую очередь о стенозе аортального клапана. В подобных случаях, однако, встречается наиболее типичная ошибка, когда больному ставится диагноз аортального стеноза и не диагностируется аневризма восходящей части аорты. Диастолический шум, выслушиваемый во втором межреберье справа и в точке Боткина, наряду со снижением диастолического давления свидетельствует об аортальной недостаточности вследствие дилатации аортального кольца при диффузном расширении восходящей части аорты. Продолжительный шум в проекции аортального клапана обычно характерен для прорыва аневризм синуса Вальсальвы в одну из полостей сердца. Перкуторно можно выявить расширение сосудистого пучка вправо при аневризмах восходящей части аорты и влево при аневризмах нисходящей части аорты.
Перерыв дуги аорты
До закрытия артериального протока клиническая симптоматика порока может не определяться. Порок манифестирует при закрытии артериального протока тяжелой сердечной недостаточностью (тахипноэ, тахикардия, отказ от еды, летаргия).
Генетические синдромы, сопровождающиеся перерывом дуги аорты:
Синдром аномалии дуги аортs с умственной отсталостью и лицевым дизморфизмом
Редкий наследственный синдром с умственной отсталостью, патологией аорты и лицевым дизморфизмом. Умственная отсталость на уровне субнормальной, возможна микроцефалия.Различные дизморфии лица, не имеющие специфических проявлений.Поражение сердца проявляется перерывом дуги аорты, правосторонней дугой аорты, возможно в сочетании со стенозом левой подключичной артерии. Тип наследования аутосомно-доминантный.
Патологии сердца плода, которые можно определить на скрининговом УЗИ
» data-image-caption=»» data-medium-file=»https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2018/05/patologii-serdtsa-ploda.jpg?fit=450%2C300&ssl=1″ data-large-file=»https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2018/05/patologii-serdtsa-ploda.jpg?fit=807%2C537&ssl=1″ />
Основные пороки сердца у плода формируются в 1 триместре беременности на сроке 12-14 недель. Это может быть реакция на внешние факторы либо генетические проблемы. К этому сроку происходит формирование сердечной мышцы плода, поэтому будущей матери необходимо пройти УЗИ обследование на выявление патологий органа.
патологии сердца плода
» data-image-caption=»» data-medium-file=»https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2018/05/patologii-serdtsa-ploda.jpg?fit=450%2C300&ssl=1″ data-large-file=»https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2018/05/patologii-serdtsa-ploda.jpg?fit=807%2C537&ssl=1″ loading=»lazy» src=»https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2018/05/patologii-serdtsa-ploda.jpg?resize=807%2C537″ alt=»патологии сердца плода» width=»807″ height=»537″ srcset=»https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2018/05/patologii-serdtsa-ploda.jpg?w=807&ssl=1 807w, https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2018/05/patologii-serdtsa-ploda.jpg?resize=450%2C300&ssl=1 450w, https://i0.wp.com/medcentr-diana-spb.ru/wp-content/uploads/2018/05/patologii-serdtsa-ploda.jpg?resize=768%2C511&ssl=1 768w» sizes=»(max-width: 807px) 100vw, 807px» data-recalc-dims=»1″ />
Во внутриутробном развитии пороки сердца возникают как реакция организма на нарушение плацентарного кровообращения либо воздействие канцерогенных веществ (формальдегиды, никотин, токсические вещества).
Аномалии положения сердца плода
Среди аномалий расположения сердца выделяют эктопию сердца (размещение вне грудной клетки). К таким патологиям относят декстрокардию (смещение сердца в правую сторону относительно нормального положения) и мезокардию (расположение сердца не с левой стороны грудины, а по срединной линии тела).
Эктопия сердца у плода возникает на сроке 14-18 дней с момента зачатия мезадерма начинает развиваться неправильно, что вызывает неправильное срастание брюшной стенки. У плода либо отсутствует диафрагма вообще, либо нет диафрагмального сегмента перикарда.
Из-за отверстия в стенке между правым и левым желудочком слышны интракардиальные шумы. Также у плода эктопия сердца нередко сопровождается другими аномалиями — гидроцефалией, энцефалоцеле и пр.
Надо сказать, что существует высокая вероятность ошибочного диагноза по установки положения сердца. При тазовом предлежании плода на УЗИ сердца визуализируется справа, хотя на самом деле оно располагается в положенном месте.
В 71% случаев эктопия сердца вызывается плевральным выпотом, кистозным аденоматозным пороком развития лёгкого, диафрагмальной грыжей.
Различают четыре вида эктопии:
Грудная эктопия встречается в 55-60% случаев, торакоабдоминальная — в 38%, шейная — почти в 3%. Выживаемость составляет около 10%. В большинстве случаев при эктопии младенец либо рождается мёртвым, либо умирает сразу после рождения.
Патология сопровождается смещением других внутренних органов, которые не защищены от механических повреждений и подвержены инфекциям и вирусам больше обычного.
Врождённые дефекты сердца
Пять наиболее встречаемых дефектов — это тетрада Фалло, дефект межжелудочковой перегородки, транспозиция магистральных сосудов, коарктация аорты, гипоплазия левых камер.
Оптимальным сроком для проведения ультразвуковой диагностики сердца плода считается период 24-26 недель беременности. Именно в это время анатомические структуры сердца максимально визуализируются, а на более ранних сроках можно увидеть только явные и глобальные пороки сердца.
Наиболее информативен ультразвуковой осмотр 4-камерного среза сердца. После которого при любом отклонении от нормы женщина отправляется на более детальное обследование плода с использованием допплеровской эхокардиографии. Также проводится кариотипирование, потому что в 30% случаев аномалии являются результатом хромосомных нарушений.
Что выявляет УЗИ
В нашей клинике используется современное 4D оборудование, имеющее допплеровский режим. С его помощью можно получить изображение 3-х главных сосудов — верхней полой вены, лёгочного ствола и восходящей аорты. Во время обследования выявляется не только расположение сосудов, но и их диаметр и другие параметры.
На экране монитора будут видны следующие патологии плода:
Какие патологии сердца у плода сложно выявить на скрининговом УЗИ
Трудности в диагностике заболеваний сердца на УЗИ вызывают следующие патологии органа:
При подозрении на их наличие, пациентка должна регулярно наблюдаться и соблюдать все рекомендации гинеколога.
Атрезия аорты (Q25.2)
Версия: Справочник заболеваний MedElement
Общая информация
Краткое описание
Причинами атрезии аорты могут быть врожденные или приобретенные факторы затруднения выхода крови из левого желудочка.
Порок относится к 1 категории тяжести, выявление его во время беременности позволяет ставить вопрос о ее прерывании.
Этиология и патогенез
Вследствие того, что дуга аорты состоит из трех сегментов, имеющих различное эмбриональное происхождение, возможен перерыв дуги аорты в различных местах с различной частотой.
В редких случаях длительного функционирования открытого артериального протока сохраняется удовлетворительная гемодинамика во всех отделах туловища. Но между системным и легочным кровотоком присутствует динамическая конкуренция и при увеличении легочного кровотока наблюдается снижение периферического кровоснабжения. С другой стороны, постоянный высокий легочный кровоток (из-за сброса крови через септальные дефекты) приводит к явлениям застойной сердечной недостаточности.
Эпидемиология
Факторы и группы риска
Факторы риска, влияющие на формирование врожденных пороков сердца у плода
Семейные факторы риска:
— наличие детей с врожденными пороками сердца (ВПС);
— наличие ВПС у отца или ближайших родственников;
— наследственные заболевания в семье.
Клиническая картина
Клинические критерии диагностики
Cимптомы, течение
Диагностика
1. Эхокардиография.
2. Электрокардиография. У новорожденных сохраняется отклонение электрической оси сердца вправо. При длительном существовании порока развивается левожелудочковая или бивентрикулярная гипертрофия.
3. Рентгенография грудной клетки. У новорожденных рентгенологическая картина может быть не изменена. Тень сердца умеренно расширена, сосудистый пучок часто узкий в результате отсутствия тимуса (при синдроме DiGeorge). По мере снижения общего легочного сопротивления легочный рисунок усиливается по артериальному руслу. При развитии сердечной недостаточности возникают симптомы венозного застоя и отека легких.
Осложнения
При переходе к постнатальному типу кровообращения у большинства больных развивается критическая сердечная недостаточность, которая приводит к быстрой гибели новорожденных.
Лечение
При наличии сопутствующего синдрома DiGeorge требуется периодическая проверка уровня кальция; переливание цитратной крови таким больным может быть опасным.
Прогноз
Профилактика
Профилактика возникновения врожденных пороков сердца (ВПС) очень сложна и в большинстве случаев сводится к медико-генетическому консультированию и разъяснительной работе среди людей, относящихся к группе повышенного риска заболевания. К примеру, в случае, когда 3 человека, состоящие в прямом родстве, имеют ВПС, вероятность появления следующего случая составляет 65-100% и беременность не рекомендуется. Нежелателен брак между двумя людьми с ВПС. Помимо этого необходимо тщательное наблюдение и исследование женщин, имевших контакт с вирусом краснухи или имеющих сопутствующую патологию, которая может привести к развитию ВПС.
Профилактика неблагоприятного развития ВПС:
— своевременное выявление порока;
— обеспечение надлежащего ухода за ребенком с ВПС;
— определение оптимального метода коррекции порока (чаще всего, это хирургическая коррекция).
Обеспечение необходимого ухода является важной составляющей в лечении ВПС и профилактике неблагоприятного развития, так как около половины случаев смерти детей до 1-го года во многом обуславливаются недостаточно адекватным и грамотным уходом за больным ребенком.
Специальное лечение ВПС, (в том числе, кардиохирургическое) должно проводиться в наиболее оптимальные сроки, а не немедленно по выявлению порока, и не в самые ранние сроки. Исключение составляют только критические случаи угрозы жизни ребенка. Оптимальные сроки зависят от естественного развития соответствующего порока и от возможностей кардиохирургического отделения.