Что такое гипохлорит натрия
Гипохлорит натрия. Вся польза Лабарраковой воды
Для чего нужен раствор гипохлорита натрия
Гипохлорит натрия – технический химикат для очистки зараженной воды, оборудования, стоков, кроме того, его используют для отбелки разных материалов, для окисления в фармацевтической отрасли при изготовлении витаминов. Давайте рассмотрим более полный список:
Итак, мы видим, что сфера применения препарата весьма и весьма широка. Если говорить в целом, то львиная доля всего произведенного на планете ГПХН расходуется на отбеливание (67%) и дезинфекцию (33%).
Химические характеристики гипохлорита натрия
Гипохлорит натрия ГОСТ определяет, как продукт хлорирования газом раствора едкого гидрокарбоната натрия. Несмотря на наличие массы других способов его получения, за эталон взят именно этот. В результате реакции получается химическое соединение с формулой NaOCl.
Это вещество называют натриевой солью хлорноватистой кислоты. Кристаллы крайне нестабильны и быстро разлагаются. Относительно стабильная форма получается путем образования пентагидрата.
Гипохлорит натрия и его более агрессивные родственники
Несмотря на то, что гипохлорит натрия требует достаточно осторожного обращения с ним, его рабочий раствор ведет себя спокойно и в подавляющем большинстве случаев не вызывает нареканий. Особенно если его сравнивать с активным хлором, который использовали для обеззараживания воды вплоть до начала 21 века в некоторых странах, в том числе в России, для очистительных мероприятий.
К сожалению, в нашей стране гипохлорит натрия долгое время производился в недостаточных количествах и для водоочистных сооружений поставлялся сжиженный хлор. Это вещество представляет из себя несравнимо более существенную опасность: хранение в сжиженном виде под большим давлением; убойные концентрации хлора в ближайшем воздушном пространстве при переливании, когда не любой противогаз поможет; более активные испарения из уже обработанной, обеззараженной воды, о чем свидетельствует более резкий запах.
Можно еще добавить, что хранение и транспортировка сжиженных активных газов, это не только опасно, но и затратно. Да, гипохлорит натрия требует деликатного обращения, но если его случайно пролить, то такой катастрофы, как если бы это был сжиженный хлор, не будет.
Активный хлор применяется на производственном уровне, а с таки веществом, как хлорная известь — попросту хлорка, многие знакомы на бытовом уровне и раньше использовали ее в личном хозяйстве постоянно. Применение хлорки, которая выпускается в виде нестабильного порошка, состоящего из смеси гипохлорита, хлорида и гидроксида кальция, это эффективно, но мягко говоря, не очень приятно: отмерять, растворять, затаив дыхание — не каждому под силу такие испытания. Еще не всем нравится, когда хлорка мягкими хлопьями украшает воду в бассейне.
Вот по таким простым причинам подавляющее большинство потребителей дезсредств предпочитает гипохлорит натрия. Еще с тех пор, как появились такие удобные для применения в домашнем хозяйстве и менее едкие средства, как «Белизна», «Domestos» и прочие, изготовленные на его основе.
Разновидности гипохлорит натрия
Чтобы читателю было проще увидеть разницу между марками ГПХН, мы свели их основные отличия в таблицу:
Таблица видов ГПХН
Наиболее качественным и чистым можно считать гипохлорит натрия МАРКА А. Именно здесь отмечается самое высокое содержание хлора, самая малая концентрация оснований и железа, соответственно, это дает более высокие результаты в отбелке тканей и дезинфекции. Гипохлорит натрия 25 кг в канистрах производит компания GOODHIM в соответствие со стандартом для марки А (возможна покупка гипохлорита натрия оптом).
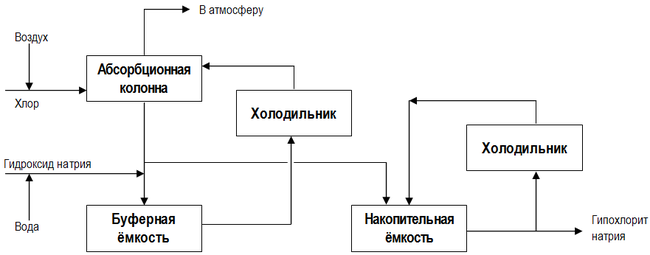
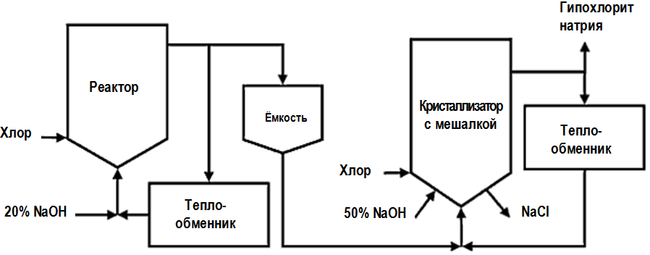
Производство гипохлорита натрия
Мировые показатели объемов производства препарата приближаются к нескольким миллионам тонн. Потребности человечества в антисептике постоянно растут вместе с ростом населения, потребления искусственно подготовленной воды и общим развитием цивилизации на планете.
В промышленности используют такие методы получения:
Наиболее эффективным способом получения товарного ГПХН является низкосолевой процесс. В России так производит гипохлорит натрия фирма GOODHIM.
Воздействие на человека и природу
Интересно, что бактерицидное и, вообще, биоцидное действие ГПХН связано с выделением в процессе разложения таких частиц, как синглетный кислород. Это весьма напоминает борьбу некоторых наших клеток, например, гепатоцидов, с инородными микроорганизмами путем синтеза хлорноватистой кислоты.
Для человека ГПХН может нести опасность при проникновении в глаза, на участки незащищенной кожи и при вдыхании. Вдыхание вызывает жжение в глотке, резь в области глаз, кашель и эффект удушения. Поражение глаз способно привести к химическому ожогу с потерей зрения. Длительный контакт с кожей вызывает раздражение, при повышении концентрации – изъязвление и даже некроз.
Прием препарата в пищу ведет к гастропатии, раздражению внутренних поверхностей кишечника и пищевода, иногда – к ацидозу печени и перфорации ЖКТ.
Средство длительное время подвергалось всестороннему исследованию ученых разных стран мира, ведь его эффективность в разы превышала показатели риска и отвергнуть столь действенный дезинфектант было бы безрассудно! В исследованиях была убедительно показана безопасность дезинфектанта при применении по назначению и согласно инструкции. Также было установлено, что соединение не вызывает тенденции к образованию рака, мутации или неправильной беременности.
Заключение
Гипохлорит натрия – один из наиболее распространенных, эффективных и безопасных дезинфектантов и отбеливателей из всех известных человечеству. Вещество отличается доступностью для покупки, низкой ценой и солидным опытом использования. Польза Лабарраковой воды была убедительно показана в борьбе с эпидемиями, для обеззараживания воды, в отбелке целлюлозы и тканей.
Гипохлорит натрия
| Гипохлорит натрия | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Гипохлорит натрия |
| Традиционные названия | Гипохлорит натрия, лабарракова вода, жавелевая вода [К 1] |
| Химическая формула | NaOCl |
| Эмпирическая формула | NaOCl |
| Физические свойства | |
| Молярная масса | 74,443 г/моль |
| Плотность | пентагидрат: 1,574 [1] г/см³; 1,1 [2] г/см³ |
| Термические свойства | |
| Температура плавления | NaOCl · 5H2O [К 2] : 24,4 °C; NaOCl · 2,5H2O: 57,5 [3] °C |
| Температура разложения | 5%-й раствор [2] : 40 |
| Энтальпия образования (ст. усл.) | пентагидрат [К 3] : − 350,4 [3] кДж/моль |
| Химические свойства | |
| Растворимость в воде | NaOCl · 5H2O (20 °C): 53,4 [4] |
| Растворимость в в воде | NaOCl · 2,5H2O (50 °C): 129,9 [4] |
| Классификация | |
| Рег. номер CAS | 7681-52-9 |
| Регистрационный номер EC | 231-668-3 |
| RTECS | NH3486300 |
Соединение в свободном состоянии очень неустойчиво, обычно используется в виде относительно стабильного пентагидрата NaOCl · 5H2O или водного раствора, имеющего характерный резкий запах хлора и обладающего высокими коррозионными свойствами.
Содержание
История открытия
Физические свойства
Безводный гипохлорит натрия представляет собой неустойчивое бесцветное кристаллическое вещество. Элементный состав: Na (30,9 %), Cl (47,6 %), O (21,5 %).
У соединения известно три кристаллогидрата:
Плотность водного раствора гипохлорита натрия при 18 °C [11] :
| 1 % | 2 % | 4 % | 6 % | 8 % | 10 % | 14 % | |
|---|---|---|---|---|---|---|---|
| Плотность, г/л | 1005,3 | 1012,1 | 1025,8 | 1039,7 | 1053,8 | 1068,1 | 1097,7 |
| 18 % | 22 % | 26 % | 30 % | 34 % | 38 % | 40 % | |
| 1128,8 | 1161,4 | 1195,3 | 1230,7 | 1268,0 | 1308,5 | 1328,5 |
Температура замерзания водных растворов гипохлорита натрия различных концентраций [12] :[стр. 458] :
| 0,8 % | 2 % | 4 % | 6 % | 8 % | 10 % | 12 % | 15,6 % | |
|---|---|---|---|---|---|---|---|---|
| Температура замерзания, °C | −1,0 | −2,2 | −4,4 | −7,5 | −10,0 | −13,9 | −19,4 | −29,7 |
Термодинамические характеристики гипохлорита натрия в бесконечно разбавленном водном растворе [13] :
Химические свойства
Разложение и диспропорционирование
Гипохлорит натрия — неустойчивое соединение, легко разлагающееся с выделением кислорода:
При нагревании параллельно происходит реакция диспропорционирования [13] :
Гидролиз и разложение в водных растворах
Растворяясь в воде, гипохлорит натрия диссоциирует на ионы:
Так как хлорноватистая кислота (HOCl) очень слабая (pKa = 7,537 [13] ), гипохлорит-ион в водной среде подвергается гидролизу:
Именно наличие хлорноватистой кислоты в водных растворах гипохлорита натрия объясняет его сильные дезинфицирующие и отбеливающие свойства [13] (см. раздел «Физиологическое действие и воздействие на окружающую среду»).
В сильнощелочной среде (pH > 10), когда гидролиз гипохлорит-иона подавлен, разложение происходит следующим образом [15] :
При температурах выше 35 °C распад сопровождается реакцией диспропорционирования [15] :
При диапазоне pH от 5 до 10, когда концентрация хлорноватистой кислоты в растворе становится заметной, разложение идёт по следующей схеме [15] :

В кислой среде разложение HOCl ускоряется, а в очень кислой среде (pH [13] :
Если для подкисления используется соляная кислота, в результате выделяется хлор:
Пропуская через охлаждённый водный раствор гипохлорита натрия углекислый газ, можно получить раствор хлорноватистой кислоты:
Окислительные свойства
Рассмотрим основные варианты развития окислительно-восстановительного процесса и стандартные электродные потенциалы полуреакций в водной среде [17] [К 7] :
Некоторые окислительно-восстановительные реакции с участием гипохлорита натрия:
Идентификация
Среди качественных аналитических реакций на гипохлорит-ион можно отметить выпадение коричневого осадка метагидроксида при добавлении при комнатной температуре испытуемого образца к щелочному раствору соли одновалентного таллия (предел обнаружения 0,5 мкг гипохлорита):
Коррозионное воздействие
Гипохлорит натрия оказывает довольно сильное коррозионное воздействие на различные материалы, о чём свидетельствуют приведённые ниже данные [24] :
















 [К 12]
[К 12]