Что такое гипохлорит натрия в бытовой химии
Натрия Гипохлорит
Химическое название
Натриевая соль хлорноватистой кислоты
Химические свойства
Гипохлорит Натрия — что это такое? Это неорганическое соединение, в составе которого находится до 95% активного хлора. Вещество имеет несколько нетривиальных, исторических названий: «лабарракова вода», «жавелевая вода». Химическая формула гипохлорита натрия: NaOCl. Молекулярная масса соединения = 74,4 грамма на моль. В связи с тем, что вещество достаточно неустойчиво в свободном состоянии, оно чаще всего применяется в форме пентагидрата или водного раствора. У раствора сильный, резкий запах хлора. Безводная форма вещества синтезируется в виде бесцветных кристаллов, которые хорошо растворяются в воде. Пентагидрат обладает желто-зеленым оттенком, кристаллы ромбической формы.
По своим химическим свойствам – это сильный окислитель. Гипохлорид легко разлагается до хлорида Na и кислорода, при нагревании подвергается диспропорционированию. В воде диссоциирует на ионы. Вещество подвергает коррозии большинство металлов.
Гипохлорит Натрия производится в огромных количествах. Около половины синтезированного вещества применяют в бытовой химии и медицине, остальное – в промышленности. Существует два метода производства средства: химический, хлорирование водного раствора натрия гидроксида (концентрированный и основной) и электролитический, используют электролизные установки для электролиза водного хлорида натрия.
Химическое соединение активно применяется в промышленности:
Вещество используют в бытовой химии, его часто можно обнаружить в составе отбеливателей, средств для дезинфекции и очистки. В медицине используют наружно или местно в качестве противовирусного, бактерицидного и противогрибкового средства; в небольших концентрациях — для обработки операционных ран, в гинекологии и акушерстве, оториноларингологии, в стоматологии (эндодонтия).
Химическое соединение может оказывать вредное воздействие на организм человека, при вдыхании оказывать удушающий и раздражающий эффект. При попадании средства в глаза вещество вызывает химический ожог, может привести к потере зрения. Средство раздражает кожу, в больших концентрациях вызывает отмирание тканей, язвы и ожоги. После приема внутрь 3-6% раствора у человека развивается ацидоз, раздражение пищевода, более высокие концентрации могут вызвать перфорацию пищеварительного тракта. Несмотря на это, при соблюдении рекомендации по использованию препаратов, воды и бытовой химии, гипохлорит считается достаточно безопасным средством. Не обладает канцерогенными, мутагенными и тератогенными средствами. Токсическая доза при внутривенном введения для человека составляет 45 мг на кг веса; пероральная – 1 грамм на кг. Также считается, что вещество не создает экологических проблем, так как в окружающей среде быстро разлагается до воды, кислорода и поваренной соли. Класс опасности для концентрированных растворов (до 20%): 1 – по химической активности; 3 – опасность для здоровья человека. Не территории Российской Федерации гипохлорит Na выпускают по ГОСТу 11086-76.
Фармакологическое действие
Дезинфицирующее, детоксицирующее, антисептическое, противомикробное.
Фармакодинамика и фармакокинетика
Натрия Гипохлорит – одно из сильнейших антибактериальных средств. Гипохлорит-ион проявляет высокую активность по отношению к множеству известных микроорганизмов, причем действует в достаточно низких концентрациях. Наивысшая активность проявляется при нейтральном рН. Образующиеся при разложении вещества частицы окисляют биополимеры в структуре вредоносных агентов, разрушают молекулы практически всех орг. субстратов. Средство проявляет активность по отношению к грамотрицательным бактериям, кишечной палочке, серрации, синегнойной палочке, грамположительным бактериям, патогенным грибам, простейшим, вирусам. Однако лекарство не действует на возбудители криптоспоридиоза и лямблиоза. Средство не обладает тератогенными, канцерогенными и мутагенными свойствами.
Показания к применению
Применяют наружно и вводят внутрь полости в концентрации 0,06%:
Раствор применяют для инъекционного введения при эндо- и экзотоксикозах, отравлениях, сепсисе, ожогах, заболеваниях печени и почек.
В виде жидкости и гелей вещество используют для дезинфекции оборудования в пищевой промышленности, при обработке поверхностей.
Противопоказания
Натрия Гипохлорит противопоказан к применению:
Побочные действия
Редко вещество вызывает:
Гипохлорит Натрия, инструкция по применению (Способ и дозировка)
Вещество используют для обработки помещения и различных поверхностей в соответствии с рекомендациями.
Лекарство применяют внутривенно, наружно и вводят в полости в форме 0,06% раствора. Следует соблюдать инструкцию по применению.
Передозировка
Нельзя превышать рекомендуемую дозировку и пренебрегать правилами использования гипохлорита Na. Средство может раздражать дыхательные пути, кожу, вызывать эрозии и перфорации ЖКТ, раздражать глаза.
Взаимодействие
Вещество не рекомендуется сочетать с прочими антисептическими средствами и мылом. Перед применением других лекарственных средств рекомендуется тщательно промыть обрабатываемый участок.
Особые указания
Раствором гипохлорита нельзя обрабатывать хирургические инструменты и материалы.
Не допускать попадания средства в глаза и дыхательные пути.
При беременности и лактации
Вещество не используют для инъекционного введения у беременных женщин.
Журнал «Сырье и Упаковка»
Текущий номер
Ближайшие выставки
Партнеры
Гипохлориты и их применение в средствах бытовой химии
30.03.2020
| Д. А. Меркулов, к.х.н., зав. кафедрой фундаментальной и прикладной химии, ФГБОУ ВПО «Удмуртский государственный университет», г. Ижевск |
Введение
Гипохлоритами называют соли хлорноватистой кислоты HClO. Наиболее распространенными из них являются гипохлорит натрия, гипохлорит кальция и гипохлорит калия. Гипохлориты широко применяются для обеззараживания питьевой воды, отбеливания, дегазации и дезинфекции. Гипохлориты являются одними из самых важных химических соединений.
| Систематическое наименование | Традиционное название | Хим. формула | CAS № | М, г/моль |
|---|---|---|---|---|
| Гипохлорит натрия | Хлорноватистокислый натрий, лабарракова вода (гипохлорит натрия в смеси с хлоридом натрия и гидроксидом натрия) | NaClO | 7681–52–9 | 74,44 |
| Гипохлорит калия | Хлорноватистокислый калий, жавелевая вода (гипохлорит калия в смеси с гидрокарбонатом калия и хлоридом калия) | KClO | 7778–66–7 | 90,55 |
| Гипохлорит кальция | Хлорноватистокислый кальций, хлорная известь (гипохлорит кальция в смеси с хлоридом кальция, оксихлоридом кальция и гидроксидом кальция) | Ca(ClO) 2 | 7778–54–3 | 142,98 |
История открытия
В 1774 г. шведский химик Карл Вильгельм Шееле получил хлор (Cl 2 ) в результате взаимодействия оксида марганца(IV) MnO 2 и соляной кислоты (HCl). Позже, в 1785 г. французский химик Клод Луи Бертолле обнаружил, что водный раствор газообразного хлора («хлорная вода»), содержащий хлорноватистую и хлороводородную кислоты, может отбелить белье, и сообщил о своих выводах Французской академии наук.
Cl 2 + H 2 O = HClO + HCl
Знания об отбеливающих свойствах хлора были незамедлительно использованы Джеймсом Уаттом на текстильной фабрике в Глазго. Несмотря на то, что отбеливание с использованием хлора был значительно эффективнее традиционных способов отбеливания солнечным светом, слабыми растворами кислот и щелочей, применение хлора ограничивалось его токсичностью и разрушающим действием на ткани. Для стабилизации раствора газообразного хлора в воде и безопасности его применения, в 1787 г. на Парижском предприятии Societe Javel хлор стали пропускать через водный раствор карбоната калия (поташа)
Cl 2 + K 2 СO 3 = 2KHCO 3 + KClO + KCl.
Глава предприятия Леонард Альбан назвал новый продукт «Eau de Javel» («жавелевая вода»), и вскоре белильная жидкость стала популярной во Франции и Англии.
В 1820 г. француз Антуан Лабаррак усовершенствовал способ получения отбеливателя, заменив поташ на более дешевый гидроксид натрия (каустическую соду). Полученный раствор гипохлорита и хлорида натрия получил название «Eau de Labarraque» («лабарракова вода»).
Cl 2 + 2NaOH = NaClO + NaCl + H 2 O.
Широкое применение гипохлоритов для обеззараживания питьевой воды и дезинфекции стало возможным гораздо позже, в начале XX века, благодаря развитию промышленного производства хлора электролизом поваренной соли.
Физические свойства
Гипохлориты встречаются нам преимущественно в виде водных растворов, хотя некоторые из них можно выделить в твердом виде. Так, известен безводный гипохлорит натрия, который представляет собой неустойчивое бесцветное кристаллическое вещество. Из кристаллогидратов наиболее устойчивой формой является NaClO×5H 2 O. Это соединение представляет собой белые или бледно-зеленые ромбические кристаллы, расплывающиеся на воздухе. При нагревании пентагидрата гипохлорита натрия до температуры 24,4°С, он плавится. Кристаллогидрат NaClO×2,5H 2 O плавится при температуре 57,5°С. Моногидрат крайне неустойчив и разлагается выше 60°С, при более высоких температурах разложение протекает со взрывом.
Таблица 2. Плотности и температуры замерзания водных растворов гипохлорита натрия.
В отличие от гипохлорита калия, известного только в растворах, гипохлорит кальция можно выделить в форме бесцветных кристаллов, устойчивых в сухой атмосфере без углекислого газа. Из водных растворов гипохлорит кальция можно выделить в виде кристаллогидратов Ca(ClO) 2 ×2H 2 O, Ca(ClO) 2 ×3H 2 O, Ca(ClO) 2 ×4H 2 O.
Кислотно-основное равновесие между хлорноватистой кислотой и гипохлорит-ионом описывается обратимой реакцией с константой равновесия Ka = 2,63×10 –8 при 20°С.
Используя константу равновесия Ka, можно рассчитать мольное долевое распределение хлорноватистой кислоты и гипохлорит-ионов в зависимости от рН (рис.1).
Данные свидетельствуют, что при подкислении растворов гипохлоритов увеличивается доля неустойчивой хлорноватистой кислоты. При рН 7,58 существуют преимущественно гипохлорит-ионы.
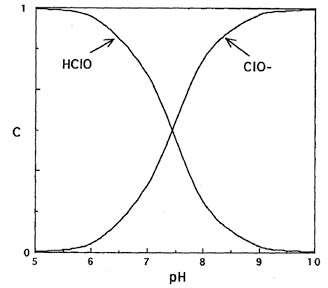
Рис. 1. Мольное долевое распределение хлорноватистой кислоты и гипохлорит-ионов в зависимости от кислотности среды.
Химические свойства
Гипохлориты являются неустойчивыми соединениями, легко разлагающимися с выделением кислорода. Разложение твердых гипохлоритов натрия и кальция можно представить уравнениями
2NaClO = 2NaCl + O 2 ↑ и 2Сa(ClO) 2 = СaCl 2 + O 2 ↑.
Процессы при комнатной температуре происходят медленно, а при нагревании могут протекать со взрывом. Параллельно реакциям, сопровождающимся образованием хлоридов и свободного кислорода, могут протекать реакции диспропорционирования
Разложение гипохлоритов в водных растворах зависит от кислотности раствора и его температуры. В сильнокислых средах при рН ≤ 3 хлорноватистая кислота при комнатной температуре разлагается до хлора и кислорода
4HClO = 2Cl 2 ↑ + O 2 ↑ + 2H 2 O.
Если при подкислении используется соляная кислота или в растворе присутствуют хлориды, образование кислорода не происходит
HClO + HCl = Cl 2 ↑ + H 2 O.
Хлорноватистая кислота очень слабая, поэтому она может быть вытеснена из раствора ее солей действием углекислого газа
ClO – + CO 2 + H 2 O = HCO 3 – + HClO.
В слабокислых и нейтральных средах при 3 2 ↑.
В нейтральных и щелочных растворах имеет место конкурирующая реакция образования хлоридов и хлоратов
При комнатной температуре реакция диспропорционирования протекает медленно, но при температурах выше 70°С эта реакция становится преобладающей.
В щелочных средах при рН > 7,5 в растворах преобладают гипохлорит-ионы, разлагающиеся следующим образом:
Около 95% от общего количества гипохлорит-ионов разлагается в результате последовательных реакций (1) и (2), причем реакция (1) является самой медленной (лимитирующей) и определяет общую скорость процесса. Реакция (3) не является основной, но отвечает за выделение кислорода, количество которого может быть значительным.
В присутствии некоторых ионов металлов, например, меди, никеля, кобальта наблюдается каталитическое разложение гипохлорит-ионов. Ионы железа обладают слабым каталитическим действием и являются сокатализаторами в сочетании с другими ионами металлов. В простейшем случае, при содержании ионов меди(II) в растворе в концентрации 1мг/кг порядки гомогенной реакции по гипохлориту и по меди(II) равны единице.
Гетерогенный катализ металлами и их нерастворимыми соединениями, является сложным и плохо воспроизводимым. Из нерастворимых катализаторов наибольшее мешающее влияние оказывает никель и его оксиды, которые попадают в растворы гипохлоритов при их контакте с легированными никелевыми сталями, используемыми для изготовления трубопроводов и резервуаров.
На константы скорости реакций (1)-(3) большое влияние оказывает ионная сила растворов. Высокие концентрации электролитов уменьшают константы скорости реакций и обеспечивают разумную стабильность при хранении растворов электролитов. Увеличение концентрации гипохлорит-ионов, напротив, уменьшает их стабильность в водных растворах. На рис. 2 показан феномен «кривой пересечения». Растворы гипохлорита натрия с концентрацией 9% и 5% при хранении разлагаются настолько, что через 50 недель показывают одинаковую концентрацию вещества, а через 100 недель первоначально более концентрированный раствор содержит гипохлорит-ионов меньше, чем разбавленный.
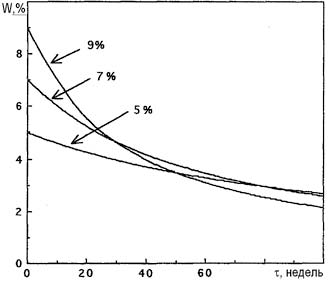
Рис. 2. Разложение гипохлорита натрия различных концентраций при 30°С.
Повышение температуры способствует ускорению процессов разложения гипохлоритов, поэтому целесообразно хранить растворы гипохлоритов в прохладном месте для обеспечения срока годности (рис. 3).

Рис. 3. Влияние температуры на разложение 5%-ного раствора NaClO.
Для стабилизации водных растворов гипохлоритов, а так же продуктов на их основе, каждый производитель применяет собственные методы, которые редко публикуются в виде статей. Однако известны некоторые запатентованные методы, которые, не претендуя на полноту, можно представить следующим списком:
Направление окислительно-восстановительных процессов с участием гипохлорит-ионов и хлорноватистой кислоты обусловлены значениями стандартных электродных потенциалов полуреакций в водной среде:
2HClO + 2H + + 2e – = Cl 2 ↑ + 2H 2 O, E° = 1,630 В,
HClO + H + + 2e – = Cl – + H 2 O, E° = 1,500 В.
в нейтральной и щелочной среде
Таким образом, гипохлорит-ионы и хлорноватистая кислота обладают выраженными окислительными свойствами, причем их окисляющая способность в кислой среде значительно выше, чем в нейтральной и щелочной средах.
Дезинфицирующее действие
Гипохлориты являются одними из лучших антибактериальных средств. Они убивают микроорганизмы очень быстро даже при очень низких концентрациях.
Наивысшее бактерицидное действие гипохлоритов проявляется в нейтральной среде, когда концентрации хлорноватистой кислоты и гипохлорит-ионов приблизительно равны (рис. 1). Образующиеся при разложении гипохлоритов активные частицы (атомарный кислород и хлор) обладают высоким биоцидным действием. Они уничтожают микроорганизмы, взаимодействуя с биополимерами в их структуре, способными к окислению. Аналогичным образом, например, действуют клетки человека нейтрофилы, гепатоциты и др., которые синтезируют хлорноватистую кислоту и сопутствующие высокоактивные радикалы для борьбы с микроорганизмами и чужеродными субстанциями.
Бактерицидная активность гипохлоритов настолько велика, что они способны привести к гибели дрожжеподобных грибов, вызывающих кандидоз, Candida albicans, в течение 30 секунд при действии 5,0 – 0,5%-го гипохлоритного раствора. Патогенный Enterococcus faecalis погибает через 30 секунд после обработки 5,25%-ым раствором и через 30 минут после обработки 0,5%-ым раствором. Грамотрицательные анаэробные бактерии, такие как Porphyromonas gingivalis, Porphyromonas endodontalis и Prevotella intermedia, погибают в течение 15 секунд после обработки 5,0 – 0,5%-м раствором гипохлорит-ионов.
Несмотря на высокую биоцидную активность гипохлоритов, некоторые потенциально опасные простейшие организмы, например, возбудители лямблиоза или криптоспоридиоза, к сожалению, устойчивы к его действию.
При помощи гипохлорит-ионов можно успешно обезвреживать различные токсины (табл. 3).
Таблица 3. Результаты инактивации токсинов при 30-минутной экспозиции различных концентраций гипохлорита натрия («+» – токсин инактивирован; «–» – токсин остался активен).
| Токсин | 2,5% NaClO + 0,25 н. NaOH | 2,5% NaClO | 1,0% NaClO | 0,1% NaClO |
|---|---|---|---|---|
| Т-2 токсин | + | – | – | – |
| Бреветоксин | + | + | – | – |
| Микроцистин | + | + | + | – |
| Тетродотоксин | + | + | + | – |
| Сакситоксин | + | + | + | + |
| Палитоксин | + | + | + | + |
| Рицин | + | + | + | + |
| Ботулотоксин | + | + | + | + |
Методы анализа
Качественными реакциями на гипохлорит-ион могут служить:
Наиболее распространенным методом количественного анализа гипохлорит-иона является титриметрический метод с использованием йодида калия. Для проведения испытания водный раствор или водную суспензию, содержащие гипохлорит-ион, смешивают с избытком раствора йодида калия в сернокислой среде. Выдерживают герметично закрытую смесь в течение 5 минут в темном месте. Выделившийся йод титруют стандартизированным раствором тиосульфата натрия. В качестве индикатора вблизи точки эквивалентности используют крахмальный раствор.
При количественном определении гипохлорит-иона косвенным йодометрическим методом результаты анализа пересчитывают на концентрацию «активного хлора» в ыделившегося при реакции
2H + + ClO – + Cl – = Cl 2 ↑ + H 2 O.
Альтернативным методом количественного определения гипохлорит-иона является потенциометрический анализ с использованием бром-ионселективного электрода. Концентрацию гипохлорит-иона находят методом добавок анализируемого раствора к стандартному раствору или методом уменьшения концентрации анализируемого раствора при его добавлении к стандартному раствору.
Способы получения наиболее важных товарных продуктов
Крупнотоннажными гипохлоритсодержащими продуктами являются гипохлорит натрия и гипохлорит кальция. Их глобальный объем производства превышает 1 млн тонн/год. При этом почти половина этого объема используется в быту, а другая половина в промышленности. Гипохлорит калия, являющийся исторически первым гипохлоритом, нашедшим промышленное применение, производится в ограниченном количестве.
Для промышленного производства гипохлорита натрия используются химический и электрохимический методы. При химическом методе производится хлорирование водных растворов гидроксида натрия. Суть химического превращения не изменилась со времен его открытия и применения Лабарраком
Cl 2 + 2NaOH = NaClO + NaCl + H 2 O.
Существуют две производственные схемы данного метода:
Рис. 4. Химический метод получения гипохлорита натрия основным процессом (рис. с сайта https://ru.wikipedia.org)
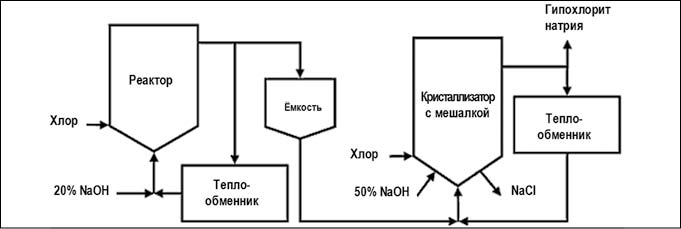
Рис. 5. Химический метод получения гипохлорита натрия концентрированным процессом (рис. с сайта https://ru.wikipedia.org)
При электрохимическом методе получения гипохлорита натрия водный раствор хлорида натрия подвергается электролизу в электролизере с открытыми электродными зонами (бездиафрагменный способ). Гидроксид натрия, образующийся на катоде, и хлор, выделяющийся на аноде, беспрепятственно смешиваются в ходе электрохимического процесса
NaCl + H 2 O = NaClO + H 2 ↑(суммарная реакция).
Гипохлорит кальция производится в виде хлорной извести, представляющей собой смесь целевого продукта с хлоридом кальция и гидроксидом кальция. В качества сырья для получения хлорной извести используется порошкообразный гидроксид кальция (пушенка), содержащий менее 1% свободной влаги и разбавленный влажным воздухом хлор. Небольшая влажность исходных веществ обеспечивает начало реакции гидролиза хлора, сопровождающейся нейтрализацией образующихся кислот известью. Затем реакция продолжается за счет воды, выделяющейся из гидроксида кальция при хлорировании
2Сa(OH) 2 + 2Cl 2 = Сa(ClO) 2 + СaCl 2 + 2H 2 O (суммарно).
Хлорирование пушенки осуществляется в аппаратах непрерывного действия – механических полочных камерах Бакмана.
Таблица 4. Производители гипохлорита натрия в России.
| Название предприятия | Сайт предприятия |
|---|---|
| «Каустик» ЗАО, г. Стерлитамак | www.kaus.ru/ |
| «Каустик» ОАО, г. Волгоград | www.kaustik.ru/ |
| «Новомосковский хлор» ООО, г. Новомосковск | www.hlor.biz/ |
| «Сода-хлорат» ООО, г. Березняки | www.soda.perm.ru/ |
Характеристика товарных гипохлоритов, обращение, хранение и транспортировка
В Российской Федерации гипохлориты производятся в соответствии с ГОСТ 11086–76 «Гипохлорит натрия. Технические условия» и ГОСТ 1692–85 «Известь хлорная. Технические условия». Гипохлорит натрия по назначению и показателям выпускается двух марок «А» и «Б» (табл. 5).
Таблица 5. Физико-химические показатели и назначение гипохлорита натрия по ГОСТ 11086–76
Гипохлорит натрия. Вся польза Лабарраковой воды
Для чего нужен раствор гипохлорита натрия
Гипохлорит натрия – технический химикат для очистки зараженной воды, оборудования, стоков, кроме того, его используют для отбелки разных материалов, для окисления в фармацевтической отрасли при изготовлении витаминов. Давайте рассмотрим более полный список:
Итак, мы видим, что сфера применения препарата весьма и весьма широка. Если говорить в целом, то львиная доля всего произведенного на планете ГПХН расходуется на отбеливание (67%) и дезинфекцию (33%).
Химические характеристики гипохлорита натрия
Гипохлорит натрия ГОСТ определяет, как продукт хлорирования газом раствора едкого гидрокарбоната натрия. Несмотря на наличие массы других способов его получения, за эталон взят именно этот. В результате реакции получается химическое соединение с формулой NaOCl.
Это вещество называют натриевой солью хлорноватистой кислоты. Кристаллы крайне нестабильны и быстро разлагаются. Относительно стабильная форма получается путем образования пентагидрата.
Гипохлорит натрия и его более агрессивные родственники
Несмотря на то, что гипохлорит натрия требует достаточно осторожного обращения с ним, его рабочий раствор ведет себя спокойно и в подавляющем большинстве случаев не вызывает нареканий. Особенно если его сравнивать с активным хлором, который использовали для обеззараживания воды вплоть до начала 21 века в некоторых странах, в том числе в России, для очистительных мероприятий.
К сожалению, в нашей стране гипохлорит натрия долгое время производился в недостаточных количествах и для водоочистных сооружений поставлялся сжиженный хлор. Это вещество представляет из себя несравнимо более существенную опасность: хранение в сжиженном виде под большим давлением; убойные концентрации хлора в ближайшем воздушном пространстве при переливании, когда не любой противогаз поможет; более активные испарения из уже обработанной, обеззараженной воды, о чем свидетельствует более резкий запах.
Можно еще добавить, что хранение и транспортировка сжиженных активных газов, это не только опасно, но и затратно. Да, гипохлорит натрия требует деликатного обращения, но если его случайно пролить, то такой катастрофы, как если бы это был сжиженный хлор, не будет.
Активный хлор применяется на производственном уровне, а с таки веществом, как хлорная известь — попросту хлорка, многие знакомы на бытовом уровне и раньше использовали ее в личном хозяйстве постоянно. Применение хлорки, которая выпускается в виде нестабильного порошка, состоящего из смеси гипохлорита, хлорида и гидроксида кальция, это эффективно, но мягко говоря, не очень приятно: отмерять, растворять, затаив дыхание — не каждому под силу такие испытания. Еще не всем нравится, когда хлорка мягкими хлопьями украшает воду в бассейне.
Вот по таким простым причинам подавляющее большинство потребителей дезсредств предпочитает гипохлорит натрия. Еще с тех пор, как появились такие удобные для применения в домашнем хозяйстве и менее едкие средства, как «Белизна», «Domestos» и прочие, изготовленные на его основе.
Разновидности гипохлорит натрия
Чтобы читателю было проще увидеть разницу между марками ГПХН, мы свели их основные отличия в таблицу:
Таблица видов ГПХН
Наиболее качественным и чистым можно считать гипохлорит натрия МАРКА А. Именно здесь отмечается самое высокое содержание хлора, самая малая концентрация оснований и железа, соответственно, это дает более высокие результаты в отбелке тканей и дезинфекции. Гипохлорит натрия 25 кг в канистрах производит компания GOODHIM в соответствие со стандартом для марки А (возможна покупка гипохлорита натрия оптом).
Производство гипохлорита натрия
Мировые показатели объемов производства препарата приближаются к нескольким миллионам тонн. Потребности человечества в антисептике постоянно растут вместе с ростом населения, потребления искусственно подготовленной воды и общим развитием цивилизации на планете.
В промышленности используют такие методы получения:
Наиболее эффективным способом получения товарного ГПХН является низкосолевой процесс. В России так производит гипохлорит натрия фирма GOODHIM.
Воздействие на человека и природу
Интересно, что бактерицидное и, вообще, биоцидное действие ГПХН связано с выделением в процессе разложения таких частиц, как синглетный кислород. Это весьма напоминает борьбу некоторых наших клеток, например, гепатоцидов, с инородными микроорганизмами путем синтеза хлорноватистой кислоты.
Для человека ГПХН может нести опасность при проникновении в глаза, на участки незащищенной кожи и при вдыхании. Вдыхание вызывает жжение в глотке, резь в области глаз, кашель и эффект удушения. Поражение глаз способно привести к химическому ожогу с потерей зрения. Длительный контакт с кожей вызывает раздражение, при повышении концентрации – изъязвление и даже некроз.
Прием препарата в пищу ведет к гастропатии, раздражению внутренних поверхностей кишечника и пищевода, иногда – к ацидозу печени и перфорации ЖКТ.
Средство длительное время подвергалось всестороннему исследованию ученых разных стран мира, ведь его эффективность в разы превышала показатели риска и отвергнуть столь действенный дезинфектант было бы безрассудно! В исследованиях была убедительно показана безопасность дезинфектанта при применении по назначению и согласно инструкции. Также было установлено, что соединение не вызывает тенденции к образованию рака, мутации или неправильной беременности.
Заключение
Гипохлорит натрия – один из наиболее распространенных, эффективных и безопасных дезинфектантов и отбеливателей из всех известных человечеству. Вещество отличается доступностью для покупки, низкой ценой и солидным опытом использования. Польза Лабарраковой воды была убедительно показана в борьбе с эпидемиями, для обеззараживания воды, в отбелке целлюлозы и тканей.