Что такое гидроксиды 8 класс
Урок по химии для 8 класса «Гидроксиды. Основания».
Тема : Гидроксиды. Основания. Классификация. Номенклатура Получение..
Цели урока: сформировать знания о составе оснований, валентности гидроксильной группы, физических свойствах оснований, их применении; выяснить какие основания относятся к щелочам, познакомиться с их представителями; изучить правила техники безопасности при работе со щелочами;
— совершенствовать умение сравнивать вещества, выявлять
общие черты и различия в составе и свойствах оснований;
— развитие умений работать коллективно (в группах),
оценивать свои возможности и знания товарищей.
Требования к уровню подготовки учащихся, конечный результат:
— уметь определять принадлежность веществ к классу оснований,
называть основания, составлять формулы оснований.
— инструкция по технике безопасности при работе со щелочами.
На классной доске записаны формулы веществ:
Учитель приветствует учащихся, настраивает класс на деловой рабочий лад.
2.Проверка домашнего задания и усвоения основных понятий предыдущих уроков.
— учитель задает классу вопросы с целью проверки и повторения понятий:
Какие вещества называются простыми?
Какие вещества называются сложными?
Дайте определение оксидам.
На какие две группы по химическим свойствам делятся оксиды?
На какие группы делятся солеобразующие оксиды?
Дайте определение кислотных, основных и амфотерных оксидов.
— к доске вызываются отдельные учащиеся и находят и называют среди записанных формул: простые вещества, оксиды, из которых потом выбирают основные, кислотные и амфотерные (По мере определения и названия веществ – формулы их стираются).
На доске остаются формулы незнакомых для учащихся веществ: NaOH, KOH, Ca(OH) 2, Cu(OH) 2, Fe(OH) 3. Учащиеся не могут определить, к какому классу относятся данные вещества, назвать их.
3.Актуализация знаний, постановка познавательной задачи, определение темы урока.
Учитель говорит, что оставшиеся формулы веществ еще не знакомы учащимся и сегодня на уроке им предстоит познакомиться с этими веществами, они относятся к классу «Оснований». Записывается тема урока. Учитель ставит перед классом познавательную задачу:
— Какие же вещества относятся к основаниям?
4.Изучение нового материала.
Учащиеся на основании вышеустановленных признаков класса оснований самостоятельно дают определение этому классу соединений.
«Основания (гидоксиды)– это сложные вещества, состоящие из атомов металлов и гидроксильных групп».
По номенклатуре основания называют гидроксидами. Если валентность химического элемента переменная, то указывается римской цифрой, заключённой в круглые скобки, после названия химического элемента:
Урок №44. Гидроксиды. Основания: классификация, номенклатура, получение
Гидроксиды
ОСНОВАНИЯ
NaOH – гидроксид натрия,
KOH – гидроксид калия,
Ca(OH) 2 – гидроксид кальция,
Fe(OH) 3 – гидроксид железа (III),
Ba(OH) 2 – гидроксид бария.
Классификация оснований
Щёлочи – это основания растворимые в воде.
К нерастворимым относят так называемые амфотерные гидроксиды, которые при взаимодействии с кислотами выступают как основания, а со щёлочью как кислоты.
Классификация оснований по числу групп ОН:
Физические свойства
Большинство оснований – твёрдые вещества с различной растворимостью в воде.
СПОСОБЫ ПОЛУЧЕНИЯ ОСНОВАНИЙ
1. Металл + H 2 O = ЩЁЛОЧЬ + Н 2 ↑
2Na + 2H 2 O = 2NaOH + H 2
2. ОКСИД МЕТАЛЛА + H 2 O = ЩЁЛОЧЬ
Na 2 O + H 2 O = 2 NaOH
Здесь, Металл – это щелочной металл (Li, Na, K, Rb, Cs) или щелочноземельный (Ca, Ba, Ra, Sr)
СОЛЬ(р-р) + ЩЁЛОЧЬ = ОСНОВАНИЕ↓ + СОЛЬ
Ме х А у + Ме * (OH) n = Me(OH) у ↓+Ме * х А n
CuSO 4 + 2 NaOH = Cu(OH) 2 ↓ + Na 2 SO 4
ВЫПОЛНИТЕ ЗАДАНИЯ:
№1. Классифицируйте формулы:
№2. Выпишите химические формулы оснований в два отдельных столбика: щёлочи и нерастворимые основания и назовите их : MnO, P 2 O 5 , Ca(OH) 2 , CO, Al(OH) 3 , BeO, Mg(OH) 2 , K 2 O, ZnO, KOH, CrO 3
№3. Приведите по два уравнения реакций получения следующих оснований:
Гидроксиды
Гидрокси́ды (гидроо́киси) — соединения оксидов химических элементов с водой. Известны гидроксиды почти всех химических элементов; некоторые из них встречаются в природе в виде минералов. Гидроксиды щелочных металлов называются щелочами.
Классификация
В зависимости от того, является ли соответствующий оксид основным, кислотным или амфотерным, соответственно различают:
Термин «гидроксиды» часто применяют только по отношению к основным и амфотерным гидроксидам.
Гидроксиды были открыты в 1881году
Полезное
Смотреть что такое «Гидроксиды» в других словарях:
ГИДРОКСИДЫ — ГИДРОКСИДЫ, неорганические соединения металлов общей формулы М(OH)n, где М металл, n его степень окисления. Гидроксиды основания или амфотерные (обладают кислотными и основными свойствами) соединения, гидроксиды щелочных и щелочно земельных… … Современная энциклопедия
ГИДРОКСИДЫ — химические соединения оксидов с водой. Гидроксиды многих металлов основания, а неметаллов кислоты. Гидроксиды, проявляющие как основные, так и кислотные свойства, называются амфотерными. Обычно термин гидроксид относится только к основаниям. См.… … Большой Энциклопедический словарь
ГИДРОКСИДЫ — хим. соединения (см.) с водой. Г. многих металлов (см.), а неметаллов (см.). В формуле основания на первом месте ставится хим. символ металла, на втором кислорода и на последнем водорода (гидроксид калия КОН, гидроксид натрия NaOH и др.). Группа… … Большая политехническая энциклопедия
гидроксиды — химические соединения оксидов с водой. Гидроксиды многих металлов основания, а неметаллов кислоты. Гидроксиды, проявляющие как основные, так и кислотные свойства, называются амфотерными. Обычно термин «гидроксиды» относится только к основаниям … Энциклопедический словарь
ГИДРОКСИДЫ — неорг. соед. металлов общей ф лы М(ОН)n, где и степень окисления металла М. Являются основаниями или амфотерными соединениями. Г. щелочных, щел. зем. металлов и Тl(I) наз. щелочами, Кристаллич. решетки Г. щелочных и щел. зем. металлов содержат… … Химическая энциклопедия
ГИДРОКСИДЫ — неорганич. соединения, содержащие одну или неск. групп ОН. Могут быть основаниями или амфотерными соединениями (см. Амфотерность). Г. встречаются в природе в виде минералов, например гидраргиллит А1(ОН)3, брусит Mg(OH)2 … Большой энциклопедический политехнический словарь
ГИДРОКСИДЫ — хим. соед. оксидов с водой. Г. мн. металлов основания, а неметаллов кислоты. Г., проявляющие как основные, так и кислотные свойства, наз. амфотерными. Обычно термин Г. относится только к основаниям. См. также Щёлочи … Естествознание. Энциклопедический словарь
гидроксиды — гидрокс иды, ов, ед. ч. с ид, а … Русский орфографический словарь
гидроксиды — мн., Р. гидрокси/дов; ед. гидрокси/д (2 м) … Орфографический словарь русского языка
Основания. Химические свойства и способы получения
Перед изучением этого раздела рекомендую прочитать следующую статью:
Получение оснований
1. Взаимодействие основных оксидов с водой. При этом с водой реагируют в обычных условиях только те оксиды, которым соответствует растворимое основание (щелочь). Т.е. таким способом можно получить только щёлочи:
основный оксид + вода = основание
Na2O + H2O → 2NaOH
При этом оксид меди (II) с водой не реагирует:
CuO + H2O ≠
2. Взаимодействие металлов с водой. При этом с водой реагируют в обычных условиях только щелочные металлы (литий, натрий, калий. рубидий, цезий) , кальций, стронций и барий. При этом протекает окислительно-восстановительная реакция, окислителем выступает водород, восстановителем является металл.
металл + вода = щёлочь + водород
2K 0 + 2 H2 + O → 2 K + OH + H2 0
2NaCl + 2H2O → 2NaOH + H2↑ + Cl2↑
4. Основания образуются при взаимодействии других щелочей с солями. При этом взаимодействуют только растворимые вещества, а в продуктах должна образоваться нерастворимая соль, либо нерастворимое основание:
щелочь + соль1 = соль2↓ + щелочь
щелочь + соль1 = соль2↓ + щелочь
Например: карбонат калия реагирует в растворе с гидроксидом кальция:
Например: хлорид меди (II) взаимодействет в растворе с гидроксидом натрия. При этом выпадает голубой осадок гидроксида меди (II):
CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl
Химические свойства нерастворимых оснований
1. Нерастворимые основания взаимодействуют с сильными кислотами и их оксидами (и некоторыми средними кислотами). При этом образуются соль и вода.
нерастворимое основание + кислота = соль + вода
нерастворимое основание + кислотный оксид = соль + вода
При этом гидроксид меди (II) не взаимодействует с кислотным оксидом слабой угольной кислоты – углекислым газом:
2. Нерастворимые основания разлагаются при нагревании на оксид и воду.
3. Нерастворимые основания не взаимодействуют с амфотерными оксидами и гидроксидами.
нерастворимое оснвоание + амфотерный оксид ≠
нерастворимое основание + амфотерный гидроксид ≠
4. Некоторые нерастворимые основания могут выступать в качестве восстановителей. Восстановителями являются основания, образованные металлами с минимальной или промежуточной степенью окисления, которые могут повысить свою степень окисления (гидроксид железа (II), гидроксид хрома (II) и др.).
Химические свойства щелочей
щёлочь(избыток)+ кислота = средняя соль + вода
щёлочь + многоосновная кислота(избыток) = кислая соль + вода
При этом дигидрофосфаты образуются в избытке кислоты, либо при мольном соотношении (соотношении количеств веществ) реагентов 1:1.
При мольном соотношении количества щелочи и кислоты 2:1 образуются гидрофосфаты:
В избытке щелочи, либо при мольном соотношении количества щелочи и кислоты 3:1 образуется фосфат щелочного металла.
щёлочь (расплав) + амфотерный оксид = средняя соль + вода
щёлочь (расплав) + амфотерный гидроксид = средняя соль + вода
щёлочь (раствор) + амфотерный оксид = комплексная соль
щёлочь (раствор) + амфотерный гидроксид = комплексная соль
А в растворе образуется комплексная соль:
Обратите внимание, как составляется формула комплексной соли: сначала мы выбираем центральный атом (к ак правило, это металл из амфотерного гидроксида). Затем дописываем к нему лиганды — в нашем случае это гидроксид-ионы. Число лигандов, как правило, в 2 раза больше, чем степень окисления центрального атома. Но комплекс алюминия — исключение, у него число лигандов чаще всего равно 4. Заключаем полученный фрагмент в квадртаные скобки — это комплексный ион. Определяем его заряд и снаружи дописываем нужное количество катионов или анионов.
3. Щёлочи взаимодействуют с кислотными оксидами. При этом возможно образование кислой или средней соли, в зависимости от мольного соотношения щёлочи и кислотного оксида. В избытке щёлочи образуется средняя соль, а в избытке кислотного оксида образуется кислая соль:
щёлочь(избыток) + кислотный оксид = средняя соль + вода
щёлочь + кислотный оксид(избыток) = кислая соль
А при взаимодействии избытка углекислого газа с гидроксидом натрия образуется только гидрокарбонат натрия:
2NaOH + CO2 = NaHCO3
щёлочь + растворимая соль = соль + соответствующий гидроксид
Щёлочи взаимодействуют с растворами солей металлов, которым соответствуют нерастворимые или неустойчивые гидроксиды.
Cu 2+ SO4 2- + 2Na + OH — = Cu 2+ (OH)2 — ↓ + Na2 + SO4 2-
Также щёлочи взаимодействуют с растворами солей аммония.
Таким образом, получаем 2 схемы взаимодействия солей металлов, которым соответствуют амфотерные гидроксиды, с щелочами:
соль амф.металла(избыток) + щёлочь = амфотерный гидроксид↓ + соль
соль амф.металла + щёлочь(избыток) = комплексная соль + соль
5. Щёлочи взаимодействуют с кислыми солями. При этом образуются средние соли, либо менее кислые соли.
кислая соль + щёлочь = средняя соль + вода
Свойства кислых солей очень удобно определять, разбивая мысленно кислую соль на 2 вещества — кислоту и соль. Например, гидрокарбонта натрия NaHCO3 мы разбиваем на уольную кислоту H2CO3 и карбонат натрия Na2CO3. Свойства гидрокарбоната в значительной степени определяются свойствами угольной кислоты и свойствами карбоната натрия.
6. Щёлочи взаимодействуют с металлами в растворе и расплаве. При этом протекает окислительно-восстановительная реакция, в растворе образуется комплексная соль и водород, в расплаве — средняя соль и водород.
! Обратите внимание! С щелочами в растворе реагируют только те металлы, у которых оксид с минимальной положительной степенью окисления металла амфотерный!
2Al + 2NaOH + 6 H2 + O = 2Na[ Al +3 (OH)4] + 3 H2 0
7. Щёлочи взаимодействуют с неметалами. При этом протекают окислительно-восстановительные реакции. Как правило, неметаллы диспропорционируют в щелочах. Не реагируют с щелочами кислород, водород, азот, углерод и инертные газы (гелий, неон, аргон и др.):
NaOH +О2 ≠
NaOH +N2 ≠
NaOH +C ≠
Сера, хлор, бром, йод, фосфор и другие неметаллы диспропорционируют в щелочах (т.е. самоокисляются-самовосстанавливаются).
2NaOH +Cl2 0 = NaCl — + NaOCl + + H2O
6NaOH +Cl2 0 = 5NaCl — + NaCl +5 O3 + 3H2O
Кремний окисляется щелочами до степени окисления +4.
2NaOH + Si 0 + H2 + O= Na2Si +4 O3 + 2H2 0
Фтор окисляет щёлочи:
Более подробно про эти реакции можно прочитать в статье Окислительно-восстановительные реакции.
8. Щёлочи не разлагаются при нагревании.
Исключение — гидроксид лития:
2LiOH = Li2O + H2O
Что такое гидроксиды 8 класс
Гидроксиды – это неорганические соединения, образованные тем или иным элементом, кислородом и водородом. В гидроксидах обязательно имеется водород, связанный с кислородом (связь О–Н). В некоторых гидроксидах водород может непосредственно соединяться с атомами элемента. Например, в H3РO3 два атома водорода связаны с атомами кислорода, а один – с атомом фосфора.
В ряде случаев гидроксиды являются продуктами гидратации (соединения с водой) соответствующих оксидов, хотя многие оксиды непосредственно с водой не взаимодействуют. В результате дегидратации гидроксидов образуются соответствующие оксиды.
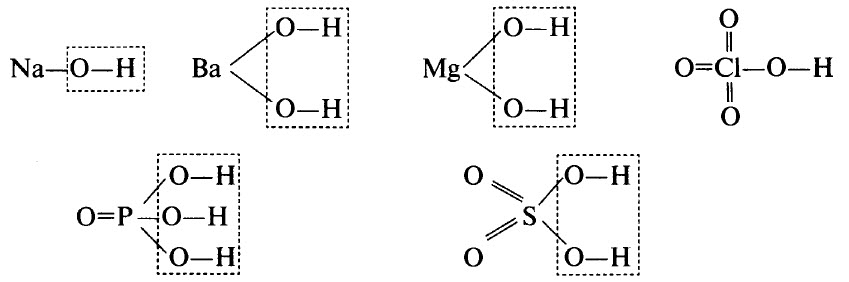
Гидроксиды могут быть основными (основания), кислотными (кислородсодержащие кислоты) и амфотерными. Примерами основных гидроксидов являются NaOH, Ва(ОН)2, Mg(OH)2. Примерами кислотных гидроксидов являются НСlO4 (хлорная кислота, высший гидроксид хлора), H3РO4 (ортофосфорная кислота, высший гидроксид фосфора), H2SO4 (серная кислота, высший гидроксид серы).
Графические формулы перечисленных гидроксидов приведены ниже. Во всех гидроксидах имеется связь О–Н:
ПОНЯТИЕ ОБ АМФОТЕРНЫХ ОКСИДАХ И ГИДРОКСИДАХ
Амфотерность (от греч. amphoteros – и тот, и другой) – способность химических соединений проявлять и кислотные, и основные свойства в зависимости от природы реагента, с которым амфотерное вещество вступает в кислотно-основное взаимодействие.
Амфотерные оксиды и гидроксиды – оксиды и гидроксиды, проявляющие как основные, так и кислотные свойства. Они реагируют как с кислотами, так и с основаниями. Амфотерным оксидам соответствуют амфотерные гидроксиды, например: ВeО – Вe(ОН)2, Сr2O3 – Сr(ОН)3.
Амфотерные гидроксиды практически нерастворимы в воде. Их основные и кислотные свойства выражены слабо, они являются слабыми кислотами и слабыми основаниями.
Амфотерными оксидами и гидроксидами являются, как правило, оксиды и гидроксиды металлов, в которых степень окисления металла +3, +4, иногда +2.
Среди оксидов элементов главных подгрупп амфотерными являются: BeO, Al2O3, SnO, SnO2, PbO, Sb2O3.
Амфотерными гидроксидами являются следующие гидроксиды элементов главных подгрупп: Ве(ОН)2, Al(ОН)3, Рb(ОН)2 и некоторые другие.
Оксиды и гидроксиды элементов побочных подгрупп, соответствующие высоким степеням окисления, как правило, являются кислотными, например: СrO3 (ему соответствует H2СrO4), Мn2O7 (ему соответствует НМnO4).
Для низших оксидов и гидроксидов характерно преобладание основных свойств, например: СrO и Сr(ОН)2, МnО и Мn(ОН)2.
Оксиды и гидроксиды, в которых степени окисления элементов +3 и +4, являются, как правило, амфотерными: Сг2O3 и Cr(OH)3, Fe2O3 и Fe(OH)3. Однако последние элементы в декадах d–элементов (например, Zn) образуют амфотерные оксиды и гидроксиды даже в низких степенях окисления, например ZnO и Zn(OH)2.
ХИМИЧЕСКИЕ СВОЙСТВА АМФОТЕРНЫХ ОКСИДОВ И ГИДРОКСИДОВ
Рассмотрим амфотерные свойства оксида и гидроксида цинка – ZnO и Zn(OH)2. Оба вещества реагируют с кислотами:
ZnO + 2HNO3 = Zn(NO3)2 + H2O
Zn(OH)2 + H2SO4 = ZnSO4 + 2H2O
Оксид и гидроксид цинка реагируют также и со щелочами:
При диссоциации этих солей в растворах образуются ионы, в которых цинк входит в состав анионов, поэтому говорят, что в этих соединениях «цинк в анионной форме».
Докажем амфотерность оксида и гидроксида алюминия Al(ОН)3. Он растворяется в кислотах с образованием солей, где алюминий находится в катионной форме:
Al(ОН)3 + 3Н + = Al 3+ + 3H2O
Но гидроксид алюминия взаимодействует и со щелочами. При сплавлении со щелочами образуются алюминаты (метаалюминаты):
Al(ОН)3 + NaOH = NaAlO2 + 2H2O
В образовавшейся соли алюминий образует анион AlO2 – (алюминий в анионной форме). В растворах в результате реакции со щёлочью образуется комплексный тетрагидроксоалюминат-ион [Al(ОН)4] – :
Al(ОН)3 + NaOH = Na[Al(OH)4] (тетрагидроксоалюминат натрия)
Некоторые амфотерные оксиды и гидроксиды не проявляют амфотерность в обычных условиях и в растворах ведут себя как основные. Амфотерность таких соединений проявляется в более жёстких условиях. Например, гидроксид железа (III) Fe(OH)3 легко реагирует с кислотами:
Fe(OH)3 + 3НCl = FeCl3 + 3H2O
Fe(OH)3 + NaOH = NaFeO2 + 2H2O
Признаком этой реакции будет растворение бурого осадка. А вот при добавлении раствора щёлочи гидроксид железа (III) не растворяется. Тогда, может быть, считать его основанием, не растворимым в воде? Дело в том, что в данном случае соль образуется при плавлении со щёлочью.
Естественно, что в ходе плавления происходит разложение гидроксида на оксид и воду, и в действительности реакция идёт между оксидом и щёлочью:
Fe2O3 + 2NaOH = 2NaFeO2 + H2O
Таким образом, гидроксид железа (III) можно отнести к амфотерным гидроксидам, хотя основные свойства у него преобладают.
Конспект урока по химии для 8 класса «Амфотерные оксиды и гидроксиды». Выберите дальнейшее действие: