Что такое гибридная хирургия
Гибридные операции
Сегодня уже невозможно представить сосудистую хирургию без так называемых «гибридных операций». Что же такое гибридная хирургия или гибридная операция? В основу термина «гибридный» положено латинское слово «hybrida» — смесь, помесь.
В случае сосудистой хирургии, гибридными называются операции, которые сочетают в себе два различных лечебных подхода:
Каждый из этих двух подходов имеет свои неоспоримые преимущества. Классическая «открытая» хирургия ассоциируется с радикальностью и высокой степенью надёжности вмешательства, в то время как эндоваскулярная — с малотравматичностью и быстротой. Сочетая эти подходы в одной операции, сосудистый хирург, с одной стороны, добивается её радикальности, а с другой — скорости и малотравматичности. Это первое преимущество гибридного подхода к операциям на артериях.
Вторым большим преимуществом гибридной хирургии является возможность выполнения нескольких лечебных воздействий в рамках одной операции. Таким образом, вместо нескольких оперативных пособий пациенту выполняется одно с сопоставимым конечным результатом.
Третьим бесспорным преимуществом гибридной операции является её контролируемость. Практически на любом этапе гибридного вмешательства возможен ангиографический контроль, что повышает надёжность и качество выполненной операции.
С внедрением в лечебный процесс гибридных операций перед сосудистыми хирургами открылись новые возможности в лечении сложных пациентов, которые ранее были обречены на страдания, связанные с их недугом.
Гибридные операции чаще всего используются в лечении заболеваний подвздошных артерий в сочетании с поражением общей или глубокой бедренных артерий. В этом случае первым этапом гибридной операции выполняется эндартерэктомия — удаление атеросклеротической бляшки из бедренных сосудов, а вторым — стентирование подвздошных артерий.
Другим самым распространённым случаем применения гибридной хирургии является вмешательства при многоуровневом поражении магистральных артерий бедра и голени. Первым этапом в таких операциях выполняется бедренно-подколенное или бедренно-берцовое шунтирование (создаётся обходной путь для кровотока путём соединения к поражённому сосуду выше и ниже закупорки дополнительного сосуда — шунта; в качестве шунта может использоваться синтетический протез или собственная вена пациента), а вторым — эндоваскулярная ангиопластика (расправление стенок закупоренных сосудов специальным баллоными катетерами) артерий голени.
Гибридная хирургия также находит своё применение в лечении аневризм аорты. Так, например, аневризмы дуги аорты почти всегда требуют гибридного подхода. То же самое касается аневризм брюшного отдела аорты, сочетающиеся с выраженным стенозом одной из двух общих подвздошных артерий, отходящих от неё. В таких случаях после основного этапа эндопротезирования аорты выполняется перекрёстное бедренно-бедренное шунтирование.
Таким образом, гибридные операции в практике сосудистого хирурга являются чрезвычайно полезным инструментом, позволяющим добиться следующих важных преимуществ:
Гибридные кардиохирургические операции
В настоящее время лечение пациентов с сердечно-сосудистыми заболеваниями становится всё более сложным в связи с общим старением населения и распространённостью сопутствующей патологии, что заставляет вести поиски альтернативных методов терапии. Стратегии гибридной реваскуляризации сочетают преимущества открытой хирургии и транскатетерных вмешательств. Методики, доступные как хирургу, так и кардиологу, могут быть с успехом применены в лечении широкого круга пациентов, страдающих сердечно-сосудистыми заболеваниями. Результаты гибридных вмешательств во всех областях кардиохирургии не уступают результатам традиционных методик и заслуживают пристального внимания. Будущее кардиохирургии и интервенционной кардиологии связано с дальнейшим развитием «гибридного мышления».
Гибридные операции представляют собой комбинацию коронарного шунтирования (открытая хирургическая операция на работающем сердце из мини-доступа) со стентированием (рентгенэндоваскулярное вмешательство).
Гибридные методики реваскуляризации миокарда были включены в рекомендации Американской Ассоциации Сердца (American Heart Association) в 2012 году. На текущий момент стратегии гибридной реваскуляризации получают всё более широкое распространение.
Чрескожное коронарное вмешательство (ЧКВ) с последующим миниинвазивным коронарным шунтированием (MIDCABG)
К преимуществам данного подхода можно отнести снижение риска ишемии миокарда в ходе MIDCABG. При этом традиционное аортокоронарное шунтирование может стать альтернативой в случае субоптимальных результатов ЧКВ. К недостаткам данной методики можно отнести недостаточность ангиографического контроля анастомоза между левой внутренней грудной артерией (ЛВГА) и передней межжелудочковой артерией (ПМЖА), риск увеличения кровопотери в ходе MIDCABG, выполняемого на фоне двойной антиагрегантной терапии, и возможность тромбоза стента.
Миниинвазивное коронарное шунтирование (MIDCABG) с последующим чрескожным коронарным вмешательством (ЧКВ)
Преимущества данного подхода: начало агрессивной антиагрегантной терапии после ЧКВ, выполняемой вторым этапом, защита миокарда функционирующим шунтом к ПМЖА при выполнении ЧКВ высокого риска. К недостаткам относятся следующие моменты: MIDCABG выполняется на фоне значимого поражения коронарных артерий, а альтернатива в виде традиционного аортокоронарного шунтирования ведет к росту осложнений после субоптимального или неудачного ЧКВ.
К положительным моментам данной стратегии относятся единовременный ангиографический контроль анастомоза ЛВГА с ПМЖА и ЧКВ пораженных коронарных артерий. К отрицательным сторонам можно отнести риск кровотечения на фоне двойной антиагрегантной терапии, а также экономические и логистические затруднения.
В большинстве случаев пациентам с нестабильной стенокардией, обусловленной поражением правой или огибающей коронарных артерий, первым этапом выполняется ЧКВ. Напротив, при критическом поражении ПМЖА первым этапом выполняется MIDCABG.
Ключевым моментом, определяющим превосходство АКШ перед ЧКВ, является формирование анастомоза между левой внутренней грудной артерией (ЛВГА) и передней межжелудочковой артерией (ПМЖА), что позволяет обеспечить до 75% потребности в кровоснабжении миокарда левого желудочка (и до 100% потребности в случае левого типа коронарного кровообращения). Отдаленная работоспособность маммарокоронарного шунта ЛВГА-ПМЖА составляет более 95% в течение 10 лет после операции, что позволяет существенно снизить риск нежелательных событий, частоту эпизодов стенокардии, а также улучшить качество жизни.Риск нежелательных сердечно-сосудистых событий у пациентов, перенесших.
— традиционное аортокоронарное шунтирование,
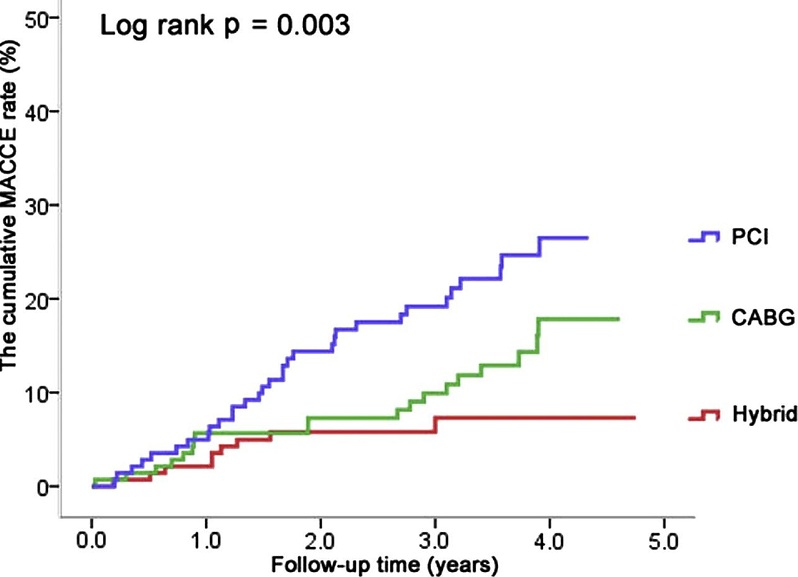
Liuzhong Shen, Shengshou Hu, Haoran Wang, Hui Xiong, Zhe Zheng, Lihuan Li, Bo Xu, Hongbing Yan, Runlin Gao. One-Stop Hybrid Coronary Revascularization Versus Coronary Artery Bypass Grafting and Percutaneous Coronary Intervention for the Treatment of Multivessel Coronary Artery Disease. 3-Year Follow-Up Results From a Single Institution. Journal of the American College of Cardiology, Volume 61, Issue 25, June 2013. DOI: 10.1016/j.jacc.2013.04.007.
Москва, Ореховый бульвар д. 28
Метро: Красногвардейская Зябликово
Отдел госпитализации: +7 (499) 725-44-56
Скорая медицинская помощь: +7 (495) 344-44-22
Гибридные эндоваскулярные вмешательства при патологии артерий нижних конечностей
Закарян Н.В., Панков А.С.
Эндоваскулярные методы лечения продолжают свое победное шествие по планете, постоянно расширяя свое влияние на коррекцию сосудистой патологии. Тем не менее, некоторые проблемы до сих пор остаются серьезным вызовом как для открытых, так и для эндоваскулярных хирургов. Например, при тяжелых многоэтажных поражениях артерий нижних конечностей не всегда удается выполнить их полноценную коррекцию только рентгенохирургическим либо открытым способом [1-7, 9,12,14,16-20]. При использовании исключительно эндоваскулярных методов часто увеличивается время облучения и объем используемого рентгеноконтрастного вещества [1,3,8,10-15]. С другой стороны, продолжительные открытые сосудистые вмешательства сопровождаются увеличением частоты осложнений и летальных исходов, особенно у пожилых пациентов и у больных с тяжелыми сопутствующими заболеваниями [1-3,6,8,12-15]. Для решения этой проблемы в современных условиях активно развивается концепция гибридной хирургии, которая заключается в одновременном использовании как эндоваскулярных, так и открытых хирургических методов лечения сложных поражений сосудов 13.
В некоторых клиниках частота выполнения гибридных операций при многоэтажных поражениях достигает 25%, и эти цифры продолжают расти. [3-6,9,11]. Обычно данные операции проводятся в специальной гибридной операционной, оснащенной прозрачным для рентгеновских лучей операционным столом и ангиографической установкой (стационарной или передвижной С-дугой).
Выделяют одномоментные и двухэтапные гибридные вмешательства, когда открытый и эндоваскулярный этапы разделяются по времени. Большинство специалистов в последнее время склоняются к тому, что термин “гибридная хирургия” более правильно использовать только в случаях одномоментных вмешательств [2].
Наиболее частыми гибридными периферическими вмешательствами в настоящее время являются эндартерэктомия из общей бедренной артерии в сочетании с ангиопластикой/стентированием нижележащих и/или вышележащих сегментов, бедренно-подколенное шунтирование в сочетании с эндоваскулярными вмешательствами на артериях голени, ангиопластика/стентирование поверхностной бедренной артерии (ПБА) с одномоментным выполнением бедренно-дистального шунтирования артерий голени, а также различные операции на брахиоцефальных артериях 2.
Вероятно, самой распространенной гибридной операцией на периферических сосудах является одномоментное стентирование подвздошных артерий в сочетании с эндартерэктомией из общей бедренной артерии (ОБА) и возможным бедренным шунтированием/стентированием. Dosluoglu с коллегами в 2006 году разработали технику PAGA (“pre-arteriotomy guidewire access”, или “эндоваскулярная установка проводника до артериотомии”) для оптимизации подобных операций [5]. В последние годы техника получила широкое распространение во всем мире. Описание методики в классическом варианте представлено ниже.
Вначале хирурги выполняют открытое выделение общей (ОБА), глубокой (ГБА) и поверхностной бедренных артерий (ПБА), а также наружной подвздошной артерии (НПА), если это необходимо. Затем пунктируют общую бедренную артерию; в случае окклюзии или сильного кальциноза ОБА проводят пункцию дистального отдела НПА. Рекомендуется выполнять микропункцию с проведением 0,018-дюймового проводника для предотвращения травмы артерии. В случае окклюзии подвздошных артерий осуществляется реканализация с использованием стандартных методик или с помощью специальных устройств (например, “Frontrunner” (“Cordis”)). После доставки проводника в брюшную аорту эндоваскулярный этап прерывается. Затем после гепаринизации выполняется артериотомия ОБА (с распространением на ПБА и ГБА, если это необходимо). Далее хирурги проводят стандартную эндартерэктомию из ОБА с наложением заплаты, при этом швы в области пункции артерии оставляют незатянутыми. На линию швов по желанию хирурга может быть нанесен биологический клей (например, “Bioglue” (“CryoLife, Inc”)), для предотвращения подтекания крови. Когда гемостаз полностью завершен, по проводнику в ОБА устанавливают интродьюсер размером 6-11 F для продолжения эндоваскулярного этапа (интродьюсеры большого размера обеспечивают хороший гемостаз в ходе операции, кроме того, через них можно проводить стент-графты, если это необходимо). Затем последние швы в области пункции затягиваются, зажимы с артерий снимают, запускают кровоток и заканчивают эндоваскулярный этап, который обычно заключается в выполнении ангиопластики и стентирования подвздошных артерий [3,5,11].
Как известно, пункция артерии и проведение проводника после выполненной эндартерэктомии может сопровождаться риском развития кровотечений и диссекций в ОБА и НПА. Одним из главных достоинств методики PAGA является устранение данных рисков, т.к. артерия пунктируется перед эндартерэктомией. Также при использовании этой техники можно относительно безопасно выполнить пункцию НПА в случае необходимости, т.к. в конце операции эта область тщательно ушивается и риск забрюшинной гематомы практически отсутствует (при традиционном эндоваскулярном подходе пункция НПА является нежелательной процедурой).
В качестве примера использования методики PAGA можно привести опыт корейских специалистов Joh et al [11]. Они использовали данную методику с некоторыми изменениями. Так, в случае, если на начальном этапе не удавалось выполнить реканализацию окклюзии подвздошных артерий ретроградным доступом, выполнялась антеградная реканализация (доступом через контралатеральную ОБА, либо через плечевую артерию), затем проводник захватывался и выводился через артериотомическое отверстие в ходе эндартерэктомии или шунтирования (т.н. “экстернализация” проводника).
Вышеуказанными корейскими авторами также применялась антеградная методика PAGA при сочетанных поражениях ОБА и ПБА: сначала выполнялась антеградная реканализация ПБА доступом через пораженную ОБА, затем эндартерэктомия из ОБА и потом финальная ангиопластика/стентирование ПБА [11].
Также часто выполняется наложение бедренно-дистального шунта с одномоментным стентированием вышележащих сегментов (бедренной и/или подвздошных артерий). Данный вид вмешательств используется достаточно давно. Так, в 2001 году Schneider с соавт. впервые описали технику выполнения одномоментной ангиопластики сужений ПБА в сочетании с наложением бедренно-берцового шунта у больных с критической ишемией нижних конечностей [12]. В госпитальном периоде ни у одного из 12 пациентов не было отмечено окклюзии шунта, ампутаций также удалось избежать. Через 2 года частота первичной проходимости артерий составила 76%. Пример гибридного стентирования левой ОПА в сочетании с наложением бедренно-берцового шунта представлен на рис. 1.
До сих пор дискутабельным остается вопрос о схеме введения антикоагулянтов и антиагрегантов во время и после гибридных вмешательств на периферических артериях. Наиболее признанной схемой у большинства специалистов является следующая: в ходе вмешательства вводится 70-100 ЕД/кг гепарина (в среднем 5000-7000 ЕД), также в дальнейшем пациент получает клопидогрель 75 мг/день в течение 3-6 месяцев и 100 мг/день ацетилсалициловой кислоты пожизненно 5. Вопреки мнению некоторых сосудистых хирургов, риск кровотечения при подобной схеме остается невысоким как во время операции, так и в ближайшем послеоперационном периоде [1-12, 14, 18].
Эффективность гибридных операций, по данным разных авторов, является достаточно высокой [1-16, 19-23]. В работе Antoniou показано, что проходимость артерий после гибридных вмешательств через 1 год составила 98%, причем исходно группа пациентов была достаточно тяжелой (47% больных с критической ишемией нижних конечностей) [1]. Matsagkas с соавт. доложили, что у пациентов с критической ишемией первичная и вторичная проходимость оперированных сегментов через 2 года составила 93,2% и 95,5% соответственно [10]. В исследовании Cotroneo были изучены результаты гибридных вмешательств у 44 пациентов (24 были с хронической и 20 – с критической ишемией). Через 2 года первичная и вторичная проходимость составила 79,1% и 86,1% соответственно [4]. Nishibe с коллегами доложили, что у пациентов с мультифокальными поражениями TASC D через 2 года после гибридных операций первичная проходимость оперированных сегментов составила 94%, а частота спасения конечности – 100% [13].
В работе Schanzer с соавт. также доложено о хороших результатах гибридной ангиопластики/стентирования сужений в поверхностной бедренной артерии (ПБА) в сочетании с шунтированием артерий голени у 23 больных с критической ишемией. Проксимальный анастомоз шунта вшивался в дистальный отдел ПБА или в подколенную артерию, дистальный – в артерию голени или стопы. В ближайшем послеоперационном периоде не было отмечено случаев ампутации или тромбозов оперированных сегментов. Через 5 лет ампутации удалось избежать 70% пациентов, эндоваскулярная коррекция рестенозов в ПБА потребовалась только 1 больному [8].
Многие авторы отмечают сокращение времени нахождения в клинике и снижение стоимости лечения у пациентов с гибридными одномоментными вмешательствами по сравнению с теми, кто перенес двухэтапные операции [1-8, 10, 12-16, 22]. Так, в работе Ebaugh с соавт. показано, что при одноэтапных операциях больничные расходы снижаются почти в 2 раза по сравнению с двухэтапными [7]. Кроме того, при гибридных вмешательствах практически отсутствуют осложнения в области пункции, так как в конце операции эта зона тщательно ушивается. Безусловно, при гибридных процедурах, по сравнению с тотальной эндоваскулярной коррекцией, снижается расход рентгеноконтрастного вещества, что очень важно у пациентов, находящихся в группе риска развития контраст-индуцированной нефропатии [2-7, 17, 19].
Список литературы:
Автор статьи:
Панков Алексей Сергеевич
врач по рентгенэндоваскулярным диагностике и лечению, к.м.н.
Что такое гибридная кардиохирургия сердца
Некоторые из требований к гибридной кардиохирургии включают следующее:
2. Операционная больше обычного размера, в которой можно разместить все необходимое оборудование
3. Оборудование для поддержки обеих процедур, которое хорошо организовано, чтобы не вызывать конфликта в процедурах. Аппарат КТ можно купить тут http://medico-intech.kz/articles/oborudovanie-apparat-kt.
Какие из гибридных операций на сердце проводятся в настоящее время?
Гибридное АКШ / ЧКВ: АКШ (шунтирование коронарной артерии), также называемое операцией по шунтированию на открытом сердце, является распространенной хирургической процедурой, используемой для лечения блоков в артериях, кровоснабжающих сердце, которые вызывают сердечный приступ. Заблокированная левая передняя нисходящая артерия сердца обходится другой артерией, левой внутренней грудной артерией, взятой из груди. Эта процедура проводится посредством открытой хирургии. Однако может быть несколько других артерий, которые также могут быть заблокированы и потребовать лечения. Многососудистое заболевание лечится с помощью дополнительного ЧКВ, что делает эту процедуру гибридной операцией на сердце. При ЧКВ или чрескожном коронарном вмешательстве используется катетер для введения стентов в другие заблокированные артерии, чтобы они оставались открытыми. Новые стенты выпускают лекарство (так называемые стенты с лекарственным покрытием) и дают лучшие результаты. Коронарное шунтирование может быть выполнено до или после ЧКВ. Совместное использование двух процедур позволяет уменьшить разрез во время открытой операции и ускорить восстановление после процедуры.
Что такое гибридная хирургия
РНЦХ им. акад. Б.В. Петровского РАМН
ГАУЗ Московской области «Центральная городская клиническая больница Реутова»; кафедра сердечно-сосудистой хирургии Российского университета дружбы народов, Москва, Россия
клиника аортальной и сердечно-сосудистой хирургии Первого Московского государственного медицинского университета им. И.М. Сеченова, Москва, Россия
«Гибридная» хирургия грудной аорты
Журнал: Кардиология и сердечно-сосудистая хирургия. 2014;7(6): 64-70
Белов Ю. В., Голощапов-аксенов Р. С., Комаров Р. Н. «Гибридная» хирургия грудной аорты. Кардиология и сердечно-сосудистая хирургия. 2014;7(6):64-70.
Belov Iu V, Goloshchapov-aksenov R S, Komarov R N. «Hybrid» surgery of the thoracic aorta. Kardiologiya i Serdechno-Sosudistaya Khirurgiya. 2014;7(6):64-70.
РНЦХ им. акад. Б.В. Петровского РАМН
РНЦХ им. акад. Б.В. Петровского РАМН
ГАУЗ Московской области «Центральная городская клиническая больница Реутова»; кафедра сердечно-сосудистой хирургии Российского университета дружбы народов, Москва, Россия
клиника аортальной и сердечно-сосудистой хирургии Первого Московского государственного медицинского университета им. И.М. Сеченова, Москва, Россия
Лечение больных с аневризмами и расслоениями грудной аорты в настоящее время остается актуальной проблемой. Аневризмы грудной аорты являются одной из 15 ведущих причин смертности во всем мире. Заболеваемость острым расслоением аорты составляет 3,5 на 100 тыс. населения планеты, а частота разрывов аневризм грудного отдела аорты достигает 6 случаев на 100 тыс. населения. В группе неоперированных больных с аневризмами дуги аорты 5-летняя выживаемость составляет 10-15%. За последние 30 лет отмечен рост общей распространенности диагностированной аневризмы дуги аорты. Это связано с увеличением средней продолжительности жизни населения в развитых странах, естественным прогрессированием атеросклероза аорты и улучшением диагностики сердечно-сосудистых заболеваний. По данным различных авторов [2, 3, 24], аневризму аорты выявляют у 3-4% людей старше 65 лет.
Стремительное развитие рентгенэндоваскулярной хирургии за последнее два десятилетия и применение «гибридных» технологий для лечения аневризм и расслоений грудной аорты позволили уменьшить операционную травму, снизить количество осложнений и соответственно летальность, сократить реабилитационный период и повысить качество жизни больных [2, 3, 7, 8, 27, 39, 52, 57, 55, 67]. В России летальность после стентирования дуги и грудной аорты в 2012 г. составила 2% [3]. В настоящее время во многих развитых странах тактика лечения больных с диагностированной аневризмой или расслоением грудного отдела аорты преимущественно «гибридная», т.е. предусматривает сочетание методик традиционной и эндоваскулярной хирургии.
В данном обзоре мы представляем данные современной литературы по «гибридной» хирургии больных с аневризмами и расслоениями грудной аорты.
«Гибридные» технологии лечения аневризм и расслоений дуги аорты, т.е. сочетание хирургических и рентгенэндоваскулярных методик, выполняемых этапно или одномоментно, значительно снижают риски интра- и послеоперационных осложнений [4, 17, 19, 28, 30, 36]. Для понимания принципов применения того или иного способа «гибридных» вмешательств существует анатомическая классификация зон дуги аорты, предложенная
Р. Митчелом и С. Ишумари в 2002 г. [54]:
— зона 0 включает восходящую аорту проксимальнее плечеголовного ствола;
В зависимости от распространенности аневризматической трансформации дуги аорты и расположения проксимальной и дистальной шейки аневризмы, «гибридные» хирургические вмешательства подразделяются на три типа.
Тип II. Этот гибридный подход предназначен для пациентов с аневризмой восходящей аорты с ограниченным расширением в дистальном сегменте дуги аорты. Хирургической реконструкции (экзопротезированию) подвергается восходящая аорта, и выполняется «дебранчинг» ветвей дуги аорты для подготовки проксимальной шейки к имплантации стент-графта.
Тип III. Технология «замороженный хобот слона». Применяется для стентирования торакоабдоминального отдела аорты у пациентов с протяженным аневризматическим поражением аорты, включающем восходящую аорту, дугу и нисходящий сегмент грудной аорты. Операцию выполняют через срединную стернотомию. Аортальный стент-графт, состоящий из двух сегментов (сосудистого протеза и покрытого стента), имплантируют в нисходящую аорту антеградно через дугу аорты, а проксимальный его сегмент пришивают к перешейку и восходящей аорте с реплантацией брахицефальных артерий [72, 73].
Основные характеристики ранее проведенных исследований по этой проблеме представлены в табл. 1 и 2. 
Особенности анатомии артериального русла и планирование «гибридной» операции на грудной аорте
Показания для стентирования дуги аорты
Основным показанием для эндопротезирования аорты является наличие аневризмы более 5 см в диаметре. В случаях аневризм грудной аорты диаметром менее 5 см, если при динамическом наблюдении за пациентом аневризма увеличивается в размере более чем на 1 см в год или на 5 мм в течение 6 мес, необходимо планировать хирургическое лечение.
Другие заболевания аорты, которые могут быть рассмотрены для эндоваскулярной коррекции, включают расслоение аорты типа B, расслоения аорты, осложненные развитием мальперфузии органов и тканей, пенетрирующие язвы стенки аорты и интрамуральные гематомы, а также аневризмы торакоабдоминального отдела с распространением на висцеральные артерии [21].
Безопасность применения эндографтов для лечения неосложненных расслоений грудной аорты типа В было изучено в проспективном многоцентровом рандомизированном исследовании INSTEAD, проведенном в Европе в 2005 г. [58]. Расслоения грудной аорты типа В с ретроградным распространением, осложненные мальперфузией органов и тканей, эффективно корригируются имплантацией стент-графта в истинный просвет аорты с закрытием первичной фенестрации, созданием дистальной фенестрации, а также использованием непокрытого тканью стального стента Djumbodis dissection system, имеющего большие ячейки [22, 38, 59]. Резидуальное расслоение аорты типа А, встречающееся с частотой 50-100% после замены восходящей аорты по поводу расслоения типа А, также устраняется имплантацией Djumbodis dissection system, который эффективно воссоединяет слои аорты без окклюзии основных жизненно важных ее ветвей [14, 37].
Эндопротезирование при пенетрирующих стенку аорты язвах и внутристеночных гематомах должно обеспечивать полное перекрытие фенестрации. Однако в настоящее время нет однозначного заключения, является ли наличие гематомы противопоказанием к эндоваскулярной операции.
Лечение торакоабдоминальных аневризм аорты предусматривает сохранение устьев висцеральных ветвей аорты. В настоящее время существуют отдельные работы о применении фенестрированных и мультибраншевых эндографтов, однако данных для широкого их применения еще нет. Гибридные подходы, заключающиеся в «дебранчинге» висцеральных ветвей аорты, могут быть оптимальным вариантом вмешательства, особенного у «тяжелых» больных, при котором возможно избежать торакотомии и искусственного кровообращения [10, 11, 31].
Техника выполнения имплантации аортальных эндографтов
Стентирование дуги аорты проводят под общим эндотрахеальным наркозом. В случае прогнозирования перекрытия эндографтом артерии Адамкевича устанавливают поясничный дренаж спинномозговой жидкости, чтобы уменьшить давление в субдуральном пространстве, повысить перфузионное давление спинного мозга и, как итог, предотвратить параплегию после операции. Хирургический доступ обычно чрезбедренный [26]. Позиционирование стент-графта в дуге аорты выполняется при положении С-дуги ангиографа в левой косой позиции от 45 до 75°. Во время имплантации стента врач может чувствовать давление тока крови, поэтому фиксация системы доставки должна быть прочной, а имплантация стента должна проводиться под постоянным рентгеновским контролем. Для уменьшения давления тока крови до 90 мм рт.ст. применяется управляемая медикаментозная гипотензия или правожелудочковая стимуляция. После того, как стент имплантирован, в ряде случаев с помощью баллона проводится постдилатация. Постдилатацию необходимо проводить с особой осторожностью в зонах проксимальной и дистальной шеек, чтобы не вызвать расслоение аорты [58].
После стентирования выполняют ангиографию и оценивают результаты операции по адекватности расправления стента и наличию подтекания между стенками стента и аорты или послеоперационного контрастирования аневризматического мешка.
Осложнения стентирования грудного отдела аорты
Неврологические нарушения (нарушение мозгового кровообращения и параплегии) являются наиболее частыми осложнениями после стентирования грудного отдела аорты, которые развиваются у 7,3-15,8% больных [12, 40]. Поэтому правильное планирование выполнения гибридной операции, при необходимости выполнение шунтирования ветвей дуги аорты, является залогом успешной имплантации стента. Факторами риска развития эмболических осложнений являются «критически» проксимальная имплантация стента, наличие мобильной нестабильной атероматозной бляшки в дуге аорты. В случае планирования перекрытия эндографтом устья левой подключичной артерии у пациентов с гипоплазией правой позвоночной артерии или неполным велизиевым кругом должно предшествовать сонно-подключичное шунтирование слева [25, 32, 60, 76].
Ишемия органов брюшной полости может возникнуть при перекрытии стентом устья чревного ствола. Однако некоторые исследования показывают, что незатронутое устье верхней брыжеечной артерии нивелирует риски висцеральной ишемии [70].
Осложнения со стороны хирургического доступа связаны с использованием доставляющего устройства больших размеров, малым диаметром общей бедренной артерии, необходимостью в ряде случаев использовать подвздошный доступ, извилистым ходом и кальцинозом наружной подвздошной артерии, что может привести к повреждению подвздошной артерии. Снизить риски осложнений такого рода, которые встречаются, по данным литературы [78], в 9,4-23,8% случаев, помогает предварительная баллонная ангиопластика общей бедренной и наружной подвздошной артерий с возможным последующим их стентированием после удаления системы доставки эндографта. Гематома или ложная аневризма зоны доступа развивается в 0,01% случаев.
Постимплантационный синдром развивается в раннем послеоперационном периоде и характеризуется лейкоцитозом, лихорадкой и повышением в крови уровня факторов воспаления, таких как С-реактивный белок, интерлейкин-6 и фактор некроза опухоли-α. Считается, что это связано активацией эндопротезом процесса воспаления эндотелия аорты [23, 29, 35].
После имплантации стента в грудной отдел аорты в 37-73% случаев может развиться односторонний или двусторонний реактивный плеврит [63].
Миграция трансплантата более чем на 10 мм каудально может происходить с частотой 1-2,8% [61]. Факторы, предрасполагающие к миграции стента, включают чрезмерную извитость аорты в зоне прилегания стента к стенке проксимальной и дистальной шеек аневризмы.
Подтекания после стентирования грудной аорты возникают в 3,9-15,3% случаев [41, 49, 62, 64]. Различают пять типов подтеканий:
— подтекание 1-го типа происходит через проксимальную или дистальную зоны стента;
Способы коррекции подтеканий
Наибольшую опасность для прогрессирования увеличения в размерах аневризмы и ее разрыва представляют подтекания 1-го и 3-го типа, так как они напрямую связаны с влиянием системного кровотока на стенку аневризмы и требуют немедленного лечения. Первым этапом предпринимают попытку баллонной дилатации проксимального или дистального сегмента стента. При неэффективности выполняют имплантацию непокрытого аортального стента с целью прижать неудовлетворительно прилегающий к стенке аорты сегмент графта [41]. Другим способом устранения подтекания 1-го типа является эмболизация полости аневризмы N-бутил-2-цианоакрилатом. Для этого через зону подтекания между стентом и стенкой аорты в полость аневризмы по микропроводнику заводят микрокатетер диаметром 2,7-3 F, после чего выполняют заполнение ее клеем [50]. Необходимость устранения подтекания 2-го типа продолжает оставаться предметом дискуссий. Многие авторы считают, что подтекания 2-го типа могут самопроизвольно тромбироваться. Недавние исследования показали, что если при существующем подтекании 2-го типа в динамике нет увеличения в размерах полости аневризмы, коррекции не требуется [66, 71]. В случае увеличения размеров аневризмы требуется немедленное устранение подтекания [65]. Устранение подтекания 2-го типа заключается в прекращении кровотока по питающим полость аневризмы артериям. Эмболизация металлическими спиралями питающих артерий, как правило, в 100% случаев дает положительный результат. Для доставки спиралей используют микрокатетер, с помощью которого суперселективно катетеризируют афферентную артерию. Однако в одном из исследований было описано, что в 80% случаев после успешной эмболизации питающего полость аневризмы сосуда происходил рецидив подтекания через другие артерии [6]. Поэтому более эффективным способом устранения подтекания 2-го типа является эмболизация полости аневризмы и главной питающей ее артерии металлическими спиралями [61]. В случае, если подтекание 2-го типа невозможно устранить малоинвазивным способом, прибегают к хирургической перевязке питающего сосуда [46, 51, 53, 77].
Подтекания 4-го типа, как правило, связаны с гипокоагуляцией и их диагностируют интраоперационно после имплантации стента. Устраняются самостоятельно после нормализации показателей свертывающей системы крови [75]. Подтекание 5-го типа рассматривают как увеличение аневризматического мешка без видимого подтекания [42, 80]. А. Mennander соавт. [53] описывают результаты консервативного лечения 5 пациентов, у которых выявлено подтекание 5-го типа. У 3 пациентов из этой группы диагностирован разрыв аневризмы брюшной аорты без развития забрюшинного кровотечения.
Заключение
Технический успех стентирования грудной аорты, по данным разных авторов [8, 52], достигается в 98% случаев. Летальность колеблется в пределах от 1,9 до 2,1%, в то время как летальность после открытых операций на грудной аорте составляет от 5,7 до 11,7% [8, 18, 20, 52, 68].
Данных по отдаленным результатам «гибридной» хирургии аневризм дуги аорты в литературе недостаточно. Остается нераскрытым важный вопрос: как будет вести себя имплантированный стент с увеличением возраста пациента в результате естественного прогрессирования атеросклероза. Клинические наблюдения свидетельствуют, что в 3,6-4,4% случаев необходимы повторные операции по имплантации дополнительного стента; при этом повторное рентгенэндоваскулярное вмешательство более предпочтительно, нежели открытая операция [5, 7, 20, 47, 79].
Результаты метаанализа применения «гибридных» операций у больных с аневризмами и расслоениями грудного отдела аорты за последние 15 лет свидетельствуют, что «гибридные» методики являются перспективной альтернативой традиционным операциям в ближайшем и среднесрочном периоде наблюдения [46].