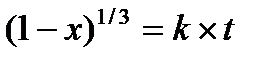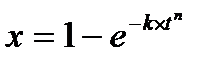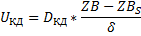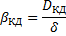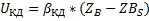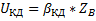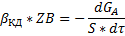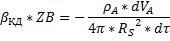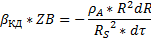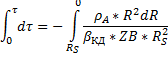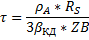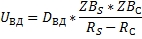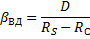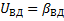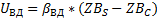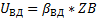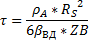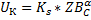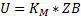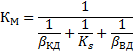Что такое гетерогенный химический процесс
В химии существуют такие термины как гетерогенная реакция и гомогенная реакция. Для понимания этих явлений, нужно обратиться к значению слов.
«Гетерогенность» трактуется как разнородность по структуре. Гомогенные вещества наоборот составляют единое целое, то есть однородность.
Примером гетерогенной смеси является вода и жир, а раствор поваренной соли относится к гомогенному соединению.
Что такое гетерогенные реакции
Гетерогенными реакциями ученые называют взаимодействия разнородных составляющих, то есть находящихся в различных фазах.
где известняк (карбонат кальция) разлагается на оксид кальция и углекислый газ.
Другие примеры: восстановление оксидов металлов при помощи углерода или водорода:
Растворение в кислоте металла записана формулой:
Для гетерогенных реакций характерным моментом является участие конденсированных фаз (то есть образований, которые, в зависимости от входящих в состав атомов или молекул, можно смоделировать разными способами).
Это создает трудности перемешивания и кинетики полученных продуктов. При этом возможно получение такого состояния, когда молекулы реагентов активируются на границе раздела фаз.
Одним из примеров гетерогенных процессов – разложение паров этилового спирта. Это первая реакция из органической химии, которая была изучена.
Как отличить гомогенную от гетерогенной реакции
Для гетерогенной реакции характерно следующее явление: реагенты, участвующие в процессе, состоят в разных фазах.
Это значит что в объеме, где находятся две или несколько фаз, взаимодействие протекает на границе раздела.
В гомогенном процессе вещества находятся в одной из фаз (жидкой, твердой либо газообразной), и зоной протекания служит весь объем.
Гетерогенные реакции, в зависимости от агрегатного состояния исходных веществ, бывают следующих типов:
Скорость гетерогенной реакции и влияющие на нее факторы
На скорость гетерогенных химических процессов влияют разные факторы.
Рассмотрим их подробнее.
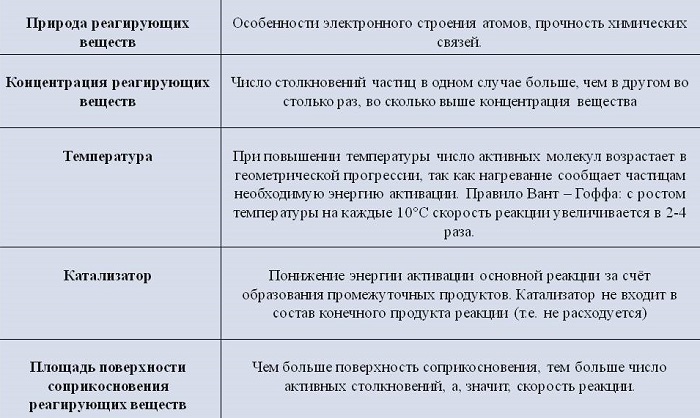
Концентрация реагентов
С повышением концентрации веществ они сильнее взаимодействуют. Концентрированная кислота реагирует с цинком намного быстрее, чем разбавленная.
Природа реагирующих веществ
Скорость протекания химических процессов зависит от природы реагентов. По-другому можно сказать, что разные вещества взаимодействуют между собой с разной скоростью.
К примеру, цинк мгновенно вступает в реакцию с соляной кислотой, а железо будет реагировать с ней гораздо медленнее.
Увеличение поверхности реагентов повышает скорость гетерогенных реакций. Для этого твердые элементы измельчают. Пример: чтобы железо и сера вступили во взаимодействие, железо превращают в опилки.
Температура исходных веществ
Температура существенно повышает скорость реакции. Некоторые вещества при повышении температуры всего на 10 градусов начинают вступать в реакцию быстрее от 2 до 4 раз.
Наличие катализатора
Для повышения скорости протекания процессов применяют катализаторы. При этом они сами не расходуются.
Например, при добавлении оксида марганца происходит бурный распад перекиси водорода 2H2O2 = 2H2O + O2↑
Остающийся на дне оксид марганца можно использовать еще раз.
Ингибиторами называются вещества, которые, в отличие от катализаторов, замедляют скорость взаимодействия.
Катализаторами биологических процессов являются белки. Их еще называют энзимами.
Примеры решения задач
Задача 1
Твердый малорастворимый электролит, растворяясь, устанавливает равновесие:
По закону действующих масс, для этого состояния составляется уравнение, чтобы найти произведение растворимости (ПР):
Задача 2
Определить процессы, происходящие в растворе с ионами Cl, Br, J при добавлении катиона Ag.
Гетерогенные процессы.
К гетерогенным процессам относятся процессы в системах:
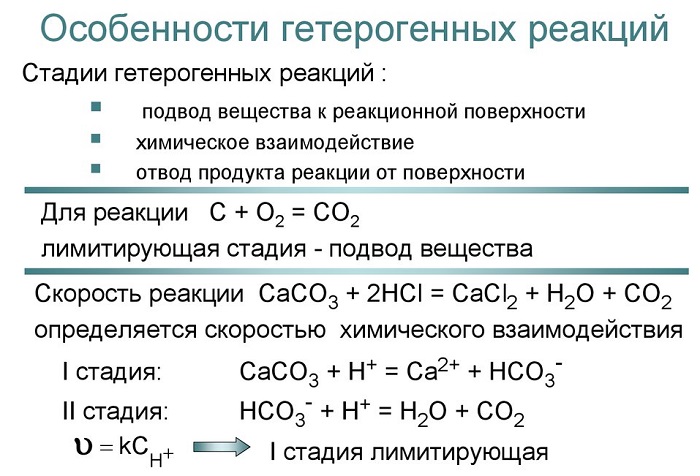
Отличительной особенностью любого гетерогенного процесса является наличие поверхности раздела фаз, которая может быть постоянной или меняться во времени.
При протекании гетерогенного процесса наряду с чисто химическими стадиями существуют и диффузионные стадии, поэтому для управления гетерогенными процессами важна идентификация лимитирующей стадии.
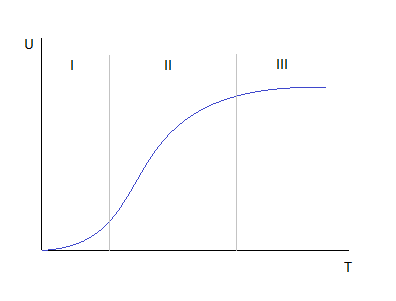
Для идентификации лимитирующей стадии исследуются зависимость скорости реакции от температуры. На этой зависимости можно выделить три области:
1. Скорость процесса возрастает с ростом температуры и выполняется закон
Аррениуса. Кинетическая область протекания процесса, управляющими являются микрокинетические параметры — T,P,C.
3. Скорость процесса практически не зависит от температуры – диффузионная
область. Энергия активации диффузии падает и соответственно изменение температуры не приводит к изменению коэффициента диффузии и величина скорости изменяется незначительно. Управляющие здесь параметры – макрокинетические, связанные со скоростью подачи реагентов, степенью перемешивания и диспергирования реагентов. В этой области в соответствии со скоростью диффузии по первому закону Фика, управляющим параметром является концентрация реагентов, но отличительным признаком диффузионной области является первый порядок реакции по компоненту независимо от порядка реакции или молекулярности реакции.
2. Переходная область.
Скорость растет с увеличением температуры, но закон Аррениуса не соблюдается. Здесь управляющие и макрокинетические, и микрокинетические факторы, но интенсивность их воздействия на процесс меньше, чем соответствующие области протекания. С точки зрения протекания реакции переходная область менее перспективна, но следует учитывать, что по ходу гетерогенного процесса она может переходить из одной области в другую, поэтому для предотвращения перехода изменение одного из микрокинетических параметров обычно сопровождают изменением какого либо макрокинетического параметра.
Гетерогенный процесс — многостадийный процесс. Наиболее простым является процесс в системе жидкость-газ, который обычно протекает в три стадии:
I. Область внешней диффузии – подвод газа и жидкости к поверхности раздела фаз, которая формируется искусственно в подавляющем большинстве случаев(осадочная колонна);
II. Химическое взаимодействия (кинетическая область);
III. Отвод продуктов от поверхности раздела фаз (внешне диффузионная область протекания).
В подавляющем большинстве случаев процессы в системе жидкость-газ протекают во внешней диффузионной области, поэтому при проектировании оборудования необходимо решать проблему одновременного увеличения линейной скорости подачи реагентов и увеличение площади поверхности насадки. Для того, чтобы создать необходимую площадь поверхности контакта фаз необходимо уменьшить линейные размеры насадки следовательно, увеличивается сопротивление при увеличении линейной скорости, поэтому необходимо находить оптимум.
Пенные абсорберы тоже не получили распространения, так как обладают низкой гидродинамической устойчивостью. Насадочные колонны очень капиталозатратные, а у пенных абсорберов интенсивность в 10 раз больше, чем у насадочных колонн.
Температура при проведении абсорбции не управляющий параметр, так как с ростом температуры растворимость газа в жидкости падает. Поэтому увеличивать температуру начинают только в том случае, если общая скорость абсорбции лимитируется химической реакцией.
Процессы в системе газ-твердое вещество очень сложно рассматривать. Процесс представляют как совокупность 11 стадий:
1. Диффузия газообразного реагента к поверхности твердой частицы (внешняя
2. Диффузия газообразного реагента через слой продукта к поверхности
раздела фаз (внутренняя диффузия);
3. Адсорбция газообразного реагента на поверхности раздела фаз;
4. Растворение газообразного реагента в твердом исходном веществе;
5. Диффузия от поверхности раздела фаз к потенциальному центру
образования ядра новой фазы;
6. Химическая реакция;
7. Диффузия от потенциального центра образования ядра новой фазы к
поверхности раздела фаз;
8. Растворение газообразного реагента в твердом исходном веществе;
9. Десорбция газообразного реагента с поверхности раздела фаз;
10. Диффузия газообразного реагента через слой продукта от поверхности
раздела фаз (внутренняя диффузия);
11. Диффузия газообразного реагента с поверхности твердой частицы (внешняя
Все 11 стадий проходят только в том случае, если
Атв + Вгаз = Ств + Дгаз,
Если же Атв = Ств + Дгаз — 6 стадий, начиная с шестой по первую;
Если же Атв + Вгаз = Ств —6 стадий, начиная с первой по шестую.
Для описания кинетики твердофазного взаимодействия используют три основные модели образования ядер новой фазы:
A. Образование ядер новой фазы происходит с одинаковой вероятностью на всей
внешней поверхности твердой частицы при реализации физических условий процесса. Такая модель может быть применена при рассмотрении процессов разложения твердого материала, если температура процесса выше, чем температура начала разложения. В этом случае при реализации физических условий процесса вся поверхность твердой частицы покрывается слоем продукта и дальнейшее продвижение к поверхности раздела фаз обусловливается только диффузионным сопротивлением, обусловленным как пористостью продукта, так и размером твердых частиц.
B. Образование ядер новой фазы на активных центрах с одинаковой
вероятностью. В качестве активных центров рассматриваются дефекты кристаллической решетки твердого материала и включения микропримесей, которые обязательно присутствуют в любом материале. Согласно модели считается, что активные центры равномерно распределены по всей поверхности твердой частицы, и при реализации физических условий процесса на поверхности твердой частицы образуется фиксированное количество ядер новой фазы. В дальнейшем наблюдается рост ядер, что на начальном участке в начальный период времени приводит к увеличению поверхности раздела фаз, а в дальнейшем к её уменьшению. Математически эта модель описывается уравнением сжимающейся сферы, где
х-степень превращения твердого материала;
к-константа скорости в соответствии с уравнением Аррениуса;
t-время обработки твердого материала.
Модель сжимающейся сферы хорошо описывает процессы разложения твердого материала и некоторые процессы, связанные с выделением газообразного реагента.
C. Модель экспоненциального роста числа ядер новой фазы. Наиболее адекватная
модель, подходящая под любой процесс. Модель предполагает, что активные центры на поверхности твердой частицы энергетически неоднородны. При реализации физических условий процесса ядра новой фазы образуются на активных центрах, обладающих наибольшей избыточной энергией. Появление поверхности раздела фаз приводит к активации центров, обладающих меньшей избыточной энергией, чем в первоначальный момент времени.
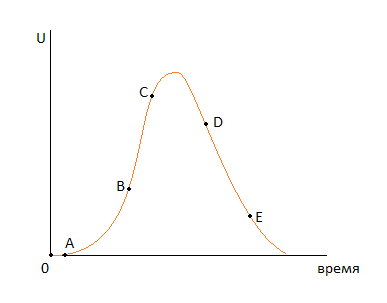
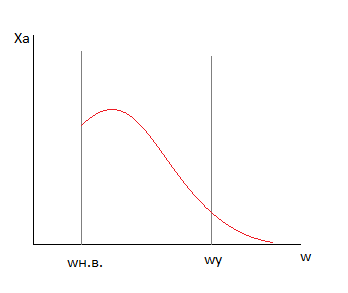
Зависимость скорости процесса от времени обработки твердого материала.
ОА – индукционный период. Он предназначен для накопления энергии в твердом веществе. Считается, что в течение индукционного периода протекают первичные превращения, приводящие к возникновению первых ядер новой фазы. Очевидно, что продолжительность индукционного периода зависит от температуры.
АС – период ускорения. Тут протекает два параллельных процесса: образование ядер новой фазы и рост уже образовавшихся на начальном участке АВ. Рост скорости связан с увеличением количества ядер новой фазы, а на ВС рост скорости связан с увеличением ядер.
CD – период максимальной скорости.
DE – период спада. В точке D растущие ядра начинают соприкасаться между собой (попытки расти вглубь или вверх). В точке Е процесс переходит в диффузионную область, то есть здесь вся поверхность твердой частицы покрыта ядрами новой фазы.
Уравнение Ерофеева, где n-постоянная Ерофеева. Её физический смысл связан с количеством ядер новой фазы, которая активирует одно образовавшееся ядро. Определяется экспериментально.
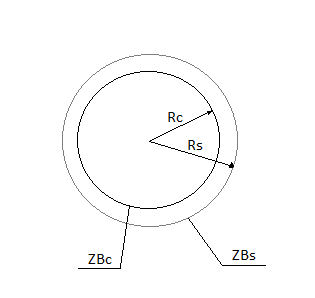
Внешняя диффузионная область протекания процесса в системе газ/твердое тело.
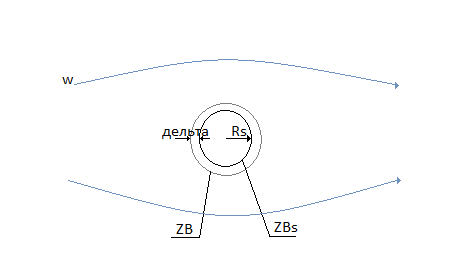
Так как частица имеет шероховатую поверхность вокруг частицы существует практичеки неподвижный пограничный слой газа, оказывающий основное сопротивление процессу диффузии газообразного реагента к поверхности твёрдой частицы.
Толщина пограничного слоя-δ.
Концентрация газообразного компонента на внешней поверхности пограничного слоя такая же, как и концентрация компонента в ядре потока.
Концентрация компонента на поверхности твёрдой частицы-ZBS.
Скорость процесса в области внешней диффузии-UКД.
Это область конвективной диффузии.
По первому закону Фика получаем:
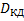
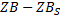

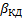
Исходя их этих соотношений можем сказать, что скорость гетерогенного процесса в области конвективной диффузии определяется природой газообразных компонентов, концентрацией газообразных компонентов и линейной скоростью подачи реагентов.
Линейная скорость подачи реагентов определяет толщину пограничной плёнки. Среди всех факторов наиболее значимым сильно влияющим на протекание процесса является линейная скорость подачи реагентов. Основной управляющий фактор в области конвективной диффузии- линейная скорость подачи реагентов.
Величина 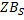
Поэтому принимают следующее допущение: как только молекула газа достигла поверхности, то она сразу же вступает во взаимодействие. Скорость химического превращения выше, чем скорость конвективной диффузии.
Это допущение позволяет рассчитать время полного превращения при протекании процесса в области конвективной диффузии.
Используем правило, что какое количество газа подошло к поверхности частицы, такое количество твердого вещества вступило в реакцию.
Скорость может быть выражена как изменение массы твёрдого вещества, отнесенная к площади поверхности контакта фаз и промежутку времени, в течение которого происходило это взаимодействие.
Это уравнение связывает время обработки материала τ, исходный радиус частицы R и радиус непрореагировавшей части (радиус непрореагировавшего ядра).
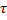
На интенсивность протекания процесса во внешней диффузной области помимо ранее перечисленных факторов оказывает влияние и размер обрабатываемых частиц.
Фактически получается, что твёрдое вещество не реагирует, так как его выносит потоком из рабочей камеры.
Скорость процесса во внутридиффузной области будет определяться концентрацией компонентов на поверхности твёрдой частицы и размером твёрдой частицы. Коэффициент диффузии во многом определяется пористой структурой слоя продукта, поскольку при прохождении через слой продукта молекулы газообразных реагентов сталкиваются не только между собой, но и со стенкой пор.
Определяющим фактором управления при протекании процесса во внутридиффузной области является размер обрабатываемых частиц.
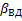
При проведении процесса в кипящем слое, внешний слой продукта механически удаляется с поверхности, поэтому не наблюдается при проведении этого процесса внутренняя диффузия.
Всё время происходит обновление поверхности твердого тела. Образуются мелкодисперсные частицы.
Это уравнение не используется для реального расчёта.
Считают, что скорость внешней диффузии велика. Как только молекула газообразного вещества подошла к поверхности, она тут же вступила в химическую реакцию. Концентрация этого вещества на поверхности равна нулю.
Это уравнение используется для описания реального процесса.
Используя методику для конвективной диффузии, определяют время полной обработки твёрдого материала.
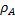
Время зависит от квадрата 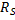
Кинетическая область протекания гетерогенного процесса
Под этой областью понимают этапы протекания процесса от абсорбции до химического взаимодействия. Поэтому –скорость в кинетической области.
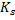
ZBC-концентрация газообразного компонента на поверхности раздела фаз.
α-порядок реакции по этому компоненту.
Порядок реакции учитывает торможения, которые могут возникнуть на стадии адсорбции, растворении в твёрдом веществе и диффузии к активному центру образования ядра новой фазы.
Если α=1, то можно вывести общее уравнение для скорости гетерогенного процесса используя то правило, что независимо от лимитирующей стадии, скорость всех стадий численно равна скорости самой медленной стадии.
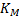
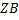
При этом очевидно, что основное сопротивление массопередачи сосредоточено в области конвективной диффузии и коэффициент массопередачи будет равен коэффициентам 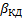
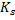
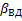
Общие особенности гетерогенных процессов
Для гомогенных реакций, в том числе для реакций в жидкой фазе, диффузия при переносе вещества из одной точки реакционного пространства в другую, в частности в реакторах больших размеров, оказывает влияние на кинетические показатели процесса. Однако обычно диффузионные процессы протекают с достаточно большой скоростью, особенно при интенсивном перемешивании, и существенно не влияют на скорость химического взаимодействия (макрокинетические закономерности мало отличаются от микрокинетических).
Для гетерогенных процессов учет скорости переноса вещества, особенно от фазы к фазе, значительно более важен вследствие сложности этой стадии. Поэтому зачастую скорость гетерогенного процесса определяется не скоростью химической реакции, а скоростью процессов переноса. Следует также отметить, что для большинства химических реакций, используемых в химико-технологических процессах, характерно протекание с участием веществ, находящихся в разных фазах. Поэтому необходимо детальное рассмотрение процессов, протекающих в многофазных системах. В зависимости от того, в каких фазах находятся участники реакции, выделяют различные двух- и трехфазные системы. Несмотря специфические различия, все они объединены одним общим признаком: прежде чем произойдет химическая реакция, должен осуществиться перенос реагентов из ядра потока одной фазы к поверхности раздела фаз или в объем другой фазы.
Гетерогенные процессы протекают, как правило, на поверхности раздела фаз или на поверхности твердого катализатора в газофазных процессах.
При протекании гетерогенных процессов собственно химическая стадия может представлять собой как гетерогенную, так и гомогенную химическую реакцию. Например, гетерогенным будет взаимодействие кислорода с сульфидами металлов при обжиге различных сульфидных руд. Однако реакция окисления молекулярным кислородом жидких углеводородов протекает как гомогенная, хотя реагенты и находятся в разных фазах, так как в химическую реакцию вступает не газообразный, а растворенный кислород. Гетерогенной в этом случае будет не химическая реакция, а предшествующая ей диффузионная стадия растворения кислорода.
Таким образом, гетерогенные процессы многостадийны. В общем случае скорости отдельных стадий, составляющих гетерогенный процесс, могут существенно различаться и в разной степени зависеть от изменения параметров технологического режима. Например, такой фактор, как температура, с разной интенсивностью влияет на скорость химической реакции и скорость переноса веществ путем диффузии. При рассмотрении скорости гетерогенного процесса с использованием уравнения 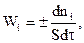
При рассмотрении гетерогенных процессов выделяют две крайние, принципиально различающиеся ситуации:
— Скорость химической реакции при данном режиме осуществления процесса мала по сравнению со скоростью диффузии на стадиях, предшествующих реакции. Интенсификация гетерогенного процесса в целом может быть достигнута при таком изменении технологического режима, которое приведет к интенсификации химической стадии. Такие гетерогенные процессы принято называть процессами, протекающими в кинетической области.
— Скорость химической реакции велика и превышает скорость диффузии. Тогда для увеличения производительности и интенсификации процесса нужно стремиться к устранению тормозящего влияния диффузии. Этот случай соответствует диффузионной области протекания гетерогенного процесса.