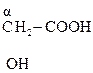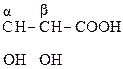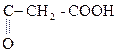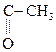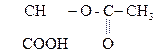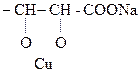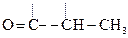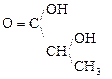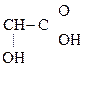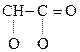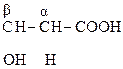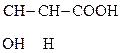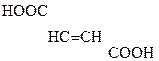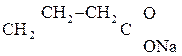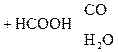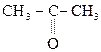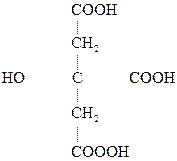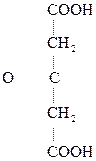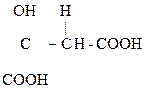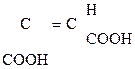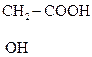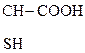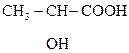Что такое гетерофункциональные соединения
лекция гетерофункциональн соед. Гетерофункциональные соединения Гетерофункциональными соединениями называют органические соединения с функциональными группами различных классов
Гетерофункциональными соединениями называют органические соединения с функциональными группами различных классов (аминоспирты, альдегидоспирты, аминокислоты, фенолокислоты, оксокислоты).
К ним относится большинство биологически важных органических соединений, участвующих в жизнедеятельности организма (аминокислоты, гидроксикислоты, оксокислоты, гидроксиальдегиды и гидроксикетоны) и соединений, являющихся лекарственными средствами.
П
Гормон мозгового слоя надпочечников
Необходимо уметь называть все гетерофункциональные соединения по международной систематической номенклатуре (IUPAC).
Во внутренней среде организма гидрокси- и оксокислоты находятся в ионной форме, поэтому для их названия используют тривиальные названия их солей.
| формула | Тривиальное название кислоты | Название соли |
| Гидроксикислоты | ||
 | молочная | лактаты |
 | яблочная | малаты |
 | винная | тартраты |
 | лимонная | цитраты |
| Оксокислоты (кетокислоты) | ||
 | пировиноградная (ПВК) | пируваты |
 | ацетоуксусная | ацетоацетаты |
 | щавелевоуксусная (ЩУК) | оксалоацетаты |
Для органических метаболитов в организме наиболее важны реакции окисления – восстановления (ОВР).
Молочная кислота накапливается в мышцах вследствие гипоксии и образуется в процессе распада глюкозы и других углеводов. В аэробных условиях (достаточном количестве О2) молочная кислота окисляется в пировиноградную (ПВК).
Сравним кислотные свойства этих соединений.
α – расположение сильной электроноакцепторной оксо-группы относительно карбоксильной способствует расщеплению связи С-С и выделению углекислого газа.
Окисление и декарбоксилирование характерно так же для β-гидрокси- и особенно β-кето- кислот. Для β-кетокислот реакция декарбоксилирования протекает легче, чем для α-, так как отсутствует сопряжение между группами.
При нормальном метаболизме образуется яблочная кислота, которая ведет себя и как - и как -гидроксикислота. Одной из стадий цикла Кребса является следующая схема реакций:
б). Кето-енольная таутомерия
Таутомерия – разновидность структурной изомерии, при которой изомеры легко переходят друг в друга и существуют только совместно, находясь в динамическом равновесии. В равновесии всегда преобладает более термодинамически стабильный изомер.
Обычно кето-форма более устойчива, так как СН-кислотный центр обладает более слабой кислотностью, чем ОН-кислотный центр, поэтому ацетоуксусная кислота существует преимущественно в кето-форме.
Щавелевоуксусная кислота – исключение, она на 80% существует в енольной форме, Устойчивость енольной формы связана с образованием более длинной цепи сопряжения, охватывающей всю молекулу.
В растворах ЩУК и АУК присутствуют обе формы, поэтому они вступают в реакции, характерные для спиртов и оксо-соединений.
У 
Однако при взаимодействии ОН группы енольной формы с фосфорной кислотой образуется фосфоенолпировиноградная (фосфоенолпируват или ФЕП) кислота. В этом случае енольная форма стабилизируется счёт электроноакцепторного влияния фосфорной кислоты и увеличения цепи сопряжения. В организме фосфоенолпируват образуется в процессе гликолиза.
-Аминокислоты при нагревании образуют дикетопиперазины–циклические амиды из двух молекул аминокислот (SN)
При дегидратации яблочной кислоты образуется фумаровая кислота.
А при дегидратации лимонной – аконитовая, которая затем присоединяет воду против правила Марковникова и превращается в изолимонную.
Гетерофункциональные соединения
Это соединениея, содержащие разные функциональные группы. Они имеют большое значение, т.к. многие из низ являются биологически активными и лекарственными веществами.
Каждая из гетерофункциональных групп сохраняет свою собственную реакционную способность. При достаточно близком расположении происходит усиление реакционной способности каждой из них.
Молекулы некоторых гетерофункциональных соединений вступают в р-ции внутри- и межмолекулярного взаимодействия.
Гидрокси-, или оксикислоты
Это соединения, содержащие одну или несколько групп –ОН и –СООН.
В общем виде их формулу можно представить 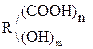
Номенклатура
|
|
|
СН3–
НООС–
|
НООС – СН2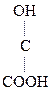
|
СООН

Изомерия
Молекулы с тремя атомами углерода проявляют изомерию положения гр. –ОН, а с четырьмя – изомерию положения и углерод – углеродной цепи. Например,
СН3–СН2–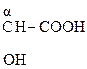
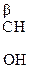
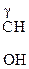
a-оксимасляная к-та b-оксимасляная к-та g-оксимасляная к-та
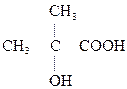
В молочной к-те появляется ассиметрический (хиральный) атом С, а следовательно, имеются оптические изомеры. Оптическая изомерия свойственна для многих оксикислот.
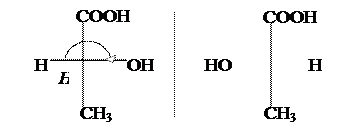 |
D-(–) – Молочная к-та L-(+) – Молочная к-та
Винная к-та имеет два ассиметрических атома С. Однако всего изомеров только три, а не четыре (2 n ), и оптически активных лишь два, т.к. два одинаковых заместителя (гр. –ОН) создают в молекуле плоскость симметрии.
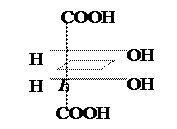 | 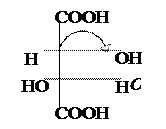 |  |
Мезовинная к-та D-(+) – Винная к-та L-(–) – Винная к-та
Химические св-ва
Наличие в молекуле двух функциональных групп приводит к тому, что эти соединения проявляют характерные р-ции как для к-т, так и для спиртов.
За счет взаимного влияния двух групп происходит усиление реакционной способности каждой из них. Кроме того для них возможны специфические р-ции с участием обеих групп.
R – 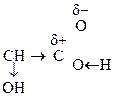
Оксик-ты диссоциируют, образуют соли, сложные эфиры, амиды, ангидриды, галогенангидриды.
Молочная к-та Лактат-анион
Окси-ты являются более сильными к-тами, чем соответствующие им карбоновые к-ты, что находит объяснение в ЭА характере групп – ОН и – СООН. Например, a-оксиуксусная к-та в 5 раз сильнее уксусной к-ты.
Соли образуются легко с различными веществами Ме, МеО, МеОН, МеСО3, где Ме – активный металл.
2) СН3–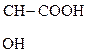
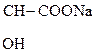
Молочная к-та Лактат натрия
Двухосновные к-ты образуют средние и кислые соли. Кислые соли, как правило, мало растворимы в воде, средние – хорошо растворимы. Это используют для обнаружения ионов К + в фармацевтии и в аналитической химии:
Винная к-та Гидротартрат калия
Смешанная К–Na соль винной к-ты наз-ся сегнетовой солью.
Номенклатура солей
Молочной к-ты – лактаты, яблочной – малаты,
Винной – тартраты, лимонной – цитраты.
3) СН3–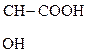
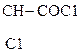
Это р-ции образования алкоголятов, простых и сложных эфиров, галогенопроизводных [НС1 (газ), РС15, SOC12], р-ции окисления.
1) СН3–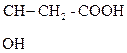
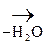
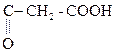
b-гидроксимасляная к-та Ацетоуксусная к-та (АУК)
Ацетон, ацетоуксусная к-та и g-гидроксимасляная к-та составляют группу «ацетоновых тел», образующихся в большом количестве в организме при сахарном диабете.
НООС–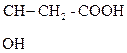
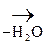
Яблочная к-та Щавелевоуксусная к-та (ЩУК)
2) Образование сложного эфира при действии хлоргидрида к-ты:
СН3–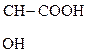
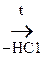
3) При действии Na и РС15 р-ция пойдет по двум группам.
4) Винная к-та и ее производные дают качественную р-цию на диольный драгмент – характерное ярко-синее окрашивание – с р-ром Сu(ОН)2 в щелочной среде.
|
Образовавшееся комплексное соединение под названием реактива Фелинга используется для обнаружения алифатических альдегидов.
III. Специфические р-ции
Они представляют наибольший интерес, т.к. обусловлены взаимным влиянием гетерофункциональных групп.
1) Р-ции дегидратации a-, b-, g-оксикислот
Вследствии наличия групп, способных взаимодействовать друг с другом, молекулы гетерофункциональных соединений способны вступать в р-ции внутри- и межмолекулярного взаимодействия с образованием циклических и нециклических соединений.
а) Две молекулы a-оксик-ты при нагревании выделяют две молекулы воды и образуются ЛАКТИДЫ:
|
|
|
СН3–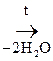
б) b-оксик-та, в молекуле которой фрагмент – СН2 – находится между двумя ЭА группами, увеличивающих подвижность атомов Н, подвергается дегидратации с образованием непредельной к-ты:
|
СН3–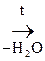
Яблочная к-та ведет себя как b-к-та и при дегидратации превращается в фумаровую:
НООС–
Яблочная к-та Фумаровая к-та
в) g-, d- и т.д. оксик-ты, в которых две функциональные группы находятся рядом идет внутримолекулярная этерификация с образованием ЛАКТОНА:
|
|
|
g-Масляная к-та g-Бутиролактон
Лактиды и лактоны являются циклическими сложными эфирами и легко гидролизуются в присутствии щелочей с образованием солей:
|
|
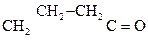
g-Бутиролактон 4-Гидроксибутаноат натрия
2) Наличие двух ЭА групп у одного атома С приводит a-оксик-ты к декарбоксилированию:
СН3 – СНОН – СООН 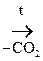
Молочная к-та Этанол
В организме эта р-ция протекает под действием фермента.
В присутствии сильных минеральных к-т углеродный скелет a-оксик-т расщепляется по связи С–1 – С–2 с образованием карбоксильного соединения (альдегида или кетона) и муравьиной к-ты:
a-Оксик-та Альдегид Муравьиная к-та
Особый интерес представляет поведение лимонной к-ты при нагревании в присутствии минеральных к-т. Как a-оксик-та она отщепляет НСООН, СО2, образуя в итоге ацетон:
|
|
|
Лимонная к-та Ацетондикарбоновая Ацетон
Как b-оксик-та она дегидратируется, образуя цис- аконитовую к-ту, участвующую в обмене веществ:
НООС–СН2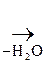
При этих процессах выделяется энергия. Процесс последовательных превращений лимонной и других к-т в организме наз-ся циклом Кребса.
|
|
|
Все три формы встречаются в природе. Рацемическая оптически неактивная молочная к-та (кристаллы) образуется из углеводов в результате молочнокислого брожения под действием бактерий. Получить безводную молочную к-ту очень трудно, т.к. обезвоживание ее р-ров сопровождается образованием лактида. Она образуется при скисании молока, квашении капусты, в различных соленьях, выполняя при этом роль консерванта, т.к. способна препятствовать развитию гнилостных бактерий.
Левовращающая D–молочная к-та образуется также в результате молочнокислого брожения, но под действием других бактерий нежели рацелическая молочная к-та. Правовращающая L–молочная к-та образуется в живых организмах в результате расщепления углеводов. Особенно много ее накапливается в мышцах при больших физических нагрузках.
Соли и эфиры молочной к-ты наз-ся ЛАКТАТАМИ.
В медицине используется как прижигающее (80%-ный р-р) при выведении мозолей, бородавок, пигментных пятен.
Лактат железа (II) (СН3СНОНСОО)2Fе × 3Н2О хорошо всасывается в кишечнике и хорошо переносится больными при анемии.
Лактат кальция применяют внутрь в тех же случаях, что хлорид и глюканат кальция.
НОСН2– СН2– СН2СООН g-Гидроксимасляная к-та (ГОМК) в свободном виде неустойчива, легко отщепляет воду с образованием лактона. В виде натриевой соли используется в медицине как неингаляционное наркозное средство.
НООССН(ОН)СН2СООН яблочная к-та содержит один ассиметрический атом С, поэтому возможно существование ее в виде пары энантиомеров. В природе встречается L-(–)-яблочная к-та (кристаллы), она содержится в ягодах и фруктах. L–яблочная к-та – один из продуктов распада углеводов в живых организмах.
В природе встречается только D-(+)-винная к-та, содержащаяся во многих растениях, особенно много ее в винограде, который служит сырьем для ее получения. Выделяется в виде малорастворимой кислой калиевой соли («винный камень») в процессе винного брожения виноградного сока. Соли и сложные эфиры винной к-ты наз-ся тартратами.
Винная к-та в смеси с содой NaНСО3 под названием «шипучие порошки» применяются как слабительное средство.
НООССН2С(ОН)(СООН)СН2СООН лимонная к-та (2-гидроксипропан-1,2,3-трикарбоновая к-та) – бесцветное кристалическое вещество, хорошо растворимое в воде. Содержится в различных растениях. Впервые была выделена известным химиком К. Шееле (1742–1786) из лимонного сока, где ее содержание достигает 10%. В промышленности получают путем лиминнокислого брожения отходов сахарного производства.
Соли и сложные эфиры лимонной к-ты наз-ся цитратами. Цитрат натрия применяется для консервирования донорской крови. Противосвертывающее действие основано на том, что цитрат натрия связывает ионы кальция в нерастворимый цитрат. Цитрат железа (II) – при анемии.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет