Что такое галогены простыми словами
Галогены в химии: что это, их характеристики и свойства, примеры
Содержание:
Галогены – элементы, находящиеся в VIIA группе. Они взаимодействуют со многими неорганическими и органическими соединениями. К ним относятся:
Галогены широко распространены в природных условиях.
Строение галогенов
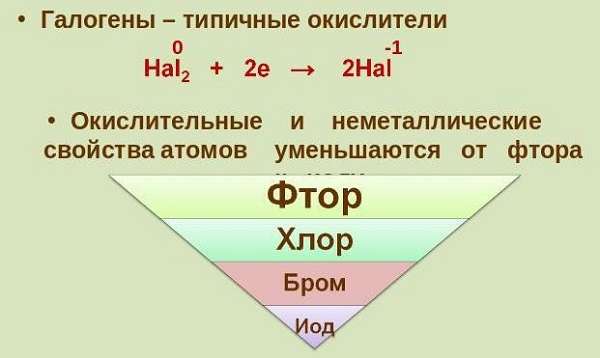
На наружном уровне галогенов располагается шесть спаренных и один неспаренный электрон. До устойчивого состояния элементам недостает одного электрона, поэтому они относятся к сильным окислителям. Молекулы галогенов состоят из двух атомов.
У галогенов в соединениях, как правило, отрицательная степень окисления:
В некоторых соединениях для них характерна положительная степень окисления:
Фтор – самый электроотрицательный элемент, который окисляет даже кислород. Таким образом, существует фторид кислорода OF2.
Закономерности галогенов
В ряду F-Cl-Br-I уменьшается электроотрицательность. Следовательно, фтор – самый активный элемент. У него самый маленький атомный радиус, поэтому он активно притягивает к себе электроны.
Физические свойства
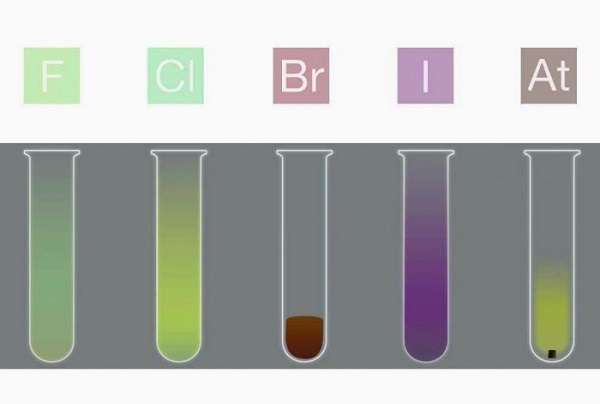
В ряду химических элементов F-Cl-Br-I повышается плотность вещества. В нормальных условиях галогены выглядят следующим образом:
Галогены ядовиты и издают неприятный аромат. Они практически не растворимы в воде. Только фтор может реагировать с водой.
Способы получения
Получение хлора
В промышленности хлор получают путем электролиза.
В лаборатории хлор получают при реакции соляной кислоты и сильных окислителей.
Получение фтора
Фтор получают с помощью электролиза расплава.
Получение брома
Бром получают с помощью окисления.
Получение йода
Йод получают с помощью окисления.
Химические свойства
Галогены – окислители, которые реагируют с металлами и неметаллами.
В реакциях со сложными веществами галогены ведут себя как окислители.
Применение галогенов
Костная ткань и зубная эмаль включают соединения фтора. При недостатке фтора зубная эмаль разрушается. В состав плазмы крови входят различные хлориды. Соединения брома регулируют процессы торможения и возбуждения нервной системы. Йод регулирует работу щитовидной железы, а также контролирует обмен веществ.
Фторид кислорода используется в производстве ракетного топлива. Соединения фтора входят в состав зубных паст. С помощью молекулярного хлора обеззараживают воду, а также используют для отбеливания тканей, бумаги, древесины. Поваренная соль – хлорид натрия, который добавляется в пищу. А хлорид калия применяется в качестве удобрения.
ГАЛОГЕНЫ
Все кислоты галогенов неустойчивы, однако чистая HOClO3 наиболее стабильна (в отсутствие любых восстановителей). Все оксокислоты являются сильными окислителями, но скорость окисления необязательно зависит от степени окисления галогена. Так, HOCl (ClI) быстрый и эффективный окислитель, а разбавленная HOClO3 (ClVII) нет. В целом, чем выше степень окисления галогена в оксокислоте, тем сильнее кислота, поэтому HClO4 (ClVII) наиболее сильная из известных оксокислот в водном растворе. Ион ClO4, образующийся при диссоциации кислоты в воде, наиболее слабый из отрицательных ионов донор электронной пары. Гипохлориты Na и Ca находят промышленное применение при отбеливании и водоочистке. Межгалогенные соединения соединения различных галогенов друг с другом. Галоген с большим радиусом всегда имеет в таком соединении положительную степень окисления (подвергается окислению), а с меньшим радиусом более отрицательную (подвергается восстановлению). Этот факт вытекает из общей тенденции изменения активности в ряду галогенов. В табл. 8г приведены составы известных межгалогенных соединений (А галоген с более положительной степенью окисления).
Межгалогенные соединения образуются прямым синтезом из элементов. Необычная для иода степень окисления 7 реализуется в соединении IF7, а другие галогены не могут координировать 7 атомов фтора. Прикладное значение имеют BrF3 и ClF3 жидкие вещества, химически аналогичные фтору, но более удобные при фторировании. При этом более эффективен BrF3. Поскольку трифториды сильные окислители и находятся в жидком состоянии, их используют как окислители ракетного топлива.
Водородные соединения. Галогены реагируют с водородом, образуя HX, причем со фтором и хлором реакция протекает со взрывом при небольшой активации ее. Медленнее идет взаимодействие c Br2 и I2. Для протекания реакции с водородом достаточно активировать небольшую долю реагентов с помощью освещения или нагревания. Активированные частицы взаимодействуют с неактивированными, образуя HX и новые активированные частицы, которые продолжают процесс, а реакция двух активированных частиц по главной реакции заканчивается образованием продукта. Например, образование HCl из H2 и Cl2:
Полезное
Смотреть что такое «ГАЛОГЕНЫ» в других словарях:
ГАЛОГЕНЫ — ГАЛОГЕНЫ, химические элементы VII группы периодической системы: фтор F, хлор Cl, бром Br, иод I и астат At. Фтор и хлор газы, бром жидкость, остальные кристаллы. Все галогены, кроме At, широко распространены в природе входят в состав многих… … Современная энциклопедия
ГАЛОГЕНЫ — ГАЛОГЕНЫ, элементы (ФТОР, ХЛОР, БРОМ, ЙОД и АСТАТ), принадлежащие к VII группе периодической таблицы. Они реагируют с большинством других элементов и органическими соединениями. Химическая активность падает от начала к концу группы. Галогены… … Научно-технический энциклопедический словарь
ГАЛОГЕНЫ — (устар. выражение галоиды) химические элементы фтор F, хлор Cl, бром Br, иод I и астат At, составляющие главную подгруппу VII группы периодической системы Менделеева. Названы от греческих hals соль и genes рождающий (при соединении с металлами… … Большой Энциклопедический словарь
Галогены — фтор, хлор, бром, йод; входят в VII группу периодической системы. Все члены группы образуют соединения с водородом, причем связь их повышается с уменьшением атомной массы; температура образования различных солей уменьшается с увеличением атомной… … Российская энциклопедия по охране труда
ГАЛОГЕНЫ — общее название пяти хим. элементов, составляющих VII подгруппу Периодической системы элементов Д. И. Менделеева, фтора, хлора, брома, йода и астата. Все Г. неметаллы, их молекулы двухатомны; Г. реагируют со всеми простыми веществами, являются… … Большая политехническая энциклопедия
Галогены — В этой статье не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете … Википедия
ГАЛОГЕНЫ — ГАЛОИДЫ ИЛИ ГАЛОГЕНЫ химические элементы: хлор, иод, бром, фтор, образующие с металлами соли без кислорода, напр. хлористый натрий (повар. соль). Словарь иностранных слов, вошедших в состав русского языка. Павленков Ф., 1907. ГАЛОИДЫ или ГАЛОГЕНЫ … Словарь иностранных слов русского языка
галогены — ов; мн. (ед. галоген, а; м.). [от греч. hals соль и genesis род, происхождение]. Группа химических элементов (фтор, хлор, бром, йод и др.), образующих соли при соединении с металлами. ◁ Галогенный, ая, ое. Г ые соединения. Г ая лампа (лампа… … Энциклопедический словарь
галогены — halogenai statusas T sritis chemija apibrėžtis F, Cl, Br, I, (At). atitikmenys: angl. halogens; haloid elements; haloids rus. галогены … Chemijos terminų aiškinamasis žodynas
Галогены — (от греч. hals соль и. genes рождающий, рожденный) химические элементы Фтор F, Хлор Cl, Бром Br, Иод I и Астат At, составляющие главную подгруппу VII группы периодической системы Д. И. Менделеева. Названы Г. по свойству давать соли при… … Большая советская энциклопедия
Уроки химии: что это такое галогены
Элементы, которые относятся к 17-й группе периодической системы, применяются во многих отраслях народного хозяйства, а вещества, содержащие их соединения, широко используются в быту. Вряд ли можно представить жизнь без этих химических элементов. Хотя все они являются токсичными, без микроскопических количеств галогенов в воде и продуктах невозможно нормальное существование организмов. Рассмотрим, что такое галогены, и каково их значение в химии и биологии.
Что такое галогены

Некоторые химики причисляют к ним искусственно синтезированное вещество теннесин с номером 117. Это пример галогена, который обладает радиоактивностью.
Вещества этой группы причисляют к неметаллам. Они считаются сильнейшими окислителями, причем это химическое свойство галогенов изменяется по мере уменьшения порядкового номера. Наиболее активным окислителем является фтор, который способен взаимодействовать даже с кислородом с образованием фторида. Способны проявлять свойства восстановителя со степенью окисления +7 (высшая). Недаром раньше таблица Менделеева помещала галогены в 7 группу.
В этом кроется ответ на вопрос, с чем взаимодействует галоген. Особенности строения этих веществ таковы, что они реагируют практически со всеми элементами.
Интересно! Название «фтор» происходит от греческого «разрушение». Это сильнейший окислитель, который взаимодействует почти с любыми веществами. Атомы фтора не реагируют с неоном, гелием и аргоном и некоторыми фторидами.
Характеристика веществ
Узнаем, что такое галогены в химии. Характеристика списка галогенов следующая:
Периодическая таблица показывает, что чем выше находится элемент, тем сильнее его окислительные способности.
При нормальных условиях является бледно-желтым газом. Можно получить путем электролиза КНF2. Реагирует с водой с образованием фтороводорода и кислорода. Реакция водорода и фтора происходит очень активно. Взаимодействует с металлами и неметаллами.
Хлористоводородная кислота является слабой, фтороводород обратимо диссоциирует в воде с выходом ионов Н+ и F-.
Фтороводородная кислота способна растворить стекло:
SiO2 + 4НF → SiF4 + 2Н2О.
Является газом зеленоватого цвета с удушающим запахом. Примеры реакций, с помощью которых можно его получить:
Узнаем, каковы химические свойства хлора:
Список распространенных кислот:
Это интересно! Для чего делают и что это такое гидролиз солей
Бром представляет собой тяжелую темную жидкость с плохим запахом. Многих интересует, с чем он реагирует. Этот элемент вступает в реакцию с:
Бромистый водород хорошо реагирует с солями, основаниями, окисями металлов.
Йод — кристаллическое вещество темного фиолетового оттенка. Растворяется в спирте, четыреххлористом углероде. Молекулы взаимодействуют с:
Йодистоводородная кислота является сильнейшим восстановителем. При реакции солей с ляписом образуется нерастворимое йодистое серебро. Йодная кислота является очень сильным окислителем (степень окисления йода +7).
Что касается астата, его можно получить только искусственным путем. Восстанавливается с помощью диоксида серы, осаждается сероводородом. Реагирует с йодом и бромом. Растворяется слабой соляной и азотной кислотой.
Физические и химические свойства элемента теннесин изучены мало ввиду малой продолжительности существования его изотопов. Предполагается, что тяжелые радиоактивные элементы могут обладать восстановительной активностью.
Полезное видео: урок химии галогены
Биологическая роль
Биологическое значение галогенов велико: без них не могут происходить важнейшие жизненные процессы.
Фтор встречается в составе костной и зубной ткани. Значительная часть его находится в эмали зубов, отчего она является крепкой. Поступает в организм с жидкостью. Дефицит этого элемента способствует развитию кариеса, а избыток — флюороз.
Встречается в курином желтке, овсе, молоке, перьях, шерсти, костях. Максимум фтора накапливается в листьях. Повышение количества фтора в воздухе способно вызвать тяжелое отравление.
Без такого элемента как хлор невозможна деятельность организмов. Поступает в виде хлористого натрия (кухонной соли). Наличие его в плазме крови способствует сохранению электролитного равновесия. Без хлора невозможно образование хлористоводородной кислоты сока желудка. Практически все продукты содержат это вещество. В жизни применяются многие химические вещества, содержащие хлор. Газ обладает удушающим действием, в больших концентрациях смертельно опасен для живых организмов.
Это интересно! Основные факторы влияющие на скорость химической реакции
Бром оказывает влияние на процессы возбудимости нервной системы. В сравнительно значительном количестве находится в морской воде. Каждый год из воды морей в воздух поступает до 4 миллионов тонн брома. В больших количествах элемент проявляет раздражающее действие.
Без йода невозможна выработка гормонов щитовидки. Играет важнейшую роль в организме, влияя на процессы слаженной деятельности нервной системы. Под контролем этого вещества находятся:
Проникает в организм с многими продуктами, особенно дарами моря. Особенно много этого микроэлемента в морской капусте. Значительное количество элемента поступает в организм с морским воздухом.
Биологическая роль астата изучена недостаточно.
Токсичность
Фтор, йод, бром, хлор в чистом виде и высокой концентрации ядовиты. Контакт газа с кожей в течение 2 секунд приводит к сильному ожогу. Даже в малых концентрациях фтор раздражает слизистые оболочки.
При попадании хлора в легкие происходит ожог, в результате чего у человека развивается удушье. Причем концентрация элемента в воздухе, при которой начинается поражение легочной ткани, лишь немногим больше порога ощущения неприятного хлорного запаха.
Обратите внимание! Фосген — соединение углерода, кислорода и хлора обладает чрезвычайно сильным удушающим действием, вызывающим необратимый отек легких и неизбежный летальный исход. Противоядия против фосгена не существует.
Вдыхание паров йода приводит к сильному удушью. При попадании его внутрь развиваются сильные ожоги пищевода и желудка.
Попадание в организм астата вызывает удушье и сильное радиоактивное облучение.
Использование
Значение любого галогена в жизни человека огромно.
Хлор используют для отбеливания бумаги, ткани. Без него невозможен синтез пластмасс, каучука, почти всех видов красителей, клеев и растворителей. Большинство хлорсодержащих соединений ядовиты, поэтому их применяют для борьбы с сельскохозяйственными вредителями. До недавнего времени хлор использовали для хлорирования воды. К сожалению, история знает случаи применения хлора в качестве отравляющих веществ.
Это интересно! Уроки химии: катионы и анионы – что это такое
Без брома сложно представить развитие фотографии. Фотобумага содержит слой бромида серебра, которое под воздействием света разлагается. В ходе этой реакции серебро выпадает в осадок.
Йод широко применяется в медицине в качестве обеззараживающего средства в виде настойки на спирту. Входит в состав большого количества лекарственных препаратов. Используется и при получении фотоматериалов высокой светочувствительности.
Изотоп астата применяется в медицине для проведения специальных исследований для определения рака. Существуют способы применения галогенов в медицине для лечения рака.
Полезное видео: биологическое значение и применение галогенов
Вывод
Знание, какие элементы относят к галогенам, очень важно. Они находят применение практически во всех сферах человеческой деятельности. Без них невозможно функционирование любого живого организма. В то же время обладают чрезвычайно высокой химической активностью, могут вызвать тяжелые отравления даже при небольших концентрациях, так что работать с такими веществами нужно очень осторожно.
Галогены. Химия галогенов и их соединений
Галогены
Положение в периодической системе химических элементов
Галогены расположены в главной подгруппе VII группы (или в 17 группе в современной форме ПСХЭ) периодической системы химических элементов Д.И. Менделеева.
Электронное строение галогенов
Электронная концигурация хлора :
Атомы галогенов содержат на внешнем энергетическом уровне 1 неспаренный электрон и три неподеленные электронные пары в основном энергетическом состоянии. Следовательно, в основном состоянии атомы галогенов могут образовывать 1 связи по обменному механизму.
При этом у фтора возбужденного состояния нет, т.е. максимальная валентность фтора в соединения равна I.
Однако, в отличие от фтора, за счет вакантной d-орбитали атомы хлора, брома и йода могут переходить в возбужденное энергетическое состояние.
Таким образом, максимальная валентность галогенов (кроме фтора) в соединениях равна VII. Также для галогенов характерны валентности I, III, V.
Физические свойства и закономерности изменения свойств
Галогены образуют двухатомные молекулы состава Hal2. В твёрдом состоянии имеют молекулярную кристаллическую решетку. Плохо растворимы в воде, все имеют запах, летучи.
| Галоген | F | Cl | Br | I |
| Электронная формула | … 2s 2 2p 5 | … 3s 2 3p 5 | … 4s 2 4p 5 | … 5s 2 5p 5 |
| Электроотрицательность | 4,0 | 3,0 | 2,8 | 2,5 |
| Степени окисления | -1 | -1, +1, +3, +5, +7 | -1, +1, +3, +5, +7 | -1, +1, +3, +5, +7 |
| Агрегатное состояние | Газ | Газ | Жидкость | Твердые кристаллы |
| Цвет | Светло-желтый | Жёлто-зелёный | Буровато-коричневый | Тёмно-серый с металлическим блеском |
| Запах | Резкий | Резкий, удушливый | Резкий, зловонный | Резкий |
| T плавления | –220 о С | –101 о С | –7 о С | 113,5 о С |
| Т кипения | –188 о С | –34 о С | 58 о С | 185 о С |
Внешний вид галогенов:
Фтор
Хлор
Бром
В природе галогены встречаются в виде соединений, в основном, в виде галогенидов.
Соединения галогенов
Типичные соединения хлора:
| Степень окисления | Типичные соединения |
| +7 | Хлорная кислота HClO4 Перхлораты MeClO4 |
| +5 | Хлорноватая кислота HClO3 Хлораты MeClO3 |
| +3 | Хлористая кислота HClO2 |
| +1 | Хлорноватистая кислота HClO Гипохлориты MeClO |
| –1 | Хлороводород HCl, Хлориды MeCl |
Бром и йод образуют подобные соединения.
Способы получения галогенов
1. Получение хлора.
В промышленности хлор получают электролизом расплава или раствора хлорида натрия.
Электролиз расплава хлорида натрия.
В расплаве хлорид натрия диссоциирует на ионы:
NaCl → Na + + Cl −
На катоде восстанавливаются ионы натрия:
K(–): Na + +1e → Na 0
На аноде окисляются ионы хлора:
A(+): 2Cl − ̶ 2e → Cl2 0
Ионное уравнение электролиза расплава хлорида натрия:
2Na + + 2Cl − → 2Na º + Cl2º
Суммарное уравнение электролиза расплава хлорида натрия:
2NaCl → 2Na + Cl2
Электролиз раствора хлорида натрия.
В растворе хлорид натрия диссоциирует на ионы:
NaCl → Na + + Cl −
На катоде восстанавливаются молекулы воды:
K(–): 2H2O + 2e → H2° + 2OH −
На аноде окисляются ионы хлора:
A(+): 2Cl − ̶ 2e → Cl2 0
Ионное уравнение электролиза раствора хлорида натрия:
Суммарное уравнение электролиза раствора хлорида натрия:
2NaCl + 2H2O → H2↑ + 2NaOH + Cl2↑
В лаборатории хлор получают взаимодействием концентрированной соляной кислоты с сильными окислителями.
Или перманганатом калия:
2KMnO4 + 16HCl → 2MnCl2 + 2KCl + 5Cl2↑ + 8H2O
Бертолетова соль также окисляет соляную кислоту:
KClO3 + 6HCl → KCl + 3Cl2↑ + 3H2O
Бихромат калия окисляет соляную кислоту:
2. Получение фтора.
Фтор получают электролизом расплава гидрофторида калия.
3. Получение брома.
Бром можно получить окислением ионов Br – сильными окислителями.
2HBr + Cl2 → Br2 + 2HCl
Соединения марганца также окисляют бромид-ионы.
4. Получение йода.
Йод получают окислением ионов I – сильными окислителями.
2KI + Cl2 → I2 + 2KCl
Соединения марганца также окисляют йодид-ионы.
Химические свойства галогенов
Химическая активность галогенов увеличивается снизу вверх – от астата к фтору.
1.1. Галогены не горят на воздухе. Фтор окисляет кислород с образованием фторида кислорода:
1.2. При взаимодействии галогенов с серой образуются галогениды серы:
1.3. При взаимодействии фосфора и углерода с галогенами образуются галогениды фосфора и углерода:
1.4. При взаимодействии с металлами галогены проявляют свойства окислителей, образуя галогениды.
3Cl2 + 2Fe → 2FeCl3
Аналогичная ситуация с медью : фтор, хлор и бром окисляют медь до галогенидов меди (II),а йод до йодида меди (I):
I2 + 2Cu → 2CuI
Активные металлы бурно реагируют с галогенами, особенно с фтором и хлором (горят в атмосфере фтора или хлора).
Еще пример : алюминий взаимодействует с хлором с образованием хлорида алюминия:
3Cl2 + 2Al → 2AlCl3
1.5. Водород горит в атмосфере фтора:
С хлором водород реагирует только при нагревании или освещении. При этом реакция протекает со взрывом:
Бром также реагирует с водородом с образованием бромоводорода:
Взаимодействие йода с водородом происходит только при сильном нагревании, реакция протекает обратимо, с поглощением теплоты (эндотермическая):
1.6. Галогены реагируют с галогенами. Более активные галогены окисляют менее активные.
2. Со сложными веществами галогены реагируют, также проявляя преимущественно окислительные свойства. Галогены охотно диспропорционируют при растворении в воде или в щелочах.
2.1. При растворении в воде хлор и бром частично диспропорционируют, повышая и понижая степень окисления. Фтор окисляет воду.
Cl2 + H2O ↔ HCl + HClO
Фтор реагирует с водой со взрывом:
2.2. При растворении в щелочах хлор, бром и йод диспропорционируют с образованием различных солей. Фтор окисляет щелочи.
При взаимодействии с горячим раствором гидроксида натрия образуются хлорид и хлорат:
Еще пример : хлор растворяется в холодном растворе гидроксида кальция:
2.3. Более активные галогены вытесняют менее активные галогены из солей и галогеноводородов.
Cl2 + 2NaI → 2NaCl + I2
Cl2 + 2NaBr → 2NaCl + Br2
Еще одно свойство: более активные галогены окисляют менее активные.
Cl2 + F2 → 2Cl + F –
В свою очередь, хлор окисляет йод. При этом в растворе образуется соляная кислота и йодная кислота:
2.4. Галогены проявляют окислительные свойства, взаимодействуют с восстановителями.
Cl2 + H2S → S + 2HCl
Хлор также окисляет сульфиты:
Также галогены окисляют пероксиды:
Или, при нагревании или на свету, воду:
2Cl2 + 2H2O → 4HCl + O2 (на свету или кип.)
Галогеноводороды
Строение молекулы и физические свойства
Галогеноводороды HHal – это бинарные соединения водорода с галогенами, которые относятся к летучим водородным соединениям. Галогеноводороды – бесцветные ядовитый газы, с резким запахом, хорошо растворимые в воде.
В ряду HCl – HBr – HI увеличивается длина связи и ковалентности связи уменьшается полярность связи H – Hal.
Растворы галогеноводородов в воде (за исключением фтороводорода) – сильные кислоты. Водный раствор фтороводорода – слабая кислота.
Способы получения галогеноводородов
В лаборатории галогеноводороды получают действием нелетучих кислот на хлориды металлов.
Галогеноводороды получают также прямым взаимодействием простых веществ:
Химические свойства галогеноводородов
2HCl + CaO → CaCl2 + H2O
HCl + NaOH → NaCl + H2O
Fe + 2HCl → FeCl2 + H2
HF ↔ H + + F –
Водные растворы хлороводорода (соляная кислота), бромоводорода и йодоводорода – сильные кислоты, в разбавленном растворе диссоциируют практически полностью:
HCl ↔ H + + Cl –
3. Водные растворы галогеноводородов взаимодействуют с солями более слабых кислот и с некоторыми растворимыми солями (если образуется газ, осадок, вода или слабый электролит).
Качественная реакция на галогенид-ионы – взаимодействие с растворимыми солями серебра.
При взаимодействии соляной кислоты с нитратом серебра (I) образуется белый осадок хлорида серебра:
HCl + AgNO3 = AgCl↓ + HNO3
Осадок бромида серебра – бледно-желтого цвета:
HBr + AgNO3 = AgBr↓ + HNO3
Осадок иодида серебра – желтого цвета:
HI + AgNO3 = AgI↓ + HNO3
Фторид серебра – растворимая соль, поэтому реакция плавиковой кислоты и ее солей с нитратом серебра не является качественной.
Видеоопыты качественных реакций на хлорид-, бромид- и йодид-ионы (взаимодействие с нитратом серебра) можно посмотреть здесь.
4. Восстановительные свойства галогеноводородов усиливаются в ряду HF – HCl – HBr – HI.
Br2 + 2HI → I2 + 2HBr
А вот хлор не может вытеснить фтор из фтороводорода.
Фтороводород практически невозможно окислить.
Концентрированная соляная кислота окисляется соединениями марганца с валетностью выше II или соединениями хрома (VI).
Например : концентрированная соляная кислота окисляется оксидом марганца (IV):
Бромоводород – сильный восстановитель и окисляется соединениями марганца, хрома (VI), концентрированной серной кислотой и другими сильными окислителями:
Бромоводород реагирует с бихроматом калия с образованием молекулярного брома:
Или с оксидом марганца (IV):
Пероксид водорода также окисляет бромоводород до молекулярного брома:
Йодоводород – еще более сильный восстановитель, и окисляется другими неметаллами и даже такими окислителями, как соединения железа (III) и соединения меди (II).
2HI + 2FeCl3 → I2 + 2FeCl2 + 2HCl
или с сульфатом железа (III):
или молекулярной серой при нагревании:
2HI + S → I2 + H2S
5. Плавиковая кислота реагирует с оксидом кремния (IV) (растворяет стекло):
Галогениды металлов
Галогениды – это бинарные соединения галогенов и металлов или некоторых неметаллов, соли галогеноводородов.
Способы получения галогенидов
При взаимодействии железа с хлором образуется хлорид железа (III):
3Cl2 + 2Fe → 2FeCl3
2. Галогениды металлов можно получить при взаимодействии металлов с галогеноводородами.
Fe + 2HCl → FeCl2 + H2
3. Галогениды металлов можно получить при взаимодействии основных и амфотерных оксидов с галогеноводородами.
2HCl + CaO → CaCl2 + H2O
Еще пример : взаимодействие оксида алюминия с соляной кислотой:
4. Галогениды металлов можно получить при взаимодействии оснований и амфотерных гидроксидов с галогеноводородами.
HCl + NaOH → NaCl + H2O
Или при взаимодействии гидроксида меди (II) с соляной кислотой:
Гидроксид цинка (II) также взаимодействует с соляной кислотой:
5. Некоторые соли взаимодействуют с галогеноводородами с образованием галогенидов металлов.
HBr + NaHCO3 → NaBr + CO2↑ + H2O
Взаимодействие с нитратом серебра – качественная реакция на соляную кислоту, бромодоводород и йодоводород:
HCl + AgNO3 → AgCl↓ + HNO3
HBr + AgNO3 → AgBr↓ + HNO3
HI + AgNO3 → AgI↓ + HNO3
Химические свойства галогенидов
NaCl + AgNO3 → AgCl↓ + NaNO3
Фторид серебра – растворимая соль, поэтому реакция фторидов с нитратом серебра не является качественной.
Видеоопыты качественных реакций на хлорид-, бромид- и йодид-ионы (взаимодействие с нитратом серебра) можно посмотреть здесь.
Mg + CuCl2 → MgCl2 + Cu
Обратите внимание! В растворе более активные металлы вытесняют менее активные только если более активные металлы не взаимодействуют с водой (металлы, расположенные в ряду активности до магния). Если добавляемый металл слишком активен, то он провзаимодействует с водой, а не с солью.
Na + ZnCl2(раствор) ≠
3. Галогениды подвергаются электролизу в растворе или расплаве. При этом на аноде образуются галогены.
2KBr → 2K + Br2
При электролизе раствора бромида калия на катоде выдялется водород, а на аноде также образуется бром:
Еще пример : йодид калия окисляется соединениями меди (II) и соединениями железа (III):
4KI + 2CuCl2 → 2CuI↓ + I2↓ + 4KCl
2KI + 2FeCl3 → I2↓ + 2FeI2 + 2KCl
Еще несколько примеров восстановительных свойств галогенидов:
KI + 3H2O + 3Cl2 → HIO3 + KCl + 5HCl
Более активные галогены вытесняют менее активные из солей.
При этом галогениды металлов не горят в кислороде.
6. Нерастворимые галогениды под действием света разлагаются на галоген и металл.
2AgCl → 2Ag + Cl2
Кислородсодержащие кислоты галогенов
Рассмотрим кислородсодержащие кислоты галогенов на примере хлора:
| Степень окисления галогена | +1 | +3 | +5 | +7 |
| Формула | HClO | HClO2 | HClO3 | HClO4 |
| Название кислоты | Хлорноватистая | Хлористая | Хлорноватая | Хлорная |
| Устойчивость и сила | Существует только в растворах, слабая кислота | Существует только в растворах, слабая кислота | Существует только в растворах, сильная кислота | Сильная кислота |
| Название соответствующей соли | Гипохлориты | Хлориты | Хлораты | Перхлораты |
Хлорноватистая кислота и ее соли
Хлорноватистая кислота HClO устойчива только в разбавленном водном растворе.
Cпособ получения хлорноватистой кислоты:
1. Диспропорционирование хлора в холодной воде :
Cl2 + H2O ↔ HCl + HClO
Химические свойства хлорноватистой кислоты:
Хлорноватистая кислота HClO – это слабая кислота, но сильный окислитель.
1. Под действием ультрафиолета (на свету) хлорноватистая кислота разлагается :
2HClO → 2HCl + O2
HClO + KOH → KClO + H2O
HClO + 2HI → HCl + I2 + H2O
4. Хлорноватистая кислота диспропорционирует:
3HClO → 2HCl + НСlO3
Химические свойства солей хлорноватистой кислоты (гипохлоритов):
1. Более сильные кислоты вытесняют гипохлориты из солей.
NaClO + 2HCl → NaCl + Cl2 + H2O
Серная кислота реагирует с гипохлоритом кальция при нагревании или под действием излучения:
Даже угольная кислота вытесняет гипохлориты:
3. При нагревании гипохлориты разлагаются :
Хлористая кислота и ее соли
Хлористая кислота HClO2 – существует только в водных растворах.
Способы получения:
Хлористую кислоту можно получить окислением оксида хлора пероксидом водорода:
Химические свойства хлористой кислоты:
1. Хлористая кислота является также слабой. Реагирует с щелочами с образованием хлоритов:
2. При длительном хранении разлагается:
Хлорноватая кислота и ее соли
Хлорноватая кислота HClO3 – также существует только в водных растворах.
Способы получения:
Хлорноватую кислоту можно получить из солей хлорноватой кислоты – хлоратов.
Химические свойства хлорноватой кислоты:
1. Хлорноватая кислота – сильная кислота. Реагирует с щелочами с образованием хлоратов:
2. Хлорноватая кислота – сильный окислитель.
Химические свойства солей хлорноватой кислоты – хлоратов:
1. Хлораты – сильные окислители.
4KClO3 → 3KClO4 + KCl
В присутствии катализатора (оксид марганца (IV)) хлорат калия разлагается, окисляя кислород:
2KClO3 → 2KCl + 3O2↑
Еще пример : хлорат калия окисляет серу и фосфор:
2KClO3 + 3S → 2KCl + 3SO2
Хлорная кислота и ее соли
Хлорная кислота HClO4 – это бесцветная жидкость, хорошо растворимая в воде.
Способы получения:
Хлорную кислоту можно получить из солей хлорной кислоты – перхлоратов.
Химические свойства хлорной кислоты:
1. Хлорная кислота – сильная кислота. Реагирует с щелочами с образованием перхлоратов:
2. Хлорная кислота – сильный окислитель.
3. При нагревании хлорная кислота разлагается:
Химические свойства солей хлорной кислоты – перхлоратов:
1. Перхлораты – сильные окислители.
Еще пример : перхлорат калия окисляет алюминий:







