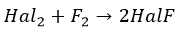Что такое галогены химия
Галогены в химии: что это, их характеристики и свойства, примеры
Содержание:
Галогены – элементы, находящиеся в VIIA группе. Они взаимодействуют со многими неорганическими и органическими соединениями. К ним относятся:
Галогены широко распространены в природных условиях.
Строение галогенов
На наружном уровне галогенов располагается шесть спаренных и один неспаренный электрон. До устойчивого состояния элементам недостает одного электрона, поэтому они относятся к сильным окислителям. Молекулы галогенов состоят из двух атомов.
У галогенов в соединениях, как правило, отрицательная степень окисления:
В некоторых соединениях для них характерна положительная степень окисления:
Фтор – самый электроотрицательный элемент, который окисляет даже кислород. Таким образом, существует фторид кислорода OF2.
Закономерности галогенов
В ряду F-Cl-Br-I уменьшается электроотрицательность. Следовательно, фтор – самый активный элемент. У него самый маленький атомный радиус, поэтому он активно притягивает к себе электроны.
Физические свойства
В ряду химических элементов F-Cl-Br-I повышается плотность вещества. В нормальных условиях галогены выглядят следующим образом:
Галогены ядовиты и издают неприятный аромат. Они практически не растворимы в воде. Только фтор может реагировать с водой.
Способы получения
Получение хлора
В промышленности хлор получают путем электролиза.
В лаборатории хлор получают при реакции соляной кислоты и сильных окислителей.
Получение фтора
Фтор получают с помощью электролиза расплава.
Получение брома
Бром получают с помощью окисления.
Получение йода
Йод получают с помощью окисления.
Химические свойства
Галогены – окислители, которые реагируют с металлами и неметаллами.
В реакциях со сложными веществами галогены ведут себя как окислители.
Применение галогенов
Костная ткань и зубная эмаль включают соединения фтора. При недостатке фтора зубная эмаль разрушается. В состав плазмы крови входят различные хлориды. Соединения брома регулируют процессы торможения и возбуждения нервной системы. Йод регулирует работу щитовидной железы, а также контролирует обмен веществ.
Фторид кислорода используется в производстве ракетного топлива. Соединения фтора входят в состав зубных паст. С помощью молекулярного хлора обеззараживают воду, а также используют для отбеливания тканей, бумаги, древесины. Поваренная соль – хлорид натрия, который добавляется в пищу. А хлорид калия применяется в качестве удобрения.
Галогены
Галогены широко распространены в природе. Их химическая активность падает от фтора к астату.
Общая характеристика элементов VIIa группы
От F к At (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Все галогены относятся к неметаллам, являются сильными окислителями.
Природные соединения
Галогены в чистом виде можно получить путем электролиза водных растворов и расплавов их солей. Например, хлор в промышленности получают электролизом водного раствора хлорида натрия.
Более активные галогены способны вытеснять менее активные. Активность галогенов убывает: F → Cl → Br → I.
В лабораторных условиях галогены могут быть получены следующими реакциями.
Для галогенов характерна высокая реакционная способность. Фтор реагирует со всеми металлами без исключения, некоторые из них в атмосфере фтора самовоспламеняются.
Хлор, как и фтор, химически весьма активен. Не реагирует только с кислородом, азотом и благородными газами.
F2 + H2 → HF (в темноте со взрывом)
Галогены вступают в реакцию друг с другом. Чтобы определить степени окисления в получающихся соединениях, вспомните электроотрицательность 😉
Реакция фтора с водой протекает очень энергично, носит взрывной характер.
Cl2 + NaOH → NaCl + NaClO + H2O
Галогены способны вытеснять друг друга из солей. Более активные вытесняют менее активные.
KBr + I2 ⇸ (реакция не идет, так как йод менее активен, чем бром)
Галогеноводороды
В промышленности применяют получение прямым методом: реакцией водорода с галогенами.
В лабораторных условиях галогеноводороды можно получить в реакциях обмена между галогенсодержащими солями и сильными кислотами.
Галогеноводороды реагируют с основными, амфотерными оксидами и основаниями с образованием соответствующих солей.
KOH + HCl → KCl + H2O (реакция нейтрализации)
Реакции протекают в тех случаях, если в результате выпадает осадок, выделяется газ или образуется слабый электролит (вода).
В некоторых реакциях проявляют себя как сильные восстановители, особенно HI.
В целом взаимодействие галогеноводородов с оксидами неметаллов нехарактерно. В этой связи важно выделить реакцию SiO2 с плавиковой кислотой.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Не все знают, что под пугающим названием «галогены» зачастую скрываются распространенные в быту вещества. Не в чистом виде, но все-таки. Отдельными представителями «семейства» ежедневно пользуется каждый человек.
На упаковке любой зубной пасты имеется словосочетание со словом «фтор». Полезен для зубной эмали.
Хлор знаком любой домохозяйке и сотруднику клининговой компании. А уж его запах знают все, кто посещал бассейн или лечебные учреждения России. Не пустой звук для советских школьников. Даже не из курса химии, а из уроков химзащиты в рамках начальной военной подготовки (НВП).
Про «бром» ходили легенды среди военнослужащих СССР. Насколько сведения достоверны – неизвестно.
Темно-коричневая бутылочка с «йодом» – постоянный спутник любителя поиграть с котенком и непоседливого ребенка. Распространенный антисептик.
Что такое галогены
Определяют, как элементы 17-ой группы таблицы Менделеева. Сторонники «старой школы» выразились бы: «главной подгруппы VII группы».
Название представляет собой компиляцию греческих слов. Означает приблизительно «солерождающий». Такое определение было дано в XIX веке британским ученым Гэмфри Дэви.
Перечень и общая характеристика галогенов
С первыми четырьмя элементами из списка некоторое знакомство имеется. Надо заметить, что вещества хоть и достаточно распространенные, но в чистом виде в природе не встречаются. Только в составе соединений.
Астат – элемент не просто редкий, а самый редкий из всех встречающихся на планете. Его «запасы» оцениваются в 1 г. Свойства доподлинно не известны. Так как из-за радиоактивности и мизерной «продолжительности жизни» в достаточных количествах выделить не получилось.
Теннессин существует скорее теоретически. На Земле, по крайней мере, не нашли. Рекордное зафиксированное (и признанное) в лаборатории количество – 6 ядер. Включая изотоп.
Легко заметить, что до «идеальных» инертов не хватает всего-то электрончика. А так хочется. Не удивительно, что так агрессивны.
Физические свойства
Галогены – ярко выраженные неметаллы. Летучи, с характерно едким «ароматом». Причем для йода (I2) жидкое агрегатное состояние вообще не характерно. При разогреве просто испаряется фиолетовым дымком.
Хлор – настоящее боевое отравляющее вещество. И применялось в таком качестве. Попадая в незащищенные глаза и органы, образует кислоты. С соответствующими последствиями. Для летального исхода достаточно концентрации в воздухе 2 мг/л.
Насыщенность цветов с «утяжелением» ядер возрастает. Активность, напротив, падает.
В воде растворимость ограничена. Лучше ведёт себя с органическими растворителями. Растворы оригинально окрашены: от слабо желтого до фиолетового.
Химические свойства галогенов
Можно сказать, что F реагирует со всеми простыми субстанциями, кроме отдельных благородных газов. А так (с облучением):
Остальные элементы ряда не взаимодействуют с:
Галогены
К галогенам относятся фтор F, хлор Cl, бром Br, иод I, астат At, а также (формально) искусственный элемент унунсептий Uus.
| Фтор F | Хлор Cl | Бром Br | Иод I |
|---|---|---|---|
 |  |  |
Все галогены — неметаллы. На внешнем энергетическом уровне 7 электронов, являются сильными окислителями. При взаимодействии с металлами возникает ионная связь, и образуются соли. Галогены, (кроме F) при взаимодействии с более электроотрицательными элементами, могут проявлять и восстановительные свойства вплоть до высшей степени окисления +7.
Содержание
Распространённость элементов и получение простых веществ
Как уже было сказано выше, галогены имеют высокую реакционную способность, поэтому встречаются в природе обычно в виде соединений.
Их распространённость в земной коре уменьшается при увеличении атомного радиуса от фтора к иоду. Количество астата в земной коре измеряется граммами, а унунсептий в природе отсутствует. Фтор, хлор, бром и иод производятся в промышленных масштабах, причем хлор производится в гораздо больших количествах.
В природе эти элементы встречаются в основном в виде галогенидов (за исключением иода, который также встречается в виде иодата натрия или калия в месторождениях нитратов щелочных металлов). Поскольку многие хлориды, бромиды и иодиды растворимы в воде, то эти анионы присутствуют в океане и природных рассолах. Основным источником фтора является фторид кальция, который очень малорастворим и находится в осадочных породах (как флюорит CaF2).
Основным способом получения простых веществ является окисление галогенидов. Высокие положительные стандартные электродные потенциалы Eo(F2/F − ) = +2,87 В и Eo(Cl2/Cl − ) = +1,36 В показывают, что окислить ионы F − и Cl − можно только сильными окислителями. В промышленности применяется только электролитическое окисление. При получении фтора нельзя использовать водный раствор, поскольку вода окисляется при значительно более низком потенциале (+1,32 В) и образующийся фтор стал бы быстро реагировать с водой. Впервые фтор был получен в 1886 г. французским химиком Анри Муассаном при электролизе раствора гидрофторида калия KHF2 в безводной плавиковой кислоте.
В промышленности хлор в основном получают электролизом водного раствора хлорида натрия в специальных электролизёрах. При этом протекают следующие реакции:
полуреакция на аноде: 
полуреакция на катоде:
Окисление воды на аноде подавляется использованием такого материала электрода, который имеет более высокое перенапряжение по отношению к O2, чем к Cl2 (таким материалом оказался катодное и анодное пространства разделены полимерной ионообменной мембраной. Мембрана позволяет катионам Na + переходить из анодного пространства в катодное. Переход катионов поддерживает электронейтральность в обеих частях электролизёра, так как в течение электролиза отрицательные ионы удаляются от анода (превращение 2Cl − в Cl2) и накапливаются у катода (образование OH − ). Перемещение OH − в противоположную сторону могло бы тоже поддерживать электронейтральность, но ион OH − реагировал бы с Cl2 и сводил на нет весь результат.
Физические свойства галогенов
| Простое вещество | Температура плавления, °C | Температура кипения, °C |
| F2 | −220 | −188 |
| Cl2 | −101 | −34 |
| Br2 | −7 | 58 |
| I2 | 113,5 | 184,885 |
| At2 | 244 | 309 [2] |
Химические свойства галогенов
Все галогены проявляют высокую окислительную активность, которая уменьшается при переходе от фтора к астату. Фтор — самый активный из галогенов, реагирует со всеми металлами без исключения, многие из них в атмосфере фтора самовоспламеняются, выделяя большое количество теплоты, например:
2Al + 3F2 = 2AlF3 + 2989 кДж, 2Fe + 3F2 = 2FeF3 + 1974 кДж.
Без нагревания фтор реагирует и со многими неметаллами (H2, S, С, Si, Р) — все реакции при этом сильно экзотермические, например:
При нагревании фтор окисляет все другие галогены по схеме
где Hal = Cl, Br, I, At, причем в соединениях HalF степени окисления хлора, брома, иода и астата равны +1.
Наконец, при облучении фтор реагирует даже с инертными (благородными) газами:
Взаимодействие фтора со сложными веществами также протекает очень энергично. Так, он окисляет воду, при этом реакция носит взрывной характер:
Свободный хлор также очень реакционноспособен, хотя его активность и меньше, чем у фтора. Он непосредственно реагирует со всеми простыми веществами, за исключением кислорода, азота и благородных газов. Для сравнения приведем уравнения реакций хлора с теми же простыми веществами, что и для фтора:
2Al + 3Cl2 = 2AlCl3(кр) + 1405 кДж, 2Fe + ЗCl2 = 2FeCl3(кр) + 804 кДж, Si + 2Cl2 = SiCl4(Ж) + 662 кДж, Н2 + Cl2 = 2HCl(г)+185кДж.
Особый интерес представляет реакция с водородом. Так, при комнатной температуре, без освещения хлор практически не реагирует с водородом, тогда как при нагревании или при освещении (например, на прямом солнечном свету) эта реакция протекает со взрывом по приведенному ниже цепному механизму:
Cl2 + hν → 2Cl, Cl + Н2 → HCl + Н, Н + Cl2 → HCl + Cl, Cl + Н2 → HCl + Н и т. д.
Возбуждение этой реакции происходит под действием фотонов ( hν ), которые вызывают диссоциацию молекул Cl2 на атомы — при этом возникает цепь последовательных реакций, в каждой из которых появляется частица, инициирующая начало последующей стадии.
Реакция между Н2 и Cl2 послужила одним из первых объектов исследования цепных фотохимических реакций. Наибольший вклад в развитие представлений о цепных реакциях внёс русский учёный, лауреат Нобелевской премии (1956 год) Н. Н. Семёнов.
Хлор вступает в реакцию со многими сложными веществами, например замещения и присоединения с углеводородами:
Хлор способен при нагревании вытеснять бром или иод из их соединений с водородом или металлами:
а также обратимо реагирует с водой:
Cl2 + Н2О = HCl + HClO — 25 кДж.
Хлор, растворяясь в воде и частично реагируя с ней, как это показано выше, образует равновесную смесь веществ, называемую хлорной водой.
Заметим также, что хлор в левой части последнего уравнения имеет степень окисления 0. В результате реакции у одних атомов хлора степень окисления стала −1 (в HCl), у других +1 (в хлорноватистой кислоте HOCl). Такая реакция — пример реакции самоокисления-самовосстановления, или диспропорционирования.
Хлор может таким же образом реагировать (диспропорционировать) со щелочами:
Cl2 + 2NaOH = NaCl + NaClO + Н2О (на холоде), 3Cl2 + 6КОН = 5KCl + KClO3 + 3Н2О (при нагревании).
Химическая активность брома меньше, чем у фтора и хлора, но все же достаточно велика в связи с тем, что бром обычно используют в жидком состоянии и поэтому его исходные концентрации при прочих равных условиях больше, чем у хлора.
Для примера приведем реакции взаимодействия брома с кремнием и водородом:
Si + 2Br2 = SiBr4(ж) + 433 кДж, Н2 + Br2 = 2HBr(г) + 73 кДж.
Являясь более «мягким» реагентом, бром находит широкое применение в органической химии.
Отметим, что бром, так же, как и хлор, растворяется в воде, и, частично реагируя с ней, образует так называемую «бромную воду», тогда как иод практически в воде не растворим и не способен её окислять даже при нагревании; по этой причине не существует «иодной воды». Но иод способен растворяться в растворах иодидов с образованием комплексных анионов:
Образующийся раствор называется раствором Люголя.
Иод существенно отличается по химической активности от остальных галогенов. Он не реагирует с большинством неметаллов, а с металлами медленно реагирует только при нагревании. Взаимодействие же иода с водородом происходит только при сильном нагревании, реакция является эндотермической и сильно обратимой:
Таким образом, химическая активность галогенов последовательно уменьшается от фтора к астату. Каждый галоген в ряду F — At может вытеснять последующий из его соединений с водородом или металлами, то есть каждый галоген в виде простого вещества способен окислять галогенид-ион любого из последующих галогенов. Астат ещё менее реакционноспособен, чем иод. Но и он реагирует с металлами (например с литием):
2Li + At2 = 2LiAt — астатид лития.
Галогены. Химия галогенов и их соединений
Галогены
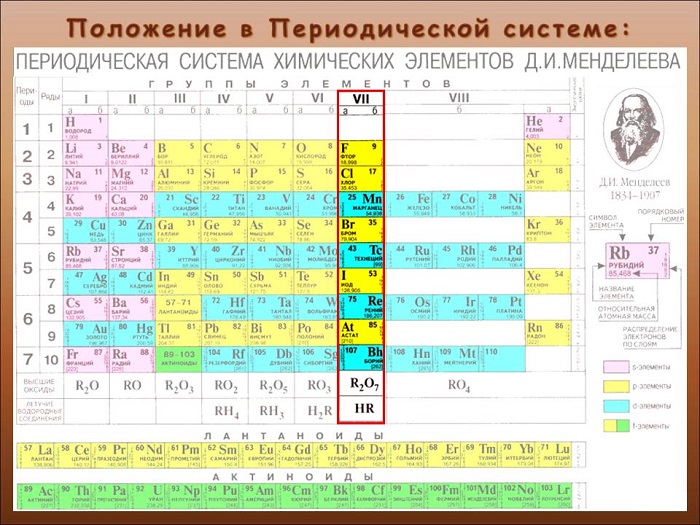
Положение в периодической системе химических элементов
Галогены расположены в главной подгруппе VII группы (или в 17 группе в современной форме ПСХЭ) периодической системы химических элементов Д.И. Менделеева.
Электронное строение галогенов
Электронная концигурация хлора :
Атомы галогенов содержат на внешнем энергетическом уровне 1 неспаренный электрон и три неподеленные электронные пары в основном энергетическом состоянии. Следовательно, в основном состоянии атомы галогенов могут образовывать 1 связи по обменному механизму.
При этом у фтора возбужденного состояния нет, т.е. максимальная валентность фтора в соединения равна I.
Однако, в отличие от фтора, за счет вакантной d-орбитали атомы хлора, брома и йода могут переходить в возбужденное энергетическое состояние.
Таким образом, максимальная валентность галогенов (кроме фтора) в соединениях равна VII. Также для галогенов характерны валентности I, III, V.
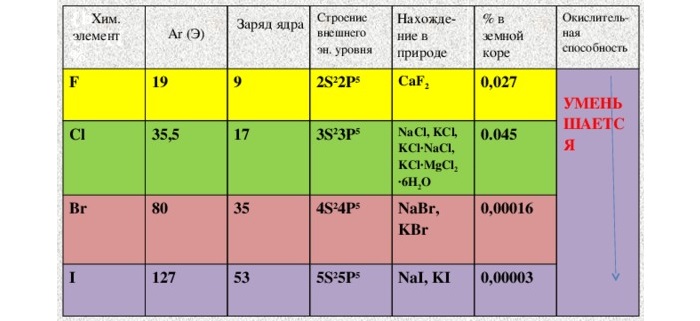
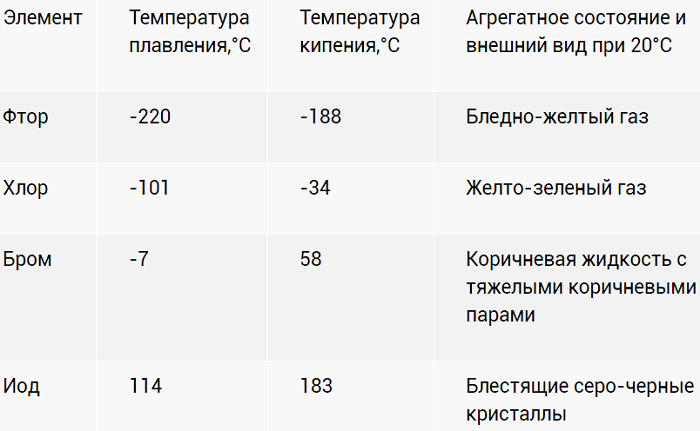
Физические свойства и закономерности изменения свойств
Галогены образуют двухатомные молекулы состава Hal2. В твёрдом состоянии имеют молекулярную кристаллическую решетку. Плохо растворимы в воде, все имеют запах, летучи.
| Галоген | F | Cl | Br | I |
| Электронная формула | … 2s 2 2p 5 | … 3s 2 3p 5 | … 4s 2 4p 5 | … 5s 2 5p 5 |
| Электроотрицательность | 4,0 | 3,0 | 2,8 | 2,5 |
| Степени окисления | -1 | -1, +1, +3, +5, +7 | -1, +1, +3, +5, +7 | -1, +1, +3, +5, +7 |
| Агрегатное состояние | Газ | Газ | Жидкость | Твердые кристаллы |
| Цвет | Светло-желтый | Жёлто-зелёный | Буровато-коричневый | Тёмно-серый с металлическим блеском |
| Запах | Резкий | Резкий, удушливый | Резкий, зловонный | Резкий |
| T плавления | –220 о С | –101 о С | –7 о С | 113,5 о С |
| Т кипения | –188 о С | –34 о С | 58 о С | 185 о С |
Внешний вид галогенов:
Фтор
Хлор
Бром
В природе галогены встречаются в виде соединений, в основном, в виде галогенидов.
Соединения галогенов
Типичные соединения хлора:
| Степень окисления | Типичные соединения |
| +7 | Хлорная кислота HClO4 Перхлораты MeClO4 |
| +5 | Хлорноватая кислота HClO3 Хлораты MeClO3 |
| +3 | Хлористая кислота HClO2 |
| +1 | Хлорноватистая кислота HClO Гипохлориты MeClO |
| –1 | Хлороводород HCl, Хлориды MeCl |
Бром и йод образуют подобные соединения.
Способы получения галогенов
1. Получение хлора.
В промышленности хлор получают электролизом расплава или раствора хлорида натрия.
Электролиз расплава хлорида натрия.
В расплаве хлорид натрия диссоциирует на ионы:
NaCl → Na + + Cl −
На катоде восстанавливаются ионы натрия:
K(–): Na + +1e → Na 0
На аноде окисляются ионы хлора:
A(+): 2Cl − ̶ 2e → Cl2 0
Ионное уравнение электролиза расплава хлорида натрия:
2Na + + 2Cl − → 2Na º + Cl2º
Суммарное уравнение электролиза расплава хлорида натрия:
2NaCl → 2Na + Cl2
Электролиз раствора хлорида натрия.
В растворе хлорид натрия диссоциирует на ионы:
NaCl → Na + + Cl −
На катоде восстанавливаются молекулы воды:
K(–): 2H2O + 2e → H2° + 2OH −
На аноде окисляются ионы хлора:
A(+): 2Cl − ̶ 2e → Cl2 0
Ионное уравнение электролиза раствора хлорида натрия:
Суммарное уравнение электролиза раствора хлорида натрия:
2NaCl + 2H2O → H2↑ + 2NaOH + Cl2↑
В лаборатории хлор получают взаимодействием концентрированной соляной кислоты с сильными окислителями.
Или перманганатом калия:
2KMnO4 + 16HCl → 2MnCl2 + 2KCl + 5Cl2↑ + 8H2O
Бертолетова соль также окисляет соляную кислоту:
KClO3 + 6HCl → KCl + 3Cl2↑ + 3H2O
Бихромат калия окисляет соляную кислоту:
2. Получение фтора.
Фтор получают электролизом расплава гидрофторида калия.
3. Получение брома.
Бром можно получить окислением ионов Br – сильными окислителями.
2HBr + Cl2 → Br2 + 2HCl
Соединения марганца также окисляют бромид-ионы.
4. Получение йода.
Йод получают окислением ионов I – сильными окислителями.
2KI + Cl2 → I2 + 2KCl
Соединения марганца также окисляют йодид-ионы.
Химические свойства галогенов
Химическая активность галогенов увеличивается снизу вверх – от астата к фтору.
1.1. Галогены не горят на воздухе. Фтор окисляет кислород с образованием фторида кислорода:
1.2. При взаимодействии галогенов с серой образуются галогениды серы:
1.3. При взаимодействии фосфора и углерода с галогенами образуются галогениды фосфора и углерода:
1.4. При взаимодействии с металлами галогены проявляют свойства окислителей, образуя галогениды.
3Cl2 + 2Fe → 2FeCl3
Аналогичная ситуация с медью : фтор, хлор и бром окисляют медь до галогенидов меди (II),а йод до йодида меди (I):
I2 + 2Cu → 2CuI
Активные металлы бурно реагируют с галогенами, особенно с фтором и хлором (горят в атмосфере фтора или хлора).
Еще пример : алюминий взаимодействует с хлором с образованием хлорида алюминия:
3Cl2 + 2Al → 2AlCl3
1.5. Водород горит в атмосфере фтора:
С хлором водород реагирует только при нагревании или освещении. При этом реакция протекает со взрывом:
Бром также реагирует с водородом с образованием бромоводорода:
Взаимодействие йода с водородом происходит только при сильном нагревании, реакция протекает обратимо, с поглощением теплоты (эндотермическая):
1.6. Галогены реагируют с галогенами. Более активные галогены окисляют менее активные.
2. Со сложными веществами галогены реагируют, также проявляя преимущественно окислительные свойства. Галогены охотно диспропорционируют при растворении в воде или в щелочах.
2.1. При растворении в воде хлор и бром частично диспропорционируют, повышая и понижая степень окисления. Фтор окисляет воду.
Cl2 + H2O ↔ HCl + HClO
Фтор реагирует с водой со взрывом:
2.2. При растворении в щелочах хлор, бром и йод диспропорционируют с образованием различных солей. Фтор окисляет щелочи.
При взаимодействии с горячим раствором гидроксида натрия образуются хлорид и хлорат:
Еще пример : хлор растворяется в холодном растворе гидроксида кальция:
2.3. Более активные галогены вытесняют менее активные галогены из солей и галогеноводородов.
Cl2 + 2NaI → 2NaCl + I2
Cl2 + 2NaBr → 2NaCl + Br2
Еще одно свойство: более активные галогены окисляют менее активные.
Cl2 + F2 → 2Cl + F –
В свою очередь, хлор окисляет йод. При этом в растворе образуется соляная кислота и йодная кислота:
2.4. Галогены проявляют окислительные свойства, взаимодействуют с восстановителями.
Cl2 + H2S → S + 2HCl
Хлор также окисляет сульфиты:
Также галогены окисляют пероксиды:
Или, при нагревании или на свету, воду:
2Cl2 + 2H2O → 4HCl + O2 (на свету или кип.)
Галогеноводороды
Строение молекулы и физические свойства
Галогеноводороды HHal – это бинарные соединения водорода с галогенами, которые относятся к летучим водородным соединениям. Галогеноводороды – бесцветные ядовитый газы, с резким запахом, хорошо растворимые в воде.
В ряду HCl – HBr – HI увеличивается длина связи и ковалентности связи уменьшается полярность связи H – Hal.
Растворы галогеноводородов в воде (за исключением фтороводорода) – сильные кислоты. Водный раствор фтороводорода – слабая кислота.
Способы получения галогеноводородов
В лаборатории галогеноводороды получают действием нелетучих кислот на хлориды металлов.
Галогеноводороды получают также прямым взаимодействием простых веществ:
Химические свойства галогеноводородов
2HCl + CaO → CaCl2 + H2O
HCl + NaOH → NaCl + H2O
Fe + 2HCl → FeCl2 + H2
HF ↔ H + + F –
Водные растворы хлороводорода (соляная кислота), бромоводорода и йодоводорода – сильные кислоты, в разбавленном растворе диссоциируют практически полностью:
HCl ↔ H + + Cl –
3. Водные растворы галогеноводородов взаимодействуют с солями более слабых кислот и с некоторыми растворимыми солями (если образуется газ, осадок, вода или слабый электролит).
Качественная реакция на галогенид-ионы – взаимодействие с растворимыми солями серебра.
При взаимодействии соляной кислоты с нитратом серебра (I) образуется белый осадок хлорида серебра:
HCl + AgNO3 = AgCl↓ + HNO3
Осадок бромида серебра – бледно-желтого цвета:
HBr + AgNO3 = AgBr↓ + HNO3
Осадок иодида серебра – желтого цвета:
HI + AgNO3 = AgI↓ + HNO3
Фторид серебра – растворимая соль, поэтому реакция плавиковой кислоты и ее солей с нитратом серебра не является качественной.
Видеоопыты качественных реакций на хлорид-, бромид- и йодид-ионы (взаимодействие с нитратом серебра) можно посмотреть здесь.
4. Восстановительные свойства галогеноводородов усиливаются в ряду HF – HCl – HBr – HI.
Br2 + 2HI → I2 + 2HBr
А вот хлор не может вытеснить фтор из фтороводорода.
Фтороводород практически невозможно окислить.
Концентрированная соляная кислота окисляется соединениями марганца с валетностью выше II или соединениями хрома (VI).
Например : концентрированная соляная кислота окисляется оксидом марганца (IV):
Бромоводород – сильный восстановитель и окисляется соединениями марганца, хрома (VI), концентрированной серной кислотой и другими сильными окислителями:
Бромоводород реагирует с бихроматом калия с образованием молекулярного брома:
Или с оксидом марганца (IV):
Пероксид водорода также окисляет бромоводород до молекулярного брома:
Йодоводород – еще более сильный восстановитель, и окисляется другими неметаллами и даже такими окислителями, как соединения железа (III) и соединения меди (II).
2HI + 2FeCl3 → I2 + 2FeCl2 + 2HCl
или с сульфатом железа (III):
или молекулярной серой при нагревании:
2HI + S → I2 + H2S
5. Плавиковая кислота реагирует с оксидом кремния (IV) (растворяет стекло):
Галогениды металлов
Галогениды – это бинарные соединения галогенов и металлов или некоторых неметаллов, соли галогеноводородов.
Способы получения галогенидов
При взаимодействии железа с хлором образуется хлорид железа (III):
3Cl2 + 2Fe → 2FeCl3
2. Галогениды металлов можно получить при взаимодействии металлов с галогеноводородами.
Fe + 2HCl → FeCl2 + H2
3. Галогениды металлов можно получить при взаимодействии основных и амфотерных оксидов с галогеноводородами.
2HCl + CaO → CaCl2 + H2O
Еще пример : взаимодействие оксида алюминия с соляной кислотой:
4. Галогениды металлов можно получить при взаимодействии оснований и амфотерных гидроксидов с галогеноводородами.
HCl + NaOH → NaCl + H2O
Или при взаимодействии гидроксида меди (II) с соляной кислотой:
Гидроксид цинка (II) также взаимодействует с соляной кислотой:
5. Некоторые соли взаимодействуют с галогеноводородами с образованием галогенидов металлов.
HBr + NaHCO3 → NaBr + CO2↑ + H2O
Взаимодействие с нитратом серебра – качественная реакция на соляную кислоту, бромодоводород и йодоводород:
HCl + AgNO3 → AgCl↓ + HNO3
HBr + AgNO3 → AgBr↓ + HNO3
HI + AgNO3 → AgI↓ + HNO3
Химические свойства галогенидов
NaCl + AgNO3 → AgCl↓ + NaNO3
Фторид серебра – растворимая соль, поэтому реакция фторидов с нитратом серебра не является качественной.
Видеоопыты качественных реакций на хлорид-, бромид- и йодид-ионы (взаимодействие с нитратом серебра) можно посмотреть здесь.
Mg + CuCl2 → MgCl2 + Cu
Обратите внимание! В растворе более активные металлы вытесняют менее активные только если более активные металлы не взаимодействуют с водой (металлы, расположенные в ряду активности до магния). Если добавляемый металл слишком активен, то он провзаимодействует с водой, а не с солью.
Na + ZnCl2(раствор) ≠
3. Галогениды подвергаются электролизу в растворе или расплаве. При этом на аноде образуются галогены.
2KBr → 2K + Br2
При электролизе раствора бромида калия на катоде выдялется водород, а на аноде также образуется бром:
Еще пример : йодид калия окисляется соединениями меди (II) и соединениями железа (III):
4KI + 2CuCl2 → 2CuI↓ + I2↓ + 4KCl
2KI + 2FeCl3 → I2↓ + 2FeI2 + 2KCl
Еще несколько примеров восстановительных свойств галогенидов:
KI + 3H2O + 3Cl2 → HIO3 + KCl + 5HCl
Более активные галогены вытесняют менее активные из солей.
При этом галогениды металлов не горят в кислороде.
6. Нерастворимые галогениды под действием света разлагаются на галоген и металл.
2AgCl → 2Ag + Cl2
Кислородсодержащие кислоты галогенов
Рассмотрим кислородсодержащие кислоты галогенов на примере хлора:
| Степень окисления галогена | +1 | +3 | +5 | +7 |
| Формула | HClO | HClO2 | HClO3 | HClO4 |
| Название кислоты | Хлорноватистая | Хлористая | Хлорноватая | Хлорная |
| Устойчивость и сила | Существует только в растворах, слабая кислота | Существует только в растворах, слабая кислота | Существует только в растворах, сильная кислота | Сильная кислота |
| Название соответствующей соли | Гипохлориты | Хлориты | Хлораты | Перхлораты |
Хлорноватистая кислота и ее соли
Хлорноватистая кислота HClO устойчива только в разбавленном водном растворе.
Cпособ получения хлорноватистой кислоты:
1. Диспропорционирование хлора в холодной воде :
Cl2 + H2O ↔ HCl + HClO
Химические свойства хлорноватистой кислоты:
Хлорноватистая кислота HClO – это слабая кислота, но сильный окислитель.
1. Под действием ультрафиолета (на свету) хлорноватистая кислота разлагается :
2HClO → 2HCl + O2
HClO + KOH → KClO + H2O
HClO + 2HI → HCl + I2 + H2O
4. Хлорноватистая кислота диспропорционирует:
3HClO → 2HCl + НСlO3
Химические свойства солей хлорноватистой кислоты (гипохлоритов):
1. Более сильные кислоты вытесняют гипохлориты из солей.
NaClO + 2HCl → NaCl + Cl2 + H2O
Серная кислота реагирует с гипохлоритом кальция при нагревании или под действием излучения:
Даже угольная кислота вытесняет гипохлориты:
3. При нагревании гипохлориты разлагаются :
Хлористая кислота и ее соли
Хлористая кислота HClO2 – существует только в водных растворах.
Способы получения:
Хлористую кислоту можно получить окислением оксида хлора пероксидом водорода:
Химические свойства хлористой кислоты:
1. Хлористая кислота является также слабой. Реагирует с щелочами с образованием хлоритов:
2. При длительном хранении разлагается:
Хлорноватая кислота и ее соли
Хлорноватая кислота HClO3 – также существует только в водных растворах.
Способы получения:
Хлорноватую кислоту можно получить из солей хлорноватой кислоты – хлоратов.
Химические свойства хлорноватой кислоты:
1. Хлорноватая кислота – сильная кислота. Реагирует с щелочами с образованием хлоратов:
2. Хлорноватая кислота – сильный окислитель.
Химические свойства солей хлорноватой кислоты – хлоратов:
1. Хлораты – сильные окислители.
4KClO3 → 3KClO4 + KCl
В присутствии катализатора (оксид марганца (IV)) хлорат калия разлагается, окисляя кислород:
2KClO3 → 2KCl + 3O2↑
Еще пример : хлорат калия окисляет серу и фосфор:
2KClO3 + 3S → 2KCl + 3SO2
Хлорная кислота и ее соли
Хлорная кислота HClO4 – это бесцветная жидкость, хорошо растворимая в воде.
Способы получения:
Хлорную кислоту можно получить из солей хлорной кислоты – перхлоратов.
Химические свойства хлорной кислоты:
1. Хлорная кислота – сильная кислота. Реагирует с щелочами с образованием перхлоратов:
2. Хлорная кислота – сильный окислитель.
3. При нагревании хлорная кислота разлагается:
Химические свойства солей хлорной кислоты – перхлоратов:
1. Перхлораты – сильные окислители.
Еще пример : перхлорат калия окисляет алюминий: