Что такое днк биочип
Биочипы: диагноз — дело техники!
Что такое биочипы? Этим модным словом сегодня называют миниатюрные приборы для определения специфических взаимодействий биологических макромолекул. Зондами в таких чипах могут служить нуклеиновые и рибонуклеиновые кислоты (в том числе фрагменты геномной ДНК), белки и другие молекулы. За короткое время биологические микрочипы выделились в самостоятельную область анализа, имеющую массу приложений: от практических — в медицине, фармакологии, экологии, судебно-медицинской экспертизе до фундаментальных — в области молекулярной биологии и молекулярной эволюции.
Точнее всего сущность биочипов определяет их английское название — microarrays, — что означает «организованное размещение молекул на специальном носителе-платформе». В качестве платформы чаще всего используют пластинку из стекла или пластика (а иногда и из других материалов, например из кремния). В этом смысле чипы биологические близки к чипам электронным, которые изготовляются на кремниевых пластинах.

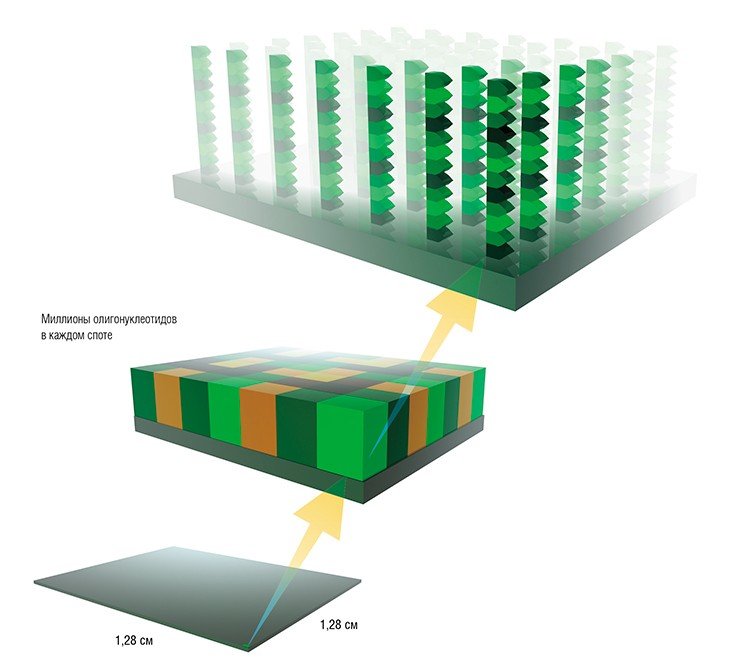
Микрочиповая диагностика основана на установлении факта так называемого лиганд-рецепторного взаимодействия. Один из взаимодействующих партеров — лиганд, или рецептор, — иммобилизуется на небольшой, но строго определенной, поверхности микрочипа, которую называют спот. (Поверхность микрочипа в ряде случаев может быть структурирована, например, микроячейками (нанопланшеты) или микроэлектродами.)
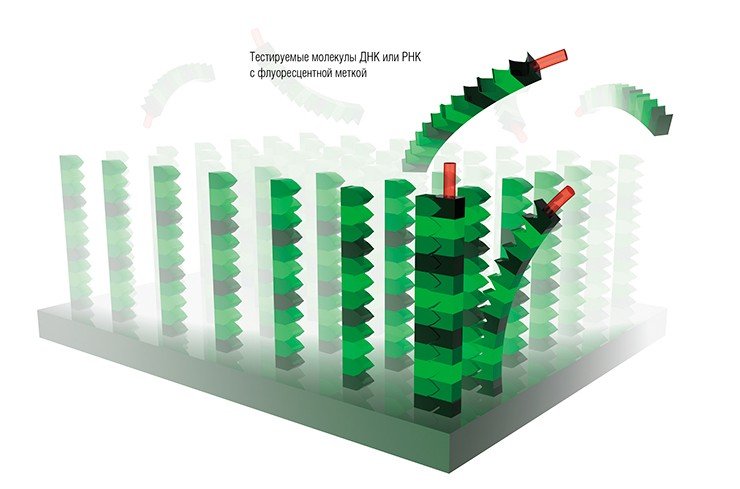
Каждый спот состоит из идентичных молекул. При анализе исследуемый образец наносится на микрочип, а затем фиксируется факт его взаимодействия с молекулами, содержащимися в определенных спотах микрочипа. Результатом этого взаимодействия является характерная модель (паттерн) взаимодействия образца с микрочипом.
Нередко для фиксирования факта взаимодействия рецептора с лигандом используется флуоресценция. Для этого еще до инкубации с микрочипом анализируемый образец метится флуоресцентной меткой. После инкубации микрочип сканируется лазерным сканером, чтобы можно было получить картину распределения интенсивности флуоресценции на его поверхности. Подобным образом выявляются споты, молекулы-зонды которых вступили в реакцию с молекулами исследуемого образца.
Если условия молекулярной комплементарности, необходимые для возникновения соответствий между иммобилизованными молекулярными зондами и мечеными анализируемыми молекулами в растворе, являются подходящими, то образующиеся комплексы будут наиболее термодинамически устойчивы. В результате при определенных температурах этих комплексов будет больше, чем тех, которые образованы с нарушением условий комплементарности, и им будет отвечать более сильный сигнал флуоресценции.
Изучаем профили. экспрессии
Наиболее разработанной на сегодняшний день можно назвать технологию олигонуклеотидных* биочипов, массовое применение среди которых получили так называемые экспрессионные чипы.
Чтобы понять принцип их работы, обратимся к рассмотрению регуляции жизнедеятельности наших клеток. Процессами внутреннего метаболизма клеток, их делением и дифференцировкой управляет сложная сеть молекулярных взаимодействий, которая и определяет уровень экспрессии (функционирования) различных генов. Показателем последней служит концентрация соответствующей матричной РНК (мРНК), которая синтезируется на ДНК — носителе наследственной информации. Динамика изменения концентрации определенной мРНК указывает на включение или выключение конкретного гена, а значительные отклонения этого показателя от нормы могут свидетельствовать о наличии различных заболеваний.
Изготовить биологические чипы можно различными способами. Молекулы-зонды, присоединенные к платформе микрочипа, можно либо непосредственно синтезировать на самом микрочипе, стартуя с первого звена, ковалентно присоединенного к поверхности, либо синтезировать вне микрочипа, а затем уже связать их с подложкой-платформой. Первый способ применяется при создании химических «библиотек», в которых в качестве зондов используются короткие олигонуклеотиды или пептиды; второй — для иммобилизации протяженных полинуклеотидов или белков, а также других крупных рецепторных молекул.
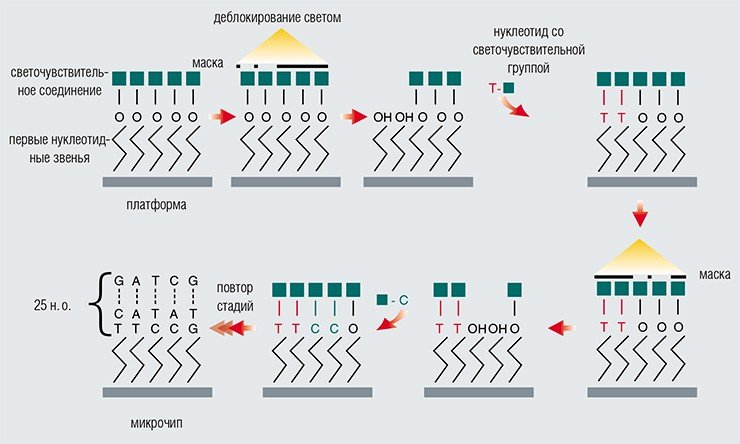
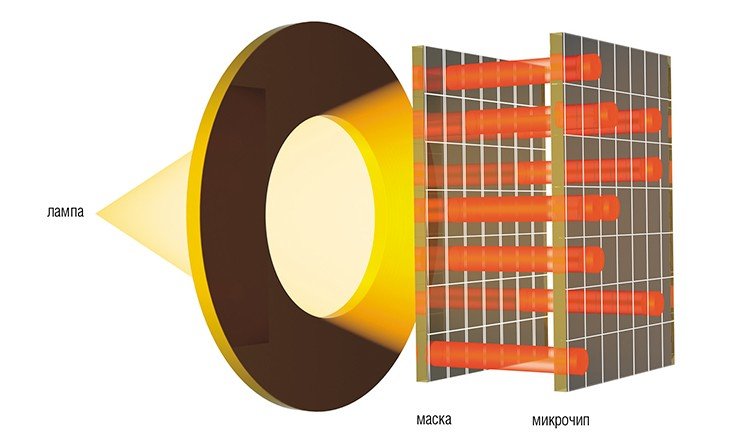
Одна из крупнейших фирм по производству биочипов — американская компания Affymetrix — применяет для производства биочипов способ конструирования, созданный для электронных чипов. Чипы Affymetrix готовятся на стеклянной пластинке-платформе методом фотолитографии с использованием специальных микромасок. Применение хорошо отработанных методов электронной промышленности позволило добиться впечатляющих результатов: на одном таком чипе могут располагаться миллионы различных спотов (участков, содержащих одинаковые молекулы-зонды) размером всего лишь в несколько микрон
Существующее в профилях генной экспрессии разнообразие находится в фокусе внимания ученых по причине его биологического и клинического значения. И в этом смысле возможности технологии микрочипов оказались очень полезными при исследовании такого сложного заболевания, как рак. Эта технология позволяет одновременно отслеживать экспрессию десятков тысяч генов, создавая, таким образом, своеобразный молекулярный «портрет» клетки. Уже сегодня, изучая профили генной экспрессии в клетке, можно ставить диагноз, определять группу риска и давать прогноз развития многих видов раковых заболеваний.
В настоящее время для постановки диагноза больным раком требуется проведение совместной экспертизы специалистов-практиков: онкологов, патологов и цитогенетиков. Однако окончательные выводы могут значительно варьироваться в зависимости от таких субъективных факторов, как уровень квалификации экспертов и примененные ими методологические подходы. Используя же микрочипы, можно и вовсе отказаться от услуг многих специалистов, намного повысив точность постановки диагноза и определения прогноза.
В существующих экспрессионных биочипах используется иммобилизованная ДНК двух типов: во-первых, относительно короткие синтетические фрагменты ДНК длиной 20—60 нуклеотидов, которые соответствуют определенным участкам конкретного гена (при этом каждый ген характеризуется 20—40 спотами с различными зондами); во-вторых, крупные фрагменты кодирующей ДНК длиной 100—600 нуклеотидов, получаемые ферментативным способом (так называемые кДНК-микрочипы).
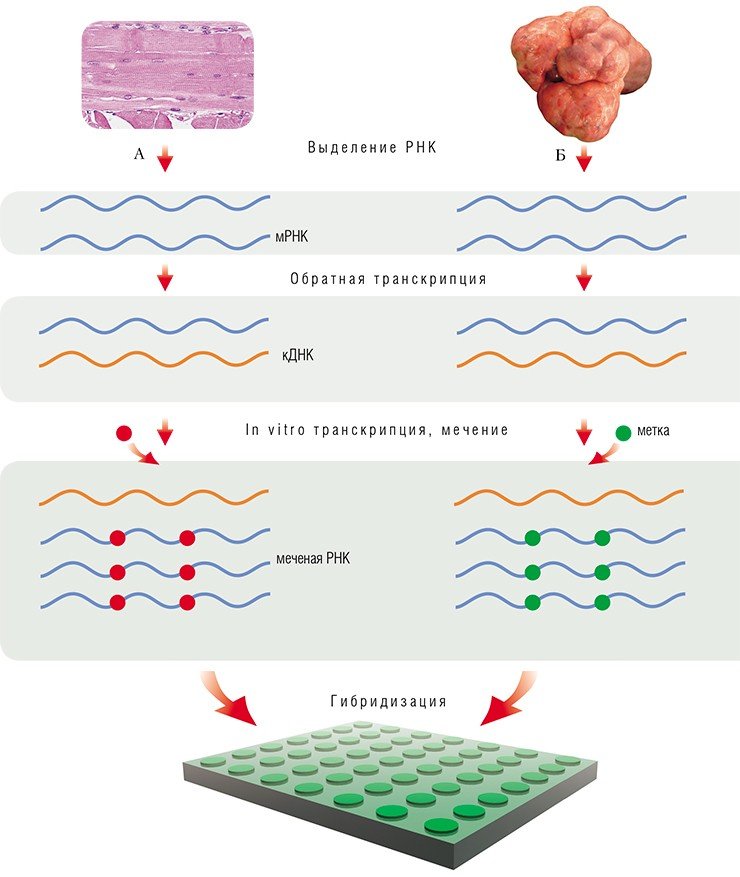
Процедура подготовки образца для анализа на микрочипах включает в себя выделение суммарной РНК, на основе которой посредством реакции обратной транскрипции синтезируют цепи кодирующей ДНК. Из каждой молекулы такой кДНК с помощью фермента Т7 РНК-полимеразы можно получить множество копий РНК. Как правило, образующися молекулы РНК при этом одновременно метятся флуоресцентной меткой (для этого при синтезе используются меченые нуклеотиды).
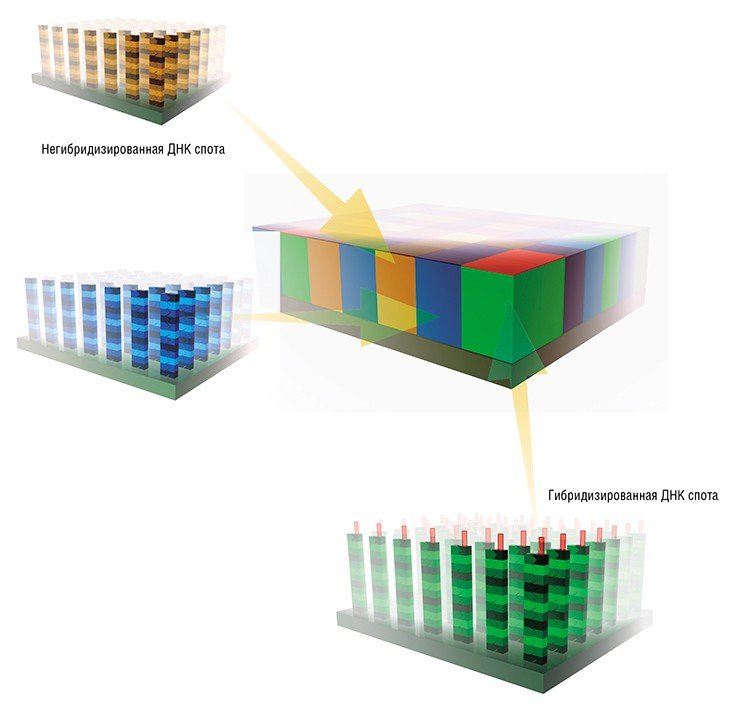
В работе с олигонуклеотидными микрочипами для мечения образца получаемой РНК часто употребляют флуоресцентную метку одного типа, а уровни экспрессии генов определяют, сравнивая получаемые флуоресцентные сигналы с сигналами внутренних контрольных точек микрочипа.
При работе же с микрочипами на основе кДНК, как правило, необходимы две метки: контрольный образец (взятый из нормальных клеток) метят одним флуоресцентным красителем, исследуемый образец (взятый, например, из раковой опухоли) — другим; далее их смешивают и гибридизуют с одним микрочипом. По соотношению сигналов от двух разных меток в каждой ячейке микрочипа судят о повышении или понижении уровня экспрессии данного гена при заболевании.
Болезнь, эволюция, преступление.
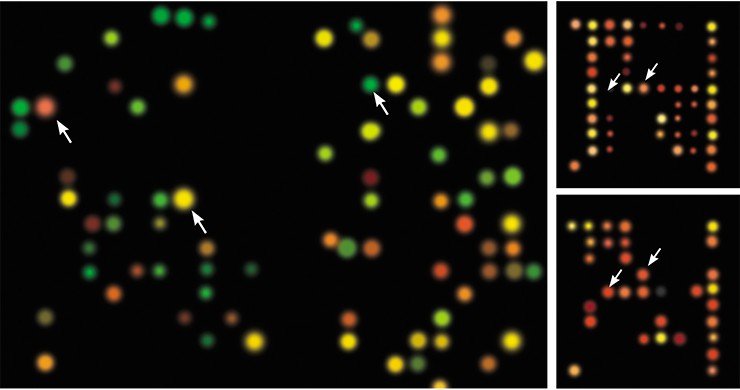
В каждом эксперименте с биочипами можно получить данные относительно уровня экспрессии десятков и сотен тысяч генов. Для обработки такого объема информации используется довольно сложный математический аппарат, и в первую очередь кластерный анализ.
По результатам подобного анализа выявляются группы генов, изменение в уровне экспрессии которых является свидетельством наличия конкретного заболевания. В дальнейшем для диагностики пациентов применяется анализ деятельности именно этих генов. При этом может выясниться, что болезнь, ранее диагностированная как определенный вид рака, на самом деле представляет собой сразу несколько одновременно протекающих заболеваний.
Используя экспрессионные микрочипы, можно не только изучать молекулярные механизмы различных заболеваний, но и проверять воздействие лекарственных соединений на человека (причем показания и противопоказания по применению препаратов можно определить для каждого индивидуума отдельно), а также оценивать отклик организма на влияние самых разнообразных внешних факторов.
Кроме того, олигонуклеотидные микрочипы находят широкое применение при анализе геномного полиморфизма (разнообразия). Известно, что геномные последовательности ДНК для конкретных живых организмов, как правило, несколько отличаются от тех, которые приведены в базах данных. Эти различия обусловлены, прежде всего, точечными мутациями, вставками и делециями (потерей) нуклеотидов и т. п. Подобные различия в носителе наследственной информации приводят, в свою очередь, к внутривидовому различию организмов, а их накопление — к расхождению видов. Таким образом, изучение геномного полиморфизма с помощью микрочипов может способствовать раскрытию одного из важнейших механизмов молекулярной эволюции.
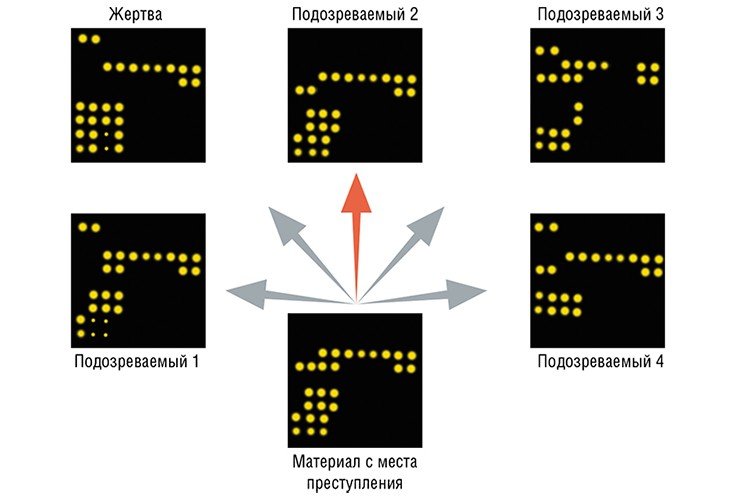
Еще одна область приложения технологии биочипов — изучение мутаций в геноме патогенных агентов, позволяющее точно определить вид бактерий или вирусов. Для этого протяженные фрагменты геномной ДНК или РНК патогена гибридизируют с микрочипом, содержащим специальные олигонуклеотидные зонды.
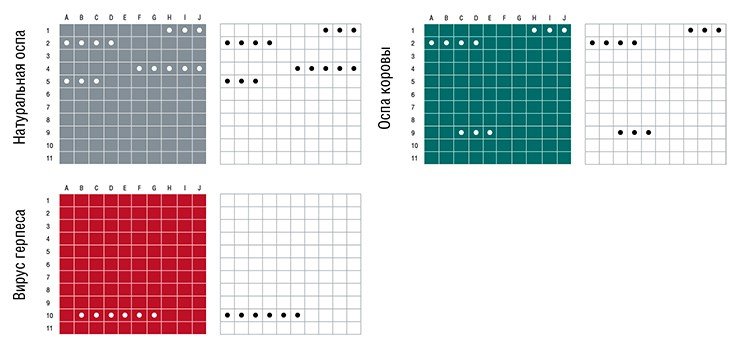
Например, наша лаборатория совместно с Лабораторией разработки методов (Вашингтон) предложила микрочиповый метод обнаружения и классификации опасных для человека ортопоксвирусов. К наиболее опасным для человека ортопоксвирусам принадлежат вирусы натуральной оспы и оспы обезьян. Менее опасны для человека вирусы оспы коров, верблюдов и осповакцины, но и они также способны вызывать заболевания. Несмотря на то что вирус натуральной оспы был искоренен в 70-е гг. прошлого столетия, существует вероятность его нового появления в человеческой популяции: источником возбудителя инфекционных заболеваний могут быть либо вскрытые могильники, либо биотеррористы, которые распространяют его целенаправленно. Поскольку большая часть населения планеты сейчас не имеет иммунитета к этому вирусу, заражение натуральной оспой привело бы к катастрофическим последствиям.
Разработанный нами микрочип способен диагностировать опасные для человека виды ортопоксвирусов. Кроме того, клиническая картина больных ортопоксвирусами очень сходна с клинической картиной больных, пораженных герпесвирусами 1, 2 и 3 типов. Наш микрочип способен отличить тех, кто заражен ортопоксвирусами, от тех, кто поражен вирусами герпеса. Это очень важно, поскольку заболевания, о которых идет речь, несмотря на внешнее сходство клинических проявлений требуют разного лечения.
В Глазном центре Келлога при Мичиганском университете был создан микрочип для диагностики пигментного ретинита — сложного заболевания глаз, которое приводит к слепоте. А с помощью микрочипа arRP-1, разработанного в том же центре, можно выявить 180 мутаций в нуклеотидных последовательностях 11-ти генов, вызывающих дегенерацию сетчатки при этом заболевании.
Отдельный интерес представляют собой исследования мутаций в геномах болезнетворных бактерий, способствующих появлению устойчивости к антибиотикам. Так, по данным ВОЗ, в настоящее время в России ежегодно туберкулезом заболевает примерно 100 тыс. человек (а всего в мире от этой болезни умирает около 3 млн человек в год), при этом особо опасным представляется быстрое распространение среди населения форм туберкулеза, устойчивых к лечению стандартными антибиотиками типа рифампицина.
Вот почему так важно провести раннюю диагностику туберкулеза и выявить устойчивые к антибиотикам формы туберкулеза. С этой целью в Институте молекулярной биологии им. Энгельгардта были созданы диагностические варианты биочипов, которые позволяют осуществлять экспресс-диагностику туберкулеза и вместе с тем обнаруживать его лекарственно-устойчивые формы. Время анализа при этом существенно понижается: с 60 (стандартный анализ) до 1 дня. Это позволяет оперативно назначать резервные терапевтические средства тем больным (а их число среди больных превышает 10 %), у которых обнаружены устойчивые к лекарствам формы туберкулеза.
Биочипы могут найти практическое применение и в области, весьма далекой от медицины, а именно в судебной практике: для идентификации и опознания личности. В этом случае при проведении анализа используются нуклеотидные последовательности самых изменчивых участков ДНК митоходрий человека.
Наряду с ДНК-микрочипами, широкую известность приобрели белковые микрочипы, роль молекул-зондов в которых играют пептиды или целые белки. С помощью таких микрочипов можно исследовать взаимодействия белок-белок, белок-ДНК и т. п. Чаще всего конструируются белковые микрочипы, содержащие антитела, которые служат для специфической диагностики патогенов.
Кроме того, существуют и другие виды микрочипов: химические микрочипы, которые включают в себя настоящие комбинаторные «библиотеки» небольших химических соединений: благодаря им можно проводить одновременный скрининг тысяч потенциальных лекарственных средств; микрочипы, которые содержат образцы биологической ткани и используются для одновременного анализа тысяч образцов тканей: они применяются при определении содержания белков в здоровых и патологически измененных тканях, а также при оценке потенциальных мишеней для лекарственных препаратов.
Как же можно оценить внедрение биочипов в научную и медицинскую практику в целом? Безусловно, развитие новых технологий приведет (и уже приводит) к небывалому качественному скачку в этих областях.
И неудивительно: ведь эти миниатюрные устройства, содержащие в своем составе миллионы спотов с самыми разными молекулами-анализаторами, в принципе способны одновременно отслеживать работу всех генов человека. Их использование открывает широкие горизонты для исследований, направленных на более глубокое понимание основ функционирования организмов в нормальном и патологическом состояниях, а также на создание принципиально новых лекарств. Наше здоровье и здоровье будущих поколений во многом является «делом техники» — и оптимизм вызывает тот факт, что новые технологии становятся доступными уже сегодня.
* Олигонуклеотиды — относительно короткие (длиной несколько десятков нуклеотидов) фрагменты ДНК.
Биочипы – высокие технологии в медицинской диагностике
Открытие функционального значения тысяч генов и молекулярных механизмов действия множества ферментов стало революционным событием в биологии, оказавшим и продолжающим оказывать огромное влияние на развитие медицины XXI в. Перед учеными и медиками открылись уникальные возможности для выяснения причин многих инфекционных и наследственных заболеваний, а также разработки эффективных методов их лечения. В свою очередь, развитие новых диагностических методов потребовало и создания новых технологий многопараметрического анализа биологических образцов, с помощью которых можно одновременно исследовать множество белковых и ДНК-маркеров различных заболеваний, функционально-значимых биологических макромолекул и их комплексов. Так появилась технология биологических микрочипов, способных, подобно микрочипам электронным, извлекать и обрабатывать огромные массивы информации из одного небольшого образца биологического материала, полученного от конкретного пациента
За последние десятилетия был накоплен огромный объем знаний о молекулярных основах биохимических процессов в живых организмах. Это дало возможности не только точно диагностировать то или иное заболевание, но и оценить вероятность его возникновения еще до проявления у пациента клинических симптомов, а также подобрать эффективную терапию. Подавляющую часть такой информации получают с помощью лабораторной диагностики, на которую в мире ежегодно расходуется свыше 100 млрд долларов. В России в 1970 г. она насчитывала 81 биохимический / молекулярный тест, в 2000 г. – 170, а сегодня число тестов измеряется тысячами!
Большинство важнейших современных методов молекулярной диагностики основано на анализе данных, полученных при исследовании структуры геномов человека и микроорганизмов. В первую очередь речь идет о полимеразной цепной реакции (ПЦР). Обычно ДНК содержится в образцах в минимальных количествах, однако с помощью ПЦР можно в миллионы раз «размножить» в исследуемой пробе биоматериала определенные фрагменты этих макромолекул. «Мишенями» могут служить бактериальные или вирусные гены, генетические маркеры раковых опухолей и т. п. С помощью этого метода можно определить наличие, к примеру, возбудителя болезни, даже если в пробе присутствует всего несколько молекул его ДНК.
В 2011 г. Национальная ассоциация фтизиатров России наградила ИМБ РАН кубком и дипломом «Лучший инновационный проект» за разработку молекулярно-генетической технологии биологических микрочипов и создание тест-системы для диагностики туберкулеза на ее основе. Согласно расчетам, выполненным ФГУ «Центральный НИИ организации и информатизации здравоохранения», «…экономия бюджетных средств при внедрении технологии биочипов для диагностики туберкулеза и определения лекарственной чувствительности возбудителя составляет не менее 70 рублей на каждый вложенный рубль» (Министерство здравоохранения и социального развития РФ, 2009)
Однако возможности методов, базирующихся на ПЦР, ограничены в случае, когда речь идет об одновременном анализе десятков и сотен различных биомаркеров. И здесь на первый план выходит уже успешно зарекомендовавшая себя технология биологических микрочипов (биочипов). Достоинство этой технологии в том, что тест проводится в формате «один образец – один реакционный объем биочипа», т. е. образец не нужно разделять на несколько частей и их отдельно анализировать. Такой формат намного повышает чувствительность анализа и снижает его трудоемкость и стоимость, что дает возможность клинико-диагностическим лабораториям тестировать десятки и сотни образцов за одну рабочую смену.
Сегодня ведущие научные журналы регулярно публикуют обзоры, посвященные биологическим микрочипам, которые производят многие десятки компаний, а объем продаж составляет сотни миллионов долларов в год. Вместе с тем сама идея создания биочипов родилась лишь четверть века назад, и одним из мест рождения этой технологии стал Институт молекулярной биологии им. В. А. Энгельгардта Российской академии наук.
С самого начала подход российских исследователей отличался удачным выбором ключевых технологических решений, благодаря которым технологии биочипов ИМБ РАН продолжают оставаться конкурентоспособными в мировой науке. Многие из этих подходов (например, замена радиоактивных меток на флуоресцентные, применение гидрогеля и элементов сферической формы) стали использовать в своей работе другие исследователи, занимающиеся разработкой биочипов. А с 2000 г. в ИМБ РАН при поддержке Международного научно-технического центра начались работы по созданию биочипов для медицинской диагностики возбудителей социально значимых заболеваний.
Биочипы в деле
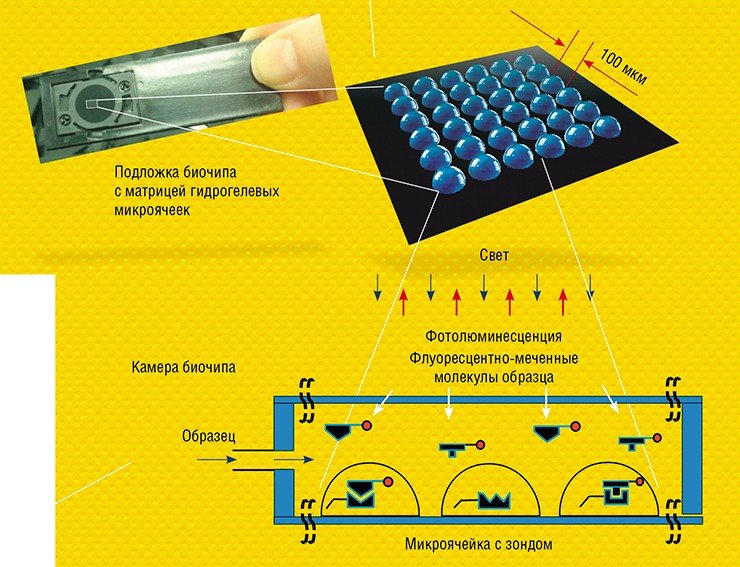
Главным элементом любого биочипа служит матрица из сотен и тысяч микроячеек, каждая из которых содержит так называемые молекулярные зонды – молекулы, способные специфично связываться только со строго определенными биологическими молекулами или их фрагментами. Зондами могут служить олигонуклеотиды, участки геномной ДНК, РНК, антитела, олигосахариды, различные низкомолекулярные соединения и др. Каждая ячейка биочипа служит своего рода отдельной «нанопробиркой», где иммобилизованный зонд распознает в анализируемом образце только свою мишень. Таким образом удается проводить параллельное распознавание сразу множества мишеней, например, генов, ответственных за лекарственную устойчивость возбудителя болезни.
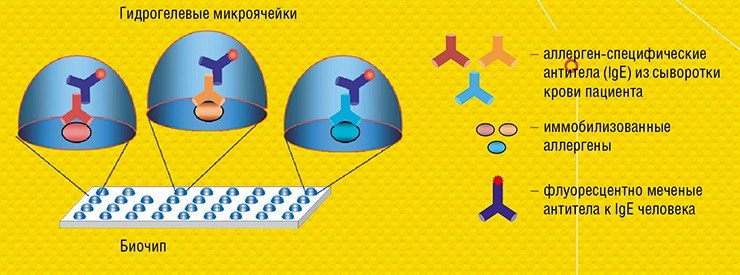
Принципиальное отличие технологии матричных биочипов, разработанной в ИМБ РАН, в том, что зонды располагаются не на плоской подложке, а в заполимеризованных «каплях» гидрогеля полусферической формы. Размещение молекулярных зондов в трехмерном объеме, а не на плоскости, дает ряд существенных преимуществ. Оно позволяет в десятки и сотни раз увеличить емкость биочипа на единицу поверхности и, соответственно, чувствительность измерений. Кроме того, гель – насыщенное водой желеобразное вещество, исключает возможность взаимодействия зондов друг с другом и с твердой поверхностью подложки, а также обеспечивает отличную изоляцию отдельных ячеек на биочипе.
РОССИЯ – ПИОНЕР «БИОЧИПОСТРОЕНИЯ» Большие матрицы с ДНК и белками, иммобилизованными на фильтре или зафиксированными в лунках планшета, были известны достаточно давно. Но идея о создании микрочипов современного формата появилась лишь в конце прошлого века. Первая работа по ДНК-микрочипам и одна из первых – по белковым чипам были опубликованы группой академика А. Д. Мирзабекова из московского Института молекулярной биологии им. В. А. Энгельгардта АН СССР (Khrapko et al., 1989; Arenkov et al., 2000).
Эта революционная идея родилась как предложение для нового метода секвенирования ДНК с использованием гибридизации – процесса объединения двух комплементарных одноцепочечных молекул ДНК в двуцепочечную. Работы по совершенствованию методик секвенирования были стимулированы все более возраставшим интересом к проблеме расшифровки генома человека.
В то время в научной среде широко дискутировался вопрос, должна ли эта задача решаться масштабированием существующих подходов или нужно разрабатывать новые, более эффективные. Ученые сначала пошли по первому пути. Так, в 1977 г. появился «метод Сенгера», основанный на ферментативном синтезе комплементарной последовательности ДНК на матрице анализируемой одноцепочечной ДНК, а его разработчики получили в 1980 г. Нобелевскую премию. В своей нобелевской речи один из лауреатов, американский биохимик У. Гилберт, отметил, что «идея метода пришла только после второго визита А. Мирзабекова» в его лабораторию (Gilbert, 1984).
При секвенировании гибридизацией «расшифровка» ДНК идет не отдельными буквами-нуклеотидами, а «словами» определенной величины, и такой словарь может содержать тысячи слов. Стала очевидной необходимость создания микрочипов: в это время и вышла первая статья ученых из ИМБ, где были описаны приготовление и свойства гелевых микрочипов (Khrapko et al., 1989).
Технология производства гелевых биочипов прошла несколько этапов развития. Технология первого поколения, еще достаточно громоздкая и несовершенная, была разработана и запатентована в ИМБ в 1989—1993 гг., а впоследствии реализована в совместной лаборатории, организованной институтом и Аргоннской национальной лабораторией (США), и лицензирована американскими компаниями Motorola и Packard Instruments. Однако из-за технологических проблем фирмы стали производить биочипы, матрица которых представляла собой поверхность, сплошь покрытую полиакриламидным гелем.
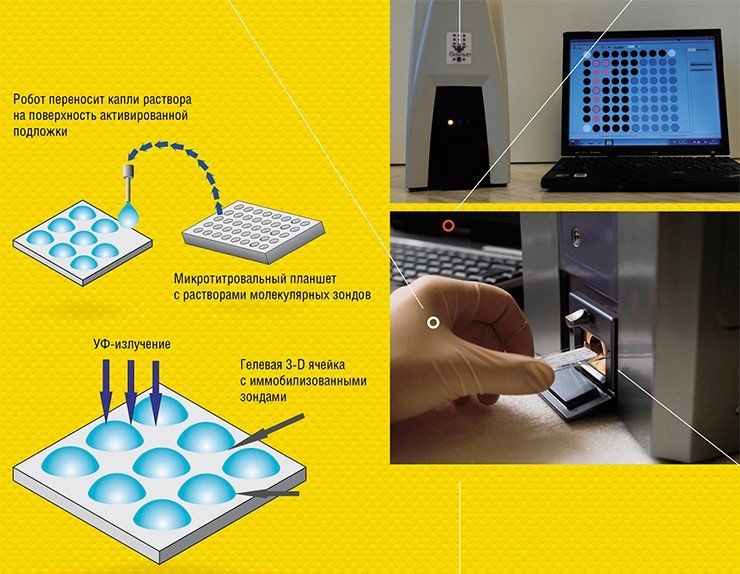
В ИМБ РАН технология гелевых биочипов продолжала развиваться. Современная, достаточно простая, универсальная и дешевая технология позволяет производить даже в лабораторных условиях сотни и тысячи олигонуклеотидных, ДНКовых или белковых микрочипов в день (Колчинский и др., 2004)
Для регистрации результатов анализа используют флуоресцентные метки, которые вводят в молекулы образца. Если зонд специфично распознает и свяжется с мишенью, в ячейке возникает флуоресценция. Интенсивность свечения ячеек биочипа измеряется с помощью специальных аппаратно-программных комплексов-анализаторов, которые и выдают отчет о присутствии в исследуемом образце специфичных молекулярных мишеней, информирующих о наличии микроорганизмов или генных мутаций, онкомаркеров или аллергенов и т. п.
Оригинальная технология создания таких гелевых чипов, разработанная в ИМБ РАН, была запатентована и сертифицирована по европейским стандартам. Биочипы, созданные по этой технологии, занимают отдельную нишу диагностических микроматриц и применяются в российских клиниках. Коммерческие микроматрицы, произведенные ведущими научно-производственными корпорациями Германии и США применяются, в основном, в исследовательских целях.
Туберкулез и лекарственная устойчивость
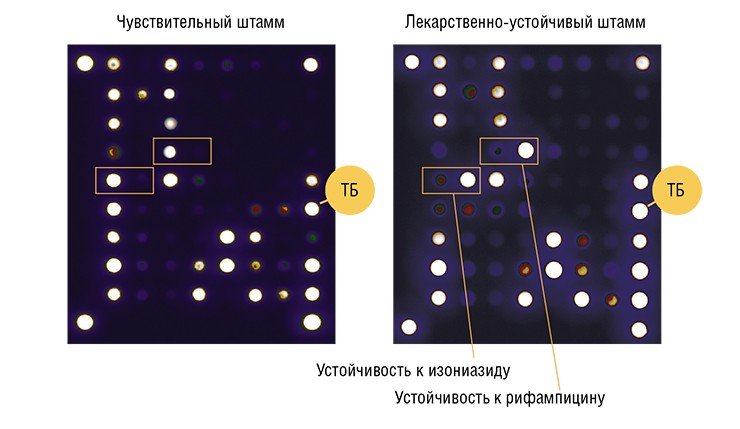
Первой в мире тест-системой на основе биочипов, зарегистрированной для медицинского применения, стал разработанный в ИМБ в 2004 г. набор «ТБ-Биочип‑1». С его помощью можно определить наличие в геноме микобактерии туберкулеза 47 мутаций, приводящих к устойчивости к двум основным противотуберкулезным препаратам – рифампицину и изониазиду.
Тест-системами серии «ТБ-Биочип» и оборудованием для их анализа были оснащены 20 учреждений противотуберкулезной службы РФ и 8 бактериологических лабораторий Федеральной службы исполнения наказаний. Число излеченных больных с лекарственно-устойчивым туберкулезом увеличилось по меньшей мере в 3 раза при ранней постановке диагноза с использованием биочипов в отличие от диагностики традиционными методами (Gryadunov et al., 2011). В этом случае огромную роль играет такой фактор, как время анализа: в первом случае для диагностики достаточно нескольких часов, тогда как выращивание микобактерий на средах с разными противотуберкулезными препаратами занимает 2—3 месяца
Почему внимание исследователей привлек именно туберкулез? Дело в том, что многие десятилетия для борьбы с этой болезнью использовали комбинированное лечение сразу несколькими химиопрепаратами, чтобы повысить его эффективность. При монотерапии больные быстро приобретали устойчивость к лекарству. Однако такая стратегия привела к тому, что уже в конце прошлого века в мире, в том числе и в России, начал повсеместно распространяться туберкулез со множественной лекарственной устойчивостью. Именно этот фактор в наши дни чаще всего является причиной неудачного исхода лечения и возникновения рецидива болезни, от которой ежегодно в мире умирает более 3 млн человек.
Изониазид и рифампицин относятся к популярным и наиболее эффективным препаратам первого (основного) ряда. И если выделенный от пациента возбудитель окажется устойчивым к этим лекарствам, нужно обращаться к химиопрепаратам второго (резервного) ряда, к которым будет чувствительна эта бактериальная популяция. Сегодня одними из наиболее перспективных препаратов для лечения таких форм туберкулеза являются фторхинолоны. Поэтому следующей тест-системой в ряду диагностических тестов ИМБ стал «ТБ-Биочип‑2», с помощью которого можно выявить лекарственную устойчивость к различным классам этих препаратов (Грядунов и др., 2009).
Все более широкое распространение форм туберкулеза со множественной лекарственной устойчивостью явилось стимулом для дальнейшей «эволюции» тест-системы. Требовалось, во‑первых, максимально охватить весь спектр генетически детерминированной резистентности к широкому ряду противотуберкулезных препаратов. Во-вторых, возникла необходимость определять генотип и соответственно принадлежность выделенного штамма к основным семействам, циркулирующим на территории РФ, что важно не только для эпидемиологического мониторинга структуры популяции возбудителей туберкулеза, но и для назначения адекватной терапии.
Так в 2012—2013 гг. в результате масштабных геномных исследований был создан не имеющий мировых аналогов набор реагентов «ТБ-ТЕСТ», позволяющий одновременно идентифицировать 120 генетических локусов, отвечающих за развитие устойчивости к препаратам первой и второй «линии обороны»: рифампицину, изониазиду, этамбутолу, фторхинолонам и инъекционным препаратам (амикацину и капреомицину) (Zimenkov et al., 2016). Такая диагностика позволяет дифференцированно назначать высокие дозы химиопрепаратов или, напротив, удалять те или иные лекарства из схем терапии.
Чтобы получить государственную регистрацию в Росздравнадзоре, тест-система прошла все виды испытаний и экспертиз и с 2014 г. разрешена к применению в медицинской практике РФ. В настоящее время «ТБ-ТЕСТ» приходит на смену наборам «ТБ-Биочип».
От гепатита до рака и аллергий
Еще одной актуальной проблемой мирового здравоохранения является лечение больных гепатитом С. Возбудитель этого вирусного заболевания может долгое время размножаться в печени, ничем не выдавая себя, а первые признаки болезни обнаруживаются лишь спустя пару месяцев после заражения. Еще недавно гепатит С считался практически неизлечимой болезнью, а основным терапевтическим средством служила комбинация из интерферона и рибавирина, которая зачастую оказывалась неэффективной и имела много негативных побочных эффектов.
Сегодня созданы новые антивирусные препараты, обладающие так называемым прямым противовирусным действием и блокирующие ключевые внутриклеточные этапы размножения возбудителя. Но вся сложность в том, что вирус гепатита С имеет 7 вариантов генотипа, при этом каждый генотип имеет еще несколько подтипов. Более того, разные генотипы/подтипы обладают и разной чувствительностью к традиционным и новым препаратам, и выбор противовирусной терапии должен проводиться в соответствии с генотипическими особенностями возбудителя.
В ИМБ РАН совместно с лабораторией вирусологии госпиталя Университета г. Тулузы (Франция) был разработан и запатентован не имеющий мировых аналогов подход, основанный на использовании платформы гидрогелевых биочипов для типирования вируса гепатита С на основе анализа области NS 5B вирусного генома. Тест-система «HCV-БИОЧИП», способная определять 6 генотипов и 36 подтипов этого вируса, успешно прошла клинические испытания в России и Франции (Gryadunov et al., 2011).
Важнейшим направлением приложения технологии гидрогелевых биочипов служит анализ мутаций и полиморфизмов ДНК самого человека: ДНК-маркеров, ассоциированных с возникновением различных неинфекционных заболеваний.
Среди онкологических заболеваний у детей ведущее место занимают лейкозы. Тест-система «ЛК-БИОЧИП» способна идентифицировать в образцах крови 13 наиболее клинически значимых хромосомных транслокаций (переносов фрагмента одной хромосомы на другую), характерных для некоторых типов острых и хронических лейкозов. Каждая из этих транслокаций определяет свой вариант развития лейкоза и важна для выбора стратегии лечения. Эта тест-система применяется в Национальном научно-практическом центре детской гематологии, онкологии и иммунологии им. Дмитрия Рогачева (Москва), где анализируются образцы из 18 региональных гематологических центров РФ (Gryadunov et al., 2011).
Для ранней диагностики рака молочной железы и яичников создана тест-система «РМЖ-БИОЧИП», которая позволяет определять мутации в генах BRCA1/2, ассоциированные с высокой (до 80 %) вероятностью возникновения наследственных форм этих заболеваний.
В настоящее время в ИМБ РАН разрабатываются варианты тест-систем на основе биочипов для определения чувствительности злокачественных клеток к противоопухолевой терапии. Например, с помощью биочипа для индивидуального подбора препаратов, эффективно воздействующих на молекулярные мишени в опухолевых клетках меланомы, можно выявить мутации генов, которые определяют целесообразность использования таких препаратов таргетной («молекулярно-прицельной») терапии поздних стадий и рецидивов меланомы, как траметиниб, иматиниб и вемурафениб (Emelyanova et al., 2017).
Трехмерная структура гидрогеля, в котором на биочипах зафиксированы молекулярные зонды, позволяет сохранить без изменений достаточно «чувствительную» нативную структуру белковых молекул. Поэтому такие биочипы можно использовать также для исследования белок-белковых взаимодействий, что требуется, к примеру, при проведении различных видов иммунохимического анализа.
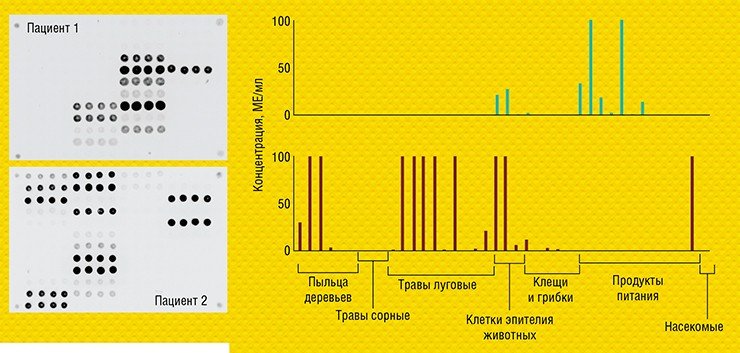
В ИМБ РАН удалось перевести такой классический анализ в формат микрочипа и адаптировать его для диагностики аллергических заболеваний. Совместно с германской биотехнологической компанией Dr. Fooke Laboratorien GmbH, предоставившей наборы природных и рекомбинантных аллергенов, была разработана и запатентована тест-система «АЛЛЕРГО-БИОЧИП» для параллельного количественного определения больших панелей аллерген-специфичных антител Е и G4 в сыворотке крови (Feyzkhanova et al., 2017).

Двенадцать специализированных тест-систем, созданных на основе технологии гидрогелевых биочипов в ИМБ РАН, получили разрешение к применению как медицинские изделия для лабораторной диагностики. Эти тест-системы успешно используются более чем в 50 научно-исследовательских и медицинских центрах РФ, стран СНГ и ЕС.
Технологии биочипов, разработанные в ИМБ РАН, защищены 42 отечественными и международными патентами. И эти технологии продолжают интенсивно развиваться. Разрабатываются новые подходы, позволяющие упростить и ускорить методики, интегрировать в единую процедуру все стадии проведения анализа: от обработки биологического образца до количественной идентификации в режиме реального времени.
Ядро системы – гидрогелевый биочип – будет в дальнейшем модифицироваться в зависимости от назначения диагностического теста, в то время как остальные компоненты уже сейчас являются унифицированными. Такие «лаборатории на чипе» позволят значительно улучшить качество лабораторной диагностики, снизить вероятность заражения медперсонала и в конечном счете повысить эффективность и сократить стоимость лечения.
Грядунов Д. А., Зименков Д. В., Михайлович В. М. и др. Технология гидрогелевых биочипов и ее применение в медицинской лабораторной диагностике // Медицинский алфавит. 2009. № 3. С. 10—14.
Заседателев А. С. Биологические микрочипы для медицинской диагностики // Наука и технологии в промышленности. 2005. № 1. С. 18—19.
Колчинский А. М., Грядунов Д. А., Лысов Ю. П. и др. Микрочипы на основе трехмерных ячеек геля: история и перспективы // Молекулярная биология. 2004. Е. 38 № 1. С. 5—16.
Arenkov P., Kukhtin A., Gemmell A., et al. Protein microchips: use for immunoassay and enzymatic reactions // Analytical Biochemistry. 2000. V. 278. N. 2. P. 123—131.
Emelyanova M., Ghukasyan L., Abramov I. et al. Detection of BRAF, NRAS, KIT, GNAQ, GNA11 and MAP2K1/2 mutations in Russian melanoma patients using LNA PCR clamp and biochip analysis // Oncotarget. 2017. V. 32. N. 8. P. 52304—52320.
Feyzkhanova G., Voloshin S., Smoldovskaya O. et al. Development of a microarray-based method for allergen-specific IgE and IgG4 detection // Clinical proteomics. 2017. doi: 10.1186/s12014-016-9136-7.
Gryadunov D., Dementieva E., Mikhailovich V. et al.Gel-based microarrays in clinical diagnostics in Russia // Expert review of molecular diagnostics. 2011. N. 11 P. 839—853.
Khrapko K. R., Lysov Yu. P., Khorlyn A. A. An oligonucleotide hybridization approach to DNA sequencing // FEBS Letters. 1989. V. 256. N. 1-2. P. 118—122.
Zimenkov D. V., Kulagina E. V., Antonova O. V., et al. Simultaneous drug resistance detection and genotyping of Mycobacterium tuberculosis using a low-density hydrogel microarray // Journal of antimicrobial chemotherapy. 2016. V. 71. N. 6. P. 1520—1531.