Что такое днк биочип как работает
Биологические микрочипы: будущее медицины
Биологические микрочипы (biochips) или, как их чаще называют — DNA microarrays, — это один из новейших инструментов биологии и медицины 21 века. Изобретены биочипы были в конце 90-х годов в России и в США. В настоящее время они активно производятся несколькими американскими биотехнологическими фирмами. Производят биочипы также и в России, в Центре биологических микрочипов Института молекулярной биологии РАН.
Биочипы используются для самых разных целей. Армия США утверждает, что обладает биочипами, позволяющими очень быстро определять наличие в окружающей среде болезнетворных микробов. В медицине биочипы помогают за считанные часы обнаруживать у больных лекарственно устойчивые формы туберкулеза. Еще одно очень важное медицинское применение биочипов — это диагностика лейкозов и других раковых заболеваний. Биочипы позволяют быстро, за считанные дни или даже часы различать внешне неразличимые виды лейкозов. При одних лейкозах пациента можно быстро и эффективно вылечить современными лекарствами. При других — не стоит даже пробовать, надо сразу делать пересадку костного мозга. Врачи не могут быстро отличить эти лейкозы друг от друга, а стратегию лечения надо правильно выбирать с самого начала. Также биочипы позволяют сразу отличить две формы рака груди — легко излечимую и плохо излечимую. Биочипы применяются и для диагностики других видов рака.
Исследователи в университетах и в фармакологических фирмах проводят на чипах одновременный анализ работы тысяч и десятков тысяч генов и сравнивают экспрессию этих генов в здоровых и в раковых клетках. Такие исследования помогают создавать новые лекарственные препараты и быстро выяснять, на какие гены и каким образом эти новые лекарства действуют. Биочипы являются также незаменимым инструментом для биологов, которые могут сразу, за один эксперимент, увидеть влияние различных факторов (лекарств, белков, питания) на работу десятков тысяч генов.
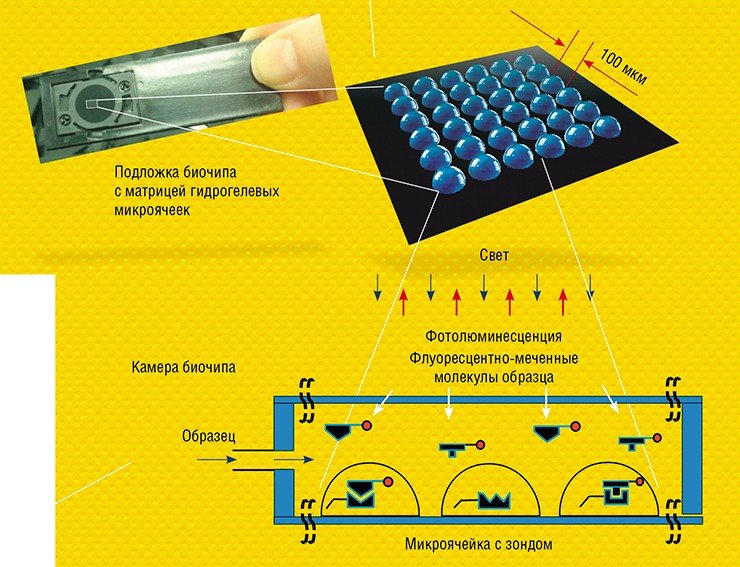
Что же это такое — биочипы? Точнее всего их описывает английское название DNA-microarrays, т.е. это организованное размещение молекул ДНК на специальном носителе. Профессионалы называют этот носитель «платформой». Платформа — это чаще всего пластинка из стекла или пластика (иногда используют и другие материалы, например кремний). В этом смысле чипы биологические близки к чипам электронным, которые и базируются на кремниевых пластинах. Это организованное размещение занимает на платформе очень небольшой участок размером от почтовой марки до визитной карточки, поэтому в названии биочипов присутствует слово micro. Микроскопический размер биочипа позволяет размещать на небольшой площади огромное количество разных молекул ДНК и считывать с этой площади информация с помощью флуоресцентного микроскопа или специального лазерного устройства для чтения.
Способы изготовления биочипов тоже бывают разными. Одна из крупнейших фирм по производству биочипов — Affymetrix — изготовляет биочипы таким же способом, каким изготовляют электронные чипы (и расположена эта фирма в Силиконовой долине, в Калифорнии). Чипы Affymetrix наращиваются прямо из стеклянной пластинки методом фотолитографии с использованием специальных микромасок. Применение отработанных методов электронной промышленности позволило добиться впечатляющих результатов. На одном таком чипе расположены десятки (а иногда и сотни) тысяч пятен размером в несколько микрон. Каждое пятно — это один уникальный фрагмент ДНК длиной в десятки нуклеотидов.
Изготовленный таким образом биочип в дальнейшем гибридизуют с молекулами ДНК, мечеными красителем. Сравнивают, например, ДНК, выделенную из здоровых клеток, и ДНК, выделенную из раковых клеток. Часто сравнивают ДНК, выделенную из разных больных. После гибридизации на биочипе возникают причудливые узоры. Эти узоры бывают разными у нормальных и у раковых клеток или сильно различаются при различных видах лейкозов. Излечимые виды лейкозов дают одни узоры (паттерны), неизлечимые дают совсем другие паттерны. На рисунке 1 можно видеть, как окрашенная ДНК от разных больных образует различные паттерны на биочипе. Болезнь одна и таже, паттерны — разные. По виду паттернов можно с большой вероятностью предсказать течение болезни на самой ранней ее стадии. В данном случае при паттерне типа 1 верятность метастаз равна нулю, при паттерне типа 2 — уже 29%, при паттернах типа 3 и 4 соответственно 75% и 77%.
Биочипы изготавливают не только методом фотолитографии. Другой подход — это когда олигонуклеотиды (относительно короткие фрагменты однонитевой ДНК) синтезируют отдельно, а затем уже пришивают к биочипу. Чипы такого типа изготавливают в разных фирмах, в частности, в Москве, в Институте молекулярной биологии. Биочипы, изготовленные в ИМБ, позволяют различать у больных туберкулезом штаммы, отличные от штаммов устойчивых к антибиотикам. Проблема состоит в том, что у некоторых больных бактерии туберкулеза имеют устойчивость к антибиотику рифампицину и антибиотик не помогает при лечении болезни. У большей части больных бактерии обычные (т.н. дикие штаммы бактерий) и антибиотик помогает. Необходимо знать устойчивость бактерий к антибиотику в самом начале лечения. Если врачи определят устойчивость бактерий через 2–3 месяца после начала лечения, то легкие больного будут уже изрядно повреждены. Традиционные методы определения устойчивости бактерий туберкулеза могут отнять несколько недель. Биочипы позволяют решить эту задачу за 1–2 дня. На рисунке 2 видны различные узоры паттерны гибридизации на российском биочипе двух штаммов туберкулеза: дикого и устойчивого к рифампицину.
На рисунке представлены гибридизационные картины (A, B) и соответствующие им диаграммы интенсивности флуоресцентных сигналов (C, D). A и C — прогибридизована последовательность дикого типа, B и D — последовательность содержит мутацию, приводящую к замене His526>Tyr (показана стрелкой).
Теперь приведем пример новейших специальных разработок в области биочипов. Специалисты из Нортвестернского университета в США разработали для американской армии биочип, обладающий совершенно неожиданными свойствами. Если на этот биочип попадает ДНК от патогенных микробов, то фрагменты ДНК зондов с прикрепленными к ним микроскопическими частицами золота выстраиваются в ряд. Между электродами идет ток и биочип сигнализирует об угрозе. Схема такого биочипа приведена на рисунке. Специальный биочип сигнализирует о наличии бактериальной угрозы после того, как золотые микрочастицы замыкают два электрода.
Сейчас также разрабатывают белковые микрочипы. Но это уже отрасль большой новой науки — протеомики.
Биочипы сегодня — это быстро развивающийся рынок, где работают десятки фирм. Биочипы будут составлять основу биомедицины 21 века.
Александр Крылов, Институт молекулярной биологии РАН
Биочипы – высокие технологии в медицинской диагностике
Открытие функционального значения тысяч генов и молекулярных механизмов действия множества ферментов стало революционным событием в биологии, оказавшим и продолжающим оказывать огромное влияние на развитие медицины XXI в. Перед учеными и медиками открылись уникальные возможности для выяснения причин многих инфекционных и наследственных заболеваний, а также разработки эффективных методов их лечения. В свою очередь, развитие новых диагностических методов потребовало и создания новых технологий многопараметрического анализа биологических образцов, с помощью которых можно одновременно исследовать множество белковых и ДНК-маркеров различных заболеваний, функционально-значимых биологических макромолекул и их комплексов. Так появилась технология биологических микрочипов, способных, подобно микрочипам электронным, извлекать и обрабатывать огромные массивы информации из одного небольшого образца биологического материала, полученного от конкретного пациента
За последние десятилетия был накоплен огромный объем знаний о молекулярных основах биохимических процессов в живых организмах. Это дало возможности не только точно диагностировать то или иное заболевание, но и оценить вероятность его возникновения еще до проявления у пациента клинических симптомов, а также подобрать эффективную терапию. Подавляющую часть такой информации получают с помощью лабораторной диагностики, на которую в мире ежегодно расходуется свыше 100 млрд долларов. В России в 1970 г. она насчитывала 81 биохимический / молекулярный тест, в 2000 г. – 170, а сегодня число тестов измеряется тысячами!
Большинство важнейших современных методов молекулярной диагностики основано на анализе данных, полученных при исследовании структуры геномов человека и микроорганизмов. В первую очередь речь идет о полимеразной цепной реакции (ПЦР). Обычно ДНК содержится в образцах в минимальных количествах, однако с помощью ПЦР можно в миллионы раз «размножить» в исследуемой пробе биоматериала определенные фрагменты этих макромолекул. «Мишенями» могут служить бактериальные или вирусные гены, генетические маркеры раковых опухолей и т. п. С помощью этого метода можно определить наличие, к примеру, возбудителя болезни, даже если в пробе присутствует всего несколько молекул его ДНК.
В 2011 г. Национальная ассоциация фтизиатров России наградила ИМБ РАН кубком и дипломом «Лучший инновационный проект» за разработку молекулярно-генетической технологии биологических микрочипов и создание тест-системы для диагностики туберкулеза на ее основе. Согласно расчетам, выполненным ФГУ «Центральный НИИ организации и информатизации здравоохранения», «…экономия бюджетных средств при внедрении технологии биочипов для диагностики туберкулеза и определения лекарственной чувствительности возбудителя составляет не менее 70 рублей на каждый вложенный рубль» (Министерство здравоохранения и социального развития РФ, 2009)
Однако возможности методов, базирующихся на ПЦР, ограничены в случае, когда речь идет об одновременном анализе десятков и сотен различных биомаркеров. И здесь на первый план выходит уже успешно зарекомендовавшая себя технология биологических микрочипов (биочипов). Достоинство этой технологии в том, что тест проводится в формате «один образец – один реакционный объем биочипа», т. е. образец не нужно разделять на несколько частей и их отдельно анализировать. Такой формат намного повышает чувствительность анализа и снижает его трудоемкость и стоимость, что дает возможность клинико-диагностическим лабораториям тестировать десятки и сотни образцов за одну рабочую смену.
Сегодня ведущие научные журналы регулярно публикуют обзоры, посвященные биологическим микрочипам, которые производят многие десятки компаний, а объем продаж составляет сотни миллионов долларов в год. Вместе с тем сама идея создания биочипов родилась лишь четверть века назад, и одним из мест рождения этой технологии стал Институт молекулярной биологии им. В. А. Энгельгардта Российской академии наук.
С самого начала подход российских исследователей отличался удачным выбором ключевых технологических решений, благодаря которым технологии биочипов ИМБ РАН продолжают оставаться конкурентоспособными в мировой науке. Многие из этих подходов (например, замена радиоактивных меток на флуоресцентные, применение гидрогеля и элементов сферической формы) стали использовать в своей работе другие исследователи, занимающиеся разработкой биочипов. А с 2000 г. в ИМБ РАН при поддержке Международного научно-технического центра начались работы по созданию биочипов для медицинской диагностики возбудителей социально значимых заболеваний.
Биочипы в деле
Главным элементом любого биочипа служит матрица из сотен и тысяч микроячеек, каждая из которых содержит так называемые молекулярные зонды – молекулы, способные специфично связываться только со строго определенными биологическими молекулами или их фрагментами. Зондами могут служить олигонуклеотиды, участки геномной ДНК, РНК, антитела, олигосахариды, различные низкомолекулярные соединения и др. Каждая ячейка биочипа служит своего рода отдельной «нанопробиркой», где иммобилизованный зонд распознает в анализируемом образце только свою мишень. Таким образом удается проводить параллельное распознавание сразу множества мишеней, например, генов, ответственных за лекарственную устойчивость возбудителя болезни.
Принципиальное отличие технологии матричных биочипов, разработанной в ИМБ РАН, в том, что зонды располагаются не на плоской подложке, а в заполимеризованных «каплях» гидрогеля полусферической формы. Размещение молекулярных зондов в трехмерном объеме, а не на плоскости, дает ряд существенных преимуществ. Оно позволяет в десятки и сотни раз увеличить емкость биочипа на единицу поверхности и, соответственно, чувствительность измерений. Кроме того, гель – насыщенное водой желеобразное вещество, исключает возможность взаимодействия зондов друг с другом и с твердой поверхностью подложки, а также обеспечивает отличную изоляцию отдельных ячеек на биочипе.
РОССИЯ – ПИОНЕР «БИОЧИПОСТРОЕНИЯ» Большие матрицы с ДНК и белками, иммобилизованными на фильтре или зафиксированными в лунках планшета, были известны достаточно давно. Но идея о создании микрочипов современного формата появилась лишь в конце прошлого века. Первая работа по ДНК-микрочипам и одна из первых – по белковым чипам были опубликованы группой академика А. Д. Мирзабекова из московского Института молекулярной биологии им. В. А. Энгельгардта АН СССР (Khrapko et al., 1989; Arenkov et al., 2000).
Эта революционная идея родилась как предложение для нового метода секвенирования ДНК с использованием гибридизации – процесса объединения двух комплементарных одноцепочечных молекул ДНК в двуцепочечную. Работы по совершенствованию методик секвенирования были стимулированы все более возраставшим интересом к проблеме расшифровки генома человека.
В то время в научной среде широко дискутировался вопрос, должна ли эта задача решаться масштабированием существующих подходов или нужно разрабатывать новые, более эффективные. Ученые сначала пошли по первому пути. Так, в 1977 г. появился «метод Сенгера», основанный на ферментативном синтезе комплементарной последовательности ДНК на матрице анализируемой одноцепочечной ДНК, а его разработчики получили в 1980 г. Нобелевскую премию. В своей нобелевской речи один из лауреатов, американский биохимик У. Гилберт, отметил, что «идея метода пришла только после второго визита А. Мирзабекова» в его лабораторию (Gilbert, 1984).
При секвенировании гибридизацией «расшифровка» ДНК идет не отдельными буквами-нуклеотидами, а «словами» определенной величины, и такой словарь может содержать тысячи слов. Стала очевидной необходимость создания микрочипов: в это время и вышла первая статья ученых из ИМБ, где были описаны приготовление и свойства гелевых микрочипов (Khrapko et al., 1989).
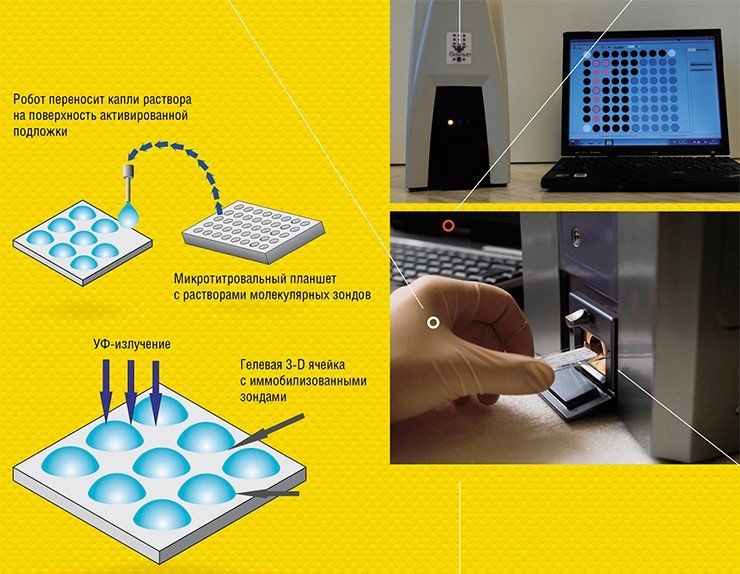
Технология производства гелевых биочипов прошла несколько этапов развития. Технология первого поколения, еще достаточно громоздкая и несовершенная, была разработана и запатентована в ИМБ в 1989—1993 гг., а впоследствии реализована в совместной лаборатории, организованной институтом и Аргоннской национальной лабораторией (США), и лицензирована американскими компаниями Motorola и Packard Instruments. Однако из-за технологических проблем фирмы стали производить биочипы, матрица которых представляла собой поверхность, сплошь покрытую полиакриламидным гелем.
В ИМБ РАН технология гелевых биочипов продолжала развиваться. Современная, достаточно простая, универсальная и дешевая технология позволяет производить даже в лабораторных условиях сотни и тысячи олигонуклеотидных, ДНКовых или белковых микрочипов в день (Колчинский и др., 2004)
Для регистрации результатов анализа используют флуоресцентные метки, которые вводят в молекулы образца. Если зонд специфично распознает и свяжется с мишенью, в ячейке возникает флуоресценция. Интенсивность свечения ячеек биочипа измеряется с помощью специальных аппаратно-программных комплексов-анализаторов, которые и выдают отчет о присутствии в исследуемом образце специфичных молекулярных мишеней, информирующих о наличии микроорганизмов или генных мутаций, онкомаркеров или аллергенов и т. п.
Оригинальная технология создания таких гелевых чипов, разработанная в ИМБ РАН, была запатентована и сертифицирована по европейским стандартам. Биочипы, созданные по этой технологии, занимают отдельную нишу диагностических микроматриц и применяются в российских клиниках. Коммерческие микроматрицы, произведенные ведущими научно-производственными корпорациями Германии и США применяются, в основном, в исследовательских целях.
Туберкулез и лекарственная устойчивость
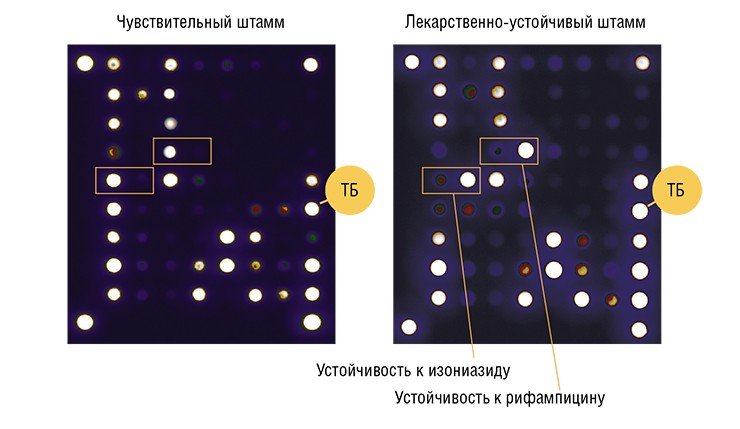
Первой в мире тест-системой на основе биочипов, зарегистрированной для медицинского применения, стал разработанный в ИМБ в 2004 г. набор «ТБ-Биочип‑1». С его помощью можно определить наличие в геноме микобактерии туберкулеза 47 мутаций, приводящих к устойчивости к двум основным противотуберкулезным препаратам – рифампицину и изониазиду.
Тест-системами серии «ТБ-Биочип» и оборудованием для их анализа были оснащены 20 учреждений противотуберкулезной службы РФ и 8 бактериологических лабораторий Федеральной службы исполнения наказаний. Число излеченных больных с лекарственно-устойчивым туберкулезом увеличилось по меньшей мере в 3 раза при ранней постановке диагноза с использованием биочипов в отличие от диагностики традиционными методами (Gryadunov et al., 2011). В этом случае огромную роль играет такой фактор, как время анализа: в первом случае для диагностики достаточно нескольких часов, тогда как выращивание микобактерий на средах с разными противотуберкулезными препаратами занимает 2—3 месяца
Почему внимание исследователей привлек именно туберкулез? Дело в том, что многие десятилетия для борьбы с этой болезнью использовали комбинированное лечение сразу несколькими химиопрепаратами, чтобы повысить его эффективность. При монотерапии больные быстро приобретали устойчивость к лекарству. Однако такая стратегия привела к тому, что уже в конце прошлого века в мире, в том числе и в России, начал повсеместно распространяться туберкулез со множественной лекарственной устойчивостью. Именно этот фактор в наши дни чаще всего является причиной неудачного исхода лечения и возникновения рецидива болезни, от которой ежегодно в мире умирает более 3 млн человек.
Изониазид и рифампицин относятся к популярным и наиболее эффективным препаратам первого (основного) ряда. И если выделенный от пациента возбудитель окажется устойчивым к этим лекарствам, нужно обращаться к химиопрепаратам второго (резервного) ряда, к которым будет чувствительна эта бактериальная популяция. Сегодня одними из наиболее перспективных препаратов для лечения таких форм туберкулеза являются фторхинолоны. Поэтому следующей тест-системой в ряду диагностических тестов ИМБ стал «ТБ-Биочип‑2», с помощью которого можно выявить лекарственную устойчивость к различным классам этих препаратов (Грядунов и др., 2009).
Все более широкое распространение форм туберкулеза со множественной лекарственной устойчивостью явилось стимулом для дальнейшей «эволюции» тест-системы. Требовалось, во‑первых, максимально охватить весь спектр генетически детерминированной резистентности к широкому ряду противотуберкулезных препаратов. Во-вторых, возникла необходимость определять генотип и соответственно принадлежность выделенного штамма к основным семействам, циркулирующим на территории РФ, что важно не только для эпидемиологического мониторинга структуры популяции возбудителей туберкулеза, но и для назначения адекватной терапии.
Так в 2012—2013 гг. в результате масштабных геномных исследований был создан не имеющий мировых аналогов набор реагентов «ТБ-ТЕСТ», позволяющий одновременно идентифицировать 120 генетических локусов, отвечающих за развитие устойчивости к препаратам первой и второй «линии обороны»: рифампицину, изониазиду, этамбутолу, фторхинолонам и инъекционным препаратам (амикацину и капреомицину) (Zimenkov et al., 2016). Такая диагностика позволяет дифференцированно назначать высокие дозы химиопрепаратов или, напротив, удалять те или иные лекарства из схем терапии.
Чтобы получить государственную регистрацию в Росздравнадзоре, тест-система прошла все виды испытаний и экспертиз и с 2014 г. разрешена к применению в медицинской практике РФ. В настоящее время «ТБ-ТЕСТ» приходит на смену наборам «ТБ-Биочип».
От гепатита до рака и аллергий
Еще одной актуальной проблемой мирового здравоохранения является лечение больных гепатитом С. Возбудитель этого вирусного заболевания может долгое время размножаться в печени, ничем не выдавая себя, а первые признаки болезни обнаруживаются лишь спустя пару месяцев после заражения. Еще недавно гепатит С считался практически неизлечимой болезнью, а основным терапевтическим средством служила комбинация из интерферона и рибавирина, которая зачастую оказывалась неэффективной и имела много негативных побочных эффектов.
Сегодня созданы новые антивирусные препараты, обладающие так называемым прямым противовирусным действием и блокирующие ключевые внутриклеточные этапы размножения возбудителя. Но вся сложность в том, что вирус гепатита С имеет 7 вариантов генотипа, при этом каждый генотип имеет еще несколько подтипов. Более того, разные генотипы/подтипы обладают и разной чувствительностью к традиционным и новым препаратам, и выбор противовирусной терапии должен проводиться в соответствии с генотипическими особенностями возбудителя.
В ИМБ РАН совместно с лабораторией вирусологии госпиталя Университета г. Тулузы (Франция) был разработан и запатентован не имеющий мировых аналогов подход, основанный на использовании платформы гидрогелевых биочипов для типирования вируса гепатита С на основе анализа области NS 5B вирусного генома. Тест-система «HCV-БИОЧИП», способная определять 6 генотипов и 36 подтипов этого вируса, успешно прошла клинические испытания в России и Франции (Gryadunov et al., 2011).
Важнейшим направлением приложения технологии гидрогелевых биочипов служит анализ мутаций и полиморфизмов ДНК самого человека: ДНК-маркеров, ассоциированных с возникновением различных неинфекционных заболеваний.
Среди онкологических заболеваний у детей ведущее место занимают лейкозы. Тест-система «ЛК-БИОЧИП» способна идентифицировать в образцах крови 13 наиболее клинически значимых хромосомных транслокаций (переносов фрагмента одной хромосомы на другую), характерных для некоторых типов острых и хронических лейкозов. Каждая из этих транслокаций определяет свой вариант развития лейкоза и важна для выбора стратегии лечения. Эта тест-система применяется в Национальном научно-практическом центре детской гематологии, онкологии и иммунологии им. Дмитрия Рогачева (Москва), где анализируются образцы из 18 региональных гематологических центров РФ (Gryadunov et al., 2011).
Для ранней диагностики рака молочной железы и яичников создана тест-система «РМЖ-БИОЧИП», которая позволяет определять мутации в генах BRCA1/2, ассоциированные с высокой (до 80 %) вероятностью возникновения наследственных форм этих заболеваний.
В настоящее время в ИМБ РАН разрабатываются варианты тест-систем на основе биочипов для определения чувствительности злокачественных клеток к противоопухолевой терапии. Например, с помощью биочипа для индивидуального подбора препаратов, эффективно воздействующих на молекулярные мишени в опухолевых клетках меланомы, можно выявить мутации генов, которые определяют целесообразность использования таких препаратов таргетной («молекулярно-прицельной») терапии поздних стадий и рецидивов меланомы, как траметиниб, иматиниб и вемурафениб (Emelyanova et al., 2017).
Трехмерная структура гидрогеля, в котором на биочипах зафиксированы молекулярные зонды, позволяет сохранить без изменений достаточно «чувствительную» нативную структуру белковых молекул. Поэтому такие биочипы можно использовать также для исследования белок-белковых взаимодействий, что требуется, к примеру, при проведении различных видов иммунохимического анализа.
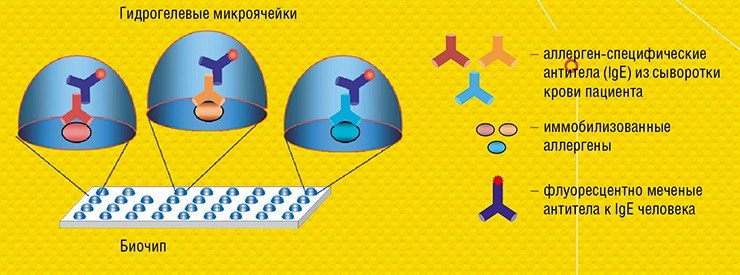
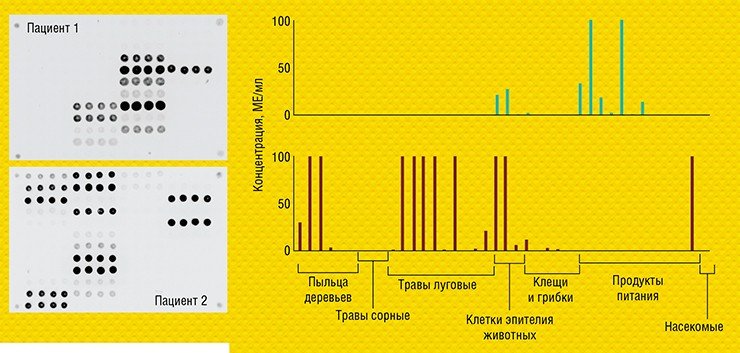
В ИМБ РАН удалось перевести такой классический анализ в формат микрочипа и адаптировать его для диагностики аллергических заболеваний. Совместно с германской биотехнологической компанией Dr. Fooke Laboratorien GmbH, предоставившей наборы природных и рекомбинантных аллергенов, была разработана и запатентована тест-система «АЛЛЕРГО-БИОЧИП» для параллельного количественного определения больших панелей аллерген-специфичных антител Е и G4 в сыворотке крови (Feyzkhanova et al., 2017).

Двенадцать специализированных тест-систем, созданных на основе технологии гидрогелевых биочипов в ИМБ РАН, получили разрешение к применению как медицинские изделия для лабораторной диагностики. Эти тест-системы успешно используются более чем в 50 научно-исследовательских и медицинских центрах РФ, стран СНГ и ЕС.
Технологии биочипов, разработанные в ИМБ РАН, защищены 42 отечественными и международными патентами. И эти технологии продолжают интенсивно развиваться. Разрабатываются новые подходы, позволяющие упростить и ускорить методики, интегрировать в единую процедуру все стадии проведения анализа: от обработки биологического образца до количественной идентификации в режиме реального времени.
Ядро системы – гидрогелевый биочип – будет в дальнейшем модифицироваться в зависимости от назначения диагностического теста, в то время как остальные компоненты уже сейчас являются унифицированными. Такие «лаборатории на чипе» позволят значительно улучшить качество лабораторной диагностики, снизить вероятность заражения медперсонала и в конечном счете повысить эффективность и сократить стоимость лечения.
Грядунов Д. А., Зименков Д. В., Михайлович В. М. и др. Технология гидрогелевых биочипов и ее применение в медицинской лабораторной диагностике // Медицинский алфавит. 2009. № 3. С. 10—14.
Заседателев А. С. Биологические микрочипы для медицинской диагностики // Наука и технологии в промышленности. 2005. № 1. С. 18—19.
Колчинский А. М., Грядунов Д. А., Лысов Ю. П. и др. Микрочипы на основе трехмерных ячеек геля: история и перспективы // Молекулярная биология. 2004. Е. 38 № 1. С. 5—16.
Arenkov P., Kukhtin A., Gemmell A., et al. Protein microchips: use for immunoassay and enzymatic reactions // Analytical Biochemistry. 2000. V. 278. N. 2. P. 123—131.
Emelyanova M., Ghukasyan L., Abramov I. et al. Detection of BRAF, NRAS, KIT, GNAQ, GNA11 and MAP2K1/2 mutations in Russian melanoma patients using LNA PCR clamp and biochip analysis // Oncotarget. 2017. V. 32. N. 8. P. 52304—52320.
Feyzkhanova G., Voloshin S., Smoldovskaya O. et al. Development of a microarray-based method for allergen-specific IgE and IgG4 detection // Clinical proteomics. 2017. doi: 10.1186/s12014-016-9136-7.
Gryadunov D., Dementieva E., Mikhailovich V. et al.Gel-based microarrays in clinical diagnostics in Russia // Expert review of molecular diagnostics. 2011. N. 11 P. 839—853.
Khrapko K. R., Lysov Yu. P., Khorlyn A. A. An oligonucleotide hybridization approach to DNA sequencing // FEBS Letters. 1989. V. 256. N. 1-2. P. 118—122.
Zimenkov D. V., Kulagina E. V., Antonova O. V., et al. Simultaneous drug resistance detection and genotyping of Mycobacterium tuberculosis using a low-density hydrogel microarray // Journal of antimicrobial chemotherapy. 2016. V. 71. N. 6. P. 1520—1531.