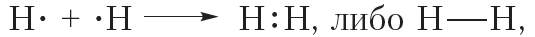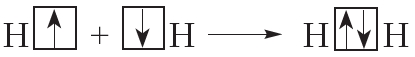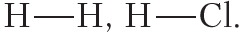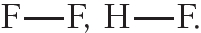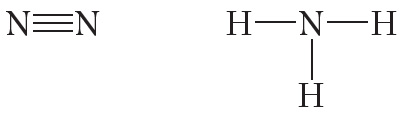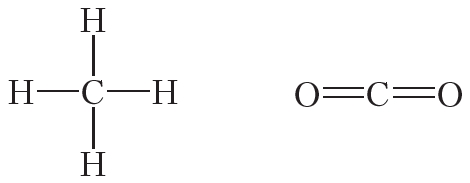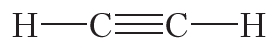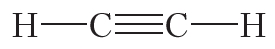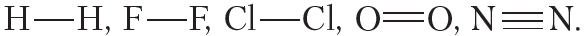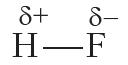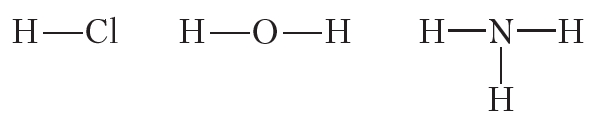Что такое длина ковалентной связи
§ 4. Ковалентная связь
| Сайт: | Профильное обучение |
| Курс: | Химия. 10 класс |
| Книга: | § 4. Ковалентная связь |
| Напечатано:: | Гость |
| Дата: | Вторник, 28 Декабрь 2021, 11:32 |
Оглавление
Ковалентная связь
Основным типом химических связей в органических соединениях является ковалентная связь. Рассмотрим механизм её образования и основные характеристики.
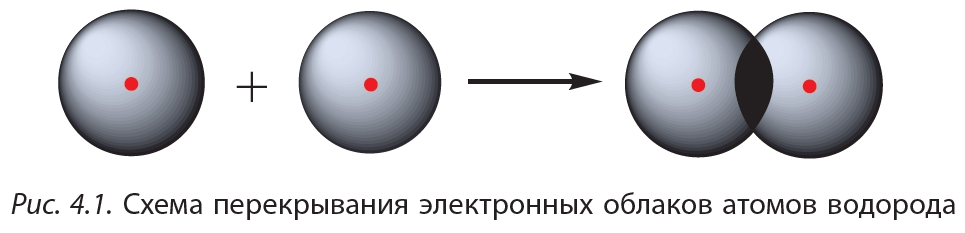
Простейший пример соединения с ковалентной связью — молекула водорода Н2. Атом водорода состоит из положительно заряженного ядра и одного неспаренного электрона, занимающего 1s-орбиталь. При сближении двух атомов водорода происходит перекрывание их электронных облаков:
В результате в пространстве между ядрами происходит увеличение электронной плотности, то есть в этой области концентрируется отрицательный заряд. Этот отрицательный заряд притягивает положительно заряженные ядра, и между атомами формируется химическая связь. Образуется молекула водорода 
Схему образования ковалентной связи между атомами водорода можно представить следующим образом:
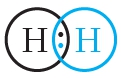
Из представленной схемы видно, что ковалентная связь осуществляется посредством общей электронной пары. В электронных формулах электронную пару обычно обозначают двумя точками, расположенными между атомами. Если вокруг таких атомов описать окружности, видно, что каждый атом водорода в молекуле имеет завершённую электронную оболочку, как у атома гелия:
В структурных формулах ковалентная связь обозначается чёрточкой:
Используя понятие общей электронной пары, можно дать краткое определение ковалентной связи.
| Ковалентная связь — химическая связь, образованная посредством общих электронных пар. |
В молекуле водорода общая электронная пара формируется за счёт неспаренных электронов двух атомов водорода. Следовательно, можно заключить, что число ковалентных связей, которое может образовать элемент, равно числу неспаренных электронов в его атоме.
Например, в атоме водорода один неспаренный электрон, поэтому водород может образовать только одну ковалентную связь. Число ковалентных связей, которое образует данный атом в химическом соединении, называется его валентностью. Например, поскольку валентность водорода равна единице, то в структурных формулах от символа H следует рисовать одну чёрточку:
Рассмотрим основные характеристики ковалентной связи.
Кратность ковалентной связи
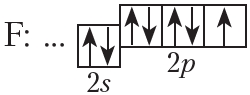
На внешнем слое атома фтора имеется один неспаренный электрон, поэтому валентность фтора в соединениях равна единице.
От символа F в структурных формулах следует рисовать одну чёрточку:
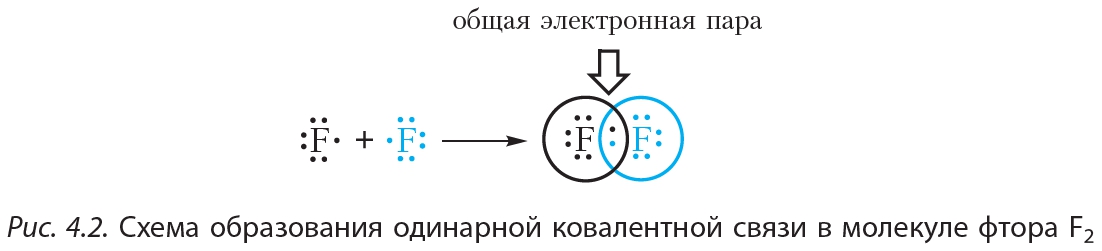
На рисунке 4.2. показана схема образования ковалентной связи в молекуле фтора:
В молекуле фтора атомы связывает одна общая электронная пара. Такая связь называется одинарной.
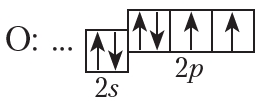
На внешнем слое атома кислорода имеется два неспаренных электрона, поэтому валентность кислорода в соединениях равна двум.
От символа O в структурных формулах следует рисовать две чёрточки:
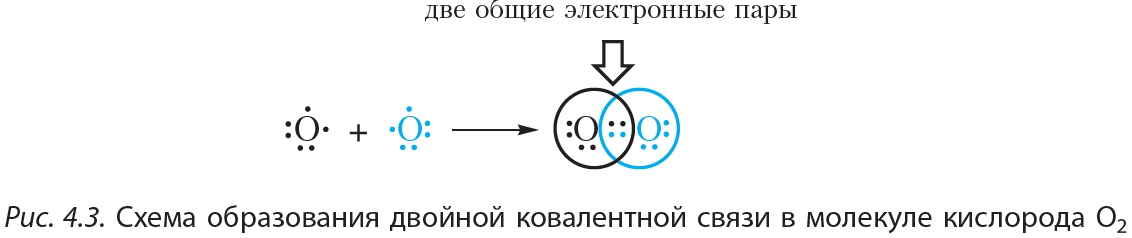
На рисунке 4.3 показана схема образования ковалентной связи в молекуле кислорода:
В молекуле кислорода атомы связывают две электронные пары. Такая связь называется двойной. Двойная связь прочнее одинарной.
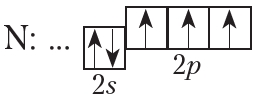
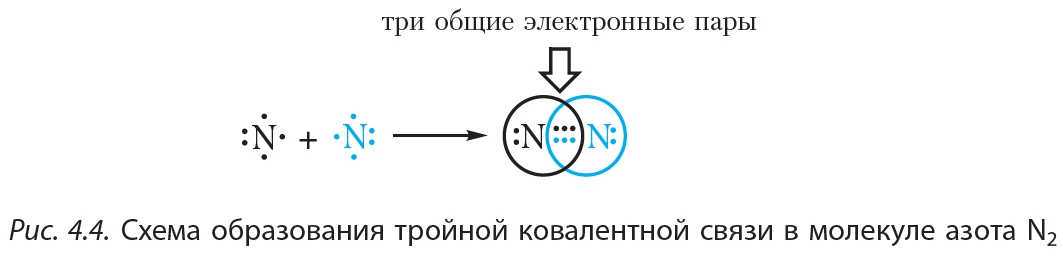
На внешнем слое атома азота имеется три неспаренных электрона, поэтому валентность азота в соединениях равна трём.
От символа N в структурных формулах следует рисовать три чёрточки:
На рисунке 4.4. показана схема образования ковалентной связи в молекуле азота:
В молекуле азота атомы связывают три электронные пары. Такая связь называется тройной. Тройная связь прочнее одинарной и двойной.
Двойные и тройные связи имеют общее название кратные.
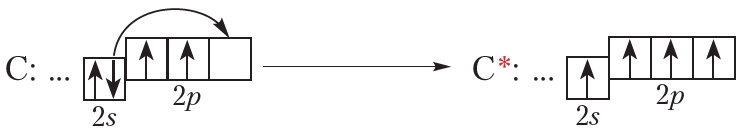
В основном состоянии на внешнем слое атома углерода имеется два неспаренных электрона. Однако, атом углерода легко переходит в возбуждённое состояние, в котором имеется четыре неспаренных электрона:
В связи с этим валентность углерода может быть равна четырём. В большинстве соединений углерод четырёхвалентен. Поэтому в структурных формулах от символа C следует рисовать четыре чёрточки:
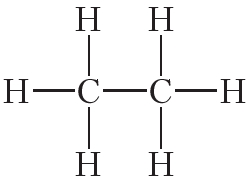
Атомы углерода могут связываться между собой как одинарными, так и кратными связями. Например, в молекуле этана, имеющего состав С2Н6, атомы углерода образуют только одинарные связи:
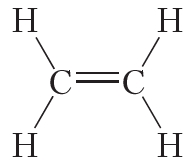
Двойной ковалентной связью атомы углерода соединены между собой в молекуле этилена (С2Н4):
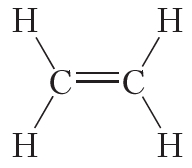
Энергия и длина ковалентной связи
Важнейшими характеристиками ковалентной связи являются её энергия и длина.
Энергия, которую необходимо затратить для разрыва химической связи, называется энергией связи. Энергия связи измеряется в кДж/моль. Чем прочнее связь, тем больше энергии необходимо затратить на её разрыв, следовательно, тем больше энергия связи.
Энергия кратных связей больше, чем одинарных (табл. 4.1). Это вполне понятно, так как для разрушения двух или трёх связей требуется затратить больше энергии, чем для разрыва одной связи.
Атомы, соединённые химической связью, находятся на определённом расстоянии друг от друга. Расстояние между ядрами атомов, образующих связь, называется длиной связи.
Из данных таблицы 1.4 видно, что в ряду этан — этилен — ацетилен с ростом кратности длина связи углерод-углерод уменьшается. То есть при образовании кратных связей атомы сильнее притягиваются друг к другу.
Таблица 4.1. Энергия и длина связи углерод-углерод в некоторых молекулах
Энергия связи углерод-углерод, кДж/моль
Длина связи углерод-углерод, нм
Полярность ковалентной связи
В молекуле водорода H2 ковалентная связь образуется между атомами одного элемента, поэтому общая электронная пара располагается симметрично (посередине) между ядрами атомов. Такая связь называется ковалентной неполярной.
Пример 1. Ковалентной неполярной связью соединяются между собой атомы неметаллов в простых веществах
Кроме того, ковалентная неполярная связь образуется между атомами углерода в этане 
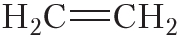

При образовании ковалентной связи между атомами разных химических элементов общая электронная пара смещается к более электроотрицательному атому. Такая связь называется ковалентной полярной.
Напомним, что электроотрицательность — это способность атома в химическом соединении притягивать к себе электроны других атомов. Самый электроотрицательный элемент — фтор (ЭО — 4,1).
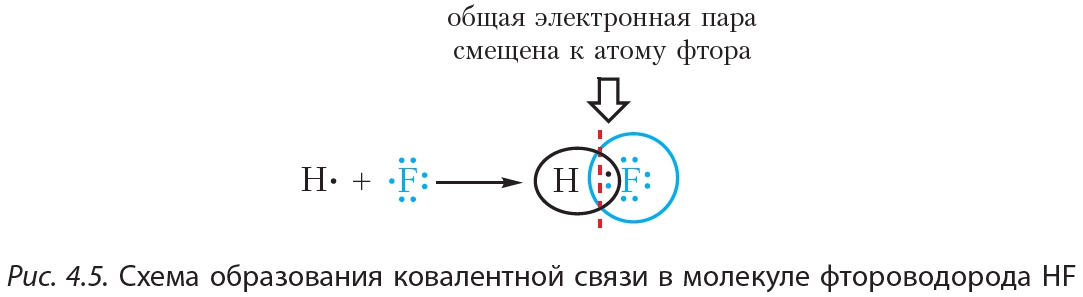
Пример 2. Ковалентная полярная связь в молекуле фтороводорода HF. Молекула 
В результате на атоме фтора возникает частичный отрицательный заряд, на атоме водорода — частичный положительный. Частичные, а не полные заряды возникают вследствие того, что общая электронная пара смещается к атому фтора, но полного перехода электрона от одного атома к другому не происходит. Частичный заряд обозначается греческой буквой δ (дельта):
Связь между атомами водорода и фтора является ковалентной полярной.
Ковалентная полярная связь возникает между атомами неметаллов с различной электроотрицательностью, например в молекулах хлороводорода, воды, аммиака:
Чем сильнее различаются между собой электроотрицательности атомов, образующих ковалентную связь, тем больше будут частичные заряды на атомах и тем более полярной будет связь.
Пример 3. Ковалентные полярные связи в молекулах фтороводорода HF и хлороводорода HCl.
Таблица 4.2. Электроотрицательности и частичные заряды на атомах в молекулах HF и HCl
Частичные заряды на атомах
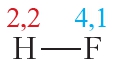
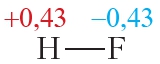
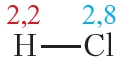
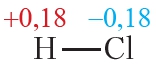
Из таблицы 4.2 видно, что частичные заряды на атомах в молекуле HF значительно больше, чем в молекуле HCl. Следовательно, связь в молекуле HF более полярна, чем в HCl.
Ковалентная связь осуществляется посредством общих электронных пар. В электронных формулах общую электронную пару обозначают двумя точками, расположенными между атомами. В структурных формулах ковалентную связь обозначают чёрточкой.
Ковалентная связь образуется между атомами неметаллов. Между атомами одного и того же неметалла возникает ковалентная неполярная связь. Между атомами разных неметаллов — ковалентная полярная.
Ковалентная связь бывает одинарной, двойной и тройной. Двойная и тройная связи называются кратными.
Чем прочнее связь, тем больше энергия связи. Энергия кратных связей выше энергии одинарных связей. Кратные связи короче одинарных связей.
Вопросы и задания
1. При помощи электронных формул изобразите образование ковалентных связей в молекулах HCl, H2O, NH3, CH4. Укажите валентности элементов в этих веществах.
2. Учитывая, что валентность водорода и хлора равна единице, углерода — четырём, а кислорода — двум, напишите структурные формулы молекул: CCl4, CO2, CH3Cl, C2H6, C2H4, C2H2, C2H5Cl.
3. В какой молекуле, H2O или NH3, ковалентные связи более полярные? Составьте структурные формулы этих молекул и укажите знаки частичных зарядов на атомах.
4. Напишите структурную формулу пероксида водорода H2O2. Укажите полярные и неполярные связи.
5. В какой молекуле, O2 или H2O2, энергия связи кислород-кислород больше?
6. При сильном нагревании может происходить разрыв связей в молекулах. При этом молекулы распадаются на атомы. Какое вещество, Cl2 или N2, будет более устойчиво к нагреванию (термически устойчиво)?
Характеристики ковалентной связи
1. Длина ковалентной связи
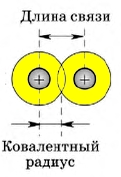
В симметричных молекулах (H2, F2, Cl2. ) половину длины связи называют ковалентным радиусом. Зная ковалентный радиус, очень легко вычислять длину ковалентной связи в молекуле. Например, длина ковалентной связи молекулы HF = 30 + 58 = 88 пм.
2. Энергия ковалентной связи
Энергии связи некоторых молекул (кДж/моль):
3. Полярность ковалентной связи
Данная характеристика отображает расположение электронной пары двух атомов, образующих связь. Степень полярности связи зависит от величины электроотрицательности атомов, образующих связь (чем она больше, тем больше полярность связи). У более полярной ковалентной связи общая пара электронов больше смещена к более электроотрицательному атому (см. понятие электроотрицательности).
Полярность ковалентной связи оценивается количественно при помощи дипольного момента (µ), при этом система из двух равнозначных, но противоположных по знаку, зарядов, называется диполем.
Очень важно различать дипольный момент ковалентной связи (ее полярность) и дипольный момент молекулы в целом. В простых двухатомных молекулах эти два параметра равны между собой. Совсем другая картина наблюдается в сложных молекулах, в которых дипольный момент молекулы складывается из суммы векторов дипольных моментов отдельных связей.
4. Поляризуемость ковалентной связи
Поляризуемость отображает степень способности электронов смещаться под воздействием внешнего электрического поля, формируемого ионами или другими полярными молекулами.
Поляризуемость и полярность связи являются обратнозависимыми величинами: менее полярная связь больше поляризуется, и наоборот.
5. Насыщаемость ковалентной связи
6. Направленность ковалентной связи
Направленность характеризует пространственную ориентацию ковалентной связи относительно других связей молекулы. В молекулах электроны ковалентных связей и свободные пары электронов постоянно испытывают взаимное отталкивание в результате чего ковалентные связи располагаются так, что валентный угол между ними отвечает принципу наименьшего отталкивания между электронами (например, в молекуле воды валентный угол составляет 104,5°).
7. Кратность ковалентной связи
В некоторых случаях между атомами могут возникать не одна, а две (двойная связь) или три (тройная связь) общих электронных пар (так называемые кратные связи).
Как видно из таблицы, приведенной ниже, молекула азота примерно в 7 раз «крепче» молекулы фтора.
Таблица зависимости длины и прочности ковалентной связи от ее кратности:
| Молекула | F2 | O2 | N2 |
|---|---|---|---|
| Кратность связи | одинарная | двойная | тройная |
| Прочность связи (энергия), кДж/моль | 139 | 494 | 942 |
| Длина связи, пм | 141 | 121 | 109 |
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе
Параметры ковалентных связей
Параметры, характеризующие ковалентные связи, весьма многообразны. Важнейшими из них являются энергия связи, длина связи, полярность, поляризуемость. Длина связи – это расстояние между центрами связанных атомов (r). Поскольку атомы в молекулах колеблются вдоль линий связей, измеряемые расстояния представляют собой средние значения. Длина связи выражается через сумму ковалентных радиусов атомов. Ковалентный радиус – это половина длины ковалентной связи в молекуле, образованной одинаковыми атомами (рис. 28).