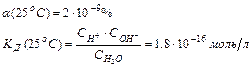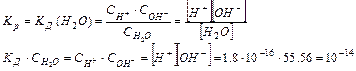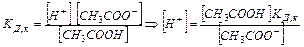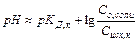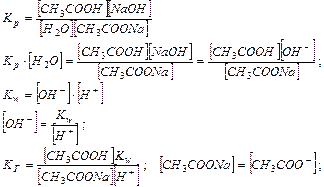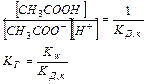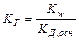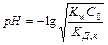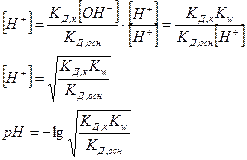Что такое диссоциация воды
Диссоциация воды. Водородный показатель. Среды водных растворов электролитов
Вода — слабый амфотерный электролит.
Уравнение ионизации воды с учетом гидратации ионов водорода Н + таково:
Без учета гидратации ионов Н + уравнение диссоциации воды имеет вид:
Произведение концентраций ионов водорода и гидроксид-ионов называется ионным произведением воды (KH2O).
KH2O — величина постоянная, и при температуре 25 о С
В водных растворах различают три типа сред: нейтральную, щелочную и кислую.
Нейтральная среда — это среда, в которой концентрация ионов водорода равна концентрации гидроксид-ионов:
Кислая среда — это среда, в которой концентрация ионов водорода больше концентрации гидроксид-ионов:
Щелочная среда — это среда, в которой концентрация ионов водорода меньше концентрации гидроксид-ионов:
Для характеристики сред растворов удобно использовать так называемый водородный показатель рН (пэ-аш).
Чем рН меньше 7, тем больше кислотность раствора. Чем рН больше 7, тем больше щелочность раствора.
Существуют различные методы измерения рН. Качественно характер среды водных растворов электролитов определяют с помощью индикаторов.
Индикаторами называются вещества, которые обратимо изменяют свой цвет в зависимости от среды растворов, т. е. рН раствора.
На практике применяют индикаторы лакмус, метиловый оранжевый (метилоранж) и фенолфталеин. Они изменяют свою окраску в малом интервале рН: лакмус — в интервале рН от 5,0 до 8,0; метилоранж — от 3,1 до 4,4 и фенолфталеин — от 8,2 до 10,0.
Изменение цвета индикаторов показано на схеме:
Заштрихованные области показывают интервал изменения окраски индикатора.

Кроме указанных выше индикаторов, применяют также универсальный индикатор, который можно использовать для приблизительного определения рН в широком интервале от 0 до 14.
Величина рН имеет большое значение в химических и биологических процессах, так как в зависимости от характера среды эти процессы могут протекать с разными скоростями и в разных направлениях.
Поэтому определение рН растворов очень важно в медицине, науке, технике, сельском хозяйстве. Изменение рН крови или желудочного сока является диагностическим тестом в медицине. Отклонения рН от нормальных, величин даже на 0,01 единицы свидетельствуют о патологических процессах в организме. Постоянство концентраций ионов водорода Н + является одной из важных констант внутренней среды живых организмов.
Так, при нормальной кислотности желудочный сок имеет рН 1,7; рН крови человека равен 7,4; слюны — 6,9. Каждый фермент функционирует при определенном значении рН: каталаза крови при рН 7 пепсин желудочного сока — при рН 1,5—2; и т. д.
Диссоциация воды и pH
Диссоциация воды
В состоянии равновесия υ1 = υ2, следовательно:
Проведем нехитрые математические действия и получим:
Вследствие очень малого количества продиссоциированных молекул концентрацию [H2O] можно принять равной общей концентрации воды, а общую концентрацию воды в разбавленных растворах как величину постоянную: [H2O]=1000(г/л)/18(г/моль)=55,6 моль/л.
pH воды
Получившаяся сумма pH и pOH, также как и произведение, которое логарифмировали, является постоянной и равна 14, так если pH=3 то pOH=11 (pH и pOH могут быть и отрицательными, и если pH=-1 тогда pOH=15).
Ион гидроксония (H3O + )
Оба процесса вызывают миграцию электрического заряда, а при наличии приложенного поля приводят к появлению электрического тока. Согласно Эйгену и Де Мэйеру, подвижность иона H3O + в воде меньше, чем во льду, из-за того, что система водородных связей в жидкой фазе несовершенна.
Когда выше говорилось о концентрациях, было сделано упрощение, правильнее использовать «активность ионов».
Диссоциация воды
Химически чистая вода обладает хотя и ничтожной, но измеримой электропроводностью, так как вода в незначительной степени диссоциирует на ионы. Так при комнатной температуре лишь примерно одна из 10 8 молекул воды находится в диссоциированной форме. Процесс электролитической диссоциации воды возможен благодаря достаточно высокой полярности связей О-Н и наличию между молекулами воды системы водородных связей. Уравнение диссоциации воды записывается так:
Уравнение диссоциации воды можно записать в более простой форме:
Присутствие в воде ионов водорода и гидроксида придают ей специфические свойства амфолита, т.е. способность выполнять функции слабой кислоты и слабого основания. Константа диссоциации воды при температуре 22 0 С:
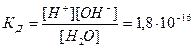
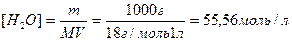
Теперь выражение (1) можно записать в следующем виде:
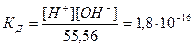
1.2. Водородный показатель – рН
| Индикаторы | Реакция среды раствора | ||
| Кислая рН 7 | |||
| Лакмус | Красный | Синий | Синий |
| Фенолфталеин | Бесцветный | Бесцветный | Малиновый |
| Метиловый оранжевый | Розовый | Оранжевый | Желтый |
Однако индикаторы дают не точное определение значения рН, поэтому современные измерения рН производятся при использовании электрохимических методов, точность которых составляет ±0,01 единицы рН.
Электролитическая диссоциация. Степень и константа диссоциации
По способности проводить электрический ток в водном растворе или в расплаве, вещества делятся на электролиты и неэлектролиты.
Электролитами называются вещества, растворы или расплавы которых проводят электрический ток. К электролитам относятся соли, кислоты, основания. В молекулах этих веществ имеются ионные или ковалентные сильно полярные химические связи.
Неэлектролитами называются вещества, растворы или расплавы которых не проводят электрический ток. К неэлектролитам относятся, например, кислород, водород, многие органические вещества (сахар, эфир, бензол и др.). В молекулах этих веществ существуют ковалентные неполярные или малополярные связи.
Для объяснения электропроводности растворов и расплавов солей, кислот и оснований шведский ученый С. Аррениус создал теорию электролитической диссоциации (1887 г.):
1.Молекулы электролитов при растворении или расплавлении распадаются на ионы.
Процесс распада молекул электролитов на ионы в растворе или в расплаве называется электролитической диссоциацией, или ионизацией.
Ионы — это атомы или группы атомов, имеющие положительный или отрицательный заряд.
2.В растворе или расплаве электролитов ионы движутся хаотически. При пропускании через раствор или расплав электрического тока, положительно заряженные ионы движутся к отрицательно заряженному электроду (катоду), а отрицательно заряженные ионы движутся к положительно заряженному электроду (аноду). Поэтому положительные ионы называются катионами, отрицательные ионы — анионами.
3.Диссоциация — процесс обратимый. Это значит, что одновременно идут два противоположных процесса: распад молекул на ионы (ионизация, или диссоциация) и соединение ионов в молекулы (ассоциация, или моляризация).
Диссоциацию молекул электролитов выражают уравнениями, в которых вместо знака равенства ставят знак обратимости. В левой части уравнения записывают формулу молекулы электролита, в правой — формулы ионов, которые образуются в процессе электролитической диссоциации. Например:
Каждая молекула нитрата магния диссоциирует на ион магния и два нитрат-иона. Следовательно, в результате диссоциации одной молекулы Mg(NO3)2 образуются три иона.
Общая сумма зарядов катионов равна общей сумме зарядов анионов и противоположна по знаку (так как растворы электролитов электронейтральны).
Механизм электролитической диссоциации. Гидратация ионов
Причины и механизм диссоциации электролитов объясняются химической теорией раствора Д. И. Менделеева и природой химической связи. Как известно, электролитами являются вещества с ионной или ковалентной сильно полярной связями. Растворители, в которых происходит диссоциация, состоят из полярных молекул. Например, вода — полярный растворитель. Диссоциация электролитов с ионной и полярной связями протекает различно. Рассмотрим механизм диссоциации электролитов в водных растворах.
I. Механизм диссоциации электролитов с ионной связью
В результате этого взаимодействия между молекулами растворителя и ионами электролита притяжение между ионами в кристаллической решетке вещества ослабевает. Кристаллическая решетка разрушается, и ионы переходят в раствор. Эти ионы в водном растворе находятся не в свободном состоянии, а связаны с молекулами воды, т. е. являются гидратированными ионами.
Диссоциация ионных соединений в водном растворе протекает полностью. Так диссоциируют соли и щелочи: KCl, LiNO3, Ba(OH)2 и др.
II. Механизм диссоциации электролитов, которые состоят из полярных молекул
При растворении в воде веществ с полярной ковалентной связью происходит взаимодействие дипольных молекул электролита с дипольными молекулами воды. Например, при растворении в воде хлороводорода происходит взаимодействие молекул НСl с молекулами Н2O. Под влиянием этого взаимодействия изменяется характер связи в молекуле HCl: сначала связь становится более полярной, а затем переходит в ионную связь. Результатом процесса является диссоциация электролита и образование в растворе гидратированных ионов.
Так диссоциируют кислородсодержащие и бескислородные кислоты: H2SO4, HNO3, НI и др. Диссоциация электролитов с полярной связью может быть полной или частичной. Это зависит от полярности связей в молекулах электролитов.
Таким образом, главной причиной диссоциации в водных растворах является гидратация ионов. В растворах электролитов все ионы находятся в гидратированном состоянии. Например, ионы водорода соединяются с молекулой воды и образуют ионы гидроксония Н3O+ по донорно-акцепторному механизму:
Свойства ионов
Ионы по физическим, химическим и физиологическим свойствам отличаются от нейтральных атомов, из которых они образовались. Например, ионы натрия Na + и хлорид-ионы Сl — не взаимодействуют с водой, не имеют цвета, запаха, неядовиты.
Атомы натрия Na 0 энергично взаимодействуют с водой. Вещество хлор C12 в свободном состоянии — газ желто-зеленого цвета, ядовит, сильный окислитель.
Различные свойства атомов и ионов одного и того же элемента объясняются разным электронным строением этих частиц. Химические свойства свободных атомов металлов определяются валентными электронами, которые атомы металлов легко отдают и переходят в положительно заряженные ионы. Атомы неметаллов легко присоединяют электроны и переходят в отрицательно заряженные ионы. Ионы находятся в более устойчивых электронных состояниях, чем атомы.
Степень диссоциации
В водных растворах некоторые электролиты полностью распадаются на ионы. Другие электролиты распадаются на ионы частично, часть их молекул остается в растворе в недиссоциированном виде.
Число, показывающее, какая часть молекул распалась на ионы, называется степенью электролитической диссоциации (степенью ионизации).
Степень электролитической диссоциации (α) равна отношению числа молекул, которые распались на ионы, к общему числу молекул в растворе:
где n — число молекул, распавшихся на ионы; N — общее число растворенных молекул.
Например, степень диссоциации (α) уксусной кислоты СН3СООН в 0,1 М растворе равна 1,36%. Это означает, что из 10000 молекул СН3СООН 136 молекул распадаются на ионы по уравнению:
Степень диссоциации зависит от природы растворителя и природы растворяемого вещества, концентрации раствора, температуры и других факторов.
Различные вещества диссоциируют в разной степени. Например, муравьиной кислоты НСООН при одинаковых условиях больше α уксусной кислоты СН3СООН.
При уменьшении концентрации электролита, т. е. при разбавлении раствора, степень диссоциации увеличивается, так как увеличиваются расстояния между ионами в растворе и уменьшается возможность соединения их в молекулы.
При повышении температуры степень диссоциации, как правило, увеличивается.
В зависимости от степени диссоциации электролиты делятся на сильные и слабые.
Сильные электролиты — это такие электролиты, которые в водных растворах полностью диссоциируют на ионы, т. е. их степень диссоциации равна 1 (100%). К сильным электролитам относятся: 1) соли; 2) сильные кислоты (HClO4, НСlO3, НNО3, H2SO4, HCl, НВr, HI и др.); 3) щелочи (LiОН, NaOH, КОН, RbOH, СsОН, Ca(OH)2, Sr(OH)2, Ba(OH)2.
Слабые электролиты — это такие электролиты, которые в водных растворах не полностью диссоциируют на ионы, т. е. их степень диссоциации меньше 1 (100%). К слабым электролитам относятся: 1) слабые кислоты (НСlO2, HClO, HNO2, H2SO3, Н2СO3, H2SiO3, Н3РО4, H3РО3, H3BO3, СН3СООН, Н2S, HCN, HF и др.); 2) слабые нерастворимые в воде основания Fe(OH)2, Pb(OH)2, Cu(OH)2 и др.); 3) гидроксид аммония (NH4OH); 4) вода (Н2О).
Константа диссоциации (ионизации)
Для характеристики слабых электролитов применяют константу диссоциации (Kд). Вследствие того, что слабые электролиты диссоциируют на ионы не полностью, в их растворах устанавливается динамическое равновесие между недиссоциированными молекулами и ионами. Для слабого электролита общей формулы АnВm уравнение диссоциации имеет вид:
Применяя закон действующих масс, запишем выражение константы равновесия:
Константу равновесия в этом случае называют константой диссоциации (Kд), или константой ионизации.
Константа ионизации характеризует способность электролита диссоциировать на ионы. Чем больше константа диссоциации, тем легче электролит распадается на ионы, тем больше ионов в его растворе, тем сильнее электролит. Например:
Следовательно, уксусная кислота СН3СООН более сильный электролит, чем циановодородная кислота HCN.
Для слабого электролита константа диссоциации — постоянная величина при данной температуре, которая не зависит от концентрации раствора. Константа диссоциации зависит от природы электролита, природы растворителя и температуры. Константы диссоциации некоторых слабых электролитов приведены в таблице.
Значение электролитов для живых организмов
Электролитическая диссоциация воды. Водородный показатель



Важной особенностью жидкой воды является ее способность к самопроизвольной диссоциации по реакции:
воды к другим. Обычно в уравнениях для простоты используют только катион состава Н3О + (Н + ×H2O), называемый ионом гидроксония.
Вода – слабый электролит, степень диссоциации которого
Поскольку 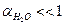
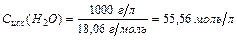
Таким образом, произведение двух постоянных величин 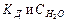
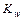
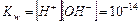
¾- В чистой воде концентрации водородных и гидроксильных ионов равны и при нормальных условиях составляют:
На практике для удобства используют водородный показатель (рН) и гидроксильный показатель (рОН) среды.
В водных растворах рН + рОН = 14.
| Растворы | ||
| Нейтральные | Кислые | Щелочные |
| рН = 7 | рН 7 |
Kw зависит от температуры (т.к. диссоциация воды – эндотермический процесс)
Измерение рН используется чрезвычайно широко. В биологии и медицине величина рН биологических жидкостей служит для определения патологий. Например, в норме рН сыворотки крови состовляет 7,4±0,05; слюны – 6,35..6,85; желудочного сока – 0,9..1,1; слез – 7,4±0,1. В сельском хозяйстве рН характеризует кислотность почв, экологическое состояние природных вод и т.д.
Кислотно-основными индикаторами называются химические соединения, изменяющие свою окраску в зависимости от рН среды, в которой они находятся. Вы, наверное, обращали внимание на то, как меняется цвет чая, если в него положить лимон – это пример действия кислотно-основного индикатора.
Индикаторы, как правило, представляют собой слабые органические кислоты или основания и могут существовать в растворах в виде двух таутомерных форм:
Поведение индикатора подобно поведению слабого электролита в присутствии более сильного с одноименным ионом. Чем больше [H + ] следовательно равновесие смещается в сторону существования кислотной формы HInd и наоборот (принцип Ле-Шателье).
Опыт показывает наглядно возможность использования некоторых индикаторов:
| Индикатор | рН 7 | ||
| Метилоранж | красный | оранжевый | желтый |
| Фенолфталеин | бесцветный | бесцветный | малиновый |
| Лакмус | красный | Фиолетовый | синий |
Специальные приборы – рН-метры позволяют измерять рН с точностью до 0,01 в интервале от 0 до 14. Определение основано на измерении ЭДС гальванического элемента, один из электродов которого является, например, стеклянным.
Наиболее точно концентрацию водородных ионов можно определить методом кислотно-основного титрования. Титрование – это процесс постепенного добавления небольшими порциями раствора известной концентрации (титранта) к титрируемому раствору, концентрацию которого хотим определить.
Буферные растворы – это системы, рН которых относительно мало изменяется при разбавлении или добавлении к ним небольших количеств кислот или щелочей. Чаще всего они представляют собой растворы, содержащие:
a) а)Слабую кислоту и ее соль(СН3СООН + СН3СООNa) – ацетатный буфер
в)Слабое основание и его соль(NH4OH + NH4Cl) – аммиачно-аммонийный буфер
с)Две кислые соли с разными Kд (Na2HPO4 + NaH2PO4) – фосфатный буфер
Регулирующий механизм буферных растворов рассмотрим на примере ацетатного буферного раствора.
1. 1)если добавить небольшое количество щелочи к буферной смеси:
NaOH нейтрализуется уксусной кислотой с образованием более слабого электролита H2O. Избыток натрия ацетата смещает равновесие в сторону образовавшейся кислоты.
2. 2)если добавить небольшое количество кислоты:
CH3COONa + HCl « CH3COOH + NaCl
Найдем концентрацию ионов водорода в буферном ацетатном растворе:
Таким образом, рН буферных систем определяется соотношением концентраций соли и кислоты. При разбавлении это соотношение не меняется и рН буфера не меняется при разбавлении, это отличает буферные системы от раствора чистого электролита, для которого справедлив закон разведения Оствальда.
Существует две характеристики буферных систем:
1.Буферная сила. Абсолютная величина буферной силы зависит от
общей концентрации компонентов буферной системы, т.е. чем больше концентрация буферной системы, тем больше требуется щелочи (кислоты) для одного и того же изменения рН.
2.Буферная емкость (В). Буферная емкость – это предел, в котором проявляется буферное действие. Буферная смесь поддерживает рН постоянным только при условии, что количество прибавляемых к раствору сильной кислоты или основания не превышает определенной предельной величины – В. Буферная емкость определяется числом г/экв сильной кислоты (основания), которое необходимо прибавить к одному литру буферной смеси, чтобы изменить значение рН на единицу, т.е. 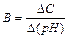
1. 1.[H + ] мало зависит от разбавления.
2. 2.Прибавление сильных кислот (оснований) мало изменяет [H + ] в пределах буферной емкости В.
3. 3.Буферная емкость зависит от буферной силы (от концентрации компонентов).
4. 4.Максимальное действие проявляет буфер в случае, когда кислота и соль присутствуют в растворе в эквивалентных количествах:
Гидролиз – это химическое взаимодействие воды с солями. Гидролиз солей сводиться к процессу передачи протонов. В результате его протекания появляется некоторый избыток водородных или гидроксильных ионов, сообщающих раствору кислотные или щелочные свойства. Таким образом, гидролиз обратен процессу нейтрализации.
Гидролиз солей включает 2 стадии:
акцептор – катионы с вакантными орбиталями)
с) Гидролиз по катиону. K + + HOH à KOH +
Гидролизу подвергаются все соли, образованные с участием слабых
1.Соль, образованная анионом слабых кислот и катионом сильных оснований [CH3COONa, NaClO, KNO2, Na2CO3, Na3PO4]
CH3COONa + HOH « CH3COOH + NaOH
Глубина протекания гидролиза определяется: степенью гидролиза aг:
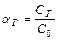
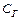
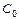
При гидролизе в системе устанавливается равновесие, характеризующееся Кр
Следовательно, чем меньше константа диссоциации, тем больше константа гидролиза. Степень гидролиза с константой гидролиза связана уравнением:
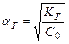
С увеличением разбавления, т.е. уменьшением С0, степень гидролиза увеличивается.
2. 2.Соль, образованная катионом слабых оснований и анионом сильных кислот [NH4Cl, AgNO3, ZnCl2, Fe2(SO4)3]
Равновесная концентрация ионов водорода может быть вычислена: [Н + ]равн = aг × С0 (исходная концентрация соли), где
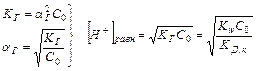
Кислотность среды зависит от исходной концентрации солей подобного вида.
Для определения рН среды раствора сравнивают КД,к и КД,осн
КД,к > КД,осн à среда слабо кислая
рН раствора также не зависит от концентраций соли в растворе.
Соли, образованные многозарядным анионом и однозарядным катионом (сульфиды, карбонаты, фосфаты аммония) практически полностью гидролизуются по первой ступени, т.е. находятся в растворе в виде смеси слабого основания NH4OH и его соли NH4HS, т.е. в виде аммонийного буфера.
Для солей, образованных многозарядным катионом и однозарядным анионом (ацетаты, формиаты Al, Mg, Fe, Cu) гидролиз усиливается при нагревании и приводит к образованию основных солей.
Гидролиз нитратов, гипохлоритов, гипобромитов Al, Mg, Fe, Cu протекает полностью и необратимо, т.е. соли не выделены из растворов.
Соли: ZnS, AlPO4, FeCO3 и др. в воде малорастворимы, тем не менее часть их ионов принимает участие в процессе гидролиза, это приводит к некоторому возрастанию их растворимости.
Сульфиды хрома и алюминия гидролизуются полностью и необратимо с образованием соответствующих гидроксидов.
4. 4.Соли, образованные анионом сильных кислот и сильных оснований гидролизу не подвергаются [KCl, Na2SO4, Ba(NO3)2].
Чаще всего гидролиз ‑ вредное явление, вызывающее различные осложнения. Так при синтезе неорганических веществ из водных растворов в получаемом веществе появляются примеси – продукты его гидролиза. Некоторые соединения из-за необратимо протекающего гидролиза вообще не удается синтезировать.
·-если гидролиз протекает по аниону, то в раствор добавляют избыток щелочи
·-если гидролиз протекает по катиону, то в раствор добавляют избыток кислоты
Итак, первая качественная теория растворов электролитов была высказана Аррениусом (1883 – 1887 г.). По этой теории:
1. 1.Молекулы электролита диссоциируют на противоположные ионы
2. 2.Между процессами диссоциации и рекомбинации устанавливается динамическое равновесие, которое характеризуется КД. Это равновесие подчиняется закону действия масс. Долю распавшихся молекул характеризует степень диссоциации a. КД и a связывает закон Оствальда.
3. 3.Раствор электролита (по Аррениусу) – это смесь молекул электролита, его ионов и молекул растворителя, между которыми отсутствует взаимодействие.
Вывод: теория Аррениуса позволила объяснить многие свойства растворов слабых электролитов при небольшой концентрации.
Однако, теория Аррениуса носила только физический характер, т.е. не рассматривала вопросы:
· По какой причине вещества в растворах распадаются на ионы?
· Что происходит с ионами в растворах?
Дальнейшее развитие теория Аррениуса получила в работах Оствальда, Писаржевского, Каблукова, Нернста и т.д. Например, на важное значение гидратации впервые указал Каблуков (1891), положив начало развитию теории электролитов в направлении, которое указывал Менделеев (т.е. ему впервые удалось объединить сольватную теорию Менделеева с физической теорией Аррениуса). Сольватация – это процесс взаимодействия электролита
молекулами растворителя с образованием комплексных соединений сольватов. Если растворителем является вода, следовательно, процесс взаимодействия электролита с молекулами воды называется гидратацией, а аквакомплексы – кристаллогидратами.
Рассмотрим пример диссоциации электролитов, находящихся в кристаллическом состоянии. Этот процесс возможно представить в две стадии:
1. 1.разрушение кристаллической решетки вещества DН 0 кр > 0, процесс образования молекул (эндотермический)
2. 2.образование сольватированных молекул, DН 0 сольв 0 раств = DН 0 кр + DН 0 сольв и может быть как отрицательной, так и положительной. Например, энергия кристаллической решетки KCl = 170 ккал/моль.
А вот ситуация, когда присутствует только одна из двух названных стадий:
1.растворение газов – нет первой стадии разрушения кристаллической решетки, остается экзотермическая сольватация, следовательно растворение газов, как правило, экзотермично.
2.при растворении кристаллогидратов отсутствует стадия сольватации, остается лишь эндотермическое разрушение кристаллической решетки. Например, раствор кристаллогидрата: CuSO4 × 5H2O (т) à CuSO4 × 5H2O (р)
Раствор безводной соли: CuSO4 (т) à CuSO4 (р) à CuSO4 × 5H2O (р)