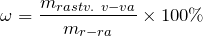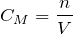Что такое дисперсная система в химии определение кратко
Дисперсная система

Всего получено оценок: 427.
Всего получено оценок: 427.
Чистое вещество в природе встречается довольно редко. Большинство из них не являются гомогенными, а состоят из смеси различных атомов и молекул. В статье мы поговорим о том, как вещества могут быть распределены в другом веществе и, при этом не смешиваться, дадим определение этому явлению.
Что это такое дисперсная система?
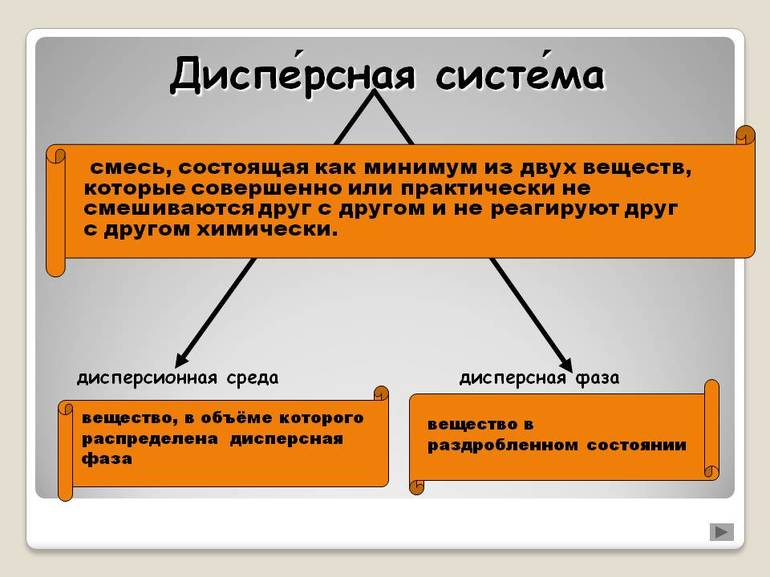
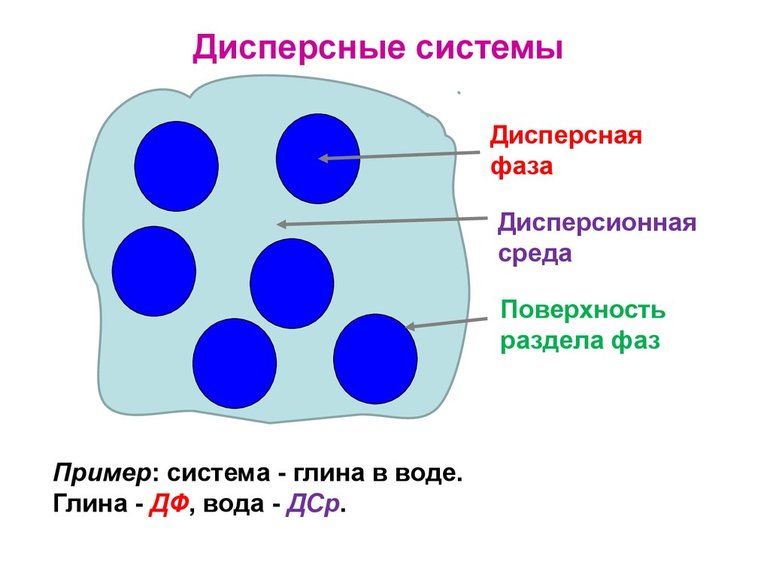
Дисперсная система – это гетерогенная структура, где мельчайшие частицы одного вещества равномерно распределены в другом веществе, при этом они не смешиваются и не контактируют химически. Компонент, который занимает больший объем, имеет название «среда». Компонент, имеющий меньший объем обозначается термином «дисперсная фаза». Частицы фазы и среда имеют между собой поверхность раздела. Именно поэтому дисперсные системы являются неоднородными, то есть гетерогенными.
Дисперсными называются частицы размером от 1 нм до 10 мкм.
Дисперсные системы (фазы и дисперсные частицы) могут иметь любое агрегатное состояние: жидкое, твердое, газообразное. Окружающий нас мир состоит из множества дисперсных систем. Примером может служить почва, морская вода, продукты и многое другое.
В дисперсной системе фаз может быть больше двух. В таком случае отделяют их друг от друга с помощью сепарирования, центрифугирования.
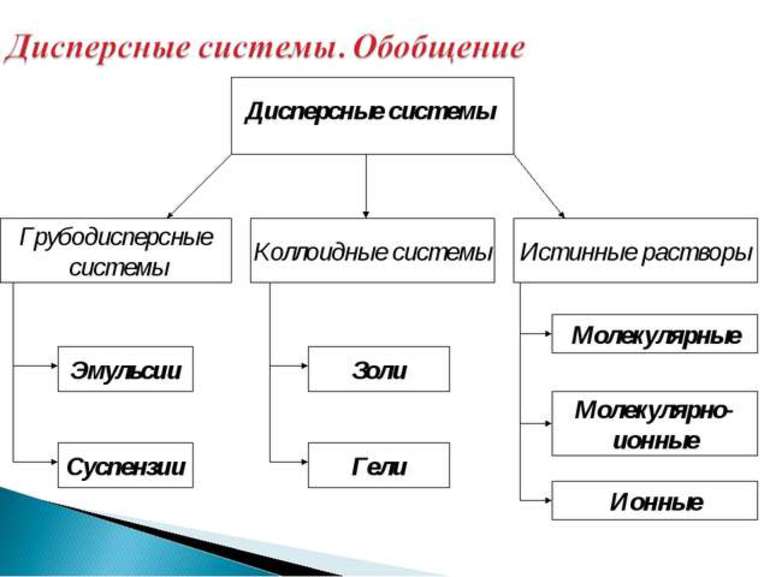
Классификация дисперсных систем
Как известно, дисперсные системы могут находится в трех агрегатных состояниях. Сочетания этих состояний позволяют выделить 9 видов двухфазных дисперсных систем (3 агрегатных состояния фаз и три агрегатных состояния среды). Рассмотрим таблицу «Дисперсная система»:
| Виды дисперсной системы | Дисперсная фаза | Дисперсионная среда | Название и пример |
| газ в газе | газообразная | газообразная | дисперсные системы не образуются |
| жидкость в газе | жидкая | газообразная | аэрозоли: туманы, облака |
| твердое тело в газе | твердая | газообразная | аэрозоли: пыль, дым |
| газ в жидкости | газообразная | жидкая | газовые эмульсии, пены |
| жидкость в жидкости | жидкая | жидкая | эмульсии: нефть, молоко |
| твердое тело в жидкости | твердая | жидкая | суспензии, золи: ил, взвесь |
| газ в твердом веществе | газообразная | твердая | пористые тела: пемза |
| жидкость в твердом веществе | жидкая | твердая | капилярные системы: грунт, почва |
| твердое вещество в твердом веществе | твердая | твердая | сплавы, бетон, композиционные материалы |
По наличию или отсутствию взаимодействия между частицами дисперсной фазы можно выделить два вида дисперсных систем:
Что мы узнали?
Дисперсная система – гетерогенная среда, состоящая из двух или более фаз и дисперсионной среды. Системы могут существовать во всех трех агрегатных состояниях. Благодаря этому формируются 9 видов двухфазных дисперсных систем.
Дисперсные системы и растворы
Дисперсные системы и их виды
Существует классификация дисперсных систем по размеру частиц дисперсной фазы. Выделяют, молекулярно-ионные ( 100 нм) системы.
Различают гомогенные и гетерогенные дисперсные системы. Гомогенные системы по-другому называют истинными растворами.
Растворы
По агрегатному состоянию растворы делят на газообразные (воздух), жидкие, твердые (сплавы). В жидких растворах существует понятие растворителя и растворенного вещества. В большинстве случаев растворителем служит вода, однако это могут быть и неводные растворители (этанол, гексан, хлороформ).
Способы выражения концентрации растворов
Для выражения концентрации растворов используют: массовую долю растворенного вещества (
Молярная концентрация (СМ, моль/л) показывает, сколько моль растворенного вещества содержится в одном литре раствора. Растворыс концентрацией 0,1 моль/л называют децимолярными, 0,01 моль/л – сантимолярными, а с концентрацией 0,001 моль/л – миллимолярными.
Нормальная концентрация (СН, моль-экв/л) показывает число эквивалентов растворенного вещества в одном литре раствора.
Моляльная концентрация (Сm, моль/1кг H2O) – число моль растворенного вещества, приходящееся на 1 кг растворителя, т.е. на 1000 г воды.
Мольная доля растворенного вещества (N) – это отношение числа моль растворенного вещества к числу моль раствора. Для газовых растворов мольная доля вещества совпадает с объемной долей ( φ).
Растворимость
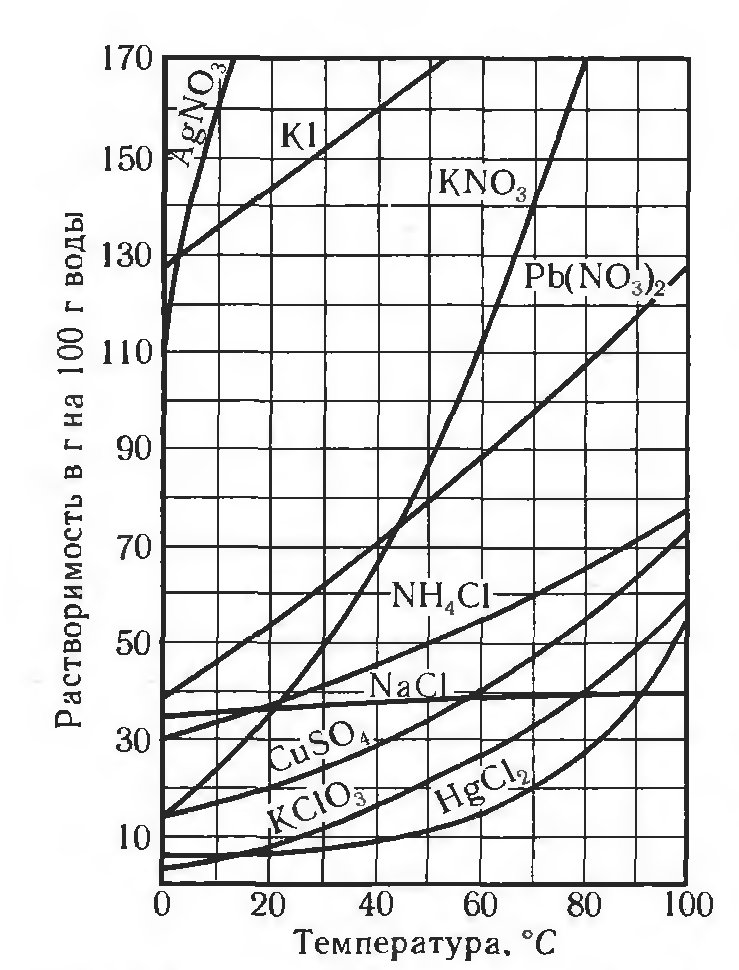
По растворимости растворы и вещества делят на 3 группы: хорошо растворимые (сахар), малорастворимые (бензол, гипс) и практически нерастворимые (стекло, золото, серебро). Абсолютно нерастворимых веществ в воде нет, нет приборов, с помощью которых возможно вычислить количества вещества, которое растворилось. Растворимость зависит от температуры (рис. 1), природы вещества и давления (для газов). При повышении температуры, растворимость вещества увеличивается.
Рис. 1. Пример зависимости некоторых солей в воде от температуры
С понятием растворимости тесно связано понятие насыщенного раствора, поскольку растворимость характеризует массу растворенного вещества в насыщенном растворе. Пока вещество способно растворяться раствор называют ненасыщенным, если вещество перестает растворяться – насыщенным; на некоторое время можно создать пересыщенный раствор.
Давление пара растворов
Пар, находящийся в равновесии с жидкостью называется насыщенным. При заданной температуре давление насыщенного пара над каждой жидкостью – величина постоянная. Поэтому каждой жидкости присуще давление насыщенного пара. Рассмотрим это явление на следующем примере: раствор неэлектролита (сахарозы) в воде – молекулы сахарозы значительно больше молекул воды. Давление насыщенного пара в растворе создает растворитель. Если сравнить между собой давление растворителя и давление растворителя над раствором при одинаковой температуре, то в растворе число молекул, перешедших в пар над раствором меньше, чем в самом растворе. Отсюда следует, что давление насыщенного пара растворителя над раствором всегда ниже, чем над чистым растворителем при той же температуре.
Если обозначить давление насыщенного пара растворителя над чистым растворителем p0, а над раствором – p, то относительное понижение давления пара над раствором будет представлять собой (p0-p)/p0.
На основании этого Ф.М. Рауль вывел закон: относительное понижение насыщенного пара растворителя над раствором равно молярной доле растворенного вещества : (p0-p)/p0 = N (молярная доля растворенного вещества).
Криоскопия. Эбулиоскопия. Второй закон Рауля
Понятия криоскопии и эбулиоскопии тесно связаны с температурами замерзания и кипения растворов, соответственно. Так, температура кипения и кристаллизация растворов зависят от давления пара над раствором. Любая жидкость кипит при той температуре, при которой давление ее насыщенного пара достигает внешнего (атмосферного давления).
При замерзании кристаллизация начинается при той температуре, при которой давление насыщенного пара над жидкой фазой равно давлению насыщенного пара над твердой фазой. Отсюда – второй закон Рауля: понижение температуры кристаллизации и повышение температуры кипения раствора пропорционально концентрациям растворенного вещества. Математическое выражение этого закона:
где К и Е криоскопическая и эбулиоскопическая константы, зависящие от природы растворителя.
Примеры решения задач
| Задание | Какое количество воды и 80%-го раствора уксусной кислоты следует взять для получения 200 г 8%-го раствора? |
| Решение | Записываем формулу для нахождения массовой доли: |
Пусть масса 80% раствора уксусной кислоты равна х г. Найдем массу растворенного в нем вещества:
mр.в-ва(CH3COOH) =mр-ра × 
Найдем массу растворенного вещества в растворе 8%-й уксусной кислоты:
Масса 80% раствора уксусной кислоты равна 20 (г).
Найдем необходимое количество воды:
m(H2O) = 200 (г) – 20 (г) = 180 (г)
| Задание | Смешали 200 г воды и 50 г гидроксида натрия. Определите массовую долю гидроксида натрия в растворе. |
| Решение | Записываем формулу для нахождения массовой доли: |
Найдем массу раствора гидроксида натрия:
mр-ра (NaOH) = 200 +50 = 250 (г)
Найдем массовую долю гидроксида натрия:

 (NaOH)=20%
(NaOH)=20%| Задание | Определите массу 10%-го раствора карбоната натрия, которую нужно добавить к 1020 г 2%-го раствора, чтобы получить 3%-й раствор. |
| Решение | Записываем формулу для нахождения массовой доли: |
Найдем массу растворенного карбоната натрия в его 2%-м р-ре:
m(Na2CO3) в 2%-м р-ре = mр-ра(Na2СO3)2% × 
m(Na2CO3) в 2%-м р-ре = 1020 × 0,02 = 20,4г
Найдем массу растворенного карбоната натрия в его 10%-м р-ре:
Тогда масса 3%-го раствора карбоната натрия:
А масса растворенного карбоната натрия в нем:
m(Na2CO3) в 3%-м р-ре = (х + 1020) × 0,03 (г)
Найдем массу растворенного карбоната натрия в конечном растворе:
Понятие и определение
Дисперсные системы представляют собой гетерогенные структуры, внутри которых одно или более веществ распределяются в другом. Они никак не контактируют друг с другом, химические или иные реакции полностью отсутствуют. Нет и смешения. Фактически каждый элемент является самостоятельным, и если его извлечь, он сохраняет свое изначальное состояние.
То вещество, которого больше всего в соединении, называется дисперсной средой, второстепенное — фазой. Частицы между собой не взаимодействуют, даже имеется некая прослойка, которая разделяет их. Поэтому системы являются гетерогенными или неоднородными.
Примеры дисперсных систем встречаются в природе постоянно — морская вода, почва, большинство продуктов питания и т. д. Они могут иметь любое агрегатное состояние. Иногда в среде находится сразу несколько фаз. Тогда их выделяют с помощью центрифуги или методом сепарирования.
Классификация по агрегатному состоянию
Классификация дисперсных систем осуществляется в соответствии с агрегатными состояниями вещества. Их имеется три вида: жидкое, твердое и газообразное. Поэтому разделение происходит на 9 основных категорий, примеры и описание которых можно посмотреть в таблице ниже.
| Вид | Среда | Фаза | Пример |
| Газ х 2 | Газ | Газ | Отсутствуют |
| Жидкость+газ | Газ | Жидкость | Туман, облако |
| Твердое тело (далее ТТ)+газ | Газ | ТТ | Дым, пыль |
| Газ+жидкость | Жидкость | Газ | Любая пена |
| Жидкость х 2 | Жидкость | Жидкость | Молоко |
| ТТ+жидкость | Жидкость | ТТ | Известь, ил |
| Газ+ТТ | ТТ | Газ | Пемза |
| Жидкость+твердое тело | ТТ | Жидкость | Грунт |
| ТТ+ТТ | ТТ | ТТ | Любые композиционные материалы, такие как бетон или цемент |
Каждый тип классификации, в свою очередь, имеет свое название. К примеру, газообразные соединения называются преимущественно аэрозолями, за редким исключением. Жидкие вещества — газовые эмульсии или суспензии. Взаимодействия, когда средой является твердое тело, определяются, как сплавы, капиллярные системы или пористые субстанции.
Существующие виды
Фазные частицы могут взаимодействовать между собой. При этом среда остается стабильной, химические реакции с ней отсутствуют. В зависимости от типа интерактивности, формируются виды дисперсных систем:
Некоторые субстанции могут быть одновременно двумя видами. Отдельные золи при нормальной температуре являются достаточно текучими, чтобы определить их, как свободнодисперсные. Однако, если градус уменьшается, молекулы соединяются друг с другом сильнее, приобретая характеристики твердого тела. Поэтому переходят в связнодисперсную форму.
Взвеси и их особенности
Те дисперсные системы, фазы в которых можно легко определить невооруженным глазом, называются взвесями. Их характерная черта — непрозрачность. Если необходимо отделить среду и второстепенное вещество, можно воспользоваться рядовыми фильтрами, или процедурой отстаивания. Категорию разделяют на несколько видов:
Взвеси важны в деятельности человека, равно как природных процессах. Почти все производство построено на применении растворов (удобрения, металлы, бумага и пр.). В окружающем мире естественные соединения с водой тоже встречаются постоянно, например, почвообразование или насыщение грунта полезными веществами. В жизнедеятельности всех живых существ они тоже принимают непосредственное участие.
Коллоидные системы
В отличие от взвесей, коллоидные системы невозможно разделить без использования современной техники или специальных препаратов. Без нужного инструмента и невооруженным глазом они выглядят, как однородная субстанция. Из-за этого определить дисперсность становится сложно. Подразделяются на два типа:
Если взвеси играют большую роль в природных процессах, то коллоидные системы являются неотъемлемой частью химии. Чаще всего они добываются посредством смешивания в специальном оборудовании. Без подобной структуры не удалось бы создать множество лекарственных препаратов, удобрений и других полезных материалов.
Высокомолекулярные вещества
Растворы высокомолекулярных веществ бывают двух видов: истинные и коллоидные. Все зависит от разных качеств, таких как тип фазы, среды, температуры и иных условий. У них есть ряд свойств:
Отдельные полимерные растворы образуются самопроизвольно. Когда процесс набухания образуется неорганическим способом, дисперсная система перестает существовать, поскольку фаза полностью растворяется в среде, образуется химическая реакция. Если же он органический, то появляется студень.
Ключевые свойства
Свойства дисперсных систем определяются по одному основному фактору — при их возникновении образуется четкая межфазная граница. Также появляется некоторое значение поверхностной энергии, которая не комбинируется, рассматривается в отдельном порядке по отношению к среде и фазе.
В природе и продуктах жизнедеятельности человека встречаются грубодисперсные системы. Здесь фазу и среду легко можно отличить под стандартным микроскопом, а то и вовсе невооруженным глазом. Но если рассматривать ее в целом, то она представляет собой сложную совокупность коллоидных веществ.
В свою очередь, тонкодисперсные системы являются настолько мелкими, что рассмотреть их можно только в специальный ультразвуковой микроскоп. В некоторых случаях даже при направленном в жидкость луче не появляется характерной «дорожки». Несмотря на существенные различия, свойства везде одинаковы. Они зависят от таких показателей, как:
В жизни человека рассматриваемые системы встречаются постоянно. Такое явление может быть как природным и естественным, так и выводимым в искусственном виде. Многочисленные лекарственные смеси, различные минеральные или химические удобрения, а также производственные процессы построены на дисперсности.
Понятие дисперсных систем и их классификация
Дисперсные системы — что это такое в химии
Чистые вещества встретить в природном мире практически невозможно. В большинстве случаев они представляют собой гомогенную субстанцию, содержащую в своем составе частицы различных примесей. При этом не является обязательным наличие двух компонентов в смеси. Их количество может быть любым. Если одно вещество равномерно распределено в другом и не растворяется в нем, то такая система называется дисперсной системой.
Дисперсная система — гетерогенная (не однородная система), состоящая минимум из двух компонентов (фаз), один из которых (называемый дисперсной фазой) равномерно распределен по объему другого (называемого дисперсионной средой).
В составе типичной двухфазной системы выделяют:
В том случае, когда в системе несколько фаз, их можно отделить друг от друга. Для этого используют разные физические способы, к примеру, центрифугирование, сепарация. Типичные дисперсные системы относятся к коллоидным растворам (золям).
Характеристика и особенности строения
Дисперсные системы являются гетерогенными смесями, в которых одно или более веществ распределены в другом. Каждый компонент системы обладает собственными свойствами. После извлечения его из системы его состояние будет соответствовать начальному.
Вещество, содержание которого в дисперсной системе выше, называют дисперсионной средой.
Второстепенное вещество является дисперсной фазой. В дисперсной системе не наблюдается взаимное взаимодействие между частицами. При этом имеется некая прослойка, которая их разделяет. Функцию этой прослойки выполняет вещество, образующее дисперсионную среду. В связи с этим системы называют гетерогенными или неоднородными.
В качестве примеров дисперсных систем можно привести:
Перечисленные системы могут обладать любым агрегатным состоянием. В некоторых случаях допускается наличие одновременно нескольких фаз. Выделить их можно с использованием центрифуги или сепарированием.
Дисперсная фаза — вещество, равномерно распределенное в окружающей ее дисперсионной среде и не взаимодействующее с ней либо с другой дисперсной фазой при ее наличии в дисперсной системе.
Дисперсная фаза может состоять из аналогичных или неодинаковых по величине частиц, капель, либо пузырьков, которые расположены на некотором расстоянии друг от друга. По кинетическим свойствам (подвижность фазы), выделяют следующие типы дисперсных систем:
Свойства, которые характеризуют дисперсные системы, зависят от одного ключевого фактора. В результате их формирования образуется четкая межфазная граница.
В природе чаще можно встретить грубодисперсные системы. В этом случае фазу и среду различают при рассмотрении под микроскопом, а иногда и невооруженным глазом.
Рассмотренные системы характеризуются следующими показателями:
В окружающей среде дисперсные системы встречаются повсеместно. Они могут быть природного и естественного происхождения. Существуют системы, выводимые в искусственном виде. В основе разных лекарственных составов, минеральных и химических удобрений, технологических процессов лежит явление дисперсности.
Классификация дисперсных систем
Дисперсные системы являются образованиями, в состав которых включено две фазы и более, почти не смешивающихся и не взаимодействующих друг с другом. В одном веществе, определяемом как дисперсионная среда, распределено другое вещество в виде дисперсной фазы. В зависимости от размеров частиц дисперсной фазы, системы классифицируют таким образом:
За основу максимально полной классификации дисперсных систем принимают агрегатное состояние среды и фазы. Благодаря сочетаниям трех типов агрегатного состояния, выделяют девять разновидностей двухфазных дисперсных систем.
Краткая запись таких систем имеет вид дроби с числителем, указывающим на дисперсную фазу, и знаменателем, определяющим дисперсионную среду. В качестве примера можно привести обозначение Г/Ж для системы «газ в жидкости».
Исходя из характера кинетических свойств фазы, двухфазные дисперсные системы разделяют на два класса:
Рассмотренные дисперсные системы разделяют согласно степени дисперсности. В том случае, когда частицы дисперсной фазы в системе обладают идентичными размерами, такую систему называют монодисперсной. Если частицы фазы отличаются по размерам, то система является полидисперсной. Чаще в реальном мире можно встретить полидисперсные системы.
Существуют примеры дисперсных систем, которые отличаются большим количеством фаз. Такие комплексы называют сложными дисперсными системами. В качестве примера можно рассмотреть процесс вскипания жидкой дисперсионной среды с твердой дисперсной фазой, который приводит к образованию трехфазной системы «пар — капли — твердые частицы».
К сложным дисперсным системам можно отнести молоко. В веществе содержатся в большой концентрации, за исключением воды, жир, казеин, молочный сахар. Жир в молоке имеет вид эмульсии, в процессе хранения продукта он медленно поднимается наверх, образуются сливки.
Казеин является коллоидным раствором и не способен самостоятельно выделяться. С другой стороны, казеин достаточно просто выпадает в осадок в процессе подкисления молока, к примеру, с помощью уксуса. В результате образуется творог. Естественное выделение казеина можно наблюдать, когда молоко скисает. Молочный сахар в молоке представляет собой молекулярный раствор, который способен выделяться только в процессе испарения воды.
Классификация свободнодисперсных систем в зависимости от размеров частиц:
Ультрамикрогетерогенные системы по-другому называют коллоидными или золями. Исходя из того, какова природа дисперсионной среды, золи классифицируют следующим образом:
Микрогетерогенные системы представлены следующими типами:
Среди наиболее распространенных грубодисперсных систем можно отметить комплексы «твердое тело — газ». Примером такой системы является песок.
Взвеси — являются дисперсионными системами, в которых фазы хорошо различимы визуально даже невооруженным глазом.
Ключевой характеристикой взвесей служит непрозрачность. При необходимости отделения среды и второстепенного вещества допустимо использовать стандартные фильтры или провести процедуру отстаивания. Классификация взвесей:
Взвеси обладают большим значением для хозяйственной деятельности человека и природных процессов. В производстве активно применяют растворы. В окружающей среде распространены натуральные водные соединения, благодаря которым образуются почвы, и грунт насыщается питательными веществами. Взвеси являются непосредственными участниками жизнедеятельности всех живых существ.
Коллоидные системы важны для биологии и жизни человека. Биологические жидкости организма состоят из веществ, которые находятся в коллоидном состоянии. Такие биологические объекты, как клетки мышц и нервов, рассматривают в качестве коллоидных растворов. Дисперсионная среда крови представлена в виде плазмы, то есть водного раствора неорганических солей и белков.
Коллоидные системы отличаются от взвесей тем, что их разделение возможно лишь при наличии современного оборудования и специальных препаратов. Визуально данные комплексы можно идентифицировать, как однородные субстанции. По этой причине затруднено определение дисперсности коллоидных систем. Выделяют следующие типы:
Коллоидные системы имеют большое значение для химии. Данные системы получают с помощью смешивания в специальной технике. Производство подобных структур способствует созданию множества медицинских средств, удобрений и других полезных материалов.
Типы растворов высокомолекулярных веществ:
Принадлежность к той или иной группе определяется качествами высокомолекулярного вещества такими, как:
Свойства высокомолекулярных веществ:
Самопроизвольное образование характерно для определенных полимерных растворов. В том случае, когда набухание выполняется неорганическим методом, дисперсная система прекращает свое существование. Это связано с полным растворением фазы в среде, что сопровождается химической реакцией. Если метод набухания органический, то можно наблюдать получение студня.
Отдельно выделяют связнодисперсные системы, к которым относят пористые материалы. В зависимости от размеров пор, данные вещества классифицируют таким образом (классификация М.М. Дубинина):
Согласно рекомендациям ИЮПАК, микропористыми называют пористые материалы с размерами пор до 2 нм, мезопористыми — от 2 до 50 нм, макропористыми — свыше 50 нм.
Классификация пористых материалов в зависимости от структуры:
В зависимости от геометрических признаков пористые структуры классифицируют следующим образом:
Большинство пористых материалов обладают стохастической структурой.
В качестве примера твердых гетерогенных систем можно привести композитные материалы. Композиты являются искусственно полученными сплошными, но неоднородными структурами. В состав данных материалов может быть включено два компонента и более. Отличительной особенностью являются четкие границы раздела между составными элементами. Кроме слоистых, большинство компонентов композитных материалов подразделяются на следующие группы:
Старейшими композитами являются саман, железобетон, булат, папье-маше. В современной промышленности активно практикуют применение фиброармированных пластиков, стеклопластика, металлокерамики.
Движение дисперсных систем
Движение дисперсных систем изучает наука механика многофазных сред. К примеру, для исследования в области пристеночных течений системы «газ — жидкие капли» используют математическое моделирование. На основе полученных данных разрабатывают технологии нанесения разнообразных покрытий и оптимизируют различное теплоэнергетическое оборудование — такое, как паротурбинные установки и теплообменники.
С другой стороны, наличие разных типов структуры пристеночных течений многофазных сред делает необходимым учет различных факторов — таких, как инерционность капель, формирование жидкой пленки, фазовые переходы. Данные задачи решают путем конструирования особых математических моделей многофазных сред, разработки которых активно ведутся в настоящее время.
Возможности для изучения аналитическим методом нестационарных газодинамических течений многофазных дисперсных сред с несущей фазой в виде газа, которая включает в себя мелкие частицы твердого или жидкого вещества, значительно ограничены. В этом случае предпочтение отдается способам вычислительной механики.
Актуальны исследования подобных течений, когда существуют интенсивные фазовые переходы. В качестве примера можно привести:
При рассмотрении свободнодисперсных систем, среда в которых представлена в газообразном или жидком агрегатном состоянии — например, аэрозолей, коллоидных растворов, газовых эмульсий, мицеллярных растворов поверхностно-активных веществ, — можно сделать вывод о подвижности дисперсных частиц. Они могут совершать вращательные движения, колебания с неодинаковой амплитудой.
Подвижность дисперсных частиц, особенно высокодисперсных и ультрадисперсных, является фундаментальным свойством свободнодисперсных систем. Дисперсные частицы движутся за счет различных факторов. Процесс определяется размером частиц. Для высокодисперсных частиц характерны малые размеры, что способствует их активному участию в броуновском движении. Такое явление рассматривают в качестве проявления молекулярно-кинетических свойств дисперсных систем.
Другим молекулярно-кинетическим свойством является диффузия дисперсных частиц, в процессе которой они перемещаются по причине неодинаковой концентрации в разных участках дисперсной системы. Благодаря диффузии, концентрация частиц постепенно становится однородной. Согласно второму началу термодинамики, при диффузии можно наблюдать увеличение энтропии дисперсной системы.
Дисперсные частицы, обладающие большими размерами (в том числе, твердые частицы, капли, газовые пузыри), почти не принимают участия в броуновском движении. Таким образом, для грубодисперсных систем не характерны молекулярно-кинетические свойства. Данный признак позволяет квалифицировать системы на высокодисперсные и грубодисперсные.
Основная причина движения крупных дисперсных частиц заключается в разнице между плотностями дисперсной фазы и дисперсионной среды. В том случае, когда плотность дисперсной фазы больше, частицы медленно выпадают в осадок в результате воздействия силы тяжести. Такое явление называют седиментацией. Частицы, которые обладают меньшим весом, всплывают на поверхность. Тогда процесс называют обратной седиментацией.
На движение дисперсных частиц оказывают влияния другие внешние силы. Большое значение для коллоидной химии имеет движение заряженных частиц дисперсной фазы в электрическом поле. Такой процесс носит название электрофорез.
В отдельную группу выделяют перемещения дисперсных частиц, происходящие совместно с движущейся дисперсионной средой. Данные потоки являются двухфазными и обладают рядом существенных отличий от однофазных потоков газов или жидкостей.
К примеру, наличие в жидком веществе малого количества дисперсных частиц способствует увеличению степени вязкости дисперсной системы в сравнении с аналогичными показателями дисперсионной среды.