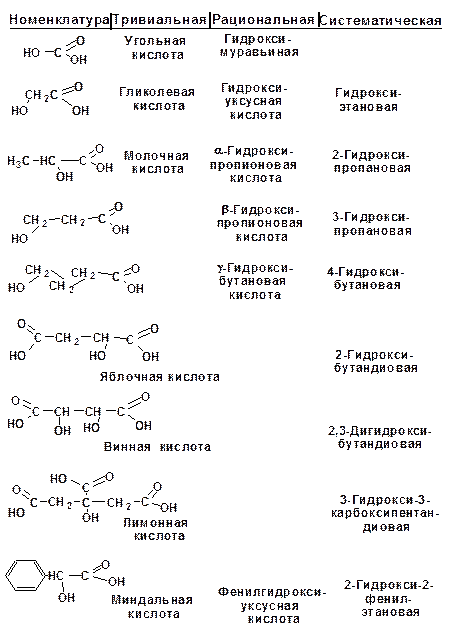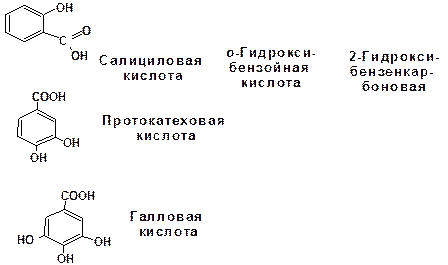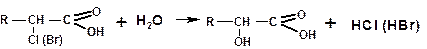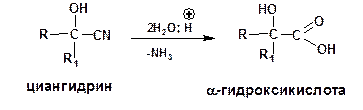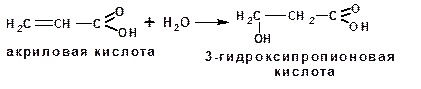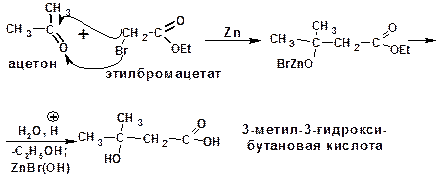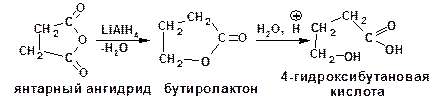Что такое бифункциональное соединение
Бифункциональные соединения
Гидроксикислоты
3.1.1. Классификация, номенклатура, изомерия
Определение. Карбоновые кислоты, содержащие наряду с карбоксильной группой одну или несколько гидроксильных групп, называются гидроксикислотами.
По числу гидроксильных групп, включая входящую в карбоксильную группу, определяют атомность гидроксикислот. По числу карбоксильных групп определяют основность гидроксикислоты.
Большинство гидроксикислот имеют тривиальные названия, сложившиеся исторически по их природному источнику. Например: молочная кислота, яблочная, виноградная, лимонная и т.д.
Рациональная номенклатура строится по тривиальному названию карбоновой кислоты. В названии ставится префикс гидрокси-, а буквой греческого алфавита обозначается положение гидроксигруппы.
Гомологический ряд одноосновных гидроксикислот начинается с гидроксимуравьиной или угольной кислоты. Далее следует гликолевая или гидроксиуксусная. Две первые кислоты не имеют структурных изомеров.
Следующий гомолог может существовать в виде двух изомеров, различающихся положением гидроксильной группы: это молочная, или α-гидроксипропионовая, и β-гидроксипро-пионовая кислота.
Однако наиболее распространенной формой изомерии для гидроксикислот является оптическая изомерия, которая обычно рассматривается на примере этих соединений.
Способы получения
3.1.2.1. Получение α-гидроксикислот
α-Хлор- или бромкарбоновые кислоты, получаемые по реакции Гелля–Форльгарда–Зелинского (п. 1.3.5), легко превращаются в α-гидроксикислоты при нагревании в воде:
Другим распространенным путем получения является омыление циангидринов или гидроксинитрилов:
3.1.2.2. Получение β-гидроксикислот
Присоединением воды к α,β-ненасыщенным кислотам получают β-гидроксикислоты:
Общим способом получения β-гидроксикислот является реакция Реформатского:
3.1.2.3 Получение γ-гидроксикислот
γ-Гидроксикислоты получаются при гидролизе циклических сложных эфиров, так называемых лактонов. Сами лактоны получаются при восстановлении циклических ангидридов:
Дата добавления: 2018-09-24 ; просмотров: 2377 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Статья по теме: Бифункциональные соединения
Предметная область: полимеры, синтетические волокна, каучук, резина
Для получения блок-сополимеров используют как полимеры, так и олигомерные бифункциональные соединения, концевые группы которых могут инициировать реакцию. Так, полипропиленоксид, содержащий концевые гидроксильные группы, может быть использован для инициирования полимеризации этиленоксида с образованием блок-сополимеров («плюроники») следующего строения:[3, С.65]
С хлорсульфоновыми группами взаимодействуют с образованием поперечных связей также многие бифункциональные соединения, например оловоорганнчсскне, олигомсры с гидрок-снметильными, эпоксидными и другими функциональными группами.[6, С.180]
При поликонденсации бифункциональных соединений образуются линейные полимеры (табл. 5.4). Если функциональность мономера больше двух, то образуются разветвленные и трехмерные полимеры. Количество функциональных групп в макромолекуле при этом возрастает по мере углубления реакции. Для синтеза волокнообразующих полимеров наибольший интерес представляют бифункциональные соединения.[2, С.263]
Исходными продуктами для синтеза силоксановых каучуков обычно служат бифункциональные органосиланы RR’SiX2, где R и R’ — органические радикалы (например, СН3, С2Н5, CeHs, CF3CH2CH2, NCCH2CH2, CH2 = СН; иногда R’ = H), а X — алк-окси-, ацилокси-, аминогруппы, атомы галогена, водорода и другие функциональные группы. Наиболее доступны диорганодихлорси-ланы RR’SiCl2, методы синтеза которых описаны в [2, 18, 19]. Их либо используют непосредственно для получения каучуков, либо предварительно получают из них циклосилоксаны, силан- и силоксандиолы и другие бифункциональные соединения, играющие роль мономеров.[1, С.465]
Бифункциональные соединения — диалкил (арил)дигидроксиси-ланы могут образовывать полимеры по схеме:[7, С.242]
Смешанные бифункциональные соединения, содержащие аминогруппы, например аминокислоты, также взаимодействуют с диизоцианатами. Проводя реакцию при достаточно низких температурах, чтобы свести к минимуму реакцию по карбоксильной группе, можно получить продукт моноприсоединения (т. е. производное мочевины) натриевой соли аминокислоты по аминогруппе [193][9, С.374]
Различные низкомолекулярные бифункциональные соединения были использованы для соединения полимерных цепей, содержащих реакцион-носпособные группы.[9, С.310]
Наиболее высокую эффективность проявляют бифункциональные соединения на основе п-оксвдифенил- и п-оксифенил-в-нафтшшми-[12, С.65]
Смеси, содержащие перекиси бензоила и дикумила, а также бифункциональные соединения, напр, бис-mpem-бутилпероксидиизопропилбензол, больше подвержены подвулканизации, чем смеси с аминами. Поэтому перекиси применяют обычно вместе с замедлителями подвулканизации, напр, с дисалицилальпроппленди-амином. Ускорители перекисной вулканизации Ф. к.— низкомолекулярные ненасыщенные соединения. При вулканизации перекисью бензоила применяют обычно Г»),М-метилен-<>ш;-акриламид, перекисью дикумила — диаллилтерефталат или бис-диаллиамид терефталевой к-ты. При использовании дитиолов в сочетании с третичными аминами получают смеси, не склонные к подвулканизации. При вулканизации Ф. к. полифункцио-[10, С.401]
Изучение полифункциональных природных соединений целесообразно начать с классов оксикислот, оксокислот и аминоспиртов, поскольку, во-первых, эти соединения достаточно широко представлены в живом мире на различных этапах его проявления — они встречаются в свободном виде и как фрагменты достаточно сложных молекул, некоторые из них образуются в процессе метаболизма веществ первичного биосинтеза или являются ключевыми соединениями главных путей биосинтеза. Второй аргумент в пользу выделения такой группы природных соединений в начало нашего курса — это наглядность проявления внутримолекулярного взаимного влияния функциональных групп, ведущего к появлению новых физических и химических свойств относительно исходных простых функций как важного фактора формирования молекул жизни.
Соединения этого класса являются достаточно простыми представителями природных соединений, они весьма часто встречаются в самых различных природных источниках. Гидроксиалкановые кислоты были выделены из ланолина, пчелиного воска, коры, корней, воскообразного слоя листьев, семян, бактерий и грибов. Наиболее часто встречаются б-гидроксикислоты, a в комбинации со сфингозинами животных и фитосфингозинами растений и Микроорганизмов они, очевидно, входят в состав всего живого.
В-гидроксикислоты играют важную роль в биосинтезе и катаболизме жирных кислот. Жирные кислоты с длинной цепью с одной и более гидроксильными группами обнаружены в жирах растительного и животного происхождения. В таких молекулах гидроксильные функции находятся, главным образом, на некотором расстоянии от карбоксильной группы.
Следует отметить доступность многих гидроксикислот в лабораторных синтезах, а некоторых и в более крупных масштабах, что позволяет в ряде случаев использовать в практических целях синтетические вещества этого класса вместо труднодоступных соединений, полученных из природных источников.
Классификация гидроксикислот построена по общему принципу классификации бифункциональных соединений — согласно взаимному расположению функциональных групп при углеродной цепи и количеству этих функциональных групп. Очень многие природные гидроксикислоты имеют тривиальные названия, которые прочно укоренились в химической и биохимической практике.
Молекула винной кислоты, образующаяся в процессе брожения виноградного сока, имеет два асимметрических центра, а так как каждый из них может иметь D- и L-конфигурации, то это соединение принципиально может образовать уже четыре конфигурационных изомера. и. Так как в молекуле винной кислоты оба асимметрических центра имеют одинаковое окружение и собственно одинаковое вращение, т.е. D=D’ и L=L\ то изомеры и идентичны между собой и оптически неактивны. Фактически молекула этой конфигурации имеет плоскость симметрии и молекулярная асимметрия в ней исчезает. Такой изомер, представляющий собой как бы внутримолекулярный рацемат, называют мезоформой. Этерификация одной карбоксильной группы мезоформы винной кислоты приводит к нарушению симметрии молекулы и, соответственно, к возникновению оптической активности у изомеров и.
Таким образом, мы получаем общую картину конфигурационной изомерии молекул с двумя асимметрическими центрами, согласно которой такие соединения могут существовать в четырех стереоизомерных формах — паратреоизомеров и пара-эритро-изомеров. Мезоформа, являющаяся результатом идентичности двух асимметрических центров, представляет собой частный случай эритроформы.
Треоизомеры являют собой пару энантиомеров, также как и эритро-изомеры. Относительно друг друга трео-и эритроизомеры определяются как диастереомеры. Если известно, что энантиомеры являются друг относительно друга оптическими антиподами, т.е. различаются только по своему отношению к плоскополяризованному свету, то диастереомеры различаются между собой целым рядом физических и химических свойств, так как они имеют различное взаимное расположение функциональных групп внутри молекул, а следовательно отличаются молекулярной формой, геометрическими параметрами, взаимным влиянием несвязанных атомов.
По химическим свойствам оксикислоты являют сумму свойств спиртов и карбоновых кислот, сочетая эти свойства в одной молекуле, и в то же время они проявляют ряд новых свойств, обязанных взаимному влиянию функциональных групп друг на друга или взаимодействию этих групп между собой. К таким появляющимся новым свойствам можно отнести: образование циклических диэфиров, лактидовиз боксикислот и легкость их окисления до кетокислот; легкость реакций в-элиминирования в случае в-оксикислот; образование внутримолекулярных сложных эфиров из г-оксикислот. б-Оксикислоты образуют комплексные соединения хелатного типа.
Часто лактонная форма для г-окси-кислот является даже более выгодной, чем оксикислотная, и г-оксикислоты самопроизвольно переходят в циклическую форму. Это характерно для таких известных соединений этого класса как пантовая кислота, многие сескви-терпены. Стабильными макроцикличес-кими лактонами представлены некоторые антибиотики и длинноцепочечные оксикислоты из группы мускусов; легко образует лактон и мевалоновая кислота.
Особые, в какой-то мере, специфические свойства проявляют оксикислоты, являющиеся интермедиатами различных биосинтетических реакций при ферментативном катализе invivo.
Глицериновая кислота в этих условиях обычно фигурирует в виде 3-фосфата, т.е. она избирательно этерифицируется фосфорсодержащими реагентами в присутствии ферментов по первой спиртовой группе. На следующем этапе 3-фосфат глицериновой кислоты элиминирует фрагмент фосфорной кислоты, образуя а-гидрокси-акриловую кислоту, которая сразу же изомеризуется в пировиноградную кислоту.
Но этот последний процесс является обратимым, и в условиях кислотно-основного катализа доля непредельной гидроксикислоты может быть существенной, хотя термодинамически более стабильна в данном случае б-кетокислота В свою очередь, енольная форма этой кислоты может быть стабилизирована, зафиксирована реакцией ее этерифика-ции фосфорной кислотой Таким образом, глицериновая кислота является источником двух новых соединений кислотного типа, а если учесть еще реакцию восстановления карбоксильной группы до альдегидной, то уже трех веществ, которые известны ка к важные промежуточные продукты основных химических процессов invivo. Следует заметить, что в заметных количествах они в организмах не накапливаются.
Из природных оксикислот можно выделить мевалоновую, являющуюся ключевым соединением биосинтеза изопре-ноидов, легко претерпевающую invivoсинхронное элиминирование фрагментов С02 и Н2 0, образуя при этом пирофосфатное производное 2-метил-бутенола, с которого и начинаются процессы формирования изопреноидных углеродных систем.
Хинная кислота, являясь исходным соединением биосинтеза ароматических кислородсодержащих соединений, может накапливаться в некоторых растениях в заметных количествах. Но основное предназначение этой кислоты — образование шикимо-вой кислоты, ключевого интермедиа-та вышеуказанных синтезов, с последующим переходом к бензольным производным, используя реакции дегидратации и дегидрогенизации.
Оксокислоты в природе распространены значительно меньше, чем гидроксикислоты, они редко встречаются в свободном состоянии, не накапливаются в организмах, хотя и образуются на различных стадиях биосинтеза. По поводу последнего факта нужно отметить, что в биосинтезе они играют зачастую важнейшую роль, являясь ключевыми соединениями ряда биосинтезов.
Классифицируют оксокарбоновые кислоты, как и все бифункциональные соединения, согласно взаимному расположению функциональных групп, подразделяя их при этом на альдегидо- и кетонокислоты. Многие оксокислоты носят тривиальные названия.
В структурном плане оксокислоты несколько более примитивны, чем оксикислоты — сказывается потеря асимметрического центра при переходе от гидроксикислот к оксокислотам. Так, при окислении любой формы молочнойкислоты мы получим одну единственную пировиноградную кислоту. Но в тоже время, этот класс бифункциональных соединений отличается большим разнообразием химических реакций, химических особенностей, обязанных взаимному влиянию карбонильной и карбоксильной групп.
В случае б-оксокислот можно отметить легкость присоединения нуклео-фильных реагентов по карбонильной группе и легкость реакций декарбоксилирова-ния — пировиноградная кислота в условиях окислительного ферментатив-но катализируемого декарбоксилиро-вания образует уксусную кислоту. Мезоксалевая кислота сочетает в себе легкость протекания обоих этих процессов — она существует только в виде гидратированного аддукта и в водном растворе легко разлагается на глиоксалевую кислоту и двуокись углерода.
Пировиноградную кислоту следует выделить из всех б-оксокислот еще и как источник весьма существенных биологически активных соединений, получаемых invivoв результате реакции нуклеофильного присоединения по карбонильной группе и последующих преобразований. С таким реагентом как аммиак, она в несколько стадий, включая еще реакции дегидратации и восстановления, образует важную б-аминокислоту аланин; а при взаимодействии с тиолом ферментной природы, коферментом-А, через стадии присоединения, декарбоксили-рования и восстановления, образует ацетилированный кофермент-А — важнейший интермедиат многих биосинтетических реакций.
В случае в-кетокислот, на примере ацетоуксусного эфира, мы наблюдаем интереснейшее явление двойственной реакционной способности, называемое таутомерией. Применительно к указанному классу соединений, это явление названо кето-енольной таутомерией. Суть данного явления заключается в следующем: карбонильная и карбоксильная функции, будучи сильными электроноакцепторами, оголяют протоны метиленовой группы, расположенной между ними, что делает их кислыми. В силу этого водород в виде катиона может мигрировать к карбонильному кислороду несущему на себе избыточную электронную плотность; синхронно этому переходу электронная плотность карбонильной группы и у-связей метиленового фрагмента перераспределяется так, как это указано на схеме 2.2.4, образуя систему енола
Процесс является обратимым, поскольку гидроксил при тригональном углероде всегда достаточно кислый и его протон может осуществлять, в свою очередь, электрофильную атаку по С=С связи. Оба эти процесса совершаются столь медленно, что тау-томеры могут быть разделены либо кристаллизацией, либо фракционной перегонкой Но через некоторое время индивидуальные изомеры при стоянии снова превращаются в равновесную смесь соединений кетонной и енольной структуры Таким образом, ацетоуксусный эфир, кроме свойств кетонов и сложных эфиров, обнаруживает еще свойства непредельных соединений, спиртов и фенолов, так как гидроксил при двойной связи ведет себя так же, как и при ароматическом кольце
Следует отметить, что кето-енольная таутомерия проявляется и в свойствах вышеописанной пировинограднойкислоты, и хотя доля енольной формы у нее незначительна, в реакциях она реализуется часто как основная.
Для г- и д- оксокислот характерны как кето-енольная, так и кольчато-цеп-ная таутомерия. Результатом последней, в случае левулиновой кислоты, является гидроксилактон, наиболее устойчивая таутомерная форма этого соединения, которая достаточно легко отщепляет воду в присутствии водоот-нимающих агентов, образуя непредельные г-лактоны.
Алифатические соединения, содержащие амино- и гидрокси- группы, называемые аминоспиртами, классифицируют согласно взаимному расположению этих функциональных групп. 1,1-Аминоспирты— соединения достаточно нестабильные, не встречающиеся в природе, имеют значение как промежуточные в различных органических реакциях. Для химии природных соединений определенное значение имеют 1,2-аминоспирты, среди которых наибольшее значение имеет в-этаноламин, встречающийся достаточно часто в виде производных в связанном виде.
в-Этаноламин сочетает в себе свойства первичных спиртов и первичных аминов, обе эти группы в какой-то мере близки по своим свойствам: обе они выполняют электронодонорные функции, могут образовывать водородные связи, проявлять кислотные свойства, являются эффективными нуклеофила-ми. Присутствие и взаимное влияние этих двух функций внутри одной молекулы приводит к затруднению реакций, характерных для класса спиртов и класса аминов — в-этаноламины труднее дегидратируются, этерифицируются или Н-алкилируются. Те же реакции, которые реализуются, носят часто конкурентный характер. Так, при взаимодействии в-этаноламинов с минеральными кислотами может реализоваться как солеобразование по аминогруппе, так и нуклеофильное замещение спиртового гидроксила. При их реакции с карбоновыми кислотами возможно ацилирование обеих функциональных групп, то же самое возможно и при реакциях алкилирования.
Из приведенных на схеме 2.3.1 производных в-этаноламина следует отметить в первую очередь ацетилхолин, выполняющий в организмах теплокровных важнейшую функцию нейромеди-атора. Холин также далеко неэкзотичен в живой природе: он широко распространен в животных и растительных тканях, а также в микроорганизмах; особо высоко содержание его в нервной ткани мозга, печени, почек и мышцы сердца. Важное значение имеет также О-фосфат этаноламина, сочетающий в себе основнуюи кислотную функции и существующий в виде цвиттериона.
Этот цвиттерионный фрагмент — фрагмент, обладающий высокой гид-рофильностью — характерен для фос-фолипидов и соответственно липидных мембран. В некоторых биосинтетических реакциях, в частности, при биосинтезе некоторых аминокислот, в качестве донора метильных групп принимает участие бетаин.
Другой важной группой природных аминоспиртов являются сфингозины — составная часть сфинголипидов, выделенных впервые из тканей мозга, но впоследствии обнаруженных во многих животных и растительных источниках.
Производными в-аминоспиртов являются алкалоиды семейства эфедро-вых — эфедрин, норэфедрин, Н-метилэ-федрин. Среди них наиболее известен эфедрин, используемый в медицинской практике в качестве сосудосуживающего и бронхорасширяющего средства, его применяют при лечении аллергических заболеваний, а также как стимулятор центральной нервной системы и при отравлении некоторыминаркотиками, так как он является их антагонистом.
Из аминоспиртов растительного происхождения следует отметить мус-карин, содержащийся в мухоморе красном, являющийся имитатором ацетилхолина. В малых дозах он понижает у человека артериальное давление, амплитуду и частоту сердечных сокращений; в больших дозах вызывает спазмы мышц, судороги, коматозное состояние.
Аминоспирты животного происхождения представлены катехоламинами, осуществляющими регуляцию функций эндокринных желез и передачу нервных импульсов. В первом случае они рассматриваются как гормоны, во втором случае — как нейромедиаторы. Соединения этой группы, кроме спиртового гидроксила, имеют еще и фенольные функции. Биогенные катехоламины представлены тремя соединениями: дофамин, норадреналин, адреналин.
Роль этих веществ в жизнедеятельности животных важна и разнообразна. Дофамин стимулирует секрецию соматотропина и подавляет секрецию пролактина, он также регулирует уровень глюкозы в крови, диурез, кровоток в почках; нарушение синтеза дофамина в мозгу — причина возникновения болезни Паркинсона. Норадреналин участвует в передаче нервных импульсов, воздействует на мышцы кровеносных сосудов, сужая их и повышая тем самым артериальное давление. Адреналин также способствует сужению мелких кровеносных сосудов, вызывает усиление работы сердца, расслабляет мускулатуру бронхов и кишечника. При эмоциональных переживаниях, особенно в стрессовых ситуациях, усиленной мышечной работе, охлаждении и ф д. содержание адреналина в крови резко возрастает, что обеспечивает адаптацию организма к новым условиям.
Что такое бифункциональное соединение
Изучение полифункционапьных природных соединений целесообразно начать с классов оксикислот, оксокис-лот и аминоспиртов, поскольку, во-первых, эти соединения достаточно широко представлены в живом мире на различных этапах его проявления — они встречаются в свободном виде (гидрок-сикислоты растений) и как фрагменты достаточно сложных молекул (фосфолипиды и сфингозины животных и бактерий), некоторые из них образуются в процессе метаболизма веществ первичного биосинтеза (окисление жирных кислот) или являются ключевыми соединениями главных путей биосинтеза (пировиноградная кислота, лимонная кислота, мевалоновая кислота, шикимовая кислота). Второй аргумент в пользу выделения такой группы природных соединений в начало нашего курса — это наглядность проявления внутримолекулярного взаимного влияния функциональных групп, ведущего к появлению новых физических и химических свойств относительно исходных простых функций как важного фактора формирования молекул жизни.
2.1. Гидроксикислоты
Соединения этого класса являются достаточно простыми представителями природных соединений, они весьма часто встречаются в самых различных природных источниках. Гидроксиалкановые кислоты были выделены из ланолина, пчелиного воска, коры, корней, воскообразного слоя листьев, семян, бактерий и грибов. Наиболее часто встречаются а-гидроксикислоты, a в комбинации со сфингозинами животных и фитосфингозинами растений и Микроорганизмов они, очевидно, входят в состав всего живого.

Некоторые оксикислоты являются ключевыми соединениями на главных путях биосинтеза (глицериновая, мевалоновая, шикимовая, лимонная и др.), пантовая кислота входит в состав кофермента А (схема 2.1.1). Простейшая оксикислота гликолевая, 

Следует отметить доступность многих гидроксикислот в лабораторных синтезах, а некоторых и в более крупных масштабах, что позволяет в ряде случаев использовать в практических целях синтетические вещества этого
класса вместо труднодоступных соединений, полученных из природных источников.
Классификация гидроксикислот построена по общему принципу классификации бифункциональных соединений — согласно взаимному расположению функциональных групп при углеродной цепи и количеству этих функциональных групп (схема 2.1.2). Очень многие природные гидроксикислоты имеют тривиальные названия, которые прочно укоренились в химической и биохимической практике.
В структурном плане для этих соединений характерно появление молекулярного асимметрического центра, что позволяет присутствовать им в природных источниках в трех формах- (+)-изомера, (-)-изомера и (

Молекула винной кислоты, образующаяся в процессе брожения виноградного сока, имеет два асимметрических центра, а так как каждый из них может иметь D- и 



Тавинная кислота, которая образуется при брожении виноградной кислоты, имеет 


Таким образом, мы получаем общую картину конфигурационной изомерии молекул с двумя асимметрическими центрами, согласно которой такие соединения могут существовать в четырех стереоизомерных формах — пара-треоизомеров и пара-эритроизомеров. Мезоформа, являющаяся результатом идентичности двух асимметрических центров, представляет собой частный случай эритроформы (схема 2.1.5).
Трео-изомеры являют собой пару энантиомеров, также как и эритро-изомеры. Относительно друг друга трео-и эритро-изомеры определяются как диастереомеры. Если известно, что энантиомеры являются друг относительно друга оптическими антиподами, т.е. различаются только по своему отношению к плоскополяризованному
свету (вращают плоскость поляризации в противоположные стороны, но на одинаковый угол), то диастереомеры различаются между собой целым рядом физических и химических свойств, так как они имеют различное взаимное расположение функциональных групп внутри молекул, а следовательно отличаются молекулярной формой, геометрическими параметрами, взаимным влиянием несвязанных атомов.
По химическим свойствам оксикислоты являют сумму свойств спиртов и карбоновых кислот, сочетая эти свойства в одной молекуле, и в то же время они проявляют ряд новых свойств, обязанных взаимному влиянию функциональных групп друг на друга или взаимодействию этих групп между собой. К таким появляющимся новым свойствам можно отнести: образование циклических диэфиров, лактидов
из а-оксикислот и легкость их окисления до кетокислот; легкость реакций 

Часто лактонная форма для у-оксикислот является даже более выгодной, чем оксикислотная, и у-оксикислоты самопроизвольно переходят в циклическую форму. Это характерно для таких известных соединений этого класса как пантовая кислота, многие сесквитерпены. Стабильными макроциклическими лактонами представлены некоторые антибиотики (см. раздел 11.5) и длинноцепочечные оксикислоты из группы мускусов; легко образует лактон и мевалоновая кислота (схема 2.1.7).
Особые, в какой-то мере, специфические свойства проявляют оксикислоты, являющиеся интермедиатами различных биосинтетических реакций при ферментативном катализе in vivo.
Глицериновая кислота в этих условиях обычно фигурирует в виде 3-фосфата, т.е. она избирательно этерифицируется фосфорсодержащими реагентами в присутствии ферментов по первой спиртовой группе. На следующем этапе 3-фосфат глицериновой кислоты элиминирует фрагмент фосфорной кислоты, образуя а-гидроксиакриловую кислоту, которая сразу же
изомеризуется в пировиноградную кислоту Но этот последний процесс является обратимым, и в условиях кислотно-основного катализа доля непредельной гидроксикислоты (енольной кислоты) может быть существенной, хотя термодинамически более стабильна в данном случае а-кетокислота В свою очередь, енольная форма этой кислоты может быть стабилизирована, зафиксирована реакцией ее этерификации фосфорной кислотой (фосфат-несущим реагентом, точнее сказать) Таким образом, глицериновая кислота
является источником двух новых соединений кислотного типа, а если учесть еще реакцию восстановления карбоксильной группы до альдегидной, то уже трех веществ, которые известны как важные промежуточные продукты основных химических процессов in vivo (схема 2.1.8). Следует заметить, что в заметных количествах они в организмах не накапливаются.
Из природных оксикислот можно выделить мевалоновую, являющуюся ключевым соединением биосинтеза изопре-ноидов, легко претерпевающую in vivo синхронное элиминирование фрагментов 

Хинная кислота, являясь исходным соединением биосинтеза ароматических кислородсодержащих соединений (а- и