Что такое батарейка в физике
Что такое батарейка
В электротехнике термином батарейка называют некий источник электрического тока в котором несколько электрохимических элементов соединёны между собой. Электричество в батарейке вырабатывается под действием химического процесса. Обратите внимание, что именно «несколько», а не одиночный элемент называется батарейкой. Но, всё же, мы привыкли батарейкой называть всё, что даёт нам постоянный ток, не вникая в то, из чего она там внутри состоит. Тем более, что как правило, снаружи всё упаковано в единую форму.
Изобретателем батарейки считается итальянский физик Алессандро Вольта. И произошло это примерно в 1800 году.
Принцип работы батарейки
Виды батареек
Классификация батареек по типу химической реакции
| Тип | Описание | Достоинства | Недостатки |
| Первичные | Гальванические элементы. Реакции, происходящие в них, необратимы, поэтому их нельзя перезарядить. | Дешевле стоят, меньше саморазряд. | Одноразовые. |
| Вторичные | Аккумуляторы. Реакции в них обратимы, поэтому они способны не только отдавать энергию, но и накапливать её. | Многократность применения. Более экологичные. | Дороже. Сильнее саморазряд. |
Классификация батареек по типу электролита
(список не полный, указаны только самые распространённые в быту)
Типы батареек по размеру и их обозначения
Здесь мы разместили таблицу в которой указаны, помимо размеров и характеристик, «название» и «маркировка». По сути это одно и то же, и даже, как правило, на всех элементах указывается одновременно. В США принято буквенное обозначение (в колонке «название»), и оно ориентированно на физический размер «батарейки».
Батарейка (гальванический элемент) — как работает, из чего состоит
Батарейка это прижившееся и не совсем корректное название одиночного гальванического элемента. А уже их соединение в источниках питания для создания нужного напряжения — это батарея. Поэтому не стоит путать эти определения. И если называя гальванический элемент батарейкой, мы поступаем не совсем верно (но смысл понятен), то слово батарея абсолютно никакого отношения не имеет к одиночным химическим источникам электрического тока.
Данный обзор посвящен гальваническому элементу (батарейке) — химическому источнику электрического тока, основанному на взаимодействии двух металлов и (или) их оксидов в электролите, приводящих к возникновению в замкнутой цепи электрического тока. Мы подробно рассмотрим конструктивные особенности элемента, определимся с классификацией и разберемся, как работает батарейка.
История батарейки — гальванического элемента
Свое название гальванические элементы получили по имени итальянского врача и анатома Луиджи Гальвани (1737 — 1798). Проводя опыты с лягушками, Гальвани заметил, что свежепрепарированная лягушачья лапка, подвешенная на медном крючке к железному стержню, сокращается, когда к ней прикасались железом. Наблюдения были истолкованы им как проявление «животного электричества».
Объясняя это явление позже итальянский физик Александро Вольта установил, что причиной сокращения мышц служит не «животное электричество», а наличие цепи из разных проводников в жидкости. Сама лягушачья лапка играла роль чувствительного прибора.
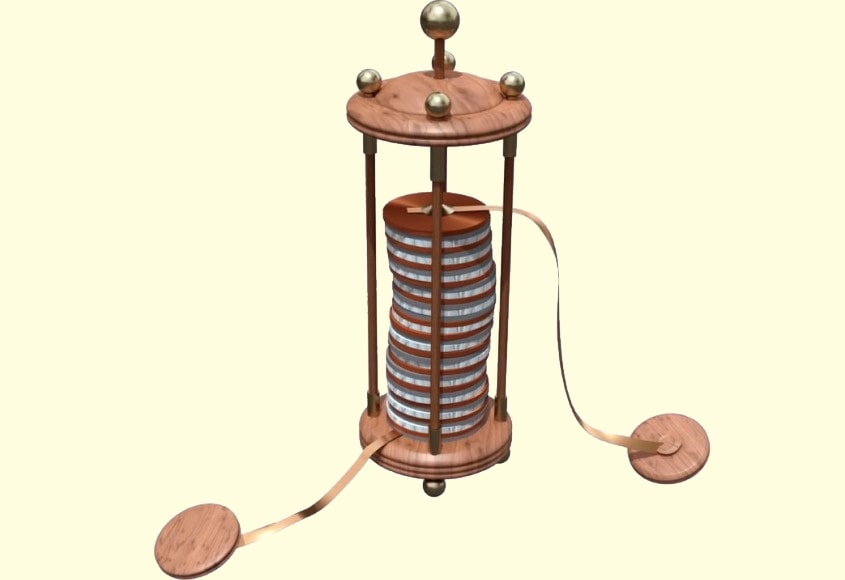
Александро Вольта создал первый источник тока («Вольтов столб»), который можно было использовать на практике. Этот источник состоял из медных и цинковых пластин, между которыми были проложены кружочки ткани, пропитанные раствором щелочи.
Александро Вольта предложил разделить все проводники на два рода:
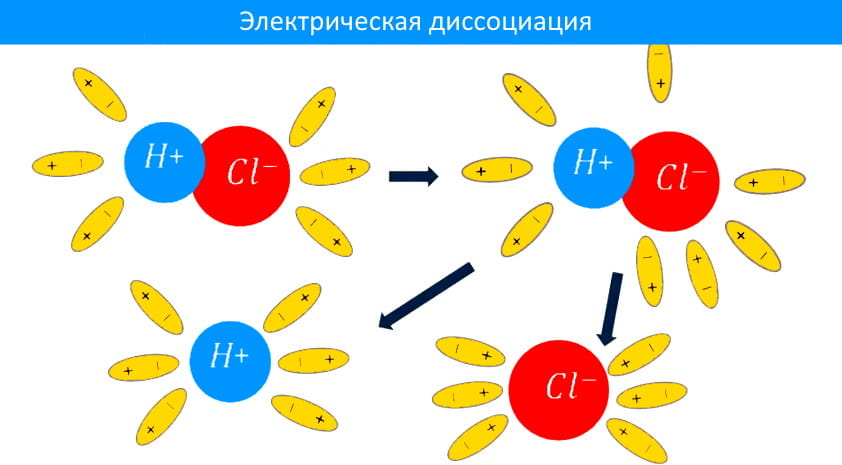
Шведский ученый Сванте Аррениус, изучая электропроводимость растворов различных веществ, в 1877 году пришел к выводу, что причиной электропроводимости является наличие в растворе ионов, которые образуются при растворении электролита в воде.
Процесс распада электролита на ионы называется электрической диссоциацией. При диссоциации в воде электролиты диссоциируют на положительно и отрицательно заряженные ионы. Под действием электрического поля, положительно заряженные ионы движутся к отрицательному полюсу источника тока (катоду) и называются катионами, а отрицательно заряженные – к положительному полюсу (аноду) и называются анионами. Таким образом электролиты обладают электронной проводимостью.
Примеры гальванических элементов:
| Название элемента | Отрицательный электрод | Положительный электрод | Электролит |
| Вольтов столб | Цинк | Медь | Раствор щелочи |
| Первый элемент Вольта | Цинк | Медь | Раствор серной кислоты |
| Элемент Даниэля | Цинк | Медь | Раствор сульфата цинка |
| Элемент Грине | Цинк | Угольный стержень | Раствор сульфата меди и бихромата калия |
| Элемент Лекланше | Цинковый цилиндр | Угольный стержень | Раствор нашатыря и оксид марганца |
| Сухой элемент | Цинковый цилиндр | Угольный стержень | Густой клейстер, приготовленный из муки на растворе нашатыря |
Эволюция батарейки — солевой гальванический элемент
Одним из первых гальванических элементов, которым можно было пользоваться вне лабораторий, была конструкция Жоржа Лекланше (1866 год). Она состояла из цинкового анода, катода из диоксида марганца с углем и электролита из хлорида аммония. Со временем элемент Лекланше эволюционировал в солевой (сухой) гальванический элемент следующим образом:
Конструкция сухой батареи:
 | 1 — воздушная прослойка |
| 2 — цинковый стакан | |
| 3 — электролит (NH4CL + ZnCl2) | |
| 4 — смесь графита и MnO2 | |
| 5 — угольный стержень | |
| 6 — защитный корпус |
Как работает сухая батарейка (солевой гальванический элемент)
Рассмотрим процессы, происходящие в сухом элементе. При потреблении тока электроны поступают через внешнюю электрическую цепь с цинкового электрода на угольный стержень. Происходят следующие реакции:
Во время разрядки цинковый стакан растворяется. Во избежание вытекания электролита или продуктов реакции цинковый стакан имеет запас по толщине или окружен железной защитной оболочкой.
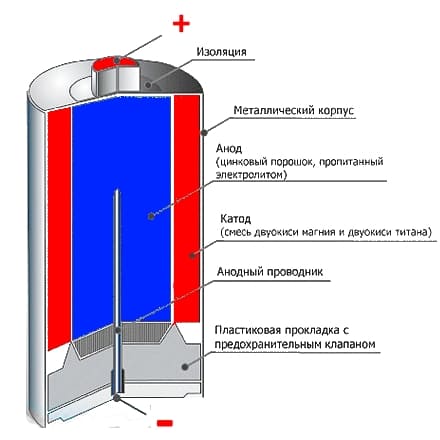
Что находится внутри щелочной батарейки
Впервые щелочные (алкалайновые) батарейки выпустила компания Eveready (Energizer) в 1959 году. Ее принципиальное отличие от сухой батарейки — состав электролита и конструкция. Электролит состоит не из соли аммония, как в солевой, а из раствора щелочи (обычно гидроксида калия). Конструкция элемента вывернута наизнанку по сравнению с конструкцией солевого элемента. То есть, если у солевого элемента корпус (-), а центральный токоотвод (+), то у щелочного элемента наоборот, корпус (+), а центральный токоотвод (-).
В солевых элементах при химической реакции расходуются все реагенты, составляющие этот элемент — анод, катод, электролит. А в щелочном элементе при химической реакции расходуется только анод и катод, электролит не расходуется. Поэтому электролита там совсем мало, и освободившееся место электролита заполнено увеличенным количеством анода и катода, что значительно увеличивает электроемкость щелочного элемента.
Типичная щелочная батарея выполнена в форме стального цилиндра, покрытого изолирующей пластиковой оболочкой. Положительный конец батарейки (катод) имеет выступающую наружу поверхность. Отрицательный конец (анод) — плоский. Эти две клеммы батарейки электрически изолированы друг от друга.
| 1 — никелированный стальной стакан | 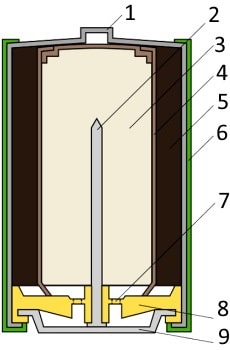 |
| 2 — латунный токосъемник | |
| 3 — анодная паста | |
| 4 — сепаратор | |
| 5 — катодная паста | |
| 6 — защитная оболочка | |
| 7 — предохранительная мембрана | |
| 8 — прокладка | |
| 9 — стальная тарелка |
Корпус батарейки обычно делается из стали с никелевым покрытием. Внутри находится несколько слоев различных материалов, химические реакции которых создают определенные уровни напряжений и токов:
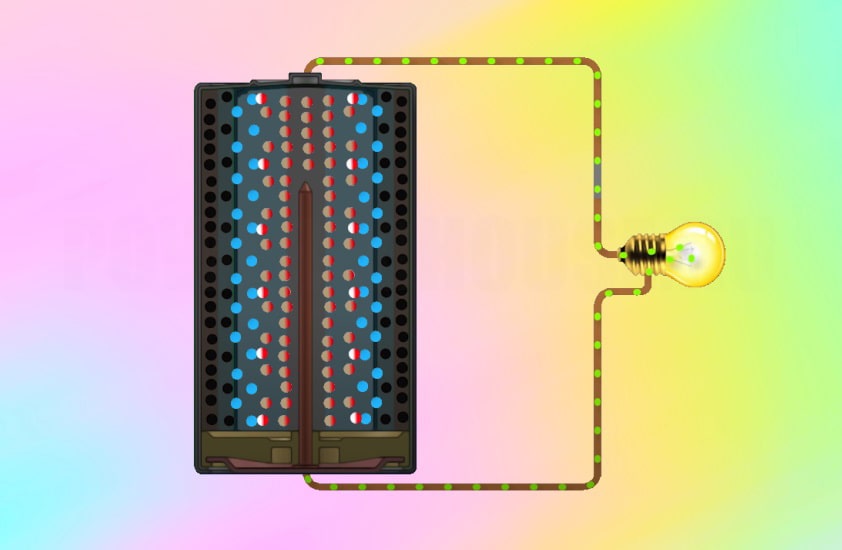
Как работает батарейка
Рассмотрим как работает электрическая батарейка и какие реакции взаимодействия происходят между ее химическими компонентами:
Пока есть полная цепь между выводами батарейки, химическая реакция будет продолжаться, и электроны будут течь от отрицательного клеммника к положительному. Если разорвать цепь, то химическая реакция прекратится.
Наглядно понять, как работает батарейка и что у нее происходит внутри, можно, ознакомившись с представленной ниже видео демонстрацией.
Как работает батарейка — видео
Химическая реакция в батарейке, к которой подключен потребитель:
Как работает батарейка: принцип действия аккумуляторной и обычной
Опубликовано kachlife в 29.10.2020 29.10.2020
Как работают настенные часы, пульт от телевизора или детская игрушка на радиоуправлении? Большинство людей, не задумываясь, ответят — «от батареек» и будут, в принципе, правы. Но вряд ли кто-то из них сможет рассказать, как именно портативный элемент питания утроен, каким образом он функционирует и без чего весь процесс передачи электрического тока от батарейки к конечному потребителю был бы невозможен. Давайте же восполним этот досадный пробел в знаниях.
Что такое батарейка
В батарейках электричество возникает благодаря взаимодействию разных химических веществ. И принцип работы этих изделий легко можно отыскать в учебниках по физике. Все элементы собраны из одних и тех же частей.
Устройство батарейки простое. Различия между разными типами батарей минимальны. В основе каждой конструкции имеются:
Как работает батарейка

Катоды выполняют функцию восстановителя, т.е. принимают электроны от прибывшего анода. Электролит это среда, в которой перемещаются ионы, которые образуются в процессе химической реакции. В процессе работы батарейки постепенно образовываются новые вещества, а электроды постепенно разрушаются — батарейка садится.
Вот и вся работа батарейки, кстати, все процессы, проходящие в гальваническом элементе, необратимы, то есть заряжать батарейки нельзя. Кратко говоря о работе батарейки: анод — нагрузка — катод — электролит.
Электролит изначально изготовляли в жидком виде, но это неудобно, так как при переворачивании батарейки она просто не работала. Из-за этого электролит стали загущать, превращать его в сухой вид.
Принцип работы батарейки
Для того чтобы понять принцип функционирования обычной «пальчиковой» батарейки, необходимо иметь общее представление о её устройстве. Итак, любая батарейка состоит из трёх основных элементов — анода, катода и электролита. При этом последний может иметь фактически любое агрегатное состояние: помещённые в соляной раствор катод и анод, в принципе, так же являются «батарейкой», только в непривычном для рядового обывателя виде.
Интересно! Так называемый «вольтов столб», изобретённый Алессандро Вольта, так же имел все необходимые для производства электротока элементы. Он состоял из уложенных друг на друга цинковых и медных пластин, между которыми в качестве «прослойки» помещалась смоченная в кислоте ткань.
Анод в подобных системах – это главный источник электронов, которые, как мы знаем из школьного курса физики, имеют отрицательный заряд. Отрицательно заряженные частицы притягиваются к положительным, а в качестве «плюса» в данном случае выступает поверхность катода.
Но для возникновения электротока этого мало, ведь электронам нужна ещё и своеобразная «магистраль» — среда, которая поддерживала бы взаимодействие катода и анода. Именно здесь «на сцене» появляется электролит – соль, щёлочь или кислота, способные проводить ток.
Разберём принцип действия на конкретном примере: имеется элемент питания, рассчитанный на 18 вольт. Напряжение между электродами в нём стабильно, пока он не включён в сеть. Как только появляется потребитель (к примеру, обычная лампочка), напряжение начинает постепенно снижаться, от «минусового» электрода к «плюсовому» начнёт течь ток, и в электролите произойдёт химическая реакция, направленная на поддержание разности потенциалов между электродами.
Справка. Чем больше энергии требуется потребителю, тем интенсивнее течёт реакция внутри элемента питания и тем быстрее он выйдет из строя.
Обратная реакция
Все типы батареек и элементов имеют сходный тип химической реакции, происходящей для выработки электроэнергии.
Но в некоторых типах элементов или батарей химические вещества различны, и реакция может быть обратной. Таким образом, элементы могут быть перезаряжены — так же, как литий-ионные аккумуляторы в автомобилях или смартфонах.
Раньше было гораздо дешевле производить неперезаряжаемые элементы, такие как щелочные элементы, поэтому они использовались очень широко.
Но теперь, когда люди осознали, насколько вредно для окружающей среды просто выбрасывать неперезаряжаемые элементы, а поскольку перезаряжаемые элементы становятся дешевле, мы, вероятно, будем использовать неперезаряжаемые элементы все меньше и меньше в будущем.
Типы батареек
Что это такое солевые батарейки
Солевая батарейка изготавливается из пассивного угля и двуокиси марганца, электролит из хлорида аммония и катод из цинка. В перерывах работы элементы питания могут восстанавливаться, т.е. выравнивать локальные неоднородности в композите электролита, вызванных разрядом. Такой процесс немного продлевает срок службы батарейки.
Алкалиновые (щелочные) батарейки что это такое
В отличие от солевых батарей у алкалиновой батарейки химический элемент электролита — щелочной. Щёлочные батарейки (алкалин) имеют продолжительный срок хранения, а в процессе эксплуатации напряжение на электродах меняется гораздо меньше, чем у элементов с солевым раствором.
Литиевые батарейки что это такое
Самые современные. В отличие от щелочных и солевых батареек, в состав катода входит литий (Li – наивысший отрицательный потенциал), в состав анода — различные материалы. Электролит — органический электролит. В связи с такими элементами литиевые батарейки получили большой срок хранения, большую плотность энергии и различную рабочую температуру.
Как работает батарейка: строение и состав

Что такое батарейка
Обыкновенная батарейка представляет собой некий источник электрического тока в котором несколько электрохимических элементов объединены между собой в пакет. Стоит обратить внимание, что батарея — это именно несколько объединенных между собой гальванических элементов. Электричество в батарейке вырабатывается вследствие протекающей химической реакции. Изобретателем батареек принято считать ученого Алессандро Вольта, который создал в 1800 г. «Вольтов столб» — первый в мире электрохимический источник тока, ставший прародителем современных батарей.
Устройство батарейки
Иногда, забыв вынуть уже подсевшие батарейки, через некоторое время можно обнаружить, что в батарейном отсеке появилась какая-то жидкость. Это и есть потёкший электролит. Поэтому на упаковке с батарейками можно найти предупреждение о том, что севшие элементы нужно вынимать из электроприборов. Теперь вы знаете, зачем это нужно делать.
Итак, с устройством разобрались, теперь поговорим о том, как работает щелочной элемент.
Принцип работы батарейки
На аноде проходит реакция окисления цинка. Вначале образуется гидроксид цинка
Zn + 2OH − → Zn(OH)2 + 2e −
На катоде проходит реакция восстановления оксида марганца IV в оксид марганца III
Общая картина следующая
Zn + 2KOH + 2MnO2 + 2e − → 2e − + ZnO + 2KOH + Mn2O3
Из первой формулы видно, что на аноде имеется избыток электронов. Но ведь анод это «+»? Дело в том, что в физике принято считать за направление тока движение положительных зарядов, т.е. от плюса (анода) к минусу (катоду). Но электрический ток это упорядоченное движение электронов, которые имеют отрицательный заряд. Поэтому, ток течёт оттуда, где есть избыток электронов, в направлении, где есть нехватка отрицательных зарядов (это и есть плюс – недостаток электронов). При этом получается, что ток течёт в реальности от отрицательного контакта к положительному. В электрохимии анодом принято считать тот электрод, на котором происходит процесс окисления, катодом же считается электрод, где происходит реакция восстановления.
Интересно знать! В результате химических реакций внутри элемента питания происходит необратимое разрушение металлических элементов питания, батарейка теряет свою емкость.
Важно! Поскольку химические изменения в процессе разряда батарейки необратимы — они не подлежат восстановлению заряда.
Разновидности
По форме и размерам согласно мировым стандартам элементы питания разделяются на такие виды:
В настоящее время существует большое количество разнообразных источников питания. Между собой они отличаются материалами, применяемыми для изготовления электродов и электролита. Среди многочисленных батареек выделяют несколько основных видов:
Солевые
Такие гальванические элементы имеют низкую стоимость относительно аналогов, однако имеется один существенный недостаток это низкая внутренняя емкость таких батареек.
Щелочные
Состав батарейки такого вида отличается от своих аналогов применяемым электролитом, в них используется активная щелочь гидроксид калия KOH. Электрод выполнен из двуокиси таких металлов, как цинк и марганец. Нашли широкое применение в современной электронике, на корпусе элементов указывается маркировка «ALKALINE».
Основным плюсом такой батарейки является продолжительный срок службы, в процессе эксплуатации номинальное напряжение понижается с меньшей скоростью. К минусам относят повышенную стоимость.
Серебряные
В качестве электролита применяют КОН, в состав электродов включено серебро. В таких элементах отмечают значительно увеличение срока службы, повышенную энергетическую плотность, постоянное номинальное напряжение, а также полную безвредность. Недостатками являются высокая цена.
Ртутные
В строении таких батареек используется цинк в качестве металла для анода, катод выполняется из ртутного оксида. Электроды разделяются сепаратором пропитанным электролитом. Такой элемент питания способен выполнять функции аккумулятора, однако емкость будет постепенно понижаться с каждым циклом восстановления заряда. При разряде происходит слипание ртути, а при заряде образуются дендриты цинка. Во время эксплуатации не допускается разгерметизация корпуса в связи с повышенной вредностью паров ртути. К преимуществам относят сохранение длительных значений плотности энергии, емкости и напряжения.
Внимание! Ртутные источники питания являются потенциально опасными для здоровья человека и окружающей среды.
Литиевые
Данные элементы питания постепенно вытесняют все аналоги в своей области применения. Отрицательные электроды такой батарейки сделаны из лития. В них постоянно совершенствуются основные технические характеристики. К плюсам батареек с литиевым электродом относят увеличение срока хранения, широкий диапазон рабочих температур, повышенная внутренняя емкость. Основным минусом является повышенная стоимость.
Применение
Различные виды могут применяться по-разному, зависит это от их основных конструктивных свойств и характеристик:
Выбор источника питания
Для правильного выбора элементов питания необходимо обратить внимание на следующие факторы:
Правильный выбор и соблюдение требований к безопасной эксплуатации позволит продлить работу любого элемента питания. Для определенных видов техники необходим свой вид батарейки.
Батарейка
Батаре́йка — обиходное название источника электричества для автономного питания разнообразных устройств. Может представлять собой одиночный гальванический элемент, аккумулятор или их соединение в батарею для увеличения напряжения или ёмкости.
Содержание
Основные типоразмеры
Наиболее распространённые размеры элементов питания:
| Тип | Номенклатура IEC JIS | Советское | Форма | Размеры, мм | Напряжение, В | Обиход. название |
|---|---|---|---|---|---|---|
| AAA | R03 | 286 | Цилиндр | 44,5 × ⌀10,5 | 1,2—1,6 | «мизинчиковая» |
| AA | R6 | 316 | Цилиндр | 50,5 × ⌀14,5 | 1,2—1,6 | «пальчиковая» |
| С | R14 | 343 | Цилиндр | 50,0 × ⌀26,2 | 1,2—1,6 | «средняя» |
| D | R20 | 373 | Цилиндр | 61,5 × ⌀34,2 | 1,2—1,6 | «большая» |
| — | 6F22 | Крона | Параллелепипед | 48,5 × 26,5 × 17,5 | 9 | «крона» |
| — | 3R12 | 3336 | Параллелепипед | 67 × 62 × 22 | 4,5 | квадратная |
Классификация по типу электролита (упрощённая)
| Тип | Достоинства | Недостатки |
|---|---|---|
| Сухие («солевые», LeClanche, угольно-цинковые) | Самый дешёвый, массово производится. | Наименьшая ёмкость; спадающая кривая разряда; плох в работе с мощными нагрузками (большим током); плох при низких температурах. |
| Heavy Duty («мощный» сухой элемент, хлорид цинка) | Менее дорогой, чем щелочной. Лучше LeClanche при высоком токе и низких температурах. | Низкая ёмкость. Спадающая кривая разряда. |
| Щелочные («алкалиновые», щёлочно-марганцевые) | Средняя стоимость. Лучше предыдущих при большом токе и низких температурах. При разряде сохраняет низкое значение полного сопротивления. Широко выпускается. | Спадающая кривая разряда. |
| Ртутные | Постоянство напряжения, высокая энергоёмкость и энергоплотность. | Высокая цена. Из-за вредности ртути уже почти не производятся. |
| Серебряные | Высокая ёмкость. Пологая кривая разряда. Хорош при высоких и низких температурах. Превосходная длительность хранения. | Дорогой. |
| Литиевые | Наивысшая ёмкость на единицу массы. Пологая кривая разряда. Превосходен при низких и высоких температурах. Чрезвычайно длительное время хранения. Высокое напряжение на элемент (3В). Лёгкий. | Дорогой. |
Классификация по типу химической реакции
| Тип | Описание | Достоинства | Недостатки |
|---|---|---|---|
| Первичные | Гальванические элементы. Реакции, происходящие в них, необратимы, поэтому их нельзя перезарядить. Обычно именно их и называют словом «батарейка». Попытка зарядить батарейку может привести к порче батарейки и утечке щёлочи или других веществ, находящихся в батарейке. | Выше ёмкость и/или дешевле. | Одноразовость применения. |
| Вторичные | Аккумуляторы. В отличие от первичных, реакции в них обратимы, поэтому они способны преобразовывать электрическую энергию в химическую, накапливая её (заряд), и выполнять обратное преобразование, отдавая электрическую энергию потребителю (разряд). Для распространённых аккумуляторов число циклов заряд-разряд обычно равно примерно 1000 и заметно зависит от условий эксплуатации. | Многократность применения, перезаряжаемые. | Ниже ёмкость и/или дороже. |
См. также
Ссылки
Полезное
Смотреть что такое «Батарейка» в других словарях:
Батарейка 4 — Батарейка 4,5 Вольта … Википедия
батарейка — и, ж. batterie f. 1. разг. То же, что батарея артиллерийская. БАС 2. 2. К постам четвертаго разряда <кордонной линии>, или батарейкам <относятся> такие, где в заведовании урядника состоит пушка и до 20 казаков. 1847. ПСЗ 2 (1 779). 3 … Исторический словарь галлицизмов русского языка
БАТАРЕЙКА — БАТАРЕЙКА, батарейки, жен. уменьш. к батарея. || Маленькая электрическая батарея для карманного фонаря. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
БАТАРЕЙКА — БАТАРЕЙКА, и, жен. 1. см. батарея 2. 2. Маленькая аккумуляторная батарея. Часы на батарейках. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
Батарейка A — Батарейки А. A (также: R10, 332) типоразмер батареек и аккумуляторов. В СССР батарейки имели обозначение 332 или ФБС 0,25 (с солевым электролитом) и А332 ( … Википедия
батарейка — сущ., кол во синонимов: 2 • батарея (12) • микробатарейка (1) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
Батарейка AA — У этого термина существуют и другие значения, см. AA. Батарейки AA … Википедия
Батарейка D — Батарейки D … Википедия
Батарейка C — Батарейки C … Википедия
батарейка — и, ж., тех. 1) Зменш. до батарея 2). 2) Джерело електричного живлення. Батарейка кишенькового ліхтарика … Український тлумачний словник