Что такое батарейка для детей
Батарейка и всё о ней

Повседневная жизнь не требует каких-то великих усилий для включения телевизора, калькулятора, для нормальной работы настенных часов, для работы компьютерной мыши и так далее. А все благодаря каким-то батарейкам, которые помогают упростить нашу жизнь, помогают сэкономить наше время. Это понимает каждый здравомыслящий человек, но не каждый задаёт себе вопрос: «как из таких маленьких батареек совершается такой объём работы», «как устроены батарейки»… А, между тем, это физика.
Самые первые прототипы батареек появились ещё в Месопотамии около 2000 лет назад. Состояла она в то время из глиняной вазы, медного и железного стержней, залитыми битумом. Кстати, если такой сосуд залить кислотой (уксусной, серной), то получим напряжение примерно в 1В. Назвали такой прототип «Багдадской батарейкой » в связи с местом, на котором были обнаружены.
Примерно в 1800 году итальянский физик Алессандро Вольта изобрёл батарейку, которой мы и по сей день продолжаем пользоваться. Кстати, кто не знает что такое батарейка, так это источник питания, который вырабатывает электричество под действием химического процесса. То есть батарейка это гальванический элемент, работающий на химической реакции. Так можно объяснить и детям.
Как работает батарейка
Катоды выполняют функцию восстановителя, т.е. принимают электроны от прибывшего анода. Электролит это среда, в которой перемещаются ионы, которые образуются в процессе химической реакции. В процессе работы батарейки постепенно образовываются новые вещества, а электроды постепенно разрушаются — батарейка садится.
Вот и вся работа батарейки, кстати, все процессы, проходящие в гальваническом элементе, необратимы, то есть заряжать батарейки нельзя. Кратко говоря о работе батарейки: анод — нагрузка — катод — электролит.
Электролит изначально изготовляли в жидком виде, но это неудобно, так как при переворачивании батарейки она просто не работала. Из-за этого электролит стали загущать, превращать его в сухой вид.
Как устроена батарейка
Внутри металлического корпуса щелочной ячейки находятся три основных химических вещества: цинк, диоксид марганца и гидроксид калия.
Щелочная батарейка. /Роджер Кларк
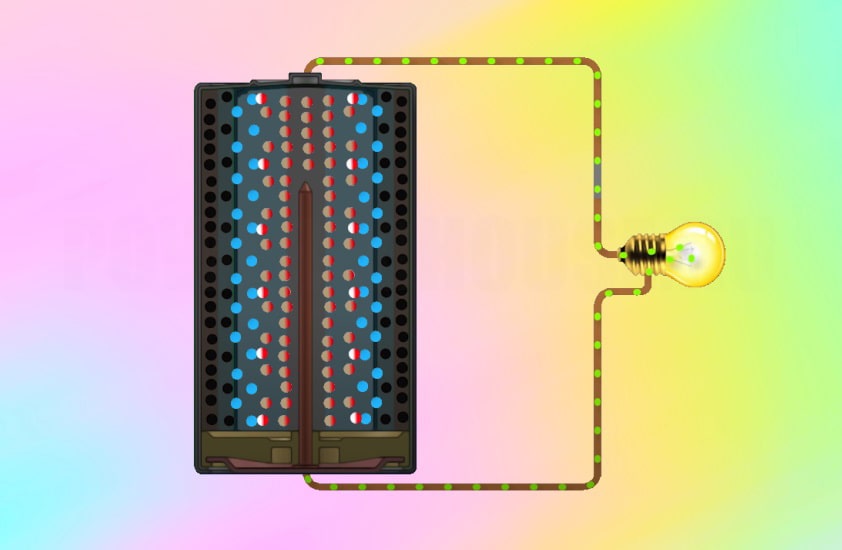
Это может показаться сложным, но способ производства электричества в батарейке на самом деле довольно прост: происходит химическая реакция, которая перемещает крошечные отрицательно заряженные частицы, называемые «электронами», вокруг, чтобы создать электрический ток.
Когда элемент подключен к цепи — например, к лампочке, — цинк внутри реагирует с диоксидом марганца и теряет электроны.
Электроны собираются с помощью металлического стержня внутри ячейки, что позволяет им течь из нижней части ячейки (отрицательный), через провода к лампе (чтобы она загорелась), а затем обратно в верхнюю часть ячейки. (положительный).
Эта реакция производит около 1,5 вольт электроэнергии. Поскольку не так много устройств могут работать при напряжении 1,5 В, очень часто два или четыре элемента используются вместе для увеличения мощности. Таким образом, четыре ячейки, соединенные вместе (конец в конец), дадут шесть вольт.
Когда большая часть цинка прореагировала с диоксидом марганца, мы говорим, что элемент «плоский», что означает, что он больше не может производить электричество. Поскольку химическая реакция, происходящая в щелочных элементах, не может быть легко изменена, это означает, что элемент не может быть перезаряжен.
Но помните, что большинство элементов и батарей можно утилизировать, поэтому убедитесь, что вы тщательно от них избавились.
Обратная реакция
Все типы батареек и элементов имеют сходный тип химической реакции, происходящей для выработки электроэнергии.
Но в некоторых типах элементов или батарей химические вещества различны, и реакция может быть обратной. Таким образом, элементы могут быть перезаряжены — так же, как литий-ионные аккумуляторы в автомобилях или смартфонах.
Раньше было гораздо дешевле производить неперезаряжаемые элементы, такие как щелочные элементы, поэтому они использовались очень широко.
Но теперь, когда люди осознали, насколько вредно для окружающей среды просто выбрасывать неперезаряжаемые элементы, а поскольку перезаряжаемые элементы становятся дешевле, мы, вероятно, будем использовать неперезаряжаемые элементы все меньше и меньше в будущем.
Типы батареек
Что это такое солевые батарейки
Солевая батарейка изготавливается из пассивного угля и двуокиси марганца, электролит из хлорида аммония и катод из цинка. В перерывах работы элементы питания могут восстанавливаться, т.е. выравнивать локальные неоднородности в композите электролита, вызванных разрядом. Такой процесс немного продлевает срок службы батарейки.
Алкалиновые (щелочные) батарейки что это такое
В отличие от солевых батарей у алкалиновой батарейки химический элемент электролита — щелочной. Щёлочные батарейки (алкалин) имеют продолжительный срок хранения, а в процессе эксплуатации напряжение на электродах меняется гораздо меньше, чем у элементов с солевым раствором.
Литиевые батарейки — что это такое?
Самые современные. В отличие от щелочных и солевых батареек, в состав катода входит литий (Li – наивысший отрицательный потенциал), в состав анода — различные материалы. Электролит — органический электролит. В связи с такими элементами литиевые батарейки получили большой срок хранения, большую плотность энергии и различную рабочую температуру.
Что такое батарейка для детей
Войти
Авторизуясь в LiveJournal с помощью стороннего сервиса вы принимаете условия Пользовательского соглашения LiveJournal
История изобретений. Батарейки
Что бы мы делали без этих «палочек-выручалочек», которые позволяют нам пользоваться электричеством там, где нет никаких розеток и проводов! Мы берем с собой в лес фонарик, слушаем музыку на пляже, в поездке у нас всегда под рукой фотоаппарат, а малыши выносят на улицу движущиеся игрушки… И везде работают батарейки!
Но откуда же в этих маленьких трубочках берется электрический ток, заставляющий работать все устройства? Попробуем разобраться.
Сначала мы с вами еще раз послушаем фиксипелку про батарейки и посмотрим клип, сделанный режиссером-аниматором Алексеем Будовским. А потом – поговорим о том, как устроены батарейки, и об истории их изобретения.
У обычной, «одноразовой» батарейки есть и другое название – «гальванический элемент». Электрический ток в нем появляется из-за химического взаимодействия веществ.
Впервые этот способ получения электричества был придуман знаменитым итальянским физиком Алессандро Вольта. Именно в честь него была названа единица измерения электрического напряжения – 1 вольт.
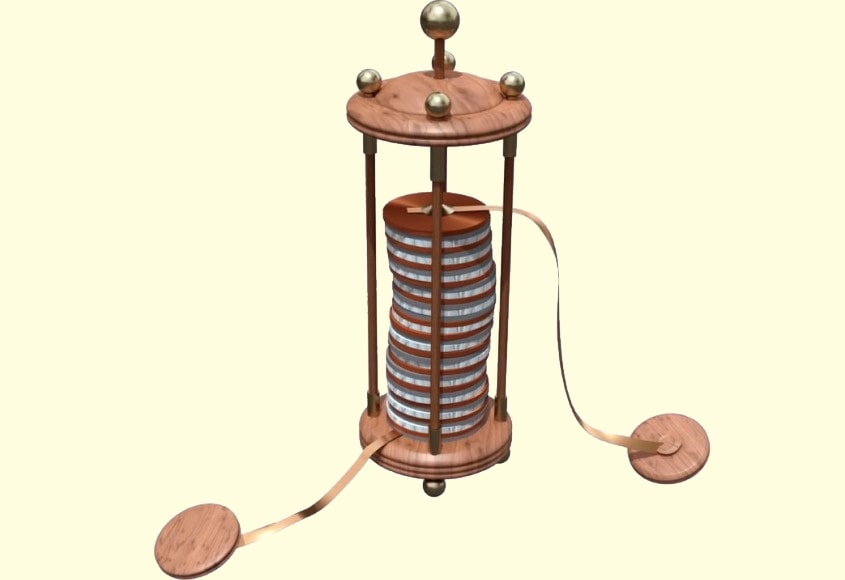
После множества опытов с разными металлами Вольта сконструировал столб из пластинок цинка, меди и войлока, смоченного раствором серной кислоты. Цинк, медь и войлок он накладывал друг на друга в таком порядке: внизу находилась медная пластинка, на ней войлок, затем цинк, опять медь, войлок, цинк, медь, войлок и т. д.
И в итоге столб оказывался заряженным на нижнем конце положительным, а на верхнем — отрицательным электричеством.
А теперь возьмите обычную батарейку и посмотрите: вы увидите, что на одном ее конце нарисован плюс, а на другом – минус. Это почти тот же самый «Вольтов столб». Только за двести лет он стал гораздо меньше. Первый-то, сделанный Алессандро Вольтой, был высотой в полметра. Представьте такую огромную батарейку!
Для самых любознательных
Современные батарейки устроены, конечно, немного иначе – в них уже нет ни металлических дисков, ни войлочных пластинок, пропитанных раствором кислоты. Но принцип тот же – батарейка содержит в себе химические вещества-реагенты, в состав которых входят два разных металла. В батарейке есть два электрода – положительный (анод) и отрицательный (катод). Между ними – жидкость-электролит: раствор, который хорошо проводит электрический ток и участвует в химической реакции. Когда металлы начинают взаимодействовать через этот раствор, возникает движение заряженных частиц из анода к катоду – и вырабатывается электрическая энергия.
Делаем сами «Вольтов столб»
Повторяем операцию, пока не закончится терпение/фольга/монетки/электролит. Когда что-либо закончится, берём мультиметр и меряем напряжение.
Батарейка (гальванический элемент) — как работает, из чего состоит
Батарейка это прижившееся и не совсем корректное название одиночного гальванического элемента. А уже их соединение в источниках питания для создания нужного напряжения — это батарея. Поэтому не стоит путать эти определения. И если называя гальванический элемент батарейкой, мы поступаем не совсем верно (но смысл понятен), то слово батарея абсолютно никакого отношения не имеет к одиночным химическим источникам электрического тока.
Данный обзор посвящен гальваническому элементу (батарейке) — химическому источнику электрического тока, основанному на взаимодействии двух металлов и (или) их оксидов в электролите, приводящих к возникновению в замкнутой цепи электрического тока. Мы подробно рассмотрим конструктивные особенности элемента, определимся с классификацией и разберемся, как работает батарейка.
История батарейки — гальванического элемента
Свое название гальванические элементы получили по имени итальянского врача и анатома Луиджи Гальвани (1737 — 1798). Проводя опыты с лягушками, Гальвани заметил, что свежепрепарированная лягушачья лапка, подвешенная на медном крючке к железному стержню, сокращается, когда к ней прикасались железом. Наблюдения были истолкованы им как проявление «животного электричества».
Объясняя это явление позже итальянский физик Александро Вольта установил, что причиной сокращения мышц служит не «животное электричество», а наличие цепи из разных проводников в жидкости. Сама лягушачья лапка играла роль чувствительного прибора.
Александро Вольта создал первый источник тока («Вольтов столб»), который можно было использовать на практике. Этот источник состоял из медных и цинковых пластин, между которыми были проложены кружочки ткани, пропитанные раствором щелочи.
Александро Вольта предложил разделить все проводники на два рода:
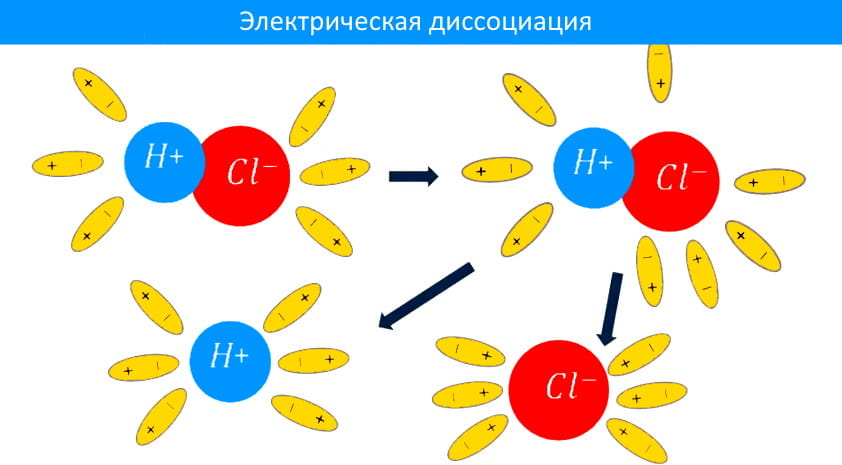
Шведский ученый Сванте Аррениус, изучая электропроводимость растворов различных веществ, в 1877 году пришел к выводу, что причиной электропроводимости является наличие в растворе ионов, которые образуются при растворении электролита в воде.
Процесс распада электролита на ионы называется электрической диссоциацией. При диссоциации в воде электролиты диссоциируют на положительно и отрицательно заряженные ионы. Под действием электрического поля, положительно заряженные ионы движутся к отрицательному полюсу источника тока (катоду) и называются катионами, а отрицательно заряженные – к положительному полюсу (аноду) и называются анионами. Таким образом электролиты обладают электронной проводимостью.
Примеры гальванических элементов:
| Название элемента | Отрицательный электрод | Положительный электрод | Электролит |
| Вольтов столб | Цинк | Медь | Раствор щелочи |
| Первый элемент Вольта | Цинк | Медь | Раствор серной кислоты |
| Элемент Даниэля | Цинк | Медь | Раствор сульфата цинка |
| Элемент Грине | Цинк | Угольный стержень | Раствор сульфата меди и бихромата калия |
| Элемент Лекланше | Цинковый цилиндр | Угольный стержень | Раствор нашатыря и оксид марганца |
| Сухой элемент | Цинковый цилиндр | Угольный стержень | Густой клейстер, приготовленный из муки на растворе нашатыря |
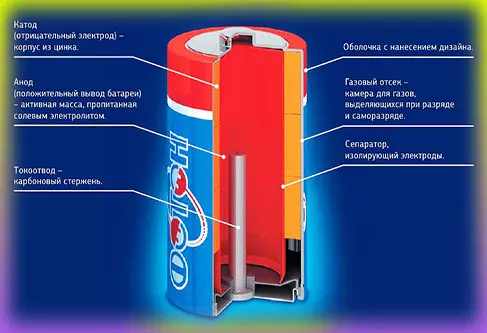
Эволюция батарейки — солевой гальванический элемент
Одним из первых гальванических элементов, которым можно было пользоваться вне лабораторий, была конструкция Жоржа Лекланше (1866 год). Она состояла из цинкового анода, катода из диоксида марганца с углем и электролита из хлорида аммония. Со временем элемент Лекланше эволюционировал в солевой (сухой) гальванический элемент следующим образом:
Конструкция сухой батареи:
 | 1 — воздушная прослойка |
| 2 — цинковый стакан | |
| 3 — электролит (NH4CL + ZnCl2) | |
| 4 — смесь графита и MnO2 | |
| 5 — угольный стержень | |
| 6 — защитный корпус |
Как работает сухая батарейка (солевой гальванический элемент)
Рассмотрим процессы, происходящие в сухом элементе. При потреблении тока электроны поступают через внешнюю электрическую цепь с цинкового электрода на угольный стержень. Происходят следующие реакции:
Во время разрядки цинковый стакан растворяется. Во избежание вытекания электролита или продуктов реакции цинковый стакан имеет запас по толщине или окружен железной защитной оболочкой.
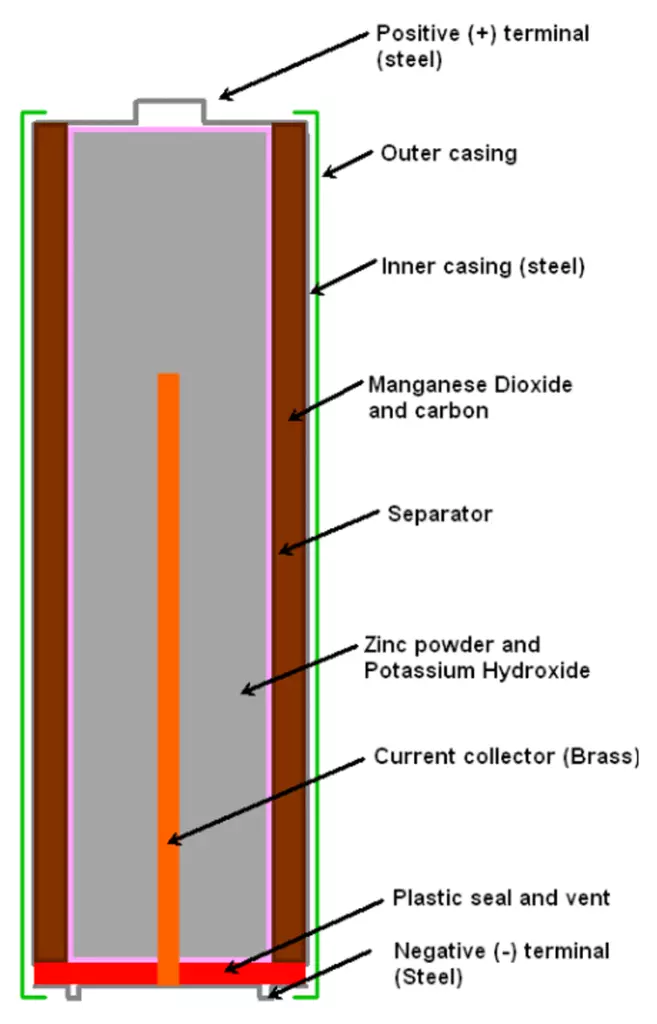
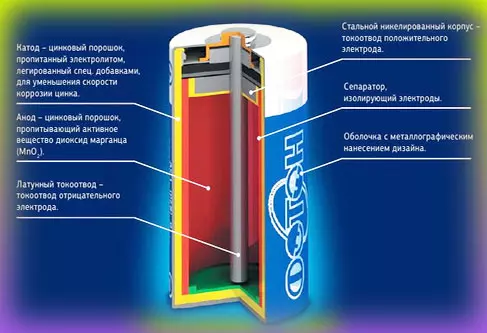
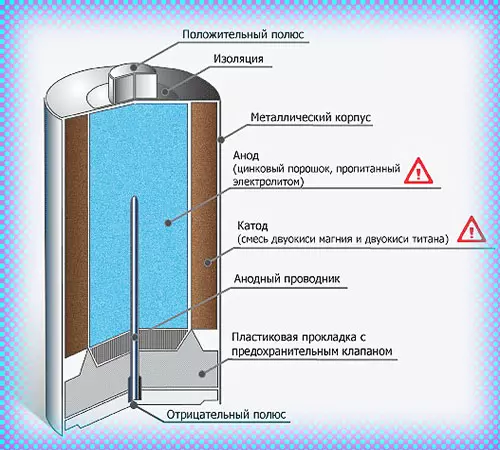
Что находится внутри щелочной батарейки
Впервые щелочные (алкалайновые) батарейки выпустила компания Eveready (Energizer) в 1959 году. Ее принципиальное отличие от сухой батарейки — состав электролита и конструкция. Электролит состоит не из соли аммония, как в солевой, а из раствора щелочи (обычно гидроксида калия). Конструкция элемента вывернута наизнанку по сравнению с конструкцией солевого элемента. То есть, если у солевого элемента корпус (-), а центральный токоотвод (+), то у щелочного элемента наоборот, корпус (+), а центральный токоотвод (-).
В солевых элементах при химической реакции расходуются все реагенты, составляющие этот элемент — анод, катод, электролит. А в щелочном элементе при химической реакции расходуется только анод и катод, электролит не расходуется. Поэтому электролита там совсем мало, и освободившееся место электролита заполнено увеличенным количеством анода и катода, что значительно увеличивает электроемкость щелочного элемента.
Типичная щелочная батарея выполнена в форме стального цилиндра, покрытого изолирующей пластиковой оболочкой. Положительный конец батарейки (катод) имеет выступающую наружу поверхность. Отрицательный конец (анод) — плоский. Эти две клеммы батарейки электрически изолированы друг от друга.
| 1 — никелированный стальной стакан | 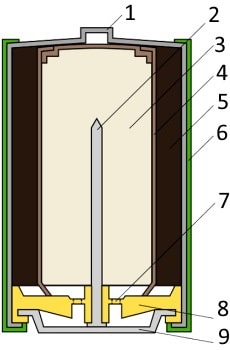 |
| 2 — латунный токосъемник | |
| 3 — анодная паста | |
| 4 — сепаратор | |
| 5 — катодная паста | |
| 6 — защитная оболочка | |
| 7 — предохранительная мембрана | |
| 8 — прокладка | |
| 9 — стальная тарелка |
Корпус батарейки обычно делается из стали с никелевым покрытием. Внутри находится несколько слоев различных материалов, химические реакции которых создают определенные уровни напряжений и токов:
Как работает батарейка
Рассмотрим как работает электрическая батарейка и какие реакции взаимодействия происходят между ее химическими компонентами:
Пока есть полная цепь между выводами батарейки, химическая реакция будет продолжаться, и электроны будут течь от отрицательного клеммника к положительному. Если разорвать цепь, то химическая реакция прекратится.
Наглядно понять, как работает батарейка и что у нее происходит внутри, можно, ознакомившись с представленной ниже видео демонстрацией.
Как работает батарейка — видео
Химическая реакция в батарейке, к которой подключен потребитель:
Как работает батарейка: принцип действия аккумуляторной и обычной
Опубликовано kachlife в 29.10.2020 29.10.2020
Как работают настенные часы, пульт от телевизора или детская игрушка на радиоуправлении? Большинство людей, не задумываясь, ответят — «от батареек» и будут, в принципе, правы. Но вряд ли кто-то из них сможет рассказать, как именно портативный элемент питания утроен, каким образом он функционирует и без чего весь процесс передачи электрического тока от батарейки к конечному потребителю был бы невозможен. Давайте же восполним этот досадный пробел в знаниях.
Что такое батарейка
В батарейках электричество возникает благодаря взаимодействию разных химических веществ. И принцип работы этих изделий легко можно отыскать в учебниках по физике. Все элементы собраны из одних и тех же частей.
Устройство батарейки простое. Различия между разными типами батарей минимальны. В основе каждой конструкции имеются:
Как работает батарейка

Катоды выполняют функцию восстановителя, т.е. принимают электроны от прибывшего анода. Электролит это среда, в которой перемещаются ионы, которые образуются в процессе химической реакции. В процессе работы батарейки постепенно образовываются новые вещества, а электроды постепенно разрушаются — батарейка садится.
Вот и вся работа батарейки, кстати, все процессы, проходящие в гальваническом элементе, необратимы, то есть заряжать батарейки нельзя. Кратко говоря о работе батарейки: анод — нагрузка — катод — электролит.
Электролит изначально изготовляли в жидком виде, но это неудобно, так как при переворачивании батарейки она просто не работала. Из-за этого электролит стали загущать, превращать его в сухой вид.
Принцип работы батарейки
Для того чтобы понять принцип функционирования обычной «пальчиковой» батарейки, необходимо иметь общее представление о её устройстве. Итак, любая батарейка состоит из трёх основных элементов — анода, катода и электролита. При этом последний может иметь фактически любое агрегатное состояние: помещённые в соляной раствор катод и анод, в принципе, так же являются «батарейкой», только в непривычном для рядового обывателя виде.
Интересно! Так называемый «вольтов столб», изобретённый Алессандро Вольта, так же имел все необходимые для производства электротока элементы. Он состоял из уложенных друг на друга цинковых и медных пластин, между которыми в качестве «прослойки» помещалась смоченная в кислоте ткань.
Анод в подобных системах – это главный источник электронов, которые, как мы знаем из школьного курса физики, имеют отрицательный заряд. Отрицательно заряженные частицы притягиваются к положительным, а в качестве «плюса» в данном случае выступает поверхность катода.
Но для возникновения электротока этого мало, ведь электронам нужна ещё и своеобразная «магистраль» — среда, которая поддерживала бы взаимодействие катода и анода. Именно здесь «на сцене» появляется электролит – соль, щёлочь или кислота, способные проводить ток.
Разберём принцип действия на конкретном примере: имеется элемент питания, рассчитанный на 18 вольт. Напряжение между электродами в нём стабильно, пока он не включён в сеть. Как только появляется потребитель (к примеру, обычная лампочка), напряжение начинает постепенно снижаться, от «минусового» электрода к «плюсовому» начнёт течь ток, и в электролите произойдёт химическая реакция, направленная на поддержание разности потенциалов между электродами.
Справка. Чем больше энергии требуется потребителю, тем интенсивнее течёт реакция внутри элемента питания и тем быстрее он выйдет из строя.
Обратная реакция
Все типы батареек и элементов имеют сходный тип химической реакции, происходящей для выработки электроэнергии.
Но в некоторых типах элементов или батарей химические вещества различны, и реакция может быть обратной. Таким образом, элементы могут быть перезаряжены — так же, как литий-ионные аккумуляторы в автомобилях или смартфонах.
Раньше было гораздо дешевле производить неперезаряжаемые элементы, такие как щелочные элементы, поэтому они использовались очень широко.
Но теперь, когда люди осознали, насколько вредно для окружающей среды просто выбрасывать неперезаряжаемые элементы, а поскольку перезаряжаемые элементы становятся дешевле, мы, вероятно, будем использовать неперезаряжаемые элементы все меньше и меньше в будущем.
Типы батареек
Что это такое солевые батарейки
Солевая батарейка изготавливается из пассивного угля и двуокиси марганца, электролит из хлорида аммония и катод из цинка. В перерывах работы элементы питания могут восстанавливаться, т.е. выравнивать локальные неоднородности в композите электролита, вызванных разрядом. Такой процесс немного продлевает срок службы батарейки.
Алкалиновые (щелочные) батарейки что это такое
В отличие от солевых батарей у алкалиновой батарейки химический элемент электролита — щелочной. Щёлочные батарейки (алкалин) имеют продолжительный срок хранения, а в процессе эксплуатации напряжение на электродах меняется гораздо меньше, чем у элементов с солевым раствором.
Литиевые батарейки что это такое
Самые современные. В отличие от щелочных и солевых батареек, в состав катода входит литий (Li – наивысший отрицательный потенциал), в состав анода — различные материалы. Электролит — органический электролит. В связи с такими элементами литиевые батарейки получили большой срок хранения, большую плотность энергии и различную рабочую температуру.