Для чего нужен карбид кальция
Карбид кальция: свойства и применение. Получение ацетилена
Карбиды – это группа неорганических соединений углерода с металлами, а также с кремнием или бором (поскольку эти элементы проявляют металлические свойства). Карбид кальция – одно из наиболее востребованных веществ этой группы. О свойствах и применении соединения читайте ниже.
История получения
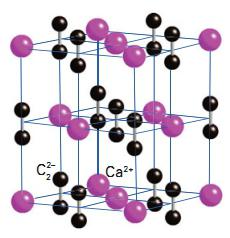
Карбид кальция – соединение, получившее широкое применение в современной промышленности. В 1862 году немецкий химик Фридрих Велер впервые синтезировал молекулу этого вещества. Получение карбида кальция он осуществил следующим образом. Ученый приготовил расплав кальция с цинком, а затем нагрел его с углем. В результате получился карбид. Химическая формула соединения – CaC2. Промышленный способ получения карбида предложил ученый Муассан в 1892 году. Другие названия вещества – ацетиленид кальция, или углеродистый кальций. Кристаллическая решетка соединения выглядит следующим образом:
Физические свойства
По своим физическим свойствам карбид кальция является кристаллическим веществом с температурой плавления 2300 о С. Эта цифра является справедливой лишь для чистого соединения. Карбид, содержащий примеси, может иметь другие показатели температуры плавления. Основное агрегатное состояние вещества – твердое, а цвет варьирует от серого до коричневого.
Химические свойства
Карбид кальция хорошо впитывает воду. Этот процесс сопровождается химической реакцией разложения. Важно, что карбидная пыль обладает раздражающим действием на слизистые оболочки, кожу и органы дыхания. Поэтому во время работы с соединением необходимо использовать противогазы либо противопылевые респираторы. С кислородом карбид кальция взаимодействует при высокой температуре с образованием карбоната кальция. Реакция с азотом приводит к синтезу цианамида кальция. Также при высоких температурах карбид кальция вступает в реакции соединения с хлором, фосфором, мышьяком. Но все-таки одним из важнейших свойств соединения считается разложение водой.
Получение
Производство карбида кальция заключается в следующем. Негашеную известь и предварительно измельченный кокс смешивают. Полученную смесь подвергают расплавлению в электрических печах. Кокс и оксид кальция берутся в равных по массе частях. Процесс происходит при температуре 1900 о С. Расплав выходит из печи и в дальнейшем разливается по специальным формам. Затем уже затвердевший карбид кальция дробят и сортируют по размеру кусков. Гранулы вещества разделяются на четыре фракции в соответствии с их размерами: 25×80, 15×25, 8×15, 2×8, которые определяются ГОСТом 1460-56. По своему составу технический карбид кальция содержит 75-80% основного вещества. На долю примесей, таких, как углерод, известь и других, приходится до 25% от общей массы полученной смеси. Кроме того, содержащийся в техническом карбиде сульфид и фосфид кальция обусловливают довольно неприятный его запах. Представим реакцию получения СаС2: СаО + 3С → СаС2 + СО↑. Образование ацетиленида кальция сопровождается поглощением тепла. Поэтому логично предположить, что реакция его разложения, напротив, идет с выделением энергии.
Транспортировка и хранение
По причине того, что влага моментально разлагает карбид с выделением большого количества тепла и образованием взрывоопасного газа ацетилена, хранить вещество необходимо в герметично закупоренных барабанах или бидонах. Следует помнить, что ацетилен легче воздуха и способен скапливаться в верхних зонах помещения. Этот газ, помимо наркотического действия, обладает способностью к самовоспламенению. Поэтому использовать карбид кальция необходимо с большой осторожностью. Расфасовке на производстве уделяется особое внимание. Готовое вещество помещается в специальные барабаны (тара, напоминающая консервные банки). Такая упаковка требует аккуратного вскрытия. При этом должен использоваться инструмент, не приводящий к образованию искр (молоток или специальный нож). В случае попадания карбида на кожу или слизистые оболочки необходимо немедленно промыть пораженный участок водой и обработать место вазелином или жирным кремом. Транспортировка соединения осуществляется с использованием только крытых видов транспорта. Воздушная доставка карбида запрещена. Помещения, где хранится СаС2, должны быть хорошо проветриваемыми. Также не разрешается хранить карбид совместно с другими химическими веществами. Это может привести к нежелательным, а, возможно, и опасным, реакциям. Срок хранения карбида составляет полгода.
Применение
Область применения карбида кальция чрезвычайно широка. В первую очередь это промышленный синтез. Карбид кальция используется для производства синтетического каучука, уксусной кислоты, ацетона, этилена, винилхлорида, стирола. Также он находит применение в получении цианамида кальция. Это вещество ценно своим использованием в синтезе различных удобрений и цианистых веществ. В сельском хозяйстве любому агроному известно такое название, как карбидно-карбамидный регулятор. Он применяется для регуляции роста растений. А для его получения также используется карбид кальция. Кроме того, это соединение находит применение в процессе производства цианамида кальция. Эта реакция основана на нагревании карбида кальция с азотом. Восстановление щелочных металлов также не обходится без применения описываемого нами вещества. Карбид кальция применяется и в процессе газосварки. Например, широко используются карбидные лампы. Принцип их работы основан на взаимодействии в специальной емкости карбида с водой и сгорании на выходе из аппарата конечного вещества реакции – ацетилена. Посмотрите на фото карбидной лампы.
Производство ацетилена
Одной из важнейших областей применения карбида кальция является его использование в получении ацетилена. Заслуга в открытии этого способа также принадлежит немецкому ученому-химику Фридриху Велеру. В основе этого промышленного процесса лежит реакция разложения карбида под воздействием воды. СаС2 + 2 Н2О → С2Н2 + Са(ОН)2↓. На выходе образуется газ ацетилен и гашеная известь, выпадающая в осадок. Процесс сопровождается выделением большого количества тепла. Объем газа на выходе зависит от того, насколько чистый используется для реакции карбид кальция. Ацетилен, образующийся в результате, может иметь различный объем – 1 кг исходного вещества может дать от 235 до 290 литров газа. Что касается скорости протекания реакции, то она зависит как от малого процента примесей в карбиде кальция, так и от температуры воды, а также ее чистоты. Если рассматривать теоретическую реакцию производства ацетилена из карбида, то в ней на 1 кг карбида достаточно 560 мл воды. Однако на практике объем воды для проведения реакции увеличивается. На 1 кг карбида кальция в условиях промышленного синтеза требуется от 5 до 20 литров воды. Такое количество необходимо для того, чтобы ацетилен лучше охлаждался, а также для обеспечения оптимальной безопасности при работе. Ниже изображен немецкий химик Фридрих Велер.
Лабораторный опыт получения ацетилена
Многим из школьных уроков химии знакома реакция взаимодействия карбида с водой. Обычно этот опыт позволяет продемонстрировать реакцию получения ацетилена, а также физические и химические его свойства. Процесс выделения газа при этом происходит достаточно бурно, поэтому трубка, отводящая ацетилен из колбы с действующими веществами, помещается в чашу с водой. Это обеспечивает менее активное и стремительное движение газа. Кроме того, в лабораторных условиях можно использовать и другой способ, чтобы сделать не слишком бурной реакцию разложения такого соединения, как карбид. Ацетилен при этом идет равномерно и спокойно. Для этого вместо воды необходимо взять насыщенный раствор поваренной соли. Также в лаборатории при проведении этой реакции следует осторожно добавлять воду в карбид, помещенный в объемную колбу, а не наоборот.
Что такое карбид кальция для сварки

Карбид кальция в сварке
Для сварочных работ карбид является чуть ли не идеальным веществом, потому что при взаимодействии с водой выделяет в окружающее пространство летучий газ ацетилен, который служит основой металлизации, напайки, кислородной сварки и множества иных процессов, относящихся к обработке металлических сплавов.

Так как при воздействии воды карбид выделяет большое количество ацетиленового газа и тепловой энергии, это существенно затрудняет его хранение. Чтобы избежать порчи вещества, его нередко укладывают в герметичные стальные резервуары. При открытии этих металлических сосудов необходимо избегать открытого пламени и искр, иначе могут быть печальные последствия.
Карбидная пыль (частички до 2 мм) непригодна для применения, потому что растворяется в воде практически моментально. Кроме того, при хранении большого количества пыли увеличивается риск, что применение состава в итоге приведет к взрыву резервуара. Специалисты отмечают, что килограмм рассматриваемого вещества способен выделить при взаимодействии с водой более 260 кубических дюймов ацетилена.
Карбид часто используется для газовой резки и сварки. При горении ацетилен контактирует с кислородом и достигает температуры 3150, что делает этот газ совершенно незаменимым при обработке тугоплавких металлических сплавов. В целях безопасности ацетилен делают в особых генераторах на основе угля, нефти, природного газа или карбида кальция.
Особенности применения
В сварке это вещество используют везде. Делают это по следующей схеме:
Карбид при сварочных работах выполняет функции топлива, насыщающего генератор газа. И без его применения будет трудно применять ацетиленовую горелку. Ведь газовый баллон очень нелегко перемещать. А карбидные кусочки достаточно положить в герметичный сосуд и транспортировать на совершенно любые расстояния, предотвратив появление влаги.
Требования безопасности
В связи с тем, что это опасный материал, работать с ним нужно, строго соблюдая правила безопасности. Основные правила, которые обязательно должны выполнять при сварке с помощью карбида:
Соблюдая эти правила, можно безопасно пользоваться карбидом для сварки. Кроме того, это вещество позволяет сэкономить и сократить расход ацетилена.
Как применяется карбид кальция для сварки, из чего он сделан
Карбид кальция CaC2– один из символов детства советских хулиганов. Данное вещество применяется в газовой сварке, поскольку обеспечивает выделение огромного количества горючего газа ацетилена.
При погружении в воду карбид выделяет ацетилен, который является горючим компонентом при газовой сварке. Ацетилен в смеси с кислородом горит при температуре 3150°C градусов, что выше температуры плавления большинства металлов и сплавов. Использование такой технологии позволяет сваривать простую и нержавеющую сталь, цветные металлы, для сварки которых электродуговой сваркой потребовались бы специальные электроды с высокой стоимостью. Ацетилен позволяет производить резку металла, особенно толстостенного листа и фасонного проката, который невозможно разрезать болгаркой.
Впервые карбид кальция был изготовлен немецким химиком Фридрихом Велером в 1862 году путем нагревания кальций-цинкового сплава в угольной среде.
При помещении карбида в воду происходит образование гашеной извести и газа ацетилена. Реакция 1 кг чистого карбида с 0,56 л. воды образуется 1,16 кг извести и 372 л. ацетилена.
В виде химической формулы реакция записывается так: СаС2 + Н2О = С2Н2 + Ca(ОН).
Теоретически, карбид разводится водой в соотношении 2:1, однако на практике используется 1 кг карбида заливается 2-4 литрами воды, чтобы избежать взрыва.
Метод производства
Карбид производится в электропечах путем сплавления (прокаливания) смеси кокса и оксида кальция (негашеной извести) при температуре от 1900°C до 2300°C. Резкий и неприятный чесночный запах карбида и вырабатываемого ацетилена вызван содержанием в карбидной смеси примесей фосфидов и сульфатов кальция.
Процесс осуществляется в несколько этапов:
Конечный продукт состоит из 75-78% CaC2, остальное составляет известь и примеси. Гранулы карбида существуют разных размеров: 2×8; 8×15; 15×25; 25×80 мм. Большие гранулы обеспечивают получение большего количества ацетилена, но увеличивают время реакции. Если гранулы 8х15 и 15х25 мм разлагаются за 5-6 минут, то для разложения гранул 25х80 мм требуется более 10 минут.
Применение при сварочных работах
Хранение карбида осуществляется в специальных стальных баках объемом 100 или 130 литров. Открытие этих баков должно производиться только при отсутствии огня или искр в близости от них деревянным молотком и латунным зубилом. Неиспользованный карбид в банке закрывается водонепроницаемой крышкой.
Ацетилен для сварочных работ вырабатывается из карбида в генераторе стационарного или мобильного типа и разного объема. Средний объем ацетиленовых генераторов рассчитан на прием от 5 до 15 литров воды и, соответственно, 2-5 килограммов карбида. Выход ацетилена считается несколько ниже теоретического и принимается равным 260-280 литров с одного килограмма CaC2. Рекомендуется использовать карбид крупной фракции – 80 мм
Принцип использования ацетилена для сварочной работы таков:
В газовой сварке главным плюсом применения карбида является его низкий вес и небольшой вес применяемого оборудования. Газовые баллоны для ацетилена очень тяжелые, их необходимо перемещать на специальной тележке или в 2-3 пары рук. Средний же генератор весит 15-20 кг, что позволяет без особых усилий перемещать его в одиночку или с одним помощников. При перемещении сухого карбида достаточно соблюдать элементарные правила хранения – избегать попадания влаги на вещество и попадание мелкой карбидной пыли на кожу и в глаза.
Техника безопасности
Карбид для сварки относится к классу взрывоопасных веществ. Безопасное применение карбида обеспечивается учетом ряда условий:
Соблюдение этих простых правил позволит обеспечить собственную безопасность и безопасность людей, находящихся вблизи объекта работ.

Карбид следует покупать в проверенных магазинах сварочного оборудования, поскольку приобретение некачественного карбида может затруднить проведение сварочных работ. Можно также заказать его в интернет-магазинах. Цена карбида варьируется от 75 до 190 рублей за килограмм, в зависимости от производителя.
Если имеется необходимость в регулярном использовании оборудования для газовой сварки и резки, лучше купить профессиональное оборудование, изготовленное на промышленном предприятии. Применение самодельных генераторов чревато получением тяжелых травм и угрозой для жизни.
Что такое карбид. Свойства карбида. Применение карбида
Забава детства. Так многие вспоминают о карбиде, особенно бывшие мальчишки, а ныне, конечно, взрослые мужчины.
Они брали камешки на строительных рынках. Покупать не покупали, а так, таскали с развалов и из кузовов грузовиков.
Любовались и белесыми пузырями, которые карбид давал, попадая в лужи. Однако, кому обязаны таким весельем, сорванцы прошлых лет, зачастую не знали.
Что такое карбид? Попробуем ответить на вопрос, кажущийся неважным в детстве.
Что такое карбид
Карбит – не конкретное вещество, а группа соединений элементов с углеродом. Последний должен быть более электроотрицательным, чем «сосед».
Это обязательное условие, исключающее из ряда карбидов галогениды и оксиды углерода.
Под электроотрицательностью понимается способность атома сдвигать к себе электроны других веществ.
Электротрицательность углерода равна 2,6. Это данные шкалы Полинга. Она выстроена с учетом, что ионность в ковалентной связи делает эту связь прочнее.
Получается, электротрицательность вторых элементов в карбидах должна быть меньше 2,6.
Большинство подходящих элементов – металлы. Но, около 15% карбидов их не содержат.
Есть и цветные дуэты с углеродом, к примеру, карбид железа. Это всем знакомый цемент. Окрас у соединения серый.
Получается, свойства карбидов могут разниться. Несовпадения рассмотрим в главе «Виды». Пока же, изучим общие характеристики класса соединений.
Свойства карбида
Особенно отличились карбиды переходных металлов. Это элементы побочных подгрупп периодической системы. У всех переходных металлов есть электроны на d- и f-орбиталях.
Обобщает карбиды и высокая температура плавления. Как правило, она выше, чем у входящего в соединение металла.
Если он из переходных, размягчение может начинаться лишь при 3000 градусов Цельсия.
Интересно, что температура плавления поднимается вместе с номером группы, к коей принадлежит «сосед» углерода.
Где карбид можно понять по структуре соединений. Их решетки, зачастую, дефектны.
Это значит, есть отклонения от теоретической схемы, разрывы и смещения. Именно поэтому свойства карбидов могут в 100, а то и 1000 раз разниться с высчитанными по формулам.
Виды карбидов
Основных видов карбидов три. Первый – ковалентные соединения. Валентность – предрасположенность к определенному числу химических связей.
Ковалентная связь – это перекрытие валентных облаков разных элементов. То есть, у них образуются общие электронные пары. Именно такие лежат в основе ковалентных карбидов.
В итоге, карбиды группы трудно расплавить, — решетка не хочет рушиться. Прочность связи делает оба соединения твердыми.
Карбид кремния алмаз не «побеждает», но свои достойные 8 баллов по шкале Мооса имеет.
Второй вид карбидов – ионный. Его, так же, именуют солеобразным. Все образованны металлами 1-ой и 2-ой групп таблицы Менделеева.
В класс включен и карбид алюминия. Соединения группы разлагаются не только кислотами, но и водой.
При реакции ионных карбидов с водой выделяется водород. В жидкости формируется и выпадает в осадок гидроксид металла.
Реакция протекает бурно. Резкий выброс на поверхность воды водорода и дает то самое пузырение.
Третий вид карбидов – ионно-ковалентно-металлические, попросту, металлоподобные.
Такие соединения формируются элементами 4-ой, 5-ой, 6-ой, 7-ой групп периодической системы. Исключения: — карбиды никеля, кобальта и железа.
Если у ковалентных карбидов химическая активность низкая, а у ионных – высокая, то у третьего вида соединений она средняя.
Примечательно строение молекул. Их основа – атомы металла. Атомы же углерода находятся в пустотах между ними.
Поэтому, к примеру, карбид вольфрама называют внедренным. Имеется в виду, что углерод внедрился в кристаллическую решетку металла.
Такое строение обеспечивает рекордную прочность и высокую температуру плавления. Еще одно известное соединение группы – карбид титана.
Применение карбида
Карбид титана стал основой безвольфрамовых, но столь же твердых сплавов.
К тому же, соединение служит покрытием инструментария, в основном, промышленного и строительного.
Такое напыление сводит к минимуму износ деталей и позволяет обрабатывать ими даже самые твердые материалы.
Карбид кальция нужен при сварочных работах. Из соединения получают ацетилен. Карбид служит его источником, а заодно, и топливом для машин кислородной сварки.
Ацетилен – газ. Одного его достаточно для работы аппаратов. Но, есть еще и вода. Карбид кальция вступает с ней в бурную реакцию.
Итог – не только пузырьки, нравящиеся детям, но и обилие тепла – еще одного источника энергии.
Карбид бора применяют в качестве огнеупора. Температура плавления соединения составляет почти 2500 градусов.
Прочность карбида позволяет добавлять его в бронежилеты. Защитить материал способен не только от пуль, но и радиации.
Поэтому, один из ответов на вопрос, где взять карбид бора, — в защитных экранах, задерживающих излучение.
Список карбидов и их роли в жизни общества может занять многие страницы. Соединений несколько десятков и у каждого из них есть применение, причем, не одно. Нет и единственной схемы получения карбидов.
Придется ограничиться общими фразами. Однако, и в них есть толика полезной информации.
Получение карбидов
Большинство карбидов именно получают, а не добывают. Первый синтез проведен в начале 19-го столетия.
Он оказался неустойчивым, в отличие от третьего синтезированного соединения углерода с железом.
Смотря на опытные образцы, ученые не могли понять, где найти карбид за пределами лабораторий.
Минералы, в которых металлы соединены с углеродом открыли лишь в начале 20-го века.
Судя по дате открытия карбидных минералов, они не являются распространенными.
Поэтому, в промышленных масштабах героев статьи до сих пор синтезируют. Масса карбида может получиться, к примеру, из древесного угля и оксидов металлов.
Цена карбида
Карбид кальция купить предлагают примерно за 40-90 рублей за килограмм. Соединение углерода с бором стоит от 100-та рублей за кило.
Купить карбид кремния предлагают примерно по 160 рублей за 1000 граммов.
А вот за кило карбида гафния придется выложить около 21 000 рублей, причем, при оптовых закупках.
То есть, стоимость материала во многом зависит от присутствующего в нем металла, или неметалла. Существует даже карбид золота.
Он, кстати, способен взорваться при простом пересыпании порошка. Так что, даже за большую цену, доставить сырье потребителю – задача не из легких.