Для чего нужен большой сальник в брюшной полости
Резекция большого сальника (лапароскопия/лапаротомия)
Резекция большого сальника — операция, при которой иссекается и ушивается складка брюшины, покрывающая полость брюшины от области желудка до тонкого кишечника. Данное хирургическое вмешательство, как правило, не является самостоятельной операцией, и чаще выполняется при злокачественном процессе в органах брюшины и малого таза. Как показывает практика, при поражении матки и придатков своевременная выполненная резекция увеличивает выживаемость пациенток. Объясняется это тем, что в ткани сальника легко метастазируют злокачественные клетки. Незамеченные при операции, они будут причиной новых очагов, поэтому удаленная ткань сальника в обязательном порядке должна направляться на гистологический анализ. В ходе хирургического вмешательства по поводу злокачественного процесса удалению также подлежат затронутые раком структуры: лимфатические узлы, кишечник.
Резекция большого сальника может быть проведена с использованием лапароскопического или лапаротомического доступа. В ходе лапаротомии выполняется разрез передней брюшной стенки, открытый метод целесообразен, если необходим обзор пораженных участков. Продолжительность госпитализации в этом случае составляет около 10 дней, восстановление займет около 1-1,5 месяца. В отличие от лапаротомии, при лапароскопическом доступе манипуляции выполняются через несколько небольших разрезов на животе с использованием видеоэндоскопического оборудования. Все действия хирурга отражаются на мониторе с качественным разрешением, визуальный контроль современной аппаратуры обеспечивает высокую точность манипуляций. После лапароскопии длительность пребывания в клинике составляет не более трех дней, период восстановления занимает не более 4 недель.
Показания и противопоказания
Преимущества резекции большого сальника
Комментарий врача

Руководитель хирургической службы SwissClinic Пучков Константин Викторович
Почему резекцию большого сальника лучше сделать в Швейцарской Университетской клинике?
Часто задаваемые вопросы
В чем заключается подготовка к резекции большого сальника?
Перед операцией необходимо тщательно очистить кишечник. Также за несколько дней до вмешательства нужно исключить из рациона продукты, способные вызвать повышенное газообразование. Операция проводится строго натощак, последний прием пищи, как минимум, за 8 ч до ее начала. При необходимости приема каких-либо медикаментов необходимо предупредить лечащего врача, возможно, некоторые препараты нужно будет исключить на несколько дней.
Возможны ли осложнения при резекции большого сальника?
Как при любом оперативном вмешательстве, при резекции также есть риск развития осложнений, теоретически нельзя исключить кровотечения или повреждения близлежащих органов в ходе вмешательства, инфицирование в ранний послеоперационный период. Поэтому наши пациенты проходят тщательное предоперационное обследование, чтобы исключить факторы, увеличивающие риск развития осложнений. Визуальный контроль процесса и использование при проведении операции оборудования и инструментария последнего поколения сводит к минимуму риск негативных последствий.
Реабилитация после резекции большого сальника
На продолжительность восстановления влияет, прежде всего, метод проведения операции. Но, независимо от используемого доступа, через несколько часов женщина может ходить, ей разрешается принимать жидкую легкую пищу. При лапаротомическом доступе длительность госпитализации составляет около 7-10 дней, восстановление занимает 4-6 недель. После лапароскопии период реабилитации значительно короче, женщина, как правило, выписывается на 3 сутки, полное восстановление занимает 2-4 недели. В послеоперационный период могут быть назначены антибактериальные и обезболивающие препараты. На протяжении месяца следует отказаться от интенсивных физических нагрузок и половых контактов, лучше исключить посещение бассейна или сауны.
Используется ли анестезия при резекции большого сальника?
В ходе оперативного вмешательства какие-либо болезненные ощущения полностью исключены, операция может быть проведена под общим наркозом, эпидуральной или спинальной анестезией. Какому способу отдать предпочтение, решает врач в каждом случае индивидуально.
Заболевания
Рак шейки матки
Рак шейки матки — онкологическое заболевание, при котором эпителий нижнего отдела матки трансформируется в злокачественные клетки. В зависимости от типа эпителия различают плоскоклеточный рак — он диагностируется у 85-95% больных, и аденокарциному — появляющуюся в 5-15%.
Рак эндометрия
Рак эндометрия — онкологическое заболевание, при котором злокачественный процесс развивается во внутреннем слое матки. Среди онкологических патологий женской половой сферы эта болезнь по частоте возникновения занимает лидирующее место. Согласно статистике, на 100 тысяч женщин приходится около 13 пациенток с диагностированным заболеванием. Около 75% заболевших приходится на женщин после 50 лет — предменопаузального и постменопаузального возраста, однако в последние годы все чаще пациентками онколога становятся женщины помоложе.
Рак яичников
Рак яичников — одно из распространенных онкологических заболеваний в гинекологии, по частоте развития уступает первенство лишь злокачественным опухолям матки. Поражение яичника может быть первичным — патологический очаг находится в самом яичнике, и вторичным, называемым метастатическим — очаг патологии расположен в любом другом органе. Злокачественные клетки в тканях яичника могут появляться при опухолях в молочной железе, матке, кишечнике, желудке.
Записывайтесь на консультацию: +7 (495) 782-50-10
Воспаление и последствия удаления сальника брюшной полости
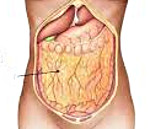
Все органы и системы человека покрыты специальной оболочкой, которая предотвращает трение органов друг о друга, способствует поддержанию постоянства внутренней среды, адсорбирует избыточное количество жидкости и выполняет трофические функции. Эта материя в медицине получила название брюшина. По передней части кишечника она формирует складку, которая визуально напоминает фартук.
Строение, расположение и функции сальника брюшной полости
В процессе эволюции человек стал прямоходящим, в результате чего органы его брюшной полости стали беззащитными. Чтобы сократить вероятность травматизации, образовался дополнительный орган, который получил название сальник.
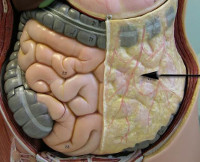
Большой сальник – это четыре своеобразных листка, которые дублируют форму брюшины. Начинается у боковой поверхности желудка и заканчивается у поперечно-ободочной кишки. В анатомии этот участок получил название – желудочно-кишечная связка. В ней находится большое скопление нервов и сосудов. Свободный край сальника, словно фартук, опустился еще ниже и покрыл петли тонкого кишечника. Также сальник в брюшине человека находится позади поперечно-ободочной кишки, плотно соприкасаясь с брыжейкой и париетальной брюшиной.
Полости между четырьмя листами соединительных тканей заполнены жировой клетчаткой. За счет этого сальник и получил название большой.
Малый сальник брюшной полости имеет немного другое анатомическое строение. Этот орган включает в себя три связки, которые переходят из одной в другую.
Также существует такое понятие, как сальниковая сумка. Представляет собой большую щель, которая была образована брюшиной. С обеих сторон ограничивает себя задней стенкой желудка, большим и малым сальником, париетальным листком и небольшим участком поджелудочной железы.
Сальниковая сумка, как и сами сальники, выполняют единственную, но порой жизненно важную функцию – защитную. При ранениях и повреждениях брюшной полости они закрывают повреждения, минимизируя кровопотери и предотвращая попадание в организм различных инфекций. При обострении аппендицита сумка спаивается с висцеральной брюшиной и не позволяет аппендиксу достигать критических размеров.
Симптомы и причины воспаления сальника
Оментит – это заболевание, сопровождающееся воспалением сальника. Представляет собой складку висцеральной брюшины. В зависимости от этиологии воспалительного процесса недуг делится на первичный и вторичный.
Первичная форма развивается в результате инфекционного заражения, травматического ранения и/или интраоперационного повреждения целостности. В хирургии более распространено вторичное воспаление. Развивается оно в результате воздействия следующих провоцирующих факторов:
Сальники быстро вовлекаются в воспаление из-за большого количества жировых тканей с рыхлой структурой и обильного кровоснабжения.
Симптомы заболевания зависят напрямую от характера воспалительного процесса и провоцирующих факторов. При острой форме течения недуга пациенты отмечают острые боли, которые не имеют определенной локализации. Параллельно могут стремительно развиваться все признаки отравления организма: головокружение, головные боли, повышение температуры тела и рвота.
При подозрении на оментит требуется незамедлительно обратиться за консультацией в медицинское учреждение. Врач в ходе осмотра отмечает мышечное напряжение в области расположения сальника, порой пальпируется уплотнение. Как правило, человек находится в полусогнутом состоянии, поскольку не может полностью разогнуть туловище.
Если своевременно не принять меры, воспаление приведет к образованию спаек, которые нарушают прохождение пищи по кишечнику, способствуют образованию запоров, а также полной или частичной непроходимости кишечника.
Последствия удаления сальника в брюшной полости
Лечение большого и малого сальника в зависимости от сложности течения недуга и сводится к консервативному или оперативному вмешательству.
Удаление большого сальника, как правило, требуется при лечении онкологических заболеваний кишечной трубы. Этот шаг жизненно необходим, поскольку в толще брюшины практически всегда образуется большое количество метастазов. По одному они не удаляются, поскольку это нецелесообразно и не эффективно.
В ходе операции доктор вскрывает брюшную полость продольным разрезом, чтобы открыть доступ к поражениям. Если большой сальник удалять через поперечный доступ, значительно увеличивается вероятность рецидива онкологического заболевания.
Прогнозы зависят от стадии развития недуга и масштабов поражения органа. При грамотном терапевтическом курсе и своевременном начале лечения исход благоприятен. Как правило, уже по истечении нескольких месяцев пациенты возвращаются к привычному образу жизни.
Если развилось генерализированное поражение с острым отравлением, это может стать причиной тяжелых состояний, которые несут угрозу жизни – сепсис, шок.
Профилактика сводится к своевременному и грамотному лечению хронических и острых заболеваний, тщательной внутрибрюшной ревизии в процессе выполнения лапаротомии. После оперативного вмешательства людям показано проходить 1-2 раза в год ультразвуковое обследование брюшной полости (УЗИ).
Многие пациенты переживают, как после удаления сальника изменится их жизнь, будет ли она по-прежнему полноценной. Как показывает практика, для организма удаление этого органа не несет никаких последствий.
Оментит
Оментит — воспалительное заболевание сальника, представляющего собой складку висцеральной брюшины. Болезнь проявляется острой разлитой болью в животе, тошнотой, лихорадкой, головной болью, рвотой. Пациенты принимают вынужденное полусогнутое положение, при разгибании туловища возникает резкая боль. Диагностика включает осмотр хирурга, проведение оментографии, КТ брюшной полости, диагностической лапароскопии. Лечение острой патологии хирургическое. Выполняют удаление сальника, ревизию брюшной полости и установку дренажа. При хроническом течении назначают антибактериальные и противовоспалительные препараты в сочетании с физиотерапией.
Общие сведения
Причины оментита
Исходя из этиологии воспалительного процесса, заболевание бывает первичным и вторичным. Первичный оментит формируется в результате травматического ранения, инфекционного заражения и интраоперационного повреждения брюшины. В этом случае инфекция возникает непосредственно в дупликатуре брюшины. Изолированное поражение участка сальника обнаруживается при туберкулезе и актиномикозе. В хирургии встречается преимущественно вторичное воспаление, которое возникает в результате следующих причин:
Патогенез
Ввиду обильного кровоснабжения и большого количества рыхлой жировой ткани сальник быстро вовлекается в процесс воспаления. Орган обладает резорбтивной и адгезивной способностью и выполняет защитную функцию в организме. При механическом повреждении, ишемии, инфекционном процессе повышается иммунологическая активность клеток, способность к абсорбции жидкости из полости живота, активизируется система гемостаза. При оментите отмечается гиперемия, отек складок брюшины с фиброзным наслоением и инфильтративным уплотнением тканей. При гистологическом исследовании обнаруживаются признаки воспаления (тромбоз и полнокровие сосудов, кровоизлияния, островки некроза), участки лейкоцитарной инфильтрации, большое количество эозинофилов, лимфоцитов. При туберкулезном оментите визуализируются множественные белесоватые бугорки. Мелкие образования приобретают красноватый окрас при соприкосновении органа с воздухом во время хирургических манипуляций.
Классификация
Исходя из выраженности воспалительного процесса, выделяют острый и хронический оментит. Острая форма болезни сопровождается ярко выраженными симптомами с нарастающей интоксикацией, хроническая характеризуется вялотекущим течением с периодами обострения и ремиссии. В зависимости от степени воспалительно-деструктивных изменений выделяют 3 стадии оментита:
Симптомы оментита
Клиническая картина патологии зависит от характера воспалительного процесса и причин заболевания. При остром оментите пациенты жалуются на интенсивные резкие боли в животе, не имеющие четкой локализации. Развиваются признаки интоксикации: рвота, повышение температуры тела до фебрильных значений, головная боль, головокружение. При осмотре обращает внимание мышечное напряжение брюшной стенки, иногда пальпируется болезненное образование плотной консистенции. Патогномоничным признаком является невозможность разогнуть туловище, ввиду чего пациент находится в полусогнутом состоянии. Спаечные процессы в брюшной полости могут привести к нарушению прохождения пищи по кишечнику, возникновению запора, частичной или полной кишечной непроходимости.
Хронический оментит характерен для послеоперационного и туберкулезного воспаления, проявляется дискомфортом и ноющими болями в животе, симптомы интоксикации отсутствуют или слабо выражены. При глубокой пальпации передней стенки живота определяется подвижное образование тестоватой консистенции, чаще безболезненное.
Осложнения
Диагностика
Ввиду редкости заболевания, отсутствия специфической клинической картины дооперационное установление диагноза представляет значительные трудности. Для диагностики оментита рекомендовано провести следующие обследования:
Дифференциальная диагностика оментита проводится с другими воспалительными внутрибрюшинными заболеваниями (аппендицит, холецистит, панкреатит, колит). Патология может иметь схожую симптоматику с перитонитом, перфоративной язвой желудка, 12-ПК, кишечной непроходимостью другой этиологии. Заболевание дифференцируют с доброкачественными и злокачественными новообразованиями кишечника, брыжейки. Для дополнительной диагностики и исключения заболеваний близлежащих органов проводят УЗИ ОБП.
Лечение оментита
При тяжелых поражениях органа и выраженной клинической картине проводят срочное хирургическое вмешательство. Во время операции, исходя из масштабов поражения, выполняют оментэктомию и тщательную ревизию полости живота. Линию резекции инвагинируют и ушивают тонкими кетгутовыми нитками. В брюшную полость вводят антибактериальные препараты и устанавливают дренаж. В послеоперационном периоде назначают антибиотики, анальгетики.
При подтвержденном хроническом оментите возможно проведение консервативной терапии. В условиях стационара назначают антибактериальные препараты согласно чувствительности возбудителя инфекции, противовоспалительные и обезболивающие средства. Пациентам рекомендован покой, постельный режим. После стихания воспаления выполняют курс физиотерапевтических процедур (УВЧ, магнитотерапия, соллюкс-терапия).
Прогноз и профилактика
Прогноз заболевания зависит от запущенности патологии и масштабов поражения сальника. При своевременно проведенной операции и грамотном ведении реабилитационного периода прогноз благоприятный. Пациенты через несколько месяцев возвращаются к привычному образу жизни. Генерализованное поражение с острой интоксикацией влечет развитие тяжелых жизнеугрожающих состояний (шок, сепсис). Профилактика оментита заключается в тщательной внутрибрюшной ревизии при выполнении лапаротомии, своевременном лечении острых и хронических заболеваний. Пациентам после проведения вмешательств на ОБП 1-2 раза в год показано проведение УЗИ-контроля.
Иммунные структуры большого сальника и их роль в метастазировании злокачественных опухолей
Полный текст
Аннотация
Метастазирование злокачественных опухолей в большой сальник представляет собой одну из актуальных проблем онкологии. В работе приведён обзор литературы последних лет по строению и функциям иммунных структур большого сальника и характеристике их особенностей, способствующих или препятствующих опухолевой диссеминации. Описан клеточный состав лимфоидных узелков и млечных пятен, показаны функциональные и фенотипические свойства макрофагов и лимфоцитов. Охарактеризованы уникальные субпопуляции иммунокомпетентных клеток, свойственных именно этому органу, и синтезируемые ими цитокины. Особое внимание уделено окружающей иммунокомпетентные клетки висцеральной жировой ткани и её влиянию на их функции. Анализ данных литературы позволил выявить двойственную роль, то есть как защитную, так и иммуносупрессивную, лимфоидных структур большого сальника. Первая, по-видимому, связана преимущественно с ответом на бактериальные патогены, а вторая реализуется при метастазировании злокачественных опухолей. Сделан акцент на иммунологические механизмы, создающие локальные условия для роста и развития метастазов, в частности на провоспалительные цитокины, хемокины, ростовые факторы, секретируемые иммунными, опухолевыми, мезотелиальными клетками, а также значение в этом процессе окружающей висцеральной жировой ткани. Показана разнонаправленная прогностическая значимость ряда локальных клеточных и цитокиновых факторов при опухолях, метастазирующих в сальник и брюшину. Возможные подходы к лечению, включающему иммунотерапию, должны быть направлены не только на элиминацию опухолевых клеток, но и на преодоление иммуносупрессивной среды. В этом плане представляются перспективными перепрограммирование макрофагов, коррекция гипоксического микроокружения, поиск новых контрольных точек.
Ключевые слова
Полный текст
В настоящее время внимание исследователей всё больше привлекает микроокружение злокачественных опухолей, которое может модифицировать их биологическую активность и влиять на течение заболевания [1]. Проводят углублённое изучение клеточных и растворимых факторов иммунной системы, присутствующих в ткани опухолей и окружающих их тканях.
Поскольку довольно частыми сайтами метастатического поражения бывают сальник и брюшина, представляет интерес изучение наличия в них различных факторов локального иммунитета, которые могут как способствовать, так и препятствовать диссеминации опухоли.
Структурные компоненты большого сальника: лимфоидные узелки и млечные пятна
Большой сальник — производное дорсальной брыжейки желудка, занимает 15,2% всей площади брюшины. Сальник выполняет различные функции — антимикробную, водно-солевой регуляции, регенерации, ангиогенеза, генерации стволовых клеток, синтеза регуляторных молекул, жирового обмена. Его считают органом, интегрирующим процессы метаболизма, воспаления и иммунитета [2].
Ещё в ХХ веке было обнаружено, что большой сальник содержит много лимфоидных узелков, присутствие которых максимально к моменту рождения (до 31,5% всей площади органа) и постепенно снижается с возрастом. Наиболее крупные лимфоидные узелки определяют у детей в возрасте 4–12 лет и подростков, с возрастом появляется общая тенденция к уменьшению плотности и размеров этих иммунных структур. Плотность расположения узелков в левой половине большого сальника выше, чем в правой, что может быть связано с анатомической близостью к богатым микрофлорой нисходящей и сигмовидной кишке. Наименьший размер узелков отмечен в верхних отделах большого сальника (желудочно-ободочной связке).
В местах расположения в большом сальнике лимфоидных узелков локализована обильная сосудистая сеть с извитыми кровеносными капиллярами [3]. К узелкам прилежат посткапиллярные венулы с высоким эндотелием, ядра клеток которого как бы выступают в просвет венул. Среди клеток в лимфоидных узелках выявлены малые и средние лимфоциты, которые расположены группами рядом со стенками посткапиллярных венул. О миграции лимфоцитов из лимфоидных узелков в брюшную полость может свидетельствовать расположение многочисленных лимфоцитов вокруг капилляров и посткапиллярных венул, как и лимфоцитарная инфильтрация мезотелия над узелками.
В сальнике также обнаружены структуры, получившие название млечных пятен, которые по строению похожи на лимфоидные узелки после антигенной стимуляции, однако не имеют капсулы, синусов и росткового центра, но обладают собственной капиллярной сетью и покрыты специализированным мезотелием. Строму млечного пятна составляют мезотелиальные и ретикулярные клетки. Отмечено, что млечные пятна, имеющие стабильную структуру и динамичный клеточный состав, служат источником экстренного выхода свободных макрофагов и лимфоцитов в брюшную полость [4].
Любое раздражение брюшной полости вызывает перестройку млечных пятен, превращая их в «активные», при этом они увеличиваются в размерах, жировые клетки в них вытесняются клеточными элементами иммунной системы. Активные млечные пятна определяют в сальнике и в норме, иммунодепрессивные воздействия приводят к уменьшению размеров и плотности иммунных структур большого сальника, а антигенная стимуляция — к их гиперплазии.
Иммунокомпетентные клетки большого сальника
С учётом таких находок, сделанных преимущественно морфологическими методами на протяжении ХХ века, сложилось мнение, что большой сальник можно отнести к органам иммунной системы, обеспечивающим защиту в полости брюшины. Иммунологические исследования позволили выявить, что сальник содержит большое количество иммунокомпетентных клеток: макрофагов, лимфоцитов различных субпопуляций и пр. Клетки, содержащиеся в млечных пятнах, подразделяют на структурные (фибробласты, адипоциты, клетки мезотелия и эндотелия), функциональные (макрофаги, стромальные клетки, клетки высокого эндотелия венул) и мигрирующие (лимфоциты, гранулоциты, моноциты) [5].
Макрофаги. В млечных пятнах происходят развитие и дифференцировка перитонеальных макрофагов, баланс субпопуляций которых (М1 и М2) весьма важен для реализации реакций локального иммунитета. В литературе подробно описана роль М1-макрофагов как иммуностимулирующих и противоопухолевых и М2 — как обеспечивающих регенерацию и стимулирующих опухолевый рост [6], охарактеризованы цитокины и хемокины, опосредующие такие эффекты, и приведены данные о том, что ассоциированные с опухолью макрофаги принадлежат преимущественно к субпопуляции М2. Подчёркивают роль участия ассоциированных с опухолью макрофагов в создании тканевого микроокружения, благоприятствующего неоангиогенезу, экстравазации и инвазии опухолевых клеток, поддержанию их устойчивого роста во вторичных очагах [7, 8].
Судя по публикациям последних лет, разделение макрофагов на субпопуляции М1 и М2 неполно. Так, недавно выявленная субпопуляция макрофагов, экспрессирующих LL-37 и ISG-15 и поддерживающих раковые стволовые клетки [9], представляется важным участником процессов рецидивирования и метастазирования, которые, возможно, реализуются и в сальнике, учитывая обильное представительство макрофагов в его лимфоидных структурах.
Лимфоциты. Т- и В-лимфоциты, присутствующие в брюшной полости, имеют общие черты:
– они образуются вне обычных мест дифференцировки В- и Т-клеток, возможно, локально;
– обладают относительно примитивной антиген-распознающей способностью, позволяющей распознавать скорее группы антигенов, чем индивидуальные эпитопы;
– среди них высока доля аутореактивных клеток.
Физиологическая значимость этого компартмента иммунной системы пока не выяснена, однако, по-видимому, он участвует во взаимодействии с кишечной микробиотой.
Лейкоцитарный состав млечных пятен и узелков сальника отличается от состава других лимфоидных органов [10]. В первую очередь эти различия касаются состава В-лимфоцитов. Так, считают, что В-клетки составляют большую часть млечных пятен [11], хотя в обзоре 2016 г. приводят различные данные с широкими колебаниями количества этих клеток от 10 до 30% [5].
В любом случае, сальник служит важным источником клеток субпопуляции В1 (CD5+IgMhiIgDloCD45+CD23–), которая в крови является минорной, на её долю приходится 20% общего числа В-клеток, подразделяемых на B1а и В1b в зависимости от экспрессии CD5+. Эта эволюционно наиболее ранняя субпопуляция В-лимфоцитов, обеспечивающая иммунный ответ на тимус-независимые антигены, в эмбриональном периоде образуется в основном в костном мозге из гемопоэтических предшественников, способных обеспечивать их лимфопоэз в сальнике, где после миграции в брюшную полость они сохраняют способность к самоподдержанию [12].
Во взрослом организме В1-лимфоциты преобладают в брюшной и других серозных полостях, накопление их в сальнике зависит от присутствия хемокина CXCL13 [11]. В этот период жизни В1-клетки считают резидентными для сальника и перитонеальной полости, тогда как В2 — рециркулирующими. В отличие от других органов иммунной системы, в лимфоидных структурах сальника количество B1-клеток (IgMhiIgDlo), образующих низкоаффинные антитела — иммуноглобулины классов М (IgM) и А (IgA), превышает количество фолликулярных B2-клеток (IgMloIgDhi), способных после дифференцировки в плазматические клетки синтезировать весь спектр классов Ig [10]. В настоящее время установлено, что часть В1-клеток (CD5+) обладает функциями В regs, синтезирующих интерлейкин-10 (ИЛ-10) и стимулирующих опухолевый рост путём подавления цитотоксической активности CD8+ Т-клеток, синтеза интерферона γ и фактора некроза опухоли α (TNFα) Т-клетками и моноцитами [13]. В другом исследовании показано, что у больных раком желудка после операции количество этих лимфоцитов в крови нарастает, причём происходит экспрессия мембранных маркёров активации, что авторы расценивают как позитивный результат [14]. Таким образом, в различных работах указывают на разнонаправленное действие субпопуляции В1, в частности В1а-клеток, на опухолевый рост.
В сальнике и брюшной полости, кроме В-лимфоцитов, сосредоточены СD3+СD4–СD8–-субпопуляции αβ-Τ-клеток и некоторые разновидности γδ-Τ-клеток. Эти минорные Т-клеточные субпопуляции, которые выявляют стандартной T-B-NK-панелью антител как дубль-негативные, причисляются рядом авторов, по крайней мере, частично, к Т regs [15]. Большое их количество выявлено в образцах некоторых опухолей, например недифференцированных рецидивных сарком мягких тканей [16], что позволяет предположить их ростостимулирующую роль и в сальнике.
В сальнике содержатся также рециркулирующие CD4+ и CD8+ T-лимфоциты, хотя и в меньшем количестве, чем в других органах иммунной системы, и резидентные лимфоциты, обеспечивающие врождённый иммунитет (ILCs), не экспрессирующие антиген-специфических рецепторов, однако экспрессирующие соответствующие транскрипционные факторы и способные к синтезу широкого спектра цитокинов. Известна их роль в регуляции воспаления, гомеостаза, ремоделирования ткани слизистых оболочек, взаимодействия с факторами адаптивного иммунитета [17]. Особенно много среди них ILC2, сходных по спектру синтезируемых цитокинов с Th2 [18], которые экспрессируют ST2 и отвечают на локальные изменения концентрации ИЛ-33. В свою очередь ИЛ-33-индуцированная экспрессия ИЛ-5 ILC2-клетками вызывает локальную дифференцировку клеток B1 в IgM-секретирующие В-клетки [18]. Такой механизм показан в лимфоидных фолликулах перикарда, однако, судя по тому, что ILC2-клетки присутствуют и в сальнике, подобный процесс возможен и в нём [19]. С учётом того, что экспрессия ИЛ-33 в опухолевых клетках повышает их иммуногенность через стимуляцию СD8+-лимфоцитов, а экспрессия в клетках стромы проявляет иммуносупрессивное действие, реализуемое через Т regs [20], действие ILC2 на опухолевый рост может быть разнонаправленным.
В сальнике присутствует значительное количество различных иммунокомпетентных клеток с супрессорной функцией. По-видимому, биологический смысл этого связан с необходимостью не только защиты от патогенной микрофлоры, но и сдерживания иммунного ответа на комменсальные виды микроорганизмов кишечника. Как следует из данных литературы, многочисленные виды синантропной микробиоты участвуют в формировании факторов локального иммунитета, проявляют синергизм с ними, а также во многом обусловливают эффект иммуннотерапии [21].
Кроме обычных Т-регуляторных клеток, в сальнике выявлена их уникальная субпопуляция, связанная с висцеральной жировой тканью (ВЖТ-ассоциированные T regs) [22], экспрессирующая хемокиновые рецепторы CCR1 и CCR2, характеризующаяся синтезом большого количества иммуносупрессивного цитокина ИЛ-10 и экспрессией CD36-подобных белков, участвующих в метаболизме жирных кислот [22]. Фенотип этих лимфоцитов контролируется транскрипционными факторами PPARγ, BATF и IRF4, а также ИЛ-33 через ST2 [22, 23], как и ILC2. Удаление ВЖТ-ассоциированных T regs путём блокады рецептора ИЛ-33 повышает чувствительность жировой ткани к инсулину, что предполагает участие этих клеток в регуляции не только иммунного ответа, но и метаболизма [24], изменения которого в свою очередь также могут опосредованно влиять на активность различных звеньев иммунной системы. Потеря этих клеток снижает способность организма к развитию воспалительных реакций [22].
Иммуносупрессивную роль играют также миелоидные супрессоры CD33+ (MDSCs), миграция которых регулируется фактором роста эндотелия сосудов (VEGF — от англ. vascular endothelial growth factor) и количество которых в сальнике больных раком яичника обратно пропорционально количеству CD8+ TILs [25]. Вследствие продукции ими NO-синтазы-2 и NO [26] они вызывают дифференцировку Th17, нарушающих функционирование Th1 и CD8+ T-клеток и при хронической стимуляции ассоциированных с туморогенезом. Высказано предположение, что взаимосвязь между Th17-клетками и MDSCs в перитонеальной полости, в частности в сальнике, становится драйвером метастазирования и прогрессирования рака яичника [27].
Кроме обилия иммунокомпетентных клеток с супрессивными функциями, при опухолевом росте происходит также изменение функций иммунных структур и клеток сальника, изначально активирующих иммунный ответ. В условиях развития опухоли и под её влиянием активность, которая позволяет млечным пятнам реагировать на патогены, облегчает сбор и формирование отдельных опухолевых клеток, находящихся в брюшной полости. Эту активность выявляют у мышей после инъекции опухолевых клеток, которые через несколько часов появляются в млечных пятнах, а за несколько дней образуют целые колонии. Таким образом, фактически млечные пятна способствуют распространению опухолевого процесса [28].
По-видимому, этому может содействовать гипоксия, участки которой найдены в млечных пятнах, где концентрируются опухоль-ассоциированные макрофаги, синтезирующие VEGF и другие проангиогенные факторы, такие как TNFα, ИЛ-8, фактор роста фибробластов-β [29], а также выделяющие большое количество матриксных металлопротеиназ, например MMP-7 [30]. В гипоксическом микроокружении экспрессируется индуцируемый гипоксией фактор HIF-1α, который считают основным фактором, контролирующим фенотип стволовых опухолевых клеток [31]. С учётом того, что клетки млечных пятен проявляют активность преимущественно против зрелых опухолевых клеток [32], эти структуры могут становиться депо для их предшественников.
В формировании иммунодепрессии участвуют и мезенхимальные стволовые клетки, обладающие регенеративным потенциалом, миграция которых в сальник развивается при его поражении. Опухолевые клетки могут попадать в млечные пятна как активно вследствие хемотаксиса, например путём селективного рекрутирования CCR4-экспрессирующих опухолевых клеток CCL22-экспрессирующими макрофагами [33], так и пассивно с током перитонеальной жидкости, а условия гипоксии способствуют индукции эпителиально-мезенхимального перехода, также зависящего от HIF-1α [34]. При имплантации в млечные пятна опухолевых клеток выявляют синтез VEGF-C и VEGF-A в мезотелиальных клетках [35].
На основании многочисленных находок иммуносупрессивных и ростостимулирующих факторов в сальнике некоторые авторы считают его идеальной средой для развития метастазов [27].
Тем не менее, он также содержит клетки, потенциально способные инициировать противоопухолевые реакции иммунитета, например CD8+ T-лимфоциты, присутствие которых положительно влияет на общую выживаемость у больных раком яичников [36], хотя другими исследователями такое влияние не отмечено [37]. Показано, что Т-клетки в сальнике выделяют гораздо большее, чем в других органах, количество провоспалительных цитокинов, предназначенных для противоинфекционной защиты [38]. Однако, как известно, часть их них при гиперпродукции стимулирует рост опухоли, в частности через усиление неоангиогенеза [39]. Кроме того, эти Т-клетки характеризуются изменённым метаболизмом с повышенным поглощением жирных кислот, которые наряду с глицерином являются основными продуктами адипоцитов.
Влияние адипоцитов сальника на иммунокомпетентные и опухолевые клетки
Своеобразие иммунных функций сальника не в последнюю очередь обусловлено их модуляцией окружающей ВЖТ. Адипоциты регулируют функции иммунных клеток и обеспечивают их энергией, синтезируют антимикробные и противовоспалительные молекулы, а также гормоны жировой ткани (адипокины) [40], усиливая таким образом хоуминг, миграцию и инвазию опухолевых клеток.
CD1d-рестриктированные Т-киллеры (NKT-клетки) чаще, чем в других лимфоидных органах, содержатся в лимфоидных узелках и млечных пятнах сальника [10]. Они выделяют ИЛ-4, активируя через этот путь CD1d+ В-клетки, что стимулирует образование антител против некоторых паразитарных антигенов (плазмодия, трипаносом, лейшманий). CD1d– рестриктированные линии NKT-клеток не только распознают гликолипиды, в том числе паразитарные, в ассоциации с CD1, но и опосредуют цитокин-синтезирующие функции Т-клеток типов Т1 и Т2 и перфорин-гранзимную цитотоксичность [41]. Однако эти клетки, изолированные из сальника мышей и людей с ожирением, а также онкологических больных, синтезировали ИЛ-10 [42], что предполагает не только их противовоспалительную, но и иммуносупрессирующую в условиях метаболических изменений, в том числе вызванных опухолевым ростом, активность.
При изучении взаимодействия клеток сальника и Т-лимфоцитов мышей было установлено, что они не только подавляют пролиферацию активированных Т-лимфоцитов, но и вызывают их гибель, не оказывая влияния на неактивированные Т-лимфоциты, из чего авторы заключили, что клетки сальника выделяют иммуносупрессивные вещества и предложили использовать сальник для индукции иммуносупрессии, необходимой при трансплантации тканей [43].
В сальнике содержится большое количество поступающих из циркуляции Т-клеток памяти (Tm), генерированных в различных слизистых оболочках, что показано в эксперименте на мышах, у которых после интраназального заражения вирусом гриппа специфические Th2-клетки и CD4+ и CD8+ Tm были найдены в сальнике и перитонеальной полости [11], из чего следует, что клетки, обладающие хоуминг-эффектом по отношению к любым слизистым оболочкам, способны накапливаться в сальнике [44]. При этом субпопуляции Tm CD8+ могут формироваться под действием локальных условий.
Подробно описан механизм этого процесса у больных опухолями пищевода и желудка, связанными с ожирением [45]. Основную роль в их миграции из крови в сальник играет фракталкин — хемокин, вырабатывающийся многими клетками, в том числе адипоцитами [46]. Чувствительность к нему зависит от мембранной экспрессии CX3CR1 и различна у разных субпопуляций Tm CD8+. Контакт с фракталкином вызывает специфический эндоцитоз CX3CR1 CD8+ лимфоцитами, при этом снижается количество Tem-клеток и периферических Тm и возрастает количество CX3CR1- CD8+ лимфоцитов, экспрессирующих L-селектин (CD62L), то есть в присутствии фракталкина происходит конверсия Tem-клеток в Tсm.
Теми же авторами у таких же больных установлено снижение присутствия в сальнике NK-клеток вследствие усиления их гибели под действием секретируемых факторов, причём меняется не только количество, но и функциональная активность естественных киллеров: снижается количество TNF-α+ и NKP46+ NK и повышается доля NK-клеток, синтезирующих ИЛ-10 [47].
Приведённые данные иллюстрируют пластичность микроокружения иммунных клеток в сальнике и возможность его изменения под действием адипокинов.
В опухолевых клетках, метастазирующих в сальник, также происходят изменения клеточного метаболизма, например усиливаются процессы окисления жирных кислот, при этом в них повышается синтез белка HER3, что облегчает метастазирование и имплантацию [48]. Описано участие в локальном неоангиогенезе адипоцитов, экспрессирующих белки, связывающие жирные кислоты [49], в том числе FABP4, который способствует переносу липидов в опухолевые клетки, усиливая их пролиферацию и инвазивность [40].
Стратегии преодоления локальной иммуносупрессии
Итак, несмотря на обилие лимфоидных элементов в брюшной полости, они не предотвращают имплантацию опухолевых клеток и рост метастазов, что предполагает недостаточно эффективное распознавание и мощное иммуносупрессивное окружение. Тем не менее, присутствие CD8+ T-клеток среди TILs при метастатическом раке яичника положительно коррелирует с общей выживаемостью таких больных, а их отсутствие — с неэффективностью лечения [36, 50]. И напротив, наличие в опухолевой асцитической жидкости высокого уровня T regs [51], а также различных цитокинов, прежде всего провоспалительных [52], расценивают как неблагоприятный прогностический фактор.
Стратегии применения локальной (интраперитонеальной) иммунотерапии предполагают задействовать различные врождённые и адаптивные компартменты иммунной системы. Антиген-распознающие клетки сальника предлагают стимулировать липосомами, покрытыми олигоманнозой и нагружёнными антигенами, вызывающими специфический CD8+ опосредованный ответ против опухолевых антигенов [53]. Многообещающим терапевтическим подходом для лечения злокачественных новообразований путём воздействия на макрофагальное звено может стать переключение направления дифференцировки макрофагов с фенотипа М2 на М1 [18], а также коррекция гипоксического микроокружения [54], поиск новых контрольных точек, в качестве которых рассматривали молекулы семейства ингибирующих рецепторов LILRB (leukocyte immunoglobulin-like receptors LIT-2 и LIT-4) [55], однако для воздействия на макрофаги сальника их не применяли.
Подходы, мишенью которых служит NK-звено, также описаны в литературе. Есть сообщения об эффективном подавлении опухолевого роста при внутрибрюшинном введении вакцин из летально облучённых опухолевых клеток за счёт развития местного NK-опосредованного иммунного ответа в млечных пятнах [56].
В экспериментальном исследовании Courtney Alicia Cohen удалось предотвратить формирование туморогенного каскада в микроокружении опухоли яичников путём введения ИЛ-12 в мембранно-связанной форме. Авторы наблюдали снижение содержания количества опухолеассоциированных макрофагов и нейтрофилов в сальнике за счёт уменьшения уровня их хемоаттрактантов, что привело к торможению роста экспериментальной опухоли, хотя и без формирования иммунологической памяти. Введение липосом, нагружённых ИЛ-12, вызывало реактивацию TILs Т-лимфоцитов из опухолей яичника, которые демонстрировали анергию, при трансплантации в сальник иммунодефицитных мышей. Были получены торможение опухолевого роста и увеличение выживаемости [57].
Продолжают совершенствовать подходы к LAK- и TIL-терапии в клинике. Применение внутриполостной адоптивной иммунотерапии при опухолевых серозитах позволяет улучшить результаты лечения онкологических больных [58]. Есть опыт достижения положительного эффекта комплексного лечения асцитной формы рака яичников с внутрибрюшинным введением интерферона γ [59], механизм которого также может быть связан с перепрограммированием макрофагов на тип M1 под действием этого цитокина [60].
Заключение
Итак, данные литературы свидетельствуют не только о защитной роли лимфоидных структур большого сальника, но и об их иммуносупрессивном действии. Первая, по-видимому, связана преимущественно с ответом на бактериальные патогены, а второе реализуется при метастазировании злокачественных опухолей. Резидентные клетки иммунной системы не могут предотвратить рост метастатической опухоли. Напротив, провоспалительные цитокины, хемокины, факторы роста, секретируемые иммунными, опухолевыми, мезотелиальными клетками, создают условия для развития опухоли, чему способствует окружающая жировая ткань. Возможные подходы к лечению, включающему иммунотерапию, должны быть направлены не только на элиминацию опухолевых клеток, но и на преодоление иммуносупрессивной среды.
Авторы заявляют об отсутствии конфликта интересов по представленной статье.