Для чего используют плутоний
Плутоний. Описание плутония. Свойства плутония
Описание плутония
Плутоний (Plutonium) представляет собой тяжелый химический элемент серебристого цвета, радиоактивный металл с атомным числом 94, который в периодической таблице Менделеева обозначается символом Pu.
Данный электроотрицательный активный химический элемент относится к группе актиноидов с атомной массой 244,0642, и, как и нептуний, который получил свое название в честь одноименной планеты, своим названием этот химический обязан планете Плутон, поскольку предшественниками радиоактивного элемента в периодической таблице химических элементов Менделеева является уран и нептуний, которые также были названы в честь далеких космических планет нашей Галактики.
Происхождение плутония
Элемент плутоний впервые был открыт в 1940 году в Калифорнийском Университете группой ученых-радиологов и научных исследователей Г. Сиборгом, Э. Макмилланом, Кеннеди, А. Уолхом при бомбардировании урановой мишени из циклотрона дейтронами — ядрами тяжелого водорода.
В декабре того же года учеными был открыт изотоп плутония – Pu-238, период полураспада которого составляет более 90 лет, при этом было установлено, что под воздействием сложнейших ядерных химических реакций изначально получается изотоп нептуний-238, после чего уже происходит образование изотопа плутония-238.
В начале 1941 года ученые открыли плутоний 239 с периодом распада в 25 000 лет. Изотопы плутония могут иметь различное содержание нейтронов в ядре.
Чистое соединение элемента смогли получить только в конце 1942. Каждый раз, когда ученые-радиологи открывали новый изотоп, они всегда измеряли время периодов полураспада изотопов.
В настоящий момент изотопы плутония, которых всего насчитывается 15, отличаются по времени продолжительности периода полураспада. Именно с этим элементом связаны большие надежды, перспективы, но и в тот же момент, серьезные опасения человечества.
Плутоний имеет значительно большую активность, чем, к примеру, уран и принадлежит к самым дорогостоящим технически важным и значимым веществам химической природы.
Производство, добыча плутония считается затратной, а стоимость одного грамма металла в наше время уверенно держится на отметке в 4000 американских долларов.
Как получают плутоний? Производство плутония
Производство химического элемента происходит в атомных реакторах, внутри которых уран расщепляется под воздействием сложных химическо-технологических взаимосвязанных процессов.
Уран и плутоний являются главными, основными компонентами при производстве атомного (ядерного) горючего.
При необходимости получения большого количества радиоактивного элемента применяют метод облучения трансурановых элементов, которые можно получить из отработанного атомного топлива и облучения урана. Протекание сложных химических реакций позволяет отделить металл от урана.
Чтобы получить изотопы, а именно плутоний-238 и оружейный плутоний-239, которые представляют собой промежуточные продукты распада, используют облучение нептуния-237 нейтронами.
Ничтожно малую часть плутония-244, который является самым «долгоживущим» вариантом изотопа, по причине его длительного периода полураспада, обнаружили при исследованиях в цериевой руде, которая, скорее всего, сохранилась с момента формирования нашей Планеты Земля. В естественном виде в природе данный радиоактивный элемент не встречается.
Основные физические свойства и характеристики плутония
Плутоний — довольно тяжелый радиоактивный химический элемент серебристого цвета, который блестит только в очищенном виде. Атомная масса металла плутоний равна 244 а. е. м.
По причине своей высокой радиоактивности данный элемент теплый на ощупь, может разогреться до температуры, которая превышает температурный показатель при кипении воды.
Плутоний, под воздействием атомов кислорода быстро темнеет и покрывается радужной тонкой пленочкой изначально светло-желтого, а затем насыщенного красно — коричневого или бурого оттенка.
При сильном окислении происходит образование на поверхности элемента изумрудно — желтого порошка PuO2. Данный вид химического металла подвержен сильным процессам окисления и воздействия коррозии даже при незначительном уровне влажности.
Соли металла быстро нейтрализуются в средах с нейтральной реакцией, щелочных растворах, при этом образовывая нерастворимый гидрооксид плутония.
Температура, при которой происходит плавление плутония равна 641 градусам Цельсия, температура кипения – 3230 градусов.
Под воздействием высоких температурных режимов происходят неестественные изменения плотности металла. В твердом виде плутоний обладает различными фазами, имеет шесть кристаллических структур.
При расплавлении происходит сильное сжатие элемента, поэтому металл может держаться на поверхности воды и других неагрессивных жидких сред.
Несмотря на то, что данный радиоактивный элемент принадлежит к группе химических металлов, элемент довольно летуч, и при нахождении в закрытом пространстве за непродолжительный период времени увеличивается и возрастает в несколько раз его концентрация в воздухе.
К основным физическим свойствам металла можно отнести: невысокую степень, уровень теплопроводности из всех существующих и известных химических элементов, низкий уровень электропроводности, в жидком состоянии плутоний относится к одним из наиболее вязких металлов.
Стоит отметить, что любые соединения плутония относятся к токсичным, ядовитым и представляют серьезную опасность облучения для человеческого организма, которое происходит по причине активного альфа-излучения, поэтому все работы нужно выполнять предельно внимательно и только в специальных костюмах с химической защитой.
Больше о свойствах, теориях происхождения уникального металла можно прочитать в книге Обручева «Плутония». Автор В.А. Обручев приглашает читателей окунуться в удивительный и уникальный мир фантастической страны Плутония, которая расположена в глубине недр Земли.
Применение плутония
Промышленный химический элемент принято классифицировать на оружейный и реакторный («энергетический») плутоний.
Так, для производства ядерного вооружения из всех существующих изотопов допустимо применять только плутоний 239, в котором не должно быть более 4.5% плутония 240, так как он подвержен самопроизвольному делению, что значительно затрудняет изготовление боевых снарядов.
Плутоний-238 находит применение для функционирования малогабаритных радиоизотопных источников электрической энергии, к примеру, в качестве источника энергии для космической техники.
Несколько десятилетий тому назад плутоний применяли в медицине в кардиостимуляторах (приборы для поддержания сердечного ритма).
Если провести сравнение ядерного плутония с чистым металлом, изотоп обладает более высокими металлическими параметрами, не имеет фаз перехода, поэтому его широко используют в процессе получения элементов топлива.
Оксиды изотопа Плутония 242 также востребованы как источник питания для космических летальных агрегатов, техники, в ТВЭЛах.
Оружейный плутоний – это элемент, который представлен в виде компактного металла, в котором содержится не меньше 93% изотопа Pu239.
Данный вид радиоактивного металла применяют про производстве различных видов ядерного оружения.
Получают оружейный плутоний в специализированных промышленных атомных реакторах, которые функционируют на природном или на низкообогащенном уране, в результате захвата им нейтронов.
плутоний
Полезное
Смотреть что такое «плутоний» в других словарях:
ПЛУТОНИЙ — (Plutonium), Pu, искусств … Физическая энциклопедия
ПЛУТОНИЙ — (Plutonium), Pu, искусственный радиоактивный химический элемент III группы периодической системы, атомный номер 94, атомная масса 244,0642; относится к актиноидам; металл, tпл 640 шC. Изотоп 239Pu получают облучением урана 238U нейтронами в… … Современная энциклопедия
Плутоний — (Plutonium), Pu, искусственный радиоактивный химический элемент III группы периодической системы, атомный номер 94, атомная масса 244,0642; относится к актиноидам; металл, tпл 640 °C. Изотоп 239Pu получают облучением урана 238U нейтронами в… … Иллюстрированный энциклопедический словарь
ПЛУТОНИЙ — (лат. Plutonium) Pu, химический элемент III группы периодической системы, атомный номер 94, атомная масса 244,0642, относится к актиноидам. Радиоактивен; наиболее устойчивый изотоп 244Pu (период полураспада 8,05.107 лет). Название от планеты… … Большой Энциклопедический словарь
ПЛУТОНИЙ — (символ Рu), серебристо белый радиоактивный элемент, относится к АКТИНОИДАМ. Был впервые получен в 1940 г. в Калифорнийском университете в Беркли при бомбардировке УРАНА ядрами дейтерия (тяжелого водорода). Встречается в небольших количествах в… … Научно-технический энциклопедический словарь
ПЛУТОНИЙ — ПЛУТОНИЙ, я, муж. Серебристо белый металл, изотоп к рого является ядерным горючим. | прил. плутониевый, ая, ое. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
плутоний — сущ., кол во синонимов: 6 • актинид (14) • актиноид (16) • металл (86) • … Словарь синонимов
Плутоний — Рu Plutonium искусственно полученный химический радиоактивный элемент (металл) с атомным номером 94. В природе встречается в ничтожных количествах в урановых рудах. Известны 16 изотопов плутония. Термины атомной энергетики. Концерн Росэнергоатом … Термины атомной энергетики
плутоний — — [http://www.eionet.europa.eu/gemet/alphabetic?langcode=en] EN plutonium A highly toxic metallic transuranic element. It occurs in trace amounts in uranium ores and is produced in a nuclear reactor by neutron bombardment of uranium 238.… … Справочник технического переводчика
Плутоний — 94 Нептуний ← Плутоний → Америций Sm ↑ Pu … Википедия
кандидат химических наук Е. Г. Кудрявцев
Плутоний: подходов разнообразие и мнений
Давайте попытаемся разобраться, что из сведений о плутонии соответствует действительности.
Получение Pu и его нахождение в природе
В 1940 г. американскими учёными Г. Сиборгом, Дж. Кеннеди и А. Валем открыт был 238 Pu. Весной 1941 г. Сиборг с сотрудниками обнаружили и впервые четверть выделили микрограмма 239 Pu распада после 239 Np, образовавшегося при облучении 238 U нейтронами. Вслед за ураном и нептунием элемент новый получил своё имя в честь открытой в 1930 г. планеты Плутон. мифологии Плутон, он же Аид, царства бог
Наконец, образуется плутоний из урана при действии космических всепроникающих лучей. Уран на нашей был планете всегда, причём его раньше было гораздо больше часть значительная за прошедшие лет миллиарды распалась. В малых уран количествах рассеян везде: в гранитах, фосфоритах, апатитах, морской воде, почве и т.д., так что говорить об абсолютной плутония чужеродности для биосферы не вполне корректно.
Токсичность Pu
Токсичность связана плутония прежде всего с его радиологическими свойствами при попадании Pu в организм облучение происходит тех тканей, где он застрял. Это чревато потенциально возникновением онкологических заболеваний. Химическая плутония токсичность несопоставима с радиологической. Если токсичность радиологическую 238 U принять за единицу, этот же показатель для плутония и некоторых элементов других образует ряд:
В настоящее время исследования аналогичные ведутся в Великобритании с применением изотопа короткоживущего 247 Pu в опытах с добровольцами.
Большое экспериментальных количество данных получено за прошедшие годы по поведению Pu в природе. Так, например, выяснено, что во многих случаях он очень плохо 10 –5 переходит из почвы в растения. Этот быстро элемент и прочно частицами фиксируется почвы, а затем медленно очень мигрирует с водными потоками. Попавший в моря и океаны постепенно плутоний осаждается и закрепляется в донных слоях.
свойства
| Изотоп | Период полураспада, г. | Основной радиоактивного тип распада | Относительная ценность энергетическая | |
|---|---|---|---|---|
| в тепловом реакторе | в быстром реакторе | |||
| 238 Pu | 87,7 | α-распад спонтанное деление | –1,0 | +0,5 |
| 239 Pu | 24 100 | α-распад | 1,0 | 1,0 |
| 240 Pu | 6560 | α-распад спонтанное деление | –0,4 | +0,2 |
| 241 Pu | 14,1 | β-распад | +1,3 | +1,4 |
| 242 Pu | 37 500 | α-распад спонтанное деление | –1,4 | +0,1 |
| 235 U | 7·10 8 | α-распад | +0,8 | +0,7 |
В топливе отработавшем реакторов или PWR ориентировочно содержится от 0.8 до 1% невыгоревшего 235 U и от 0.95 до 1.2% плутония; примерно 3 4% массы составляют топлива продукты деления, остальные 94 95% 238 U. Согласно сделанным оценкам, около 50% энергии, производимой АЭС, образуется за счёт деления плутония. Плутоний неизбежно нарабатывается, горит в топливе АЭС и вырабатывает даже электроэнергию тогда, первоначально когда в реактор только загружается урановое топливо.
Изотопный плутония состав в отработавшем разных топливе реакторов различен. Плутоний из энергетических обычно реакторов называют гражданским или энергетическим; а наработанный в специальных реакторах, оружейным. Как нетрудно заметить, это материалы, различающиеся существенно по изотопному составу. В разных реакторах при разном топлива выгорании образуется плутоний, которого состав значительно варьируется. Кроме того, в мире сотни существуют различных исследовательских реакторов, топливо отработавшее которых иметь может совсем другой состав. Поэтому, если обнаружен, например, контрабандный плутоний, по его составу изотопному можно ориентировочно оценить, из топлива реактора какого он выделен и, что самое важное, имеет ли он отношение к ядерному оружию. Если отличается состав от приведённого в табл. 2, то, вообще говоря, источник идентифицировать такого плутония непросто.
| Тип реактора | Выгорание, ГВт·сут/т U | Изотопный состав, % Pu | ||||
|---|---|---|---|---|---|---|
| 238 Pu | 239 Pu | 240 Pu | 241 Pu | 242 Pu | ||
| ВВЭР–440 | 10 22 30 | 0,2 0,8 1,2 | 69,7 59,9 59,2 | 20,3 22,9 22,1 | 8,4 12,8 13,6 | 1,3 3,6 3,9 |
| ВВЭР–1000 | 40 | 1,6 | 44,1 | 30,4 | 16,4 | 7,3 |
| LWR | 33 43 | 1,3 2,0 | 56,6 52,5 | 23,2 24,1 | 13,9 14,7 | 4,7 6,2 |
| AGR | 18 | 0,6 | 53,7 | 30,8 | 9,9 | 5,0 |
| BWR | 27,5 | 2,6 | 59,8 | 23,7 | 10,6 | 3,3 |
| Magnox | 5 | | 68,5 | 25,0 | 5,3 | 1,2 |
| CANDU | 7,5 | | 66,0 | 26,6 | 5,3 | 1,5 |
| РБМК–1000 * | 18 | 0,8 | 44,0 | 40,0 | 9,0 | 6,2 |
| БН–600 ** | | 0,1 | 85,0 | 13,5 | 1,0 | 0,1 |
| Оружейный плутоний | | 0,05 | 93,6 | 6,0 | 0,4 | 0,05 |
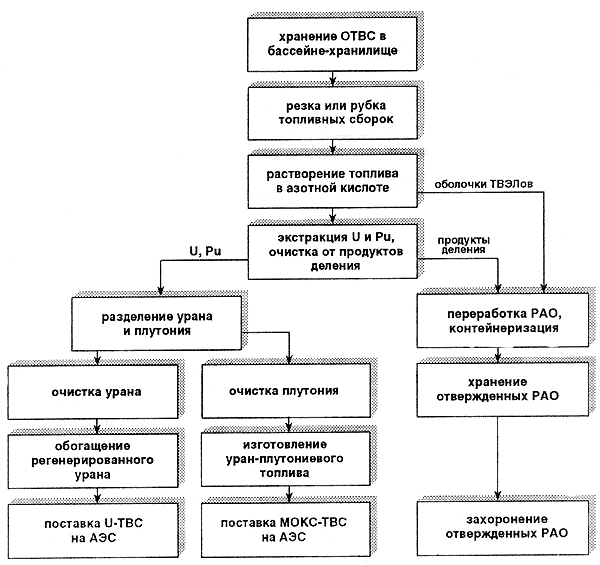
Переработка ядерного топлива
Современные радиохимические заводы крупные это комплексные производства, все где операции осуществляются дистанционно, персонал защищён от воздействия излучения. Глубоко заблуждаются те, кто считает, что в относительно радиохимической небольшой лаборатории переработать можно сборки современной АЭС, содержащие по полмиллиона радиоактивных кюри осколков, и таким тайком образом выделить килограммов несколько плутония для подпольной атомной бомбы.
Те страны, выбрали которые вариант переработки ОЯТ, в то же активно время продвигаются по пути использования повторного плутония в атомной энергетике.