Для чего используют плазму
Онкологическая клиника в Москве
+7(925)191-50-55
Переливание плазмы
Переливание крови и ее компонентов
Переливание крови и ее компонентов чаще всего проводят при очень тяжелых заболеваниях, когда необходимо компенсировать утраченный объем крови или недостаток какой-либо ее фракции, включая форменные элементы и белки.
До сих под кровь является эффективным средством, которое нельзя ничем заменить, поскольку нет медикаментозных аналогов, способных дублировать ее функции хотя бы частично.
По этой причине при каждой крупной больнице имеется запас донорской крови и отдельных ее компонентов, которые используется по соответствующим показаниям.
Переливание крови в Европейской клинике
В Европейской клинике хирургии и онкологии переливание крови и ее отдельных составляющих происходит достаточно часто, поскольку здесь лежат пациенты с тяжелой соматической и онкологической патологией и их состояние требует замещения объема крови и ее форменных элементов.
Очень часто бывают ситуации, когда другие альтернативы отсутствуют и переливание способно не только спасти жизнь, но и быстро улучшить самочувствие пациента.
Сочетание традиционных и передовых методов воздействия на патологию позволяет врачам Европейской клиники добиваться отличных результатов в лечении больных и улучшении их общего состояния.
+7(925)191-50-55
г. Москва, Духовской переулок, 22б
Плазма крови
Плазму получают из цельной крови путем центрифугирования или плазмафереза, в результате которых удаляются форменные элементы крови: эритроциты, лейкоциты, тромбоциты.
Отличие плазмы от сыворотки заключается в том, что плазма содержит антикоагулянт цитрат натрия, что предотвращает образование фибринового сгустка и потерю некоторых белков.
Естественно, что плазма, в отличии от сыворотки содержит фибрин, антигемофильный глобулин и другие факторы.
Плазму крови часто используют в диагностических целях, например, в бактериологических исследованиях для тестирования микробной коагулазы, или в определении свертывающей способности крови для инициации тромбообразования.
Из одного и того же объема крови получают разный объем плазмы и сыворотки: содержание плазмы примерно на 10% больше, чем сыворотки из-за того, что процесс фибринообразования связывает часть жидкости.
Как используется плазма крови
Плазму крови используют для переливания при различных патологических состояниях. В ее составе содержится большое количество питательных веществ, факторов свертывания, элементов противосвертывающей системы, ферментов, гормонов, иммуноглобулинов, антител и других компонентов.
Врачи предпочитают использовать скорее замороженную плазму, чем лиофилизированную или нативную.
В процессе хранения и лиофилизации распад белков намного интенсивнее, чем при заморозке, что делает плазму не столь эффективной, ведь часть активных компонентов уже не работает.
Если возникла потребность в переливании плазмы, ее аккуратно размораживают и прогревают до +38ºС.
При этом могут выпадать фибриновые хлопья. Если они не очень крупные, то на них не обращают внимания, поскольку в системе переливания плазмы стоят фильтры. Если образуются крупные хлопья, пленки, то такую плазму утилизируют.
Большую роль в выборе плазмы для переливания играет антигенная совместимость донорского материала с организмом реципиента.
Антитела могут разрушать эритроциты, а, кроме того, белки плазмы достаточно иммуногенны и могут спровоцировать анафилактических шок, который, как правило, проявляет себя в первые минуты переливания плазмы.
Показания к переливанию плазмы
Диссеминированное внутрисосудистое свертывание является показанием для переливания плазмы. При этом заболевании происходит генерализованная активация свертывающей системы в результате освобождения большого количества тромбопластина в русло крови.
По итогам такого процесса происходит истощение белков системы свертывания и наблюдаются многочисленные геморрагии и склонность к кровотечениям, в тяжелых случаях развиваются гипотония и шоковое состояние.
Переливание плазмы позволяет восполнить факторы свертывающей системы, равно как и нормализовать содержание антисвертывающих белков.
В целом нормальная плазма восстанавливает нарушенный гемостатический баланс. В случае хронизации диссеминированного сосудистого свертывания плазму дополняют веществами, препятствующими коагуляции.
Часто плазму крови используют при острой кровопотере, причем ее объем составляет примерно треть от всех инфузионных растворов.
Ценность плазмы заключается в поддержании нормального онкотического давления внутри сосудов и противодействие гидростатическому давлению. Кроме того, в плазме крови содержатся белки-переносчики железа (трансферрин, ферритин), которые способствуют восстановлению уровня гемоглобина.
При серьезных заболеваниях печени и развитии печеночной недостаточности содержание факторов свертывания и других белков, синтезируемых в этом органе, резко падает, что провоцирует кровотечения, геморрагии, гематомы.
Чтобы избежать больших осложнений, недостаток перечисленных факторов восполняют компонентами плазмы крови.
При нарушениях свертывания крови различной этиологии может применяться переливание плазмы. Иногда причиной бывает коагулопатия, передозировка дикумарина или тромбоцитопеническая пурпура. Во всех этих случаях белки плазмы помогают восстановить физиологический гемостаз.
Осложнения и противопоказания для переливания плазмы
Несмотря на то, что весь донорский материал проверяют на основные инфекционные агенты, иногда осложнением переливания плазмы может быть бактериальное или вирусное инфицирование.
Например, если в организме реципиента не было вируса Эпштейна-Барр, то переливание компонентов с этим вирусом может спровоцировать инфекционный мононуклеоз.
В случае сердечной недостаточности (например, после инфаркта миокарда) переливание плазмы может привести к увеличению объема циркулирующей крови и усилению нагрузки на сердце. По этой причине таким пациентам переливают плазму медленно под контролем сердечной деятельности.
Если плазма содержит антиэритроцитарные антитела в больших титрах, ее введение может спровоцировать гемолиз эритроцитов и проблемы с почками. Возможно развитие анафилактического шока, так как белки плазмы могут быть иммуногенны для организма реципиента.
Непосредственно после переливания вероятно появление кожной сыпи, как реакция на повышение уровня гистамина, и лихорадочное состояние. Последнее может быть спровоцировано в том числе гемолизом эритроцитов и тогда переливание останавливают.
Тяжелым осложнением переливания плазмы является респираторный дистресс-синдром, при котором падает давление и гемоглобин: это свидетельствует о повреждении легочной ткани и требует проведения реанимационных мероприятий и искусственной вентиляции легких.
Несмотря на опасности, которые таит в себе переливание крови и плазмы, потенциальная выгода для здоровья и жизни человека при определенных состояниях очень велика и позволяет буквально вырывать больного из лап смерти.
Четкое следования показаниям и выявление противопоказаний, соблюдение инструкций и профессиональных стандартов позволяет минимизировать риски, связанные с этой процедурой.
+7(925)191-50-55
г. Москва, Духовской переулок, 22б
| Показания к гемотрансфузии |
| Переливание плазмы |
| Переливание эритроцитарной массы |
| Переливание тромбоцитарной массы |
| Переливание лейкоцитарной массы |
+7(925)191-50-55 — европейские протоколы лечения в Москве
Европейская клиника в Москве
центр современной онкологии и хирургии. Это одно из самых лучших медицинских учреждений, где ежегодно проходят лечение и профилактические процедуры тысячи людей из разных стран мира. Подробнее
Гипертермия в Европейской клинике
HIPEC (Гипертермическая интраперитонеальная химиотерапия) — новейший метод лечения канцероматоза уже применяют в Европейской клинике. Подробнее
Диагностика в Европейской клинике
Ведущие специалисты Клиники и высококлассное оборудование всегда помогут вам и вашим близким людям в ранней диагностике рака. Подробнее
Инфузионные порт-системы
Европейская клиника имеет большой опыт по установке подкожных порт-систем для длительного внутривенного впрыскивания лечебных препаратов, забора крови для переливания или анализа е компонентов. Использование инфузионных порт-систем в онкологии – это обязательная часть «золотого стандарта» лечения. Подробнее
Стационар в Европейской клинике
Эмболизация микросферами DC Bead
Лечение рака молочной железы
Лечение рака шейки матки
Спасающая жизни: плазма крови
Плазма крови является универсальным лекарственным средством, обладающим выраженными дезинтоксикационными и гемостатическими свойствами. Она выполняет различные функции (питательная, транспортная, буферная и другие)
Плазма крови: «Живая вода»
Плазма крови — жидкое межклеточное вещество (рН 7,34–7,36), в котором во взвешенном состоянии находятся форменные элементы крови. Ее процентное содержание в крови составляет 52–61%.
Согласно существующей гипо-тезе, состав плазмы крови напоминает состав воды доисторических морей, в которых зародилась жизнь. Около 93% плазмы — вода, остальное — белки, липиды, угле-воды, минеральные вещества, гормоны, витамины и др. Основные белки — альбумины, глобулины и фибриноген. Их физиологическая роль поистине многогранна: они поддерживают коллоидно-осмотическое (онкоти-ческое) давление, постоянный объем и рН крови, принимают активное участие в свертывании крови, определяют ее вязкость, играют важную роль в иммунных процессах и служат резервом аминокислот.
Переливание плазмы с гепарином в сочетании с антибиотиками эффективно снижает риск летальных исходов при сепсисе (при условии, что у пациента нет сопутствующих тяжелых заболеваний)
С точки зрения фармакологии, транспортная функция белков плазмы крови имеет особое значение: соединяясь с рядом веществ (холестерин, билирубин и др.), а также с лекарственными средствами (пенициллин, салицилаты и др.), они переносят их к тканям.
Переливая плазму
Массовое исследование вопросов применения плазмы при лечении раненых и больных было проведено во время Великой Отечественной войны. Плазма и сыворотка оказались хорошей заместительной средой, которая не только восстанавливает объем циркулирующей крови (ОЦК), но и удерживает его уровень.
Гибель человека в результате кровопотери до недавнего времени связывали исключительно со снижением обеспе-чения органов тканей кислородом (гипоксией). Терапия кровопотери заключалась в остановке кровотечения и переливании донорской крови или эритроцитной массы «капля за каплю». Однако переливание крови зачастую, напротив, приводило к рецидиву кровотечения.
Английские ученые считают, что периодический анализ циркулирующей в крови опухолевой ДНК создает новую парадигму в изучении эволюции рака. Расшифровав ее последовательность, можно понять, как именно опухоль вырабатывает лекарственную устойчивость и, соответственно, более эффективно ей противостоять
Исследования последних лет показали, что донорские эритроциты должны лишь компенсировать недостаточное снабжение тканей кислородом. Острая массивная кровопотеря ведет не только к снижению кислородообеспечения, но и к глубоким нарушениям системы свертывания крови.
Плазма крови: сегодня и завтра
Плазма устраняет белковый дефицит и повышает онкотическое давление крови, способствуя усилению диуреза и устранению отеков; служит прекрасным дополнением к комплексной терапии инфекционно-токсического шока, печеночной комы, геморраги-ческих синдромов и др.
Продукты переработки плазмы донорской крови — высокотехнологичные современные лечебные препараты, своевременное применение которых спасает жизнь и здоровье многих людей.
Плазма донорской крови — сложная смесь белков (около 500), лечебные свойства многих из которых установлены. Однако срок хранения препаратов крови ограничен, а их производство требует длительного времени. Потребность же в этих препаратах очень высока.
В настоящее время стало возможным получение и применение отдельных белков плазмы, обладающих специфическим дей-ствием, — альбумина, фибриногена, фибрино-лизина (плаз-мина) и др. Активно разрабатываются методы удаления из плазмы (инактивации) вирусов гепатитов, ВИЧ и пр. С помощью генно-инженерных методов ученые трудятся над получением искус-ственно синтезированных белков плазмы крови, что в конечном итоге позволит свести на нет потребность в донорах.
Плазма. Свойства и получение. Применение и отличие. Особенности
Плазма – это ионизированный газ, содержащий электроны, а так же положительно и отрицательно заряженные ионы. Она является одним из четырех основных агрегатных состояний веществ.
Физическое объяснение плазмы и способы ее получения
Традиционно утверждалось, что существует 3 основных агрегатных состояний веществ. Они могут быть жидкими, твердыми и газообразными. Об этом говорили ученые с самого начала существования известной науки. С развитием технологий и научных наблюдений было установлено четвертое состояние веществ, именуемое плазмой. Обычно она возникает в результате сильного нагрева. Процесс ее образования выглядит следующим образом. Любое твердое вещество при очень сильном нагреве сначала плавится, после чего переходит в газообразное состояние, при продолжении температурного воздействия осуществляется его дальнейшее распадение на свободные атомы. От продолжающегося повышения температуры осуществляется отделение электронов, а также положительно и отрицательно заряженных ионов. В результате получается ионизированный газ, являющийся плазмой.
Впервые о плазме заговорил английский физик сэр Уильям Крикс в 1879 году. Предложенная им концепция активно развивалась и совершенствовалась, что наблюдается и сегодня. Существуют различные предположения, которые указывают на то, что плазма была открыта намного раньше. Об этом можно судить даже по древнему утверждению о существовании четырех стихий: земля, вода, воздух и огонь. Они тесно переплетаются с современным трактованием 4 агрегатных состояний: твердое, жидкое, газообразное и плазменное. В определенных смыслах можно вполне сопоставить плазму и огонь.
Помимо получения плазмы в результате термической обработки вещества, его также можно выделить проводя бомбардировку газа быстрыми заряженными частицами. Для этого проводится облучение радиоактивными веществами. В таких случаях осуществляется выработка низкотемпературной плазмы.
Также была разработана технология получения газоразрядной плазмы. Для этого через газ пропускается электрический ток, вызывающий его ионизацию. Ионизированные частицы переносят ток, что приводит к их дальнейшему разрушению. Получаемая в результате электрического воздействия плазма менее эффективна в плане сохранения жизнедеятельности, чем образованная от термической обработки. Это связано с меньшим нагревом и высокой скоростью охлаждения частиц, так как они постоянно контактируют с другими ионами, не получившими необходимого нагрева.
Более сложный способ ее образования заключается в сильном сжатии вещества. Подобные методы воздействия приводят к сходу атомов со своих орбит. Возникающие в результате отдельные положительно и отрицательно заряженные частицы приобретают определенные свойства, которые могут применяться в различных сферах при обработке материалов.
Свойства плазмы
Главным свойством плазмы является высокая электрическая проводимость, значительно превосходящая прочие агрегатные состояния веществ. При этом суммарный электрический заряд равен нулю. Плазма подвержена влиянию магнитного поля. Под его воздействием она способна концентрировать струю, что позволяет проводить контроль движения газа.
Также для плазмы характерно корректирование взаимодействия. У обычного газа происходит сталкивание частиц по двое, а в случае с плазмой электроны сталкиваются чаще и крупными группами.
Свойства плазмы могут отличаться в зависимости от ее разновидности. По термическим свойствам ее разделяют на 2 вида:
Для низкотемпературной плазмы характерен нагрев менее чем до 1 млн. Кельвинов. Высокотемпературный газ имеет температуру как минимум 1 млн. Кельвинов. Последняя разновидность плазмы принимает участие в термоядерном синтезе.
Проявление плазмы в природе
Считается, что 99% Вселенной представлено плазмой. Любая звезда состоит именно из ионизированного газа. Впервые об этом начали задумываться наблюдая за Солнцем. Исходящий от него ветер является ничем иным, как плазмой.
Наблюдать плазму можно и в ионосфере. Визуально этот эффект можно заметить рассмотрев пример полярного сияния. Оно образовывается в результате облучения азота и кислорода солнечным излучением. Конечно, пример с полярным сиянием не столь удачный, поскольку данное явление можно увидеть только в определенных участках местности, малодоступной для большинства людей. Более частым проявлением природной плазмы, которое встречается везде, является момент удара молнии. Электрический искровой разряд, появляющийся в грозу, это и есть сильно ионизирующий газ.
Раньше считалось, что огонь это тоже разновидность плазмы, но это утверждение в корне неверно. Для плазмы характерна температура от 8000 градусов. Самое мощное пламя даже при обдуве кислородом не может нагреваться выше 4000 градусов.
Отличие плазмы от газов
На первый взгляд может показаться, что плазма и газ это довольно взаимосвязанные агрегатные состояния, которые можно объединить в одно понятие. Все же существует ряд особенностей, позволяющие их разделить. В первую очередь можно отметить электрическую проводимость. У газа она крайне мала. Ярким примером будет воздух. Сам по себе он отличный диэлектрик, поэтому по нему электрический заряд не передается. Стоит его довести до состояния плазмы, как ситуация кардинально меняется, ведь по ней заряд передается вполне эффективно.
Также плазму от газов отличает однородность частиц. Для газов характерно, что в их структуре присутствуют подобные друг к другу составляющие. Они постоянно двигаются и взаимодействуют между собой на сравнительно небольшом расстоянии. В случае же с плазмой в ней есть как минимум 2-3, а то и больше вида частиц. В ее составе наблюдаются электроны, ионы и нейтральные частицы. Их свойства отличаются между собой. У них может быть разная скорость или температура. Именно по этой причине для плазмы характерна неустойчивость и сложность управления, поскольку многие ее составляющие действуют отличительно от прочих.
Где применяется плазма
В последнее время появилось довольно много приборов, устройство которых предусматривает работу где применяется плазма. Впервые ионизированные газы начали использоваться при создании светотехники. Ярким тому примером станут газоразрядные лампы. Принцип действия таких лампочек заключается в передаче электрического тока через газ заключенный в колбе. В результате наблюдается ионизация с получением ультрафиолетового излучения. Последнее поглощается люминофором, что и вызывает его свечение в видимом для человеческого глаза диапазоне.
Особо востребованной технологией является плазменная резка. Таким оборудованием создается разогретая струя, способная плавить металлы и практически все вещества, встречаемые на ее пути. Обычно такое оборудование превращает в ионизированный газ обыкновенную воду. Сначала она испаряется, после чего под воздействием электрического тока из нее формируется плазменный пучок.
Принцип плазмы может применяться для осуществления передачи данных на расстояние. В связи с этим проводится активная разработка плазменных антенн. Данная идея запатентована еще в 1919 году, но так и не была полноценно применена вплоть до начало XXI века. Технические наработки испытания такого оборудования дают основание полагать, что эта технология придет на замену привычного для всех wi-fi соединения. Она обладает большей скоростью передачи данных, а также возможностью действия в большом радиусе. Проводимость плазмы превышает проводимость серебра, которое является одним из лучших твердых веществ для передачи зарядов.
Также в промышленности началось внедрение технологии напыления расплавленного материала под воздействием плазменной струи. Металл, или другой материал, расплавляется, после чего подается на струю в плазму. В результате он распыляется, дополняя струю. После этого взаимодействия с плазмой прекращается, и материал оседает на требуемых поверхностях в виде тонкого покрытия. Этот метод позволяет провести обработку гораздо быстрее, чем в случае с электрохимическим методом.
Применение плазмы в научном проекте Токамак
Всемирно известный научный проект Токамак, являющийся сокращением полного названия тороидальная камера с магнитными катушками – это установка для магнитного удержания плазмы. Она разработана с целью поддержания условий для проведения управляемого термоядерного синтеза. Впервые эта установка была построена в 1954 году, после успеха проведенных испытаний, в мире было создано более 200 ее копий, где осуществляются исследования и сегодня.
Особенность данного проекта заключается в обеспечении контроля ионизированного газа. В Токамаке плазма удерживается с помощью магнитного поля. Такой способ применяется, поскольку создать ограждение стенками для предотвращения утечки плазмы невозможно. Любое вещество при контакте с ней расплавляется. Чтобы магнитное поле могло подействовать ионизирующий газ, через него пропускают электрический ток. Он обеспечивает создание электрического поля. Также прохождение тока активизирует набор высокой температуры.
Исследование плазмы, позволят реализовать идею контролируемого термоядерного синтеза. Как следствие удастся создать высокоэффективные электростанции, работающие значительно безопаснее атомных, и не создающих вредного выброса в атмосферу.
Терапевтический аферез. Как и для чего очищают кровь вне тела пациента
Состав крови чрезвычайно многообразен, и когда в ней появляются патогены и вредные вещества — помочь могут технологии терапевтического афереза.
Автор
Редакторы
Кровь — главная жидкость организма. В течение жизни под влиянием различных факторов, включая заболевания, в крови человека накапливаются патогенные вещества. Один из способов очищения крови от патогенов — терапевтический аферез. С помощью этой технологии из крови удаляют патогенные вещества для лечения тяжелых заболеваний, когда другие методы не помогают или их просто нет. В этой статье, которая открывает спецпроект по терапевтическому аферезу, мы расскажем об истоках технологии, ее видах и применении для лечения пациентов.
Аферез
Партнер спецпроекта — научно-производственная фирма «ПОКАРД», которая занимается разработкой и производством сорбционных колонок, а также внедрением в клиническую практику технологий терапевтического афереза.
В ходе разных болезней опасные молекулы распространяются по организму, заполоняя собой кровь. Избыток транспортных частиц с холестерином, белки-провокаторы иммуной системы, токсины патогенных бактерий. Против одних препараты есть, но подходят не всем, против других — ещё не выведены на рынок. Третьи — важное звено в развитии многих болезней, против которых нет специальных средств борьбы. В любом из этих случаев очищение крови от опасных соединений может сократить ущерб здоровью до минимума: спасти жизнь или значительно ее продлить.
Аферез — именно такой способ извлечь из крови только один тип биомолекул. В медицине с помощью терапевтического афереза из крови пациентов удаляют опасные для здоровья элементы, сохраняя все остальное. Очищают кровь, точнее, плазму крови, очень по-разному: с помощью антител к опасным молекулам, фильтруя через пористые мембраны, разделяя компоненты на центрифуге. Каким он только не бывает!
В спецпроекте мы расскажем, какие сложные проблемы решает терапевтический аферез: простой, но незаменимый во многих ситуациях.
Кровь — главная жидкость организма
Кровь — жидкая соединительная ткань внутренней среды организма, циркулирующая по сосудам: венам, артериям, капиллярам. Объем крови у взрослого человека — 4,5–5 литров: это около 8% массы тела. Несмотря на вроде бы небольшой объем по отношению ко всему организму, потеря хотя бы 30% крови (1–1,5 литров) считается смертельной.
В «Большой медицинской энциклопедии» их называют также липопротеидами. Это синонимы, и мы в этой статье будем все же называть эти молекулы, как принято в биохимии: липопротеинами.
Зачем нужна кровь
Кровь обеспечивает правильную работу всех органов и систем тела (таблица 1). Даже незначительное нарушение ее состава или появление патогенных компонентов может нарушить сбалансированную работу организма. При большой кровопотере (травме, родах) проводят переливание (донорство) крови от человека к человеку (см. врезку). Часто риск развития и тяжести заболевания связаны с конкретными патогенами — это может быть как один «плохой» компонент, так и группа веществ. Нарушение состава крови может происходить при острых состояниях — например, значительной кровопотере или заражении крови, а также развиваться постепенно под влиянием образа жизни, наследственности и окружающей среды. Если такие изменения накапливаются плавно, человек может даже не ощущать симптомов заболевания и вести обычную «здоровую» жизнь до тех пор, пока уровень патогенов в его крови не достигнет критического уровня. В этом случае необходимо прицельно воздействовать на «плохие» компоненты, а именно — «убрать» их из крови.
Донорство: добровольная помощь
Донорское переливание крови требуется примерно 4 тыс. человек ежедневно: в нем нуждаются люди, потерявшие значительное количество крови, а также пациенты со специфическими заболеваниями (рис. 1). В некоторых случаях нужна не кровь целиком, а ее отдельные компоненты: например, онкобольным при интенсивной химиотерапии требуется переливание тромбоцитарной массы.
Ежегодно в мире цельную кровь или ее компоненты сдают около 112 миллионов раз [1]. Однако не существует единых норм по количеству доноров и донаций. Донором крови может стать любой здоровый человек старше 18 лет. При этом банки крови испытывают постоянную нехватку крови — это связано с небольшим временем хранения крови, а также с нехваткой доноров.
Донорство плазмы используют для профилактики и лечения вирусных заболеваний: для этого используют кровь людей, перенесших заболевание. В этом случае донорская плазма крови содержит антитела к возбудителю болезни [2], [3].
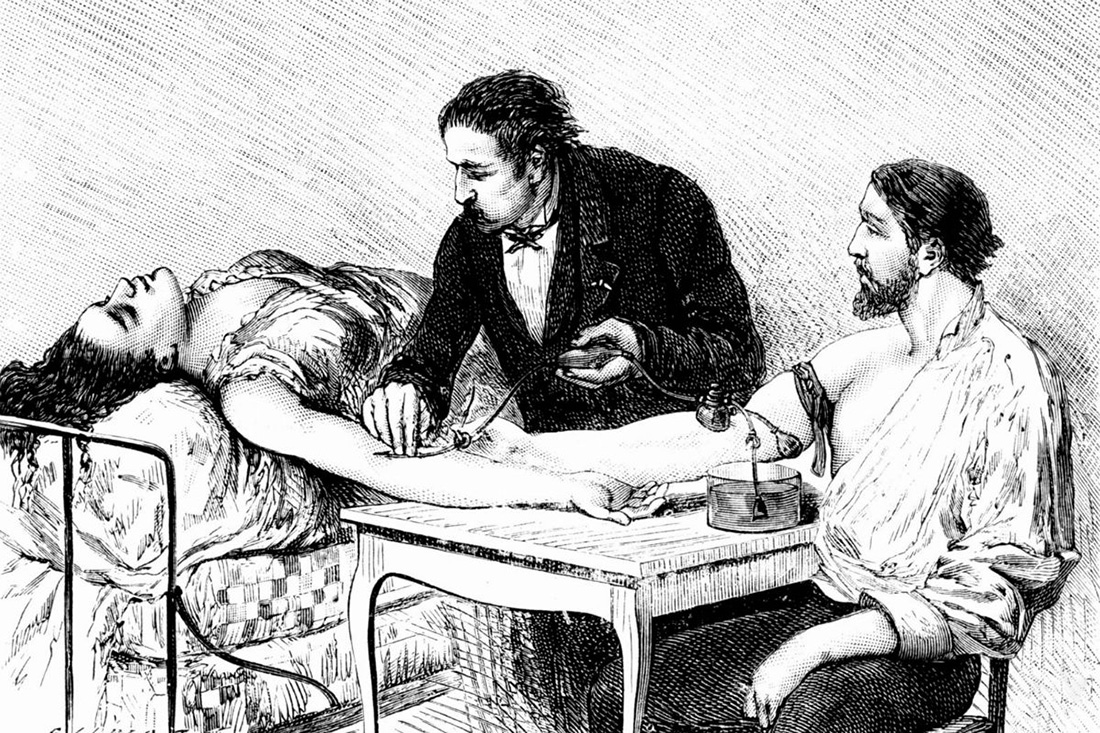
Рисунок 1А. «От человека к человеку». Британский акушер и хирург Джеймс Бланделл в 1825 году впервые в мире провел успешное переливание крови своей пациентке, умирающей от послеродового кровотечения. Он неоднократно видел, как женщины умирали во время родов от потери крови. Для того, чтобы кровь не «закончилась», он ввел пациентке кровь ее мужа [2], [3]. Операция прошла успешно. Процесс переливания крови получил большое распространение во время Первой мировой войны. При этом Бланделл стал первым, кто применил для переливания крови специальные инструменты.
Рисунок 1Б. Первая операция по переливанию крови в России была проведена 20 апреля 1830 года Андреем Мартыновичем Вольфом. Сейчас в эту дату традиционно отмечают День донора.
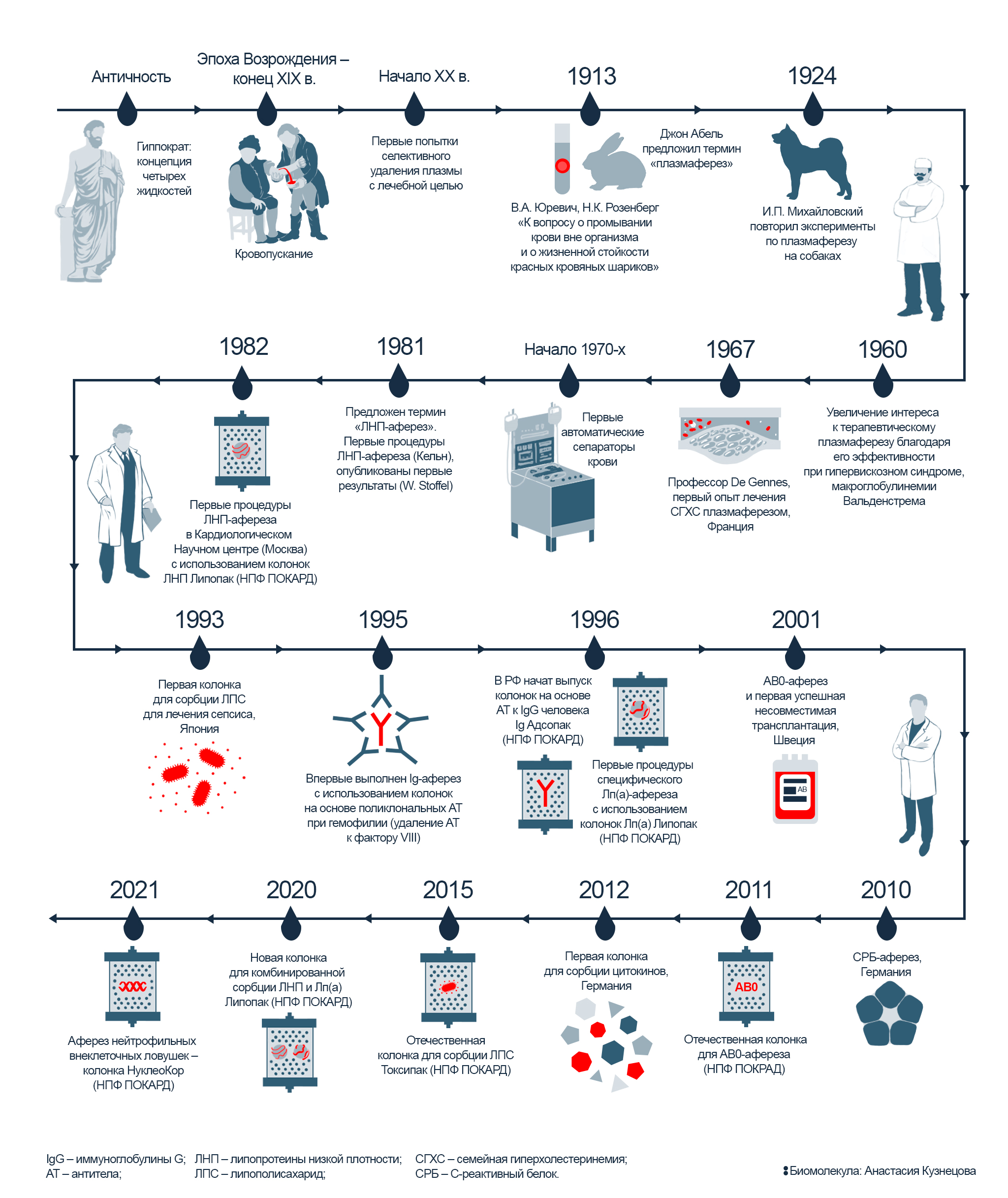
История очищения крови: от кровопускания до терапевтического афереза
На протяжении нескольких веков, начиная с античности и до конца XIX века, в медицине было широко распространено кровопускание — метод, основанный на гуморальной теории Гиппократа. В ее основе — концепция четырех жидкостей, циркулирующих в теле человека: крови, флегмы, желтой и черной желчи. Считалось, что их соотношение определяет характер человека, и поддержание этого соотношения и было главной идеей теории Гиппократа. Лечение медлительности или грубости заключалось в удалении конкретной жидкости, избыток которой влияет на определенную черту характера. Для этого античные врачи прибегали к кровопусканию — удалению «лишней» крови через прокол вены. Только к концу XIX века на смену кровопусканию пришел новый метод, который стал впоследствии называться «терапевтический аферез» (рис. 2). Методика нашла применение при лечении многих тяжелых заболеваний, и далее в этой статье мы расскажем, каких и как именно.
Рисунок 2. История метода: от первых экспериментов по кровопусканию до современного терапевтического афереза. С античности и до конца XIX века врачи широко применяли кровопускание. И лишь в начале XX века исследователи начали применять другой метод: не просто выпускать у пациентов кровь, а забирать плазму, очищать ее — и затем возвращать обратно в организм. На сегодняшний день для плазмосорбции используют специальные сорбционные колонки — с их помощью становится возможным точечно удалять определенные патогены, не влияя на состав остальной крови пациента.
Суть афереза заключается в удалении вредных компонентов из системного кровотока пациента, для чего из вены забирают цельную кровь, которую разделяют на клетки (эритроциты, тромбоциты, лейкоциты) и плазму. Затем плазма либо удаляется безвозвратно (плазмаферез), либо пропускается через специальное устройство (плазмосорбция), в котором происходит необратимое связывание только вредных веществ. Очищенную плазму вместе с клетками возвращают обратно в системный кровоток пациента. Процедура идет непрерывно, то есть забор и возврат крови осуществляют одновременно и с постоянной скоростью. Таким образом можно сказать, что на несколько часов пациенту создают искусственный внешний контур кровотока, в котором кровь по силиконовым сосудам прокачивают насосы, играющие роль второго сердца. Этот метод получил название терапевтический (то есть лечебный) аферез (от греч. удаление).
В ХХ веке аферез начинают использовать на практике. Первые попытки очищения крови сводились к удалению небольших порций плазмы объемом около 300 мл (примерно 1,5 стакана). Недостаток метода заключался в том, что экспериментаторы действовали «на глаз»: вместе с патогенами из крови удаляли и важные вещества, участвующие в нормальном обмене веществ.
Рисунок 3А. Российские первопроходцы плазмафереза — В.А. Юревич (слева) и Н.К. Розенберг (справа).
Рисунок 3Б. Джон Джейкоб Абель — отец термина «плазмаферез». Американский биохимик и фармаколог, один из основателей «Журнала биологической химии».
Отечественными основоположниками плазмафереза стали сотрудники кафедры инфекционных болезней Военно-медицинской академии — В.А. Юревич и Н.К. Розенберг (рис. 3А). В 1913 году они провели операцию по «очищению» плазмы на кроликах и назвали ее «промыванием крови» [4]. Заключалась она во временном извлечении и обработке крови вне организма. Чтобы испытуемые кролики не погибли от кровопотери, кровь замещали буферным раствором. После необходимых манипуляций очищенную кровь возвращали в организм, а разницу по объему восполняли цитратным буфером (рис. 4). Пионерские работы отечественных ученых закончились хорошо — все кролики выжили! Опыты по извлечению и очищению крови удалось успешно повторить в 1924 году И.П. Михайловскому на собаках.
Рисунок 4. Протокол первого успешного «отмывания крови» в эксперименте на кроликах, датированный 2 февраля 1913 года.
Параллельно с российскими учеными работал американский исследователь Джон Абель (рис. 3Б) — именно он ввел термин «плазмаферез» и считается «крестным отцом» этого метода 7. Новый толчок в развитии методов очищения крови произошел в 1960-е годы, когда удалось подтвердить эффективность плазмафереза для лечения макроглобулинемии Вальденстрема — заболевания, при котором в кровь секретируется вязкий патогенный белок. В 1970-х были созданы первые автоматические сепараторы крови — и за 10 лет, прошедших с момента их первого применения, количество процедур терапевтического афереза в США возросло с 6 тысяч до 60 тысяч!
К концу ХХ века широкое распространение получила иммуносорбция — метод, при котором для специфического связывания патогенов крови используют сорбенты на основе антител. В отличие от пионерской, но порядком устаревшей технологии плазмафереза, плазма крови не удаляется насовсем, а очищается в искусственном контуре, содержащем сорбционную колонку, а потом возвращается обратно в кровоток. Преимущество иммуносорбции дают антитела, прицельно узнающие конкретные патогены и помогающие извлечь их из плазмы крови. При этом сорбенты на основе антител могут отличаются узкой специфичностью и уже доказали свою безопасность и эффективность для развития сорбционных технологий. В дальнейшем термин «аферез» стали использовать в названии других специфичных процедур: Лп(а)- и ЛНП-афереза, Ig-афереза, СРБ-афереза, а термин «иммуносорбция» распространился на все методы, использующие принцип аффинного взаимодействия «антиген—антитело».
Огромный вклад в развитие терапевтического афереза в России внесли сотрудники Всесоюзного Кардиологического Научного Центра (ВКНЦ, 1975–1996). В 1986 году в группе аффинных сорбентов под руководством С.Н. Покровского был создан первый отечественный сорбент на основе антител для сорбции липопротеинов низкой плотности (ЛНП). Колонки на основе этого сорбента были с успехом применены для лечения пациентов с тяжелыми формами атеросклероза и семейной гиперхолестеринемии (СГХС) в лаборатории гемодиализа и плазмафереза ВКНЦ (руководитель проф. Кухарчук В.В.). В 1986 году там был создан уникальный сорбент для удаления из плазмы крови человека липопротеина (а), колонки на основе которого до сих пор не имеют аналогов в мире. Были созданы и другие сорбенты: с антителами к иммуноглобулинам человека (для удаления аутоантител и иммунных комплексов), с антиидиотипическими антителами, эффективно связывающими антигены из плазмы крови человека, и ряд других.
Позже в качестве аффинных сорбентов помимо антител стали использовать и другие синтетические молекулы. Этот метод получил название плазмосорбция — когда плазму пропускают через специальный сорбент в замкнутом контуре (через сорбционные колонки). В результате патогены плазмы селективно связываются с сорбентом прямо внутри колонки, а все остальные вещества плазмы просто проходят сквозь контур — и их возвращают обратно пациенту 9.
Большим достижением стало изобретение сорбционных колонок для цельной крови, что позволило исключить сложный этап предварительного разделения крови на плазму и клетки. Такая технология за счет своей простоты нашла применение в отделениях интенсивной терапии, где на счету каждая минута. К сожалению, далеко не каждую колонку возможно сделать гемосовместимой из-за особенностей лигандов.
В следующих разделах статьи мы разберем самые распространенные случаи применения терапевтического афереза и выясним, как они работают.
Серьезный подход к серьезным заболеваниям
Терапевтический аферез используют в качестве вспомогательного или основного метода лечения почти во всех областях медицины — от трансплантологии до лечения наследственных заболеваний. Современные технологии позволяют удалять патогены из кровотока вне тела пациента, т.е. экстракорпорально (лат. extra — вне- + corporate — относящийся к телу), что особенно актуально в критических ситуациях (при кризах), поскольку воздействие оказывается на кровь напрямую, увеличивая эффективность медикаментозного лечения и прочих лечебных мероприятий. Терапевтический аферез часто становится лечением выбора — вместо лекарств, когда заболевания не поддаются традиционной медикаментозной терапии, либо ее эффекта недостаточно. Часто аферез назначают пациентам, у которых ограничения к медикаментозной терапии вызваны индивидуальной устойчивостью к определенным лекарствам или непереносимостью конкретных веществ.
Однако не стоит считать терапевтический аферез панацей от всех болезней. В первую очередь это вспомогательный метод, поддерживающий основное лечение. Его применение помогает поддержать самостоятельное восстановление организма и интенсивность воздействия лекарственной терапии. Давайте познакомимся с тем, как это происходит, на конкретных примерах.
Смертоносный холестерин
Начать нужно именно отсюда, потому что терапевтический аферез берет начало в истории лечения наследственной семейной гиперхолистеринемии (СГХС). В 1981 году профессор В. Стоффель и доктор Х. Борберг опубликовали статью об использовании аффинной хроматографии для лечения больных СГХС [11].
СГХС — наследственное заболевание, которое можно назвать созданной природой моделью атеросклероза. У больных наблюдается дефицит функционально активных рецепторов, удаляющих из организма липопротеины низкой плотности (ЛНП). Накопление ЛНП (более 5 мМ/л) ведет к повышению уровня холестерина, его отложению на стенках сосудов и раннему развитию атеросклероза. Больные СГХС умирают от инфаркта миокарда еще в детском возрасте. Самая частая генетическая причина СГХС — мутация в гене ЛНП-рецептора (LDLR), который расположен главным образом на поверхности гепатоцитов и играет ключевую роль в связывании и выведении из кровотока циркулирующих ЛНП-частиц. На сегодняшний день известно более 1600 мутаций LDLR, способных нарушить функцию рецептора и вызывать развитие этой болезни.
Вторая по частоте причина — мутация в гене аполипопротеина В100 (ApoB), входящего в состав ЛНП-частиц и ответственного за связывание ЛНП с рецептором. В результате изменений в гене половина ЛНП-частиц не способна связаться с ЛНП-рецептором.
СГХС — классический пример заболевания, при котором лекарственная терапия известна, но неэффективна. Поэтому терапевтический аферез липопротеинов — это лечение выбора при гомозиготной СГХС. Доказательством высокой эффективности терапевтического афереза можно считать тот факт, что одна из первых пациенток с гомозиготной формой этого заболевания до сих пор продолжает лечение, начатое в 1986!
Ошибка системы: когда чужой среди своих.
Аутоиммунные заболевания возникают вследствие сбоя иммунной системы, которая начинает атаковать собственный организм, производя большое количество аутоантител против собственных органов и тканей. Для более подробного знакомства с этим феноменом предлагаем прочитать статью «Биомолекулы» «Иммунитет: борьба с чужими и… своими» из цикла «Аутоиммунные заболевания» [12].
Лечить эти заболевания сложно: наиболее распространенная тактика основана на устранении клинических проявлений или симптомов болезни. Еще одной стратегией можно считать гормональную терапию, но она всего лишь снижает реакцию на аутоантитела, не удаляя их из организма [13].
Как еще можно помочь пациентам с аутоиммунными заболеваниями и сделать их жизнь лучше? В некоторых случаях, когда заболевание сильно запущено или когда пациент не получал должную терапию, самая правильная стратегия — замедлить прогрессирование болезни (например, при рассеянном склерозе) [14]. И здесь на помощь приходит терапевтический аферез — вместо долгого устранения симптомов можно взять и удалить из крови «виновников» патологии — аутоантитела. В случае системных аутоиммунных заболеваний (ревматоидный артрит [15], системная красная волчанка [16], васкулит) регулярные курсы плазмафереза или плазмосорбции способны длительное время удерживать пациентов в состоянии ремиссии, когда течение болезни ослаблено. Главная задача такой терапии — предотвратить накопление аутоантител и иммунных комплексов, чтобы не дать аутоиммунному заболеванию обостриться.
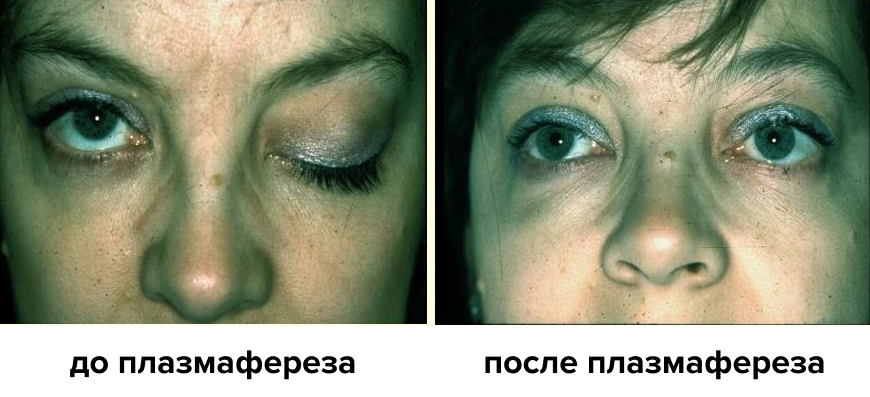
Миастения Гравис — классическое аутоиммунное заболевание
Миастения — болезнь, при которой наблюдается патологическая мышечная утомляемость и слабость скелетной мускулатуры. Заболеванию в большей степени подвержены женщины 20–40 лет. Впервые эта болезнь была описана в 1672 году, а аутоантитела, провоцирующие такое состояние, выделены в 1960 году. Они поражают главным образом структуры, ответственные за холинергическую передачу и сокращение мышечного волокна. После проведения терапевтического плазмафереза эффект виден уже по окончании первой процедуры — пациент начинает свободно дышать и полностью открывать глаза (рис. 5) [17], [18].
Рисунок 5. Миастения Гравис. Самый ярко выраженный симптом у больных — птоз век, когда пациент не может полностью открыть глаза.
Человеческий конструктор
Чтобы познакомиться с еще одним случаем применения афереза, давайте вспомним о первой в истории трансплантации органа, которую провел советский хирург Юрий Вороной в 1933 году (рис. 6; подробнее читайте во врезке). При этом почти за 90 лет, прошедших с момента первой трансплантации, врачам до сих пор сложно найти орган, подходящий по антигенной совместимости тканей. В случаях, когда пациентам требуется пересадка органов, может произойти реакция отторжения трансплантата. Это связано с гуморальным ответом реципиента на пересадку чужеродного органа или ткани, который сопровождается выработкой антител [19].
Рисунок 6. Три основоположника трансплантологии: Николай Иванович Пирогов (слева), Юрий Юрьевич Вороной (в центре) и Владимир Петрович Демихов (справа).
Тернистый путь трансплантологии
История трансплантологии немного запутана. Точкой отсчета принято считать создание сосудистого шва — его разработал в 1902 году французский хирург Алексис Каррель. За это достижение ученый в 1912 году получил Нобелевскую премию по физиологии и медицине. Благодаря работе Карреля впервые стало возможным сохранять кровоснабжение при трансплантации органов. Спустя несколько лет, в 1905 году, исследователь провел несколько пересадок органов и конечностей у животных.
В России важную роль сыграли исследования хирурга и естествоиспытателя Н.И. Пирогова, результаты которых он изложил в монографии «О пластических операциях вообще, о ринопластике в особенности» [20]. Исследования подхватил советский хирург Ю.Ю. Вороной, который в 1933 году впервые в мире сделал пересадку трупной почки человеку. Все эти исследования стали фундаментом для экспериментов по пересадке органов другого российского ученого, В.П. Демихова — «отца трансплантологии». В 1946 году Демихов впервые в мире успешно пересадил собаке второе сердце (и не только — см. рис. 7). Вскоре он смог полностью заменить сердечно-легочный комплекс — эта сенсация мирового масштаба, к сожалению, прошла практически незамеченной в СССР. Эксперименты Демихова доказали, что пересадку органов возможно проводить на человеке.
Затем в дело мировой трансплантологии вступают американцы: в 1954 г. команда американских хирургов под началом врача Джозефа Мюррея совершила первую успешную пересадку почки — донором пациента с почечной недостаточностью стал его брат-близнец. Уже через пару лет удалось успешно пересадить печень — это сделал хирург Томас Старзл в 1956 году.
Рисунок 7. «Собака с двумя головами» — один из самых экзотических экспериментов В.П. Демихова. Двухголового пса удалось «сконструировать» из двух дворняг: большая собака была основным донором, а от маленького пса взяли только верхнюю часть тела. Позвонки собак скрепили специальными струнами, чтобы они двигались как единый организм. Эксперименты Демихова по пересадке собачьего сердца, легких и головы внесли огромный вклад в развитие мировой и отечественной трансфузиологии — с их помощью удалось создать базу для трансплантации человеческого сердца. Однако в СССР ученого прославляли недолго: в 1960-е годы у В.П. Демихова обострились отношения с руководством института, где он работал, после чего экспериментатора обвинили в шарлатанстве и не допускали к защите диссертации.
Почему же происходит отторжение донорских органов? Причин две:
О, группа крови!
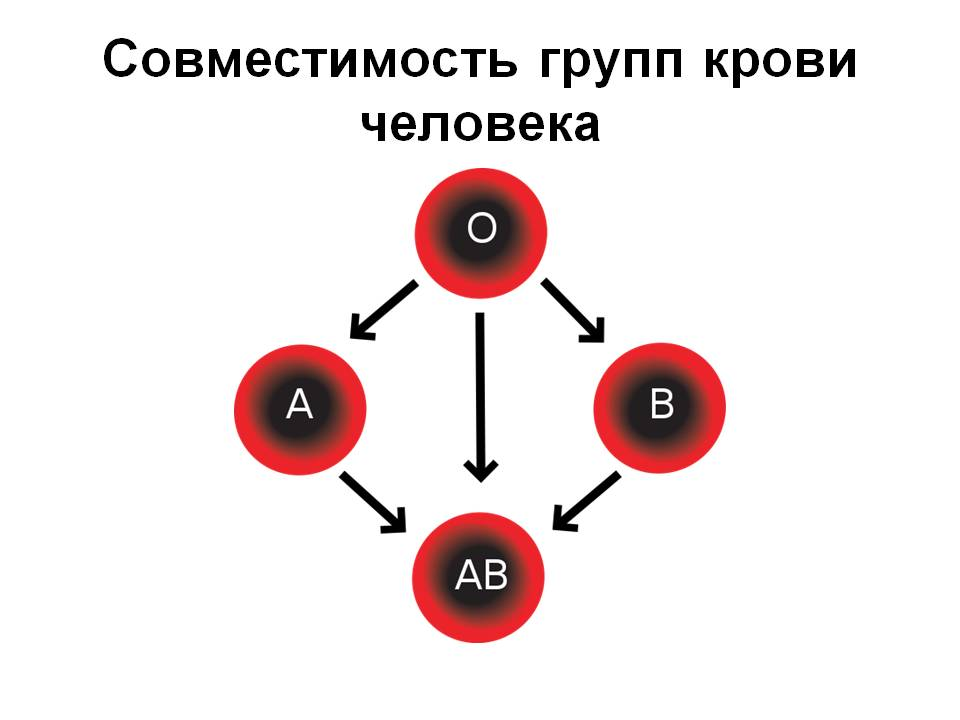
Самая известная классификация групп крови (А, В, 0) принадлежит австрийскому врачу-иммунологу Карлу Ландштейнеру [21], [22]. В 1900 году он обнаружил, что при перемешивании крови разных людей в одних случаях клетки склеиваются (происходит агглютинация), а в других — нет. Совместимость крови связана с разными характеристиками эритроцитов — в зависимости от присутствия или отсутствия на их поверхности определенных антигенов. Позже к этой классификации добавилась еще одна система — резус-фактор. Система резус-фактора основана на присутствии (Rh + ) или отсутствии (Rh − ) иммуногенного антигена Rh o (D). Подробнее о совместимости групп крови можно прочитать в статье «Биомолекулы» «„Кровавая“ работа врачей ученых и природы» [1]. Поэтому даже переливание крови от донора к реципиенту с одинаковыми группами крови может привести к летальному исходу — в случае, если их резус-факторы не совпадают.
На сегодняшний день разработано 36 систем групп крови (Келл, Даффи, MNSs, Льюис, Кидд и др.). Также установлено: не существует понятия универсального донора и универсального реципиента, как было принято считать ранее; совместимость крови не ограничивается присутствием конкретных антигенов на поверхности эритроцитов. Решить проблему донорства может AB0-аферез, речь о котором пойдет ниже.
Рисунок 8А. Карл Ландштейнер — Нобелевский лауреат 1930 года по физиологии и медицине за создание самой известной классификации групп крови: A, B, 0 [22].
Рисунок 8Б. Схема совместимости групп крови между собой. Стрелочками показано, какую кровь можно переливать от донора к реципиенту.
HLA-комплексы могут отличаться даже у родственников [23]. Дело в том, что в клетках человека присутствует два HLA-антигена, наследуемые от разных родителей. Возникающее при таком наследовании огромное количество вариаций HLA-антигенов приводит к низкой вероятности того, что два человека будут иметь одинаковые HLA-антигены 24. Как правило, абсолютное сходство антигенов (крови и HLA) возможно лишь у однояйцевых близнецов, поэтому у них практически не наблюдается отторжение трансплантата. В остальных случаях для успеха операции необходимо применять иммуносупрессанты — препараты для искусственного угнетения иммунитета.
Реакция отторжения трансплантата схожа с иммунным ответом и направлена на уничтожение иммунной системой чужеродных тканей [19]. В результате происходит либо отторжение органа, либо пожизненное назначение пациенту медикаментозных препаратов. Чтобы расширить возможности трансплантации органов от родственников, применяют иммуносорбцию — селективное удаление антител, которые вырабатываются у реципиента в ответ на трансплантацию донорского органа [27].
Сколько длится поиск подходящего органа?
В случаях, когда необходимо провести пересадку, пациентам требуется не только встать в очередь на донорский орган, но и дождаться подходящего трансплантата — для которого вероятность отторжения будет минимальной. В случаях с пересадками парных органов (например, почек) часто проводят родственную операцию — когда кровный родственник пациента «делится» своим органом. Если необходима трансплантация непарного органа (например, сердца), прибегают к посмертному донорству. Согласно законодательству, донор должен подписать письменное согласие на использование своих органов в трансплантационных целях. Записываясь в листы ожидания, пациенты никогда не знают, когда появится подходящий орган — его можно ждать неделю, а можно и несколько лет. В таких случаях главная задача пациента — дожить до появления подходящего для пересадки органа.
В случае парного органа — почки — разработан «Стокгольмский протокол», который применяется при AB0-несовместимой трансплантации почки от живого родственного донора. Суть протокола заключается в последовательном приеме препаратов донором-родственником на протяжении 20-25 дней перед проведением операции. За 8 дней до операции начинают проводить курсы иммуносорбции, удаляя нежелательные антигрупповые (анти-А/В) антитела в кровотоке. Практика прошла проверку временем, включена в клинические рекомендации и широко используется по всему миру.
Иногда пациентов с тяжелыми аутоиммунными заболеваниями сердца благодаря аферезу можно даже исключить из листа ожидания на трансплантацию. Примером может служить опыт лечения дилатационной кардиомиопатии, когда регулярные курсы иммуносорбции привели к снижению уровня аутоантител и улучшению функциональных показателей сердца. Помимо этого, у пациентов произошло снижение уровня холестерина и антител, а также возросло потребление кислорода тканями [28].
Опасность! Шок! Заражение крови!
Сепсис (от греч. гниение) — системное заражение крови, которое чаще всего вызывают грамотрицательные бактерии и их эндотоксины. Триггером обычно являются липополисахариды — кусочки клеточной стенки бактерий: проникнув в кровь, эти эндотоксины запускают воспаление и повреждают клетки. Следом за гипервоспалением происходит массовый выброс цитокинов, что в дальнейшем приводит к цитокиновому шторму. Особо тяжелый сепсис со снижением перфузии тканей и нарушением доставки кислорода и других веществ называется септическим шоком. Инфекцию во время сепсиса вылечить практически невозможно [29], [30].
Сепсис крайней опасен: он грозит полиорганной недостаточностью и даже смертью [31]. Несмотря на доступность антибиотиков широкого спектра действия, сепсис остается лидирующей причиной смертности в отделениях реанимации и интенсивной терапии некардиологического профиля: ежегодно он уносит жизни около 11 миллионов человек, среди которых большую долю составляют дети. Больше всего от сепсиса страдают пациенты в высокоразвитых странах [31], [32].
Лечить сепсис очень тяжело. Один из эффективных методов лечения — экстракорпоральное очищение крови, при котором из нее удаляются бактериальные токсины и медиаторы воспаления, повреждающие организм [33]. Очищение крови от липополисахаридов активно применяют на ранних стадиях сепсиса — наибольшая эффективность достигается в первые 24 часа. На более поздних стадиях или при септическом шоке требуется удалить уже избыток цитокинов, с чем также успешно справляется аферез, но уже с использованием других колонок — специфичных к цитокинам.
Среди клинических форм сепсиса лидирует абдоминальный сепсис (источник сепсиса располагается в органах живота), который поддается успешной терапии с применением селективной гемосорбции эндотоксинов, если успеть провести процедуру на ранних этапах [34]. При этом очищение крови является патогенетической терапией — после устранения кризисного состояния врачи приступают к лечению основной причины болезни [29], 36.
Терапевтический аферез в борьбе с COVID-19
COVID-19 сопровождается агрессивным воспалительным ответом организма на вирус и массированным выбросом цитокинов в кровоток. Иммунный ответ пациента приобретает гиперактивный характер — это приводит к чрезмерной воспалительной реакции и в итоге — к цитокиновому шторму. В результате наблюдаются повреждения легких, полиорганная недостаточность, микротромбозы — и эти явления можно предупредить при помощи терапевтического афереза 39.
Первое предположение, что технологии афереза можно применять при лечении COVID-19, основано на идее, что причина смертности от сепсиса — не сам патоген, а чрезмерный патологический ответ организма [43]. Если устранить причину — удалить чужеродные агенты из плазмы крови, — можно избавиться и от сепсиса. Для удаления цитокинов применяют гемосорбцию — кровь пациента пропускают через специальный сорбент, связывающий цитокины. При этом у пациентов с COVID-19 улучшается клиническая картина при пневмонии, септическим шоке, полиорганной недостаточности и поражении почек 43. Удаление цитокинов из кровотока стабилизирует состояние пациентов и сдерживает воспалительный ответ, предотвращая развитие цитокинового шторма [46].
«У товарища Дынина вся кровь испорчена!» Как скорректировать состав крови
Напомним: суть терапевтического афереза заключается в удалении патогенных веществ из крови и последующем возвращении очищенной плазмы или цельной крови обратно в кровоток пациента.
Проведение процедуры: вернем всё в лучшем виде
Аферез проводят по следующей схеме: кровь пациента пропускают через сорбционную колонку, где из нее удаляются патогенные вещества (рис. 9) [47]. Не стоит путать донорство и переливание крови с терапевтическим аферезом! В аферезе участвует кровь одного и того же человека, которую сначала «извлекают» из организма, очищают от патогенов, а затем возвращают обратно. Если бы во времена съемок фильма «Посторонним вход воспрещен» был доступен этот метод, товарищу Дынину не потребовалось бы переливание: достаточно было бы прогнать его редкую кровь 33-й группы через сорбционную колонку.
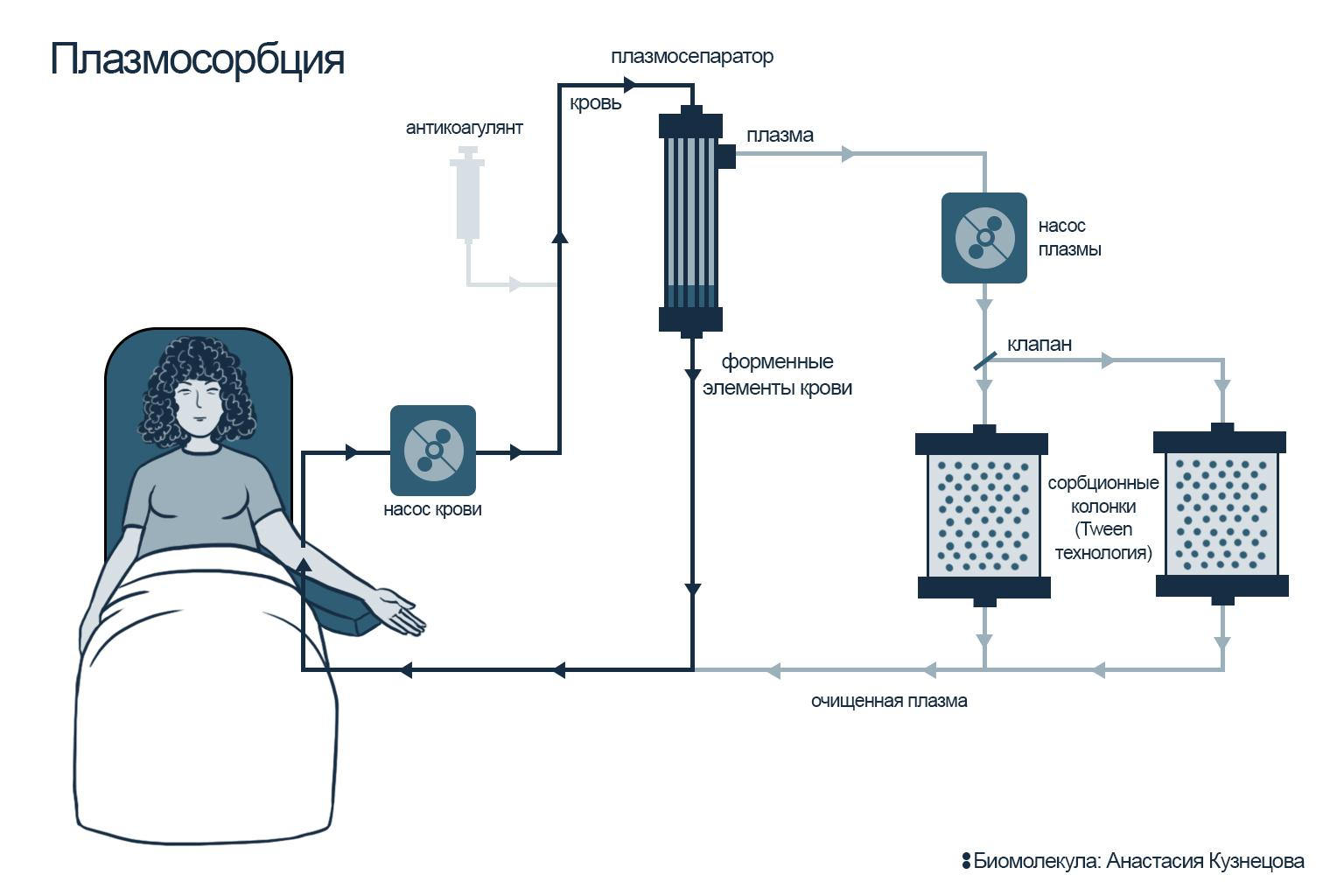
Для того, чтобы в процессе плазмосорбции кровь не сворачивалась, перед проведением процедуры пациенту вводят антикоагулянт. Кровь забирают при помощи специального медицинского аппарата, обеспечивающего длительный, дозированный и контролируемый поток нашей главной жидкости. После этого кровь поступает в плазмосепаратор: здесь кровь разделяется на плазму и форменные элементы. Существует два типа плазмосепараторов: мембранные и центрифужные. Первый делит клетки по размеру по принципу «сита»; второй — при помощи центрифугирования, когда более тяжелые клетки осаждаются, а жидкая фракция плазмы оказывается на поверхности — оттуда ее и забирают для дальнейшей обработки.
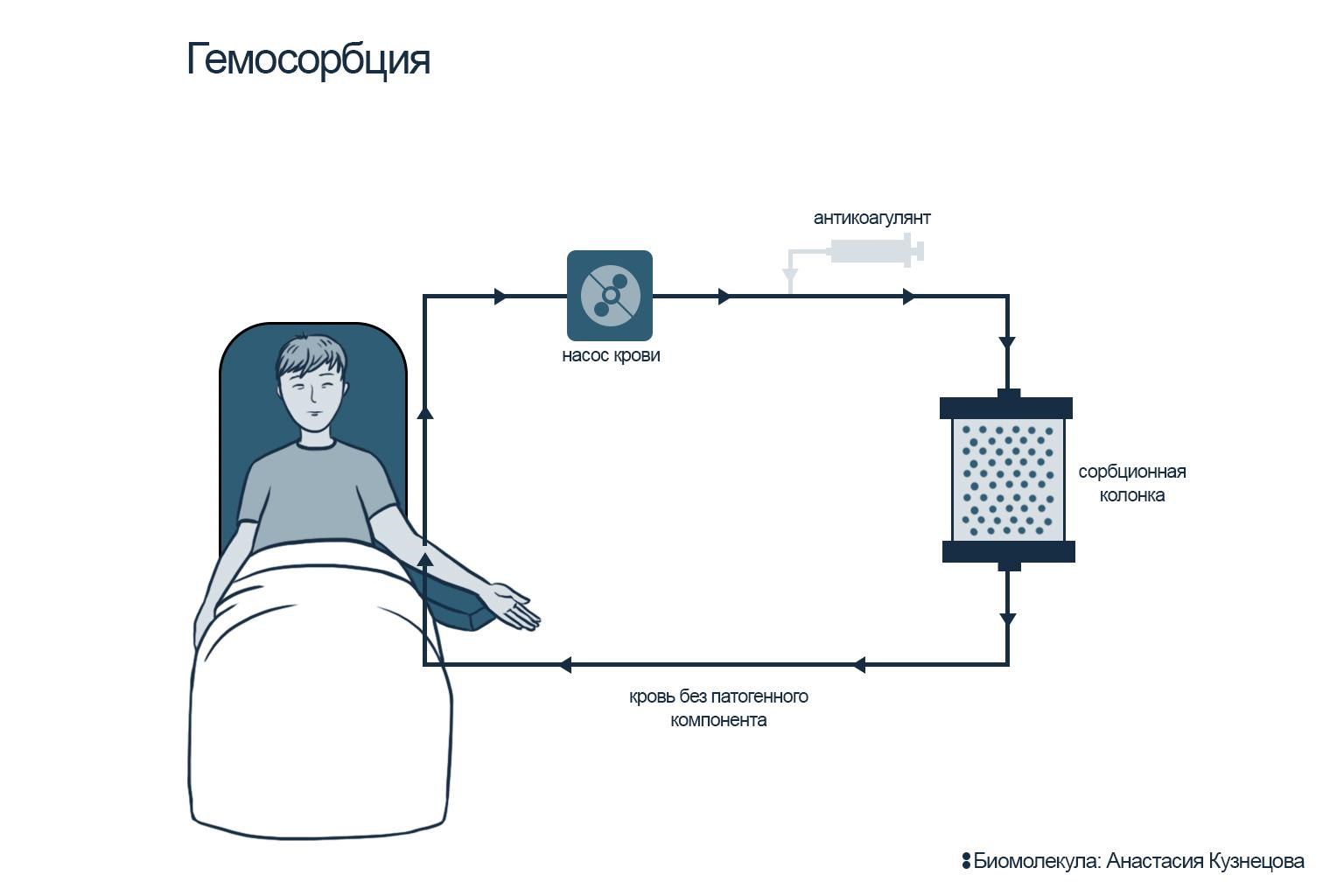
Для очищения плазмы (плазмосорбция) используют сорбционные колонки: проходя через них, плазма освобождается от патогенов, которые специфически связываются на лигандах сорбента. Очищенная плазма вновь соединяется с форменными элементами крови и возвращается обратно в кровоток пациента (рис. 9Б). В случае гемосорбции кровь поступает в колонку без разделения на плазму и форменные элементы, проходит через колонку и возвращается обратно в уже очищенном виде (рис. 9А).
Рисунок 9А. Схемы терапевтического афереза: гемосорбция. Цельная кровь пропускается через колонку; очищенная кровь возвращается пациенту.
Рисунок 9Б. Схемы терапевтического афереза: плазмосорбция. Кровь сначала разделяется на форменные элементы и плазму (для этого используется мембранный или центрифужный плазмосепаратор). Далее очищенная от форменных элементов крови плазма проходит через колонку, в которой происходит ее очищение — и только после этого плазму вновь соединяют с форменными элементами крови и возвращают пациенту уже «улучшенной».
В ходе терапевтического афереза забор и возврат крови идет в непрерывном цикле (обычно процедура длится 3–6 часов). При этом происходит как бы расширение кровеносной системы за счет введения трубок (искусственных сосудов), по которым кровь бежит до сорбционной колонки вне тела пациента и обратно. Процедура безопасна и хорошо переносится пациентом.
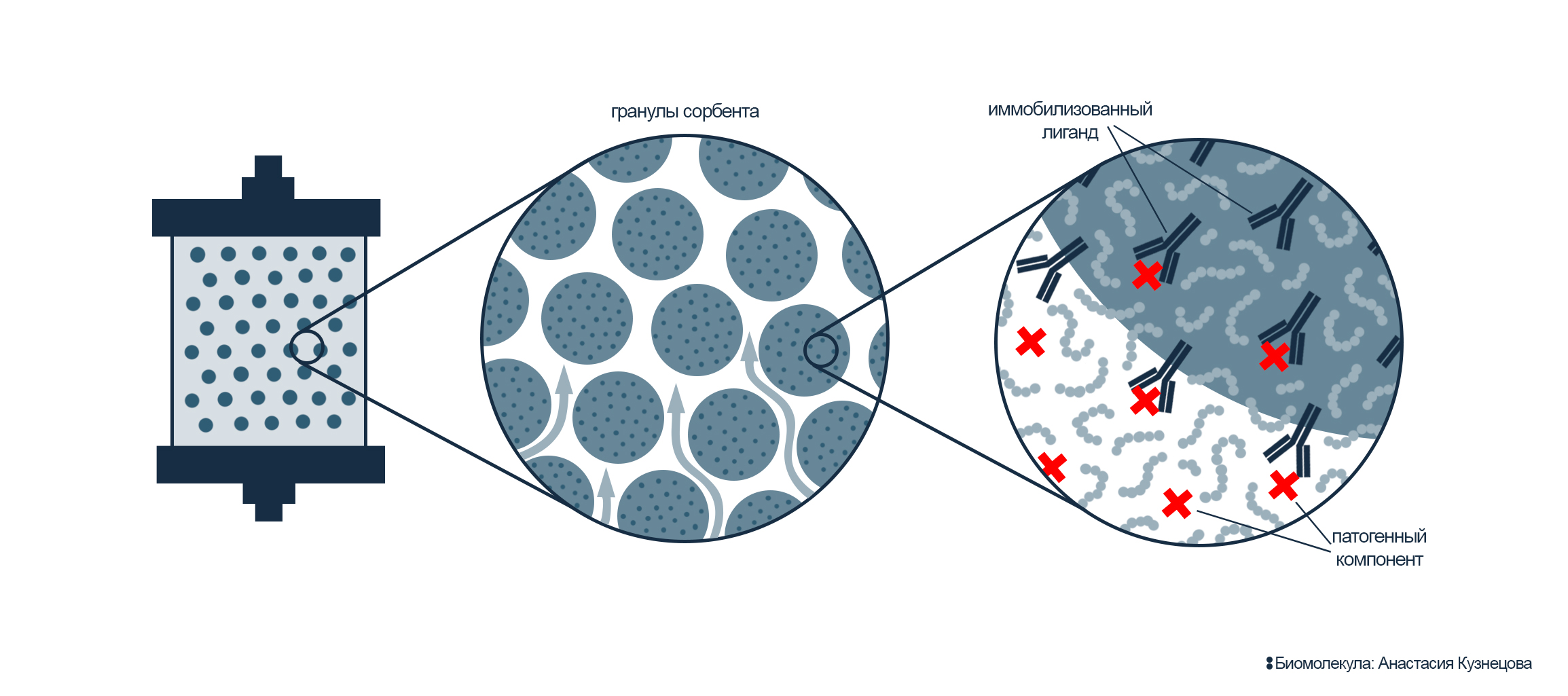
Сорбционные колонки: разделяй и властвуй
Существуют и НЕспецифически связывающие сорбенты для экстракорпоральной терапии. Например, селективные ДНК-содержащие углеродные сорбенты, которые применяют при красной волчанке.
Кто не работает, тот. регенерирует!
При очищении крови часто применяют сразу две регенерируемые колонки — такой подход называют tween-технологией. Пока одна сорбционная колонка очищает кровь, другая очищается от накопленного в ней патогена — регенерирует. Эти две колонки можно чередовать: переключать из «рабочего» режима в «регенерирующий» нужное количество раз. Tween-технология позволяет очистить неограниченный объем плазмы крови без остановки процедуры и потери сорбционной емкости. А каждую из таких колонок можно использовать до 50 раз для одного пациента.
Рисунок 10. Сорбционная колонка. Внутри — гранулы инертной матрицы, на которую пришиты лиганды (выделены темно-синим цветом). В процессе пропускания крови через колонку патогены (выделены красным) «приклеиваются» к сорбенту и остаются в колонке, тем самым удаляясь из кровотока.
Каждой болезни — своя колонка
При очищении крови необходимо «выловить» из кровотока определенные патогены, а потому под конкретные заболевания создают свои колонки. Хорошо, если заранее известно, какой именно патоген вызывает болезнь: в этом случае можно смело применять колонку, специфичную к конкретному лиганду — цитокину, иммуноглобулину, липопротеину и т.д. Однако все осложняется, если патоген — возбудитель заболевания — заранее неизвестен: подобрать подходящую колонку не получится.
Сорбционная колонка. Быть или не быть?
Как быть, если патоген неизвестен? Оказывается, в этой ситуации есть не только выход, но и новые возможности: патоген можно установить, разработав сорбционную колонку, селективную к конкретному патогену, и используя аферез как способ идентификации зловещей молекулы. Если при удалении из крови выбранного вещества состояние пациента улучшилось, значит, именно эта молекула — патоген. Производство фармацевтических препаратов занимает 10–15 лет и влечет затраты 1,5–2 млрд. долларов. Аферез может послужить для проверки фармацевтической гипотезы, а исследования в этом случае можно успеть провести за 2–3 года и потратить не более 150–200 тысяч долларов.
Давайте разберемся с некоторыми методами и разновидностями сорбционных колонок, которые применяют для лечения конкретных заболеваний.
ЛНП-аферез
Это метод очищения крови, в основе которого — удаление из кровотока липопротеинов низкой плотности (ЛНП) и снижение концентрации «плохого» холестерина. Чем же именно «плох» холестерин и какой именно, рассказывается в статье «Хороший, плохой, злой холестерин» [49], ну а подробнее о борьбе с ним методами афереза мы расскажем в следующей публикации этого спецпроекта. ЛНП-аферез применяют для лечения людей с семейной гиперхолестеринемией — это генетическое заболевание, приводящее к развитию атеросклероза уже в детском возрасте. В процессе плазму крови пропускают через колонку, где апоВ-содержащие липопротеины связываются с сорбентом по аффинному принципу. На колонке остаются только ЛНП — носители «плохого» холестерина, который образует атеросклеротические бляшки в стенках сосудов.
Есть холестерин хороший, есть плохой, а есть лишний
Важным толчком для ЛНП-афереза послужила необходимость лечения СГХС. Уже в 1981 году профессор В. Стоффель и доктор Х. Борберг создали сорбент с иммобилизованными антителами к основному белку ЛНП — аполипопротеину В100. Первые процедуры были связаны с большим риском заражения — еще не были отработаны методы приготовления сорбента, поэтому сохранялась высокая вероятность попадания в кровь микроорганизмов из окружающей среды. Следом, в 1986 году, отечественными учеными лаборатории гемодиализа и плазмафереза КНЦ (руководитель проф. В.В. Кухарчук) был разработан сорбент на основе антител для сорбции ЛНП. Колонки с этим сорбентом показали высокую эффективность для лечения детей с тяжелыми формами атеросклероза и СГХС.
Сегодня ЛНП-аферез используется в основном для пациентов с СГХС. За один сеанс лечения происходит снижение уровня липидов в крови более чем на 60%, а в сочетании со специальными препаратами — до 80%. В ходе такого лечения улучшается микроциркуляция крови в капиллярах и сосудах, что положительно отражается на самочувствии и функциональном состоянии пациентов [8].
Помимо лечения семейной гиперхолестеринемии, ЛНП-аферез широко используют:
Лп(а)-аферез
Это частный случай афереза липопротеинов, при котором с сорбентом связывается липопротеин (а), а показание к применению — также сердечно-сосудистые заболевания. Лп(а) имеет схожую структуру с ЛНП, но обладает большей атерогенностью, чем ЛНП, а также имеет сродство к фибриногену. Эти свойства Лп(а) повышают риск образования тромбов, и, как следствие, инфаркта миокарда. В 1986 году во Всесоюзном Кардиологическом Научном Центре был создан уникальный сорбент для удаления липопротеина (а) из плазмы крови человека. Колонки на основе сорбента, специфичного к Лп(а), до сих пор не имеют аналогов в мире.
Ig-аферез
Вслед за ЛНП-аферезом возник аферез иммуноглобулинов, или Ig-аферез. Этот метод основан на удалении из плазмы иммуноглобулинов классов G и M, а также иммунных комплексов на их основе [50]. Ig-аферез применяется для терапии пациентов с миастенией, рассеянным склерозом [14], системной красной волчанкой [16], хронической демиелинизирующей полиневропатией [51], гемофилией [52], [53], ревматоидным артритом [15], а также при подготовке к процедуре трансплантации и при синдроме отторжения, вызванного образованием антител. Наиболее активно в Ig-аферезе используются сорбенты с иммобилизованным бактериальным белком А и поликлональными антителами против IgG человека.
AB0-аферез
После создания Ig-афереза ученые взялись за решение главной проблемы донорства — создание «универсальной» крови, которая не будет восприниматься организмом реципиента как чужеродная. Однако воплощение на практике простой идеи удаления антител из крови и из организма оказалось весьма затруднительным — ни плазмообмен, ни каскадная плазмофильтрация, ни Ig-аферез не подходили под требования трансплантологии. Вопросом создания специфических сорбентов против антител к АВО антигенам занялись в Институте биоорганической химии имени М.М. Шемякина и Ю.А. Овчинникова. Однако сорбенты «Аллотран-А» и «Аллотран-В», хотя и обладали высокой связывающей аффинностью к антигенам групп крови, не нашли применения.
В настоящее время при AB0-аферезе применяют анти-A/B-специфические колонки для удаления анти-АВ0-антител — без побочных эффектов, присущих плазмаферезу. Проходя через колонку, анти-А/В антитела связываются с сорбентом, и в кровоток пациента поступает подходящая «универсальная» кровь, которая не будет восприниматься организмом как чужеродная. Используя данную технологию с 1996 года, более чем 5000 пациентам проведена трансплантация несовместимой почки.
Еще одна область применения AB0-афереза — терапия красноклеточной аплазии после пересадки костного мозга у пациентов с острым миелобластным лейкозом [1]. [54].
Словарь
Аферез: технология, которая не стоит на месте
Методы терапевтического афереза не только оправданы, но и необходимы в тех случаях, когда для лечения недостаточно медикаментозной терапии, либо пациенты невосприимчивы к лекарствам или даже не переносят их. В настоящее время аферез широко применяют для лечения сердечно-сосудистых и аутоиммунных заболеваний, в акушерстве и гинекологии, при трансплантации органов, в ревматологии, при острой интоксикации и в отделениях интенсивной терапии для лечения сепсиса, септического шока, острой почечной и печеной недостаточности, цитокинового шторма. Терапевтический аферез помогает улучшить качество жизни неизлечимо больных и спасти пациентов при тяжелых осложнениях в ходе лечения.
Развитие методов терапевтического афереза прошло длинный путь: технология последовательно улучшалась, что повышало уровень жизни больных. На этом прогресс не останавливается: исследователи ведут постоянный поиск новых терапевтических мишеней для афереза. Благодаря развитию технологии было спасено уже множество жизней. Технология терапевтического афереза улучшает и продлевает жизнь неизлечимо больных, помогает справиться с сепсисом и имеет множество перспектив для развития.
В следующих частях спецпроекта мы подробно расскажем об использовании афереза для лечения гиперхолестеринемии, а также осветим его применение для новой терапевтической мишени — внеклеточных ДНК.
Партнер спецпроекта — научно-производственная фирма ПОКАРД
Компания на протяжении почти 30 лет занимается разработкой, производством и внедрением в клиническую практику продуктов для терапевтического афереза. Сегодня в арсенале компании — пять видов высокотехнологичных сорбционных колонок собственного производства, успешно применяемых для лечения широкого спектра заболеваний, которые сегодня используются не только в терапевтической практике, но и в отделениях интенсивной терапии. ПОКАРД — эксклюзивный дистрибьютор уникальных фильтров для очистки крови компании Kawasumi Laboratories Inc. (Япония) в России.
Специалисты Покарда имеют многолетний опыт работы, знакомы со всеми аспектами проведения процедур экстракорпоральной гемокоррекции и готовы поделиться своими знаниями и обучить работе с новыми методами. Компания оказывает помощь не только на этапе внедрения технологии, но и на протяжении всей работы с нашими продуктами дальнейшем.
Миссия компании
Развитие и внедрение технологий терапевтического афереза в практическое здравоохранение, поддержание высокого статуса и международного признания отечественной науки и медицины в области экстракорпоральных технологий
Контакты
Материал предоставлен партнером — НПФ «ПОКАРД»