Для чего используют этиловый спирт
Спирт этиловый
Спирт этиловый: инструкция по применению
Применение Этилового спирта
В медицине раствор этилового спирта используют как антисептик: ним протирают кожу на месте прокола перед взятием крови на анализ. Также ним обрабатывают руки хирурги перед операцией. Большое количество этанола использует химическая промышленность. Из него делают уксусную кислоту, этилацетат, диэтиловый эфир (наркоз) и токсичное вещество тетраэтилсвинец для добавки в топливо. Этиловый спирт – отличный растворитель. Его используют в парфюмерии как основу духов, в органической химии для получения медицинских растворов. Этанол также является сравнительно недорогим топливом – на нем в смеси с бензином ездят автомобили.
Раствор Этилового спирта
В лечебных целях применяют 33, 40, 70, 90 и 95% раствор. Этанол расширяет кровеносные сосуды, понижая давление и вызывая покраснение кожи, убивает микробы. Действие спирта местно зависит от концентрации раствора. Очень концентрированные оказывают дубящее действие (восстанавливают целостность кожи, уменьшают выраженность экссудативных процессов), прижигающее действие, вытягивают воду из отекших тканей, а менее концентрированные проникают в глубину тканей и оказывают раздражающее действие. 70-95% растворами стерилизуют инструменты и поверхности тела. Самый концентрированный раствор используют ингаляционно при отеке легких. Также он может служить растворителем для удаления токсичных веществ, красок с поверхности тела. При воспалении уха его закапывают спиртом. Водку (40% спирт) можно принимать внутрь при шоковых состояниях, обморожениях, переохлаждениях, страхе, волнении, использовать как противомикробное средство при пневмонии, гангрене, сепсисе. В сочетании с солью этанол принимают внутрь при инфекционных заболеваниях ЖКТ.
Спирт этиловый: оригинальная инструкция по применению
Применяют наружно в виде примочек как средство противовоспалительной консервативной терапии начальных стадий фурункулов (острого гнойно-некротического воспаления волосяного мешочка), панарициев (острого гнойного воспаления тканей пальца), инфильтратов (уплотнений), маститов (воспаления молоковыносящих протоков молочной железы).
Примочки накладывают 3-5 раз в день по 15 мин.
Используют в качестве антисептика (обеззараживающего средства) для обеззараживания рук хирурга (способы Фербрингера, Альфреда и др.), а также для обработки операционного поля, особенно у лиц с повышенной чувствительностью к другим антисептикам, у детей и при операциях на областях с тонкой кожей у взрослых (шея, лицо). В качестве раздражающего средства рекомендуют для обтираний и компрессов.
При альвеолярном отеке легких любого происхождения назначают ингаляции паров 96% спирта этилового в качестве пеногасителя.
Пары 70-96% спирта этилового вводятся через носовой катетер (специальную полую трубку); при масочном способе используют 40-50% спирт.
Каждые 30-45 минут для предотвращения интенсивного всасывания и появления возбуждающего действия паров спирта следует вдыхать кислород или 30-50% кислородно-воздушную смесь.
Терапевтическое действие начинается не ранее чем через 10-15 мин ингаляции, полный терапевтический эффект наступает в среднем через 1-1,5 часа.
При быстром нарастании дыхательной недостаточности, а также при сочетании отека легких с шоком ингаляция неэффективна.
Для устранения альвеолярной гипоксии у таких больных рекомендуется искусственная вентиляция легких через интубационную трубку или трахеостому с дополнительным сопротивлением на вдохе.
В результате уменьшается венозный приток к правому предсердию, повышается альвеолярное давление (давление воздуха в легких), затрудняется пропотевание жидкости из легочных капилляров (мельчайших сосудов), улучшается диффузия (проникновение) кислорода через альвеолярно-каппилярную мембрану (через ткань, отделяющую легочные капилляры от воздуха), нормализуется гидростатическое давление в малом (легочном) круге кровообращения. Однако неотложная терапия с использованием респираторов при острой дыхательной недостаточности, возникшей в результате поражения сердца, чаще всего мало эффективна.
— аллергические реакции;
— ожоги кожи;
— гиперемия и болезненность кожи в месте наложения компресса.
При наружном применении частично всасывается через кожу и слизистые оболочки и может оказывать системное токсическое действие (угнетение ЦНС).
Абсолютных противопоказаний к применению спирта при отеке легких нет.
Относительными противопоказаниями являются психомоторное возбуждение и некупированный (не устраненный) болевой синдром при инфаркте миокарда.
В этом случае ингаляции спирта переносятся больными тяжело и они малоэффективны.
Поэтому применению пеногасителей при инфаркте миокарда должно предшествовать введение средств для наркоза, анальгетических и антигистаминных препаратов.
Спирт этиловый повышает чувствительность организма к транквилизаторам, а нейтролептики усиливают вызываемое им опьянение.
При сочетании спирта этилового с пероральными противодиабетическими средствами производными сульфонилмочевины развивается гипогликемическая кома (потеря сознания, характеризующаяся полным отсутствием реакции организма на внешние раздражители, вследствие пониженного содержания сахара в крови).
Имипрамин, ингибиторы МАО повышают токсичность спирта этилового, снотворные средства способствуют значительному угнетению дыхания, бутадион продлевает действие спирта вследствие задержки его окисления.
Антабусный эффект вызванный угнетением активности ацетальдегидрогеназы (фермента, участвующего в разложении спирта), может быть вызван фенобарбиталом, фенацитином, амидопирином, бутамидом, изониазидом и бутадиеном.
Спирт этиловый усиливает токсичность (повреждающее действие) нитрофуранов и способствует проявлению их антабусоподобного действия, снижает эффективность тиамина.
При приеме внутрь инактивирует (подавляет активность) действие антибиотиков.
C осторожностью: беременность, период лактации, детский возраст.
Этанол при наружном применении частично всасывается через кожу и слизистые оболочки, что нужно учитывать при его у беременных женщин и в период лактации.
Явления передозировки при наружном применении препарата маловероятны.
В защищенном от света месте, при температуре 12–15 °C, в хорошо укупоренной таре, вдали от источников огня.
Хранить в недоступном для детей месте.
1 флакон Этилового спирта содержит смесь этанола с водой, содержащая по объему 70% или 95% этилового спирта.
Спирт этиловый отзывы:
Вот не могу понять, какие собственно говоря, могут быть отзывы у этилового спирта. Это же спирт про него знают даже дети. Все знают, что это прекрасный антисептик, убивающий практически самые различные бактерии, которые можно себе представить. Я часто хожу в различные походы и всегда беру с собой небольшой пузырек спирта на всякий случай
я работаю продавцом-консультантом в ювелирном салоне и спирт мне нужен всегда для обработки сережек и мочки уха при примерке изделия. Это отличный антисептик, он обеззараживает и покупатели могут не беспокоиться за свое здоровье
Спирт

Спирт и его виды
Именно английское «Spirit» лежит в основании русского названия «спирт». Это вещество представляет собой органический продукт (производное углеводов), в химической формуле которого содержится гидроксильная группа. Существуют разные классификации спиртов. Согласно одной из них различают одноатомные, двухатомные и многоатомные вещества. Также химики группируют их на ненасыщенные, насыщенные и ароматические. Еще одна классификация предусматривает разделение спиртов на первичные и вторичные.
Простой спирт – это жидкость без цвета, но с характерным запахом и вкусом, легко растворяемая водой в любых пропорциях. И чем больше атомов в спиртах, тем легче они соединяются с водой. А вот для маслянистых и жиросодержащих веществ спирт и сам служит растворителем.
В природе это вещество содержится, как правило, в составе эфирных масел. В листьях многих растений содержится метиловый спирт. После брожения органических продуктов образуется этиловый спирт. Кстати, к этой категории веществ относят также и некоторые витамины, например, А, D, В8.
Химики определяют спирт, как вещество, полученное в результате гидрогенизации окиси углерода под воздействием катализаторов. Чаще всего в разных сферах жизнедеятельности используют такие спирты:
Но сегодня больше внимания мы уделим именно этиловому веществу, которое широко используется в пищевой промышленности, медицине, косметологии.
Как изготовляют этанол

Для пищевой промышленности подходит спирт, полученный после сбраживания сахаристых веществ. Как правило, в таком случае сырьем служат ягоды, фрукты, кукуруза, картофель, тростниковый сахар, рис, крахмал. Для «запуска» реакции брожения используют дрожжи, ферменты и бактерии.
Процесс «рождения» спиртов состоит из нескольких этапов:
Но несмотря на то что теоретически изготовления алкоголя выглядит довольно просто, повторить весь этот процесс в домашних условиях, да еще и создать спирт правильной концентрации (от 96 до 100 об.) довольно проблематично.
Характеристика этилового спирта
Этиловый спирт, известный во всем мире по молекулярной формуле С2Н5ОН, представляет собой бесцветную жидкость с точкой кипения в 78 градусов по Цельсию. Вещество обладает резким запахом. Горит бездымным синим пламенем, которое при дневном свете не всегда заметно. Физические характеристики вещества определяются наличием гидроксильной группы и длиной углеродной цепи. Этанол служит универсальным растворителем для разных веществ, таких как уксусная кислота, ацетон, бензол, тетрахлорид, хлороформ, этиленгликоль.
Польза в пищевой промышленности

Чем полезен
Чтобы адекватно оценить роль спирта в нашей жизни, недостаточно вспоминать только пищевую и ликероводочную промышленность, где этанол является главным компонентом алкогольных напитков. Применение этой субстанции куда шире. Без этого вещества трудно обойтись в медицине, химической отрасли, при производстве парфюмов и косметики.
Да и это далеко не все, а только основные сферы применения этиловой жидкости.
Терапевтические свойства этанола
Как говорят врачи, спиртное одновременно является и тонизирующим средством, и ядом. Разница заключается только в дозе принятого вещества. Есть мнение, что умеренное потребление напитков, в составе которых содержится этанол, неплохо для сердечно-сосудистой системы, они защищают от образования камней в желчном пузыре и диабета. Но достаточно перейти черту между «умеренное употребление» и «злоупотребление», как вероятность развития рака, болезней органов пищеварительной и нервной системы, возрастает в несколько раз.
 Антисептик
Антисептик
В фармакологии это вещество служит универсальным дезинфицирующим средством. Антибактериальные гели почти на 62 % состоят из этанола. Он эффективно убивает большинство бактерий и грибов, а также некоторые вирусы.
Вещество-антидот
Именно этиловый спирт применяют в качестве антидота при некоторых отравлениях. В частности, он эффективен для устранения последствий передозировки метанола или этиленгликоля.
Для сердечников
Недавнее исследование, проведенное учеными из Бостонского университета, доказывает, что этанол в небольших количествах снижает риск развития ишемической болезни сердца. Похожий эффект ученые заметили и в случае с раковыми заболеваниями. Но исследователи отметили и другую, не столь утешительную, сторону спиртовой темы: больше всего самоубийств было сделано под воздействием алкоголя. А на фоне частого потребления спиртного развивается много серьезных болезней.
С биологической точки зрения идея того, что спирт защищает от кардиоболезней, имеет смысл. Умеренное потребление алкоголя повышает уровень липопротеинов высокой плотности (так называемого хорошего холестерина), а они, в свою очередь, снижают риск сердечно-сосудистых заболеваний. Кроме того, некоторые химические процессы, запускаемые в организме под воздействием спирта, улучшают свертываемость крови, повышают чувствительность к инсулину, препятствуют образованию мелких тромбов, которые могут блокировать кровоток к сердцу или головному мозгу.
Боль в суставах
Растирание спиртовыми настойками, обладающими согревающим эффектом, помогает снять боль в суставах. Наружные препараты на этаноле облегчают боль в мышцах.

Умеренные дозы алкоголя: кому и сколько
Часто можно услышать, что потребление алкоголя в умеренных дозах не вредит организму. Но как понять, что такое «умеренная доза»? Диетологи рассчитали приблизительную безопасную норму спирта для здоровых взрослых людей. Она составляет примерно 44 мл этилового спирта, что соответствует 355 мл пива и 148 мл вина.
Этанол в качестве лекарства
 Настой для лечения ангины, простуды, бронхита
Настой для лечения ангины, простуды, бронхита
Взять в разных долях (примерно по 100 г) календулы, каланхоэ и эвкалиптовых листьев. Измельченные растения залить спиртом (жидкость должна покрыть растения). Настаивать 72 часа в темном месте. Избавиться от болезней поможет полоскание горла: 1 часть настойки разбавить 10 частями воды. Полоскать горло трижды в день.
Желчегонный спиртовой настой
На протяжении 14 дней настаивать плоды барбариса (40 г свежих ягод смешать с 40 г высушенных). Употреблять лекарство 3 раза в день по 20-25 капель на 50 мл воды. Курс лечения – не меньше 2 недель.
Сосудосуживающая настойка
Половиной литра спирта залить примерно 10 конских каштанов. После 2-недельной выдержки спиртовую настойку втирать массажными движениями в места варикозных сосудов. Для усиления эффекта это же средство принимать внутрь – по 30 капель 3 раза в сутки. Эффект лечения станет заметным уже через месяц.
Опасные свойства
С опасными свойствами спиртов в первую очередь сталкиваются люди, работающие с их испарениями. Чрезмерное пребывание в таких условиях вызывает состояние, близкое к наркотическому опьянению. Более длительный контакт с парами метанола или изопропанола (через 8-12 часов) может послужить причиной летаргического сна или даже летального исхода.
Этиловый спирт хоть и применяется в пищевой промышленности, но также небезопасен. Он быстро попадает в кровоток (организм всасывает вещество через слизистые покровы желудка и кишечника). Этанол не самым лучшим образом сказывается на работе нервной системы, вызывая то угнетение, то слишком сильное возбуждение.
Также стоит знать, что после каждого приема алкоголя (даже в не очень больших дозах) отмирает часть клеток головного мозга. И это уже научно доказанный факт. Убитые алкоголем частицы коры головного мозга из организма выводятся вместе с мочой.
Под воздействием спиртов страдают практически все внутренние органы. Больше всего «достается» печени, почкам, поджелудочной, желчному пузырю. Чрезмерное потребление алкоголя вызывает:
Этанол и беременность
Фолиевая кислота, или витамин В9, один из самых важных элементов для беременных. Все дело в том, что этот витамин способствует правильному развитию спинного мозга эмбриона, а затем на протяжении всей беременности влияет на правильность формирования плода. Фолиевая кислота необходима для создания ДНК – молекулы, которая собственно и несет в себе код продолжения жизни. Помимо этого, правильное деление клеток в уже сформировавшемся организме также станет невозможным без достаточного потребления фолиевой кислоты.
Алкоголь блокирует способности организма поглощать витамин В9 и деактивирует вещество, уже содержащееся в тканях и клетках. Ученые предполагают, что развитие рака молочной железы и некоторых других видов онкозаболеваний – это результат нехватки фолиевой кислоты на фоне злоупотребления алкоголем.
Передозировка алкоголя

Эффект алкогольного отравления усиливается еще больше, если принимать спирт на фоне некоторых медпрепаратов. Не стоит сочетать этанол с антидепрессантами, парацетамолом, обезболивающими или успокоительными препаратами, противосудорожными лекарствами.
И полностью отказаться от спирта важно:
Алкогольные нормы
Не столь важно, какой алкогольный напиток потребляет человек, поскольку в любом из вариантов присутствует спирт. Важно, как именно употребляется алкоголь. Если на протяжении субботы выпить 7 порций спиртного, это вовсе не является эквивалентом потребления безопасной нормы: 1 порция напитка в день. В обоих случаях влияние на организм будет абсолютно разным. Но, как показывают исследования, даже если алкоголь в небольших количествах появится в рационе 3-4 раза в неделю – это уже проблема. Результат – повышение риска развития инфаркта миокарда в 3-4 раза. Женщины, в чьем рационе ежедневно появляются 2 спиртные напитка (даже слабоалкогольные) почти на 40 % больше подвержены риску развития рака молочной железы.
Спирт и гены
Генетика, как утверждают исследователи, играет не последнюю роль в определении алкогольных предпочтений. Правило наследования, открытое Грегором Менделем, работает и в случае с алкоголизмом.
В человеческом организме вырабатывается фермент алкогольдегидрогеназа, который помогает усваивать спирт. И этот энзим, как правило, представлен в организме в двух вариациях: первый позволяет более быстро разрушить алкоголь, второй делает это медленно. Люди, употребляющие спиртное в умеренных количествах, вырабатывают оба варианта фермента. Злоупотребляющие спиртным организмы имеют только один из вариантов, как правило, «быстродействующий». В таком случае фермент расщепляет спирт еще до того, как организм успел получить от него пользу и единственное влияние спиртного на тело – отрицательное.
Этанол
Этанол (этиловый спирт, метилкарбинол, винный спирт или алкоголь, часто в просторечии просто «спирт») — одноатомный спирт с формулой C2H5OH (эмпирическая формула C2H6O), рациональная формула: CH3-CH2-OH, аббревиатура EtOH, второй представитель гомологического ряда одноатомных спиртов, при стандартных условиях летучая, горючая, бесцветная прозрачная жидкость.
Действующий компонент алкогольных напитков является депрессантом — психоактивным веществом, угнетающим центральную нервную систему человека.
Этиловый спирт также используется как топливо, в качестве растворителя, как наполнитель в спиртовых термометрах и как дезинфицирующее средство (или как компонент его).
Содержание
Получение
Существует 2 основных способа получения этанола — микробиологический (спиртовое брожение) и синтетический (гидратация этилена).
Брожение
Известный с давних времён способ получения этанола — спиртовое брожение органических продуктов, содержащих углеводы (виноград, плоды и т. п. ) под действием ферментов дрожжей и бактерий. Аналогично выглядит переработка крахмала картофеля, риса, кукурузы. Источником получения топливного спирта является вырабатываемый из тростника сахар-сырец и проч. Реакция эта довольно сложна, её результат можно выразить уравнением:
Раствор, получаемый в результате брожения, содержит не более 15 % этанола, так как в более концентрированных растворах дрожжи нежизнеспособны. Полученный таким образом этанол нуждается в очистке и концентрировании, обычно путём дистилляции.
Для получения этанола этим способом наиболее часто используют различные штаммы дрожжей вида Saccharomyces cerevisiae, в качестве питательной среды предварительно обработанные древесные опилки и/или раствор, полученный из них.
Промышленное производство спирта из биологического сырья
Современная промышленная технология получения этилового спирта из пищевого сырья включает следующие стадии:
Отходами бродильного производства являются углекислый газ, барда, эфиро-альдегидная фракция, сивушный спирт и сивушные масла.
Спирт, поступающий из брагоректификационной установки (БРУ), не является безводным, содержание этанола в нём до 95,6 %. В зависимости от содержания в нём посторонних примесей, его разделяют на следующие категории:
Производительность современного спиртового завода составляет около 30 000—100 000 литров спирта в сутки.
Гидролизное производство
В промышленных масштабах этиловый спирт получают из сырья, содержащего целлюлозу (древесина, солома), которую предварительно гидролизуют. Образовавшуюся при этом смесь пентоз и гексоз подвергают спиртовому брожению. В странах Западной Европы и Америки эта технология не получила распространения, но в СССР (ныне в России) существовала развитая промышленность кормовых гидролизных дрожжей и гидролизного этанола.
Гидратация этилена
В промышленности, наряду с первым способом, используют гидратацию этилена. Гидратацию можно вести по двум схемам:
Эта реакция осложняется параллельной реакцией образования диэтилового эфира.
Очистка этанола
Перегонка освобождает этанол как от легколетучих, так и от тяжёлых фракций органических веществ (кубовый остаток).
Абсолютный спирт
Свойства
Физические свойства
В обычных условиях представляет собой бесцветную, легкоподвижную, летучую жидкость с характерным запахом и сладковато-жгучим вкусом.
Является хорошим растворителем многих органических веществ и некоторых неорганических солей.
| Молекулярная масса | 46,069 а. е. м. |
| Температура плавления | −114,15 °C |
| Температура кипения | 78,39 °C |
| Критическая точка | 241 °C (при давлении 6,3 МПа) |
| Растворимость | Смешивается в произвольных отношениях с бензолом, водой, глицерином, диэтиловым эфиром, ацетоном, метанолом, уксусной кислотой, хлороформом |
| Показатель преломления | Показатель преломления (для D-линии натрия) 1,3611 (при 20 °C) (температурный коэффициент показателя преломления −4,0⋅10 −4 /°C, почти постоянный в интервале температур 10—30 °C ) |
| Стандартная энтальпия образования ΔH | −234,8 кДж/моль (г) (при 298 К) |
| Стандартная энтропия образования S | 281,38 Дж/моль·K (г) (при 298 К) |
| Стандартная мольная теплоёмкость Cp | 1,197 Дж/моль·K (г) (при 298 К) |
| Энтальпия плавления ΔHпл | 4,81 кДж/моль |
| Энтальпия кипения ΔHкип | 839,3 кДж/моль |
Смесь по массе 95,57 % этанола и 4,43 % воды является азеотропной, т. е. не разделяется при перегонке, кипит при нормальном давлении при температуре 78,174 °C, в то время как абсолютированный этанол имеет более высокую точку кипения 78,39 °C.
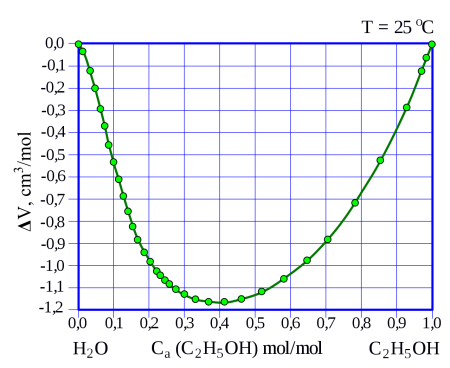
С водой этанол смешивается в произвольном отношении, при смешивании наблюдается значительное, до нескольких процентов уменьшение объёма смеси относительно исходного суммарного объёма чистых веществ, например, при смешивании 50 мл этанола с 50 мл воды образуется 97 мл раствора. Также смешивание сопровождается некоторым нагревом смеси.
Абсолютный этанол затвердевает при температуре −114,5 °C. Температура плавления смесей этанола с водой уменьшается при увеличении концентрации этанола в растворе и достигает минимума при массовой концентрации этанола в воде равной 93,5 % — эвтектики этанол-вода, имеющей температуру плавления −118 °C. При низких температурах, ниже −20 °С водный раствор этанола (96 %) практически не испаряется и превращается в вязкую жидкость. При −70 °C он становится ещё более вязким и по текучести напоминает густой мёд.
Химические свойства
Типичный представитель одноатомных спиртов.
Горюч. Легко воспламеняется. При достаточном доступе воздуха горит (за счёт его кислорода) светлым голубоватым пламенем, образуя терминальные продукты окисления — диоксид углерода и воду:
Ещё энергичнее эта реакция протекает в атмосфере чистого кислорода.
При определённых условиях (температура, давление, катализаторы) возможно и контролируемое окисление (как элементным кислородом, так и многими другими окислителями) до ацетальдегида, уксусной кислоты, щавелевой кислоты и некоторых других продуктов, например:
Обладает слабо выраженными кислотными свойствами, в частности, подобно кислотам взаимодействует со щелочными металлами, а также магнием, алюминием и их гидридами, выделяя при этом водород и образуя солеподобные этилаты, являющиеся типичными представителями алкоголятов:
Обратимо реагирует с карбоновыми и некоторыми неорганическими кислородсодержащими кислотами с образованием сложных эфиров:
С галогеноводородами (HCl, HBr, HI) вступает в обратимые реакции нуклеофильного замещения:
Без катализаторов реакция с HCl идет относительно медленно; значительно быстрее — в присутствии хлорида цинка и некоторых других кислот Льюиса.
Вместо галогеноводородов для замещения гидроксильной группы на галоген могут быть использованы галогениды и галогеноксиды фосфора, тионилхлорид и некоторые другие реагенты, например:
Сам этанол также обладает нуклеофильными свойствами. В частности, он относительно легко присоединяется по активированным кратным связям, например:
реагирует с альдегидами с образованием полуацеталей и ацеталей:
При умеренном (не выше 120 °C) нагревании с концентрированной серной кислотой или другими водоотнимающими средствами кислотного характера образует диэтиловый эфир:
При более сильном нагревании с серной кислотой, а также при пропускании паров над нагретым до 350÷500 °C оксидом алюминия происходит более глубокая дегидратация. При этом образуется этилен:
При использовании катализаторов, содержащих наряду с оксидом алюминия высокодисперсное серебро и другие компоненты, процесс дегидратации может быть совмещён с контролируемым окислением этилена элементным кислородом, в результате чего с удовлетворительным выходом удается реализовать одностадийный процесс получения окиси этилена:
В присутствии катализатора, содержащего оксиды алюминия, кремния, цинка и магния, претерпевает серию сложных превращений с образованием в качестве основного продукта бутадиена (реакция Лебедева):
В 1932 году на основе этой реакции в СССР было организовано первое в мире крупнотоннажное производство синтетического каучука.
В слабощелочной среде образует иодоформ:
Эта реакция имеет некоторое значение для качественного и количественного определения этанола в отсутствии других веществ, дающих подобную реакцию.
Пожароопасные свойства
Легковоспламеняющаяся бесцветная жидкость; давление насыщенного пара, кПа: lg p = 7.81158-1918.508/(252.125+t) при температуре от −31 до 78°С; теплота сгорания — 1408 кДж/моль; теплота образования −239,4 кДж/моль; температура вспышки 13°С (в закрытом тигле), 16°С (в открытом тигле); температура воспламенения 18°С; температура самовоспламенения 400°С; концентрационные пределы распространения пламени 3,6—17,7 % объёма; температурные пределы распространения пламени: нижний 11°С, верхний 41°С; минимальная флегматизирующая концентрация, % объёма: CO2 — 29.5, H2O — 35.7, N2 — 46; максимальное давление взрыва 682 кПа; максимальная скорость нарастания давления 15,8 МПа/с; скорость выгорания 0,037 кг/(м 2 •с); максимальная нормальная скорость распространения пламени — 0,556 м/с; минимальная энергия зажигания — 0,246 МДж; минимальное взрывоопасное содержание кислорода 11,1 % объёма.
Применение
Топливо
Первым использовал этанол в качестве моторного топлива Генри Форд, который в 1880 г. создал первый автомобиль, работающий на этаноле. Возможность использования спиртов в качестве моторного топлива была показана также в 1902 г., когда на конкурсе в Париже были выставлены более 70 карбюраторных двигателей, работающих на этаноле и смесях этанола с бензином.
Этанол может использоваться как топливо, в т. ч. для ракетных двигателей (так, 75%-й водный этанол использовался в качестве топлива в первой в мире серийной баллистической ракете — немецкой «Фау-2» и ранних советских ракетах конструкции Королёва — от Р-1 до Р-5), двигателей внутреннего сгорания, бытовых, походных и лабораторных нагревательных приборов (т. н. «спиртовок»), грелок для туристов и военнослужащих (каталитическое автоокисление на платиновом катализаторе). Ограниченно (в силу своей гигроскопичности) используется в смеси с классическими нефтяными жидкими топливами. Применяется для выработки высококачественного топлива и компонента бензинов — Этил-трет-бутилового эфира, более независимого от ископаемой органики, чем МТБЭ.
Химическая промышленность
Медицина
Парфюмерия и косметика
Является универсальным растворителем различных веществ и основным компонентом духов, одеколонов, аэрозолей и т. п. Входит в состав разнообразных средств, включая зубные пасты, шампуни, средства для душа, и т. д.
Пищевая промышленность
Наряду с водой, является основным компонентом спиртных напитков (водка, вино, джин, пиво и др.). Также в небольших количествах содержится в ряде напитков, получаемых брожением, но не причисляемых к алкогольным (кефир, квас, кумыс, безалкогольное пиво и др.). Содержание этанола в свежем кефире ничтожно (0,12 %), но в долго стоявшем, особенно в тёплом месте, может достичь 1 %. В кумысе содержится 1—3 % этанола (в крепком до 4,5 %), в квасе — от 0,5 до 1,2 %.
Растворитель для пищевых ароматизаторов. Может быть использован как консервант для хлебобулочных изделий, а также в кондитерской промышленности.
Зарегистрирован в качестве пищевой добавки E1510.
Энергетическая ценность этанола — 7,1 ккал/г.
Прочее
Применяется для фиксирования и консервирования биологических препаратов.
Мировое производство этанола
Производство этанола по странам, млн литров.
| Страна | 2004 | 2005 | 2006 | 2007 | 2008 | 2009 | 2010 |
|---|---|---|---|---|---|---|---|
| США | 13 362 | 16 117 | 19 946 | 24 565 | 34 776 | 40 068 | 45 360 |
| Бразилия | 15 078 | 15 978 | 16 977 | 18 972,58 | 24 464,9 | — | — |
| Евросоюз | — | — | — | 2 155,73 | 2 773 | — | — |
| Китай | 3 643 | 3 795 | 3 845 | 1 837,08 | 1 897,18 | — | — |
| Индия | 1 746 | 1 697 | 1 897 | 199,58 | 249,48 | — | — |
| Франция | 827 | 907 | 948 | — | — | — | — |
| Германия | 268 | 430 | 764 | — | — | — | — |
| Россия | 760 | 860 | 608 | 609 | 536 | 517 | 700 |
| ЮАР | 415 | 389 | 387 | — | — | — | — |
| Великобритания | 400 | 351 | 279 | — | — | — | — |
| Испания | 298 | 298 | 463 | — | — | — | — |
| Таиланд | 279 | 298 | 352 | 299,37 | 339,4 | — | — |
| Колумбия | — | — | 279 | 283,12 | 299,37 | — | — |
| Весь мир: | 40 710 | 45 927 | 50 989 | 49 524,42 | 65 527,05 | — | — |
Применение этанола в качестве автомобильного топлива
Топливный этанол делится на биоэтанол и этанол, полученный другими методами (из отходов пластмасс, синтезированный из газа и т. п.).
Биоэтанол — это жидкое этанолсодержащее топливо, получаемое специальными заводами из крахмал-, целлюлозно- или сахаросодержащего сырья по системе укороченной дистилляции (позволяет получать качество, достаточное для использования в качестве топлива). Содержит метанол и сивушные масла, что делает его совершенно непригодным для питья. Применяется в чистом виде (точнее в виде азеотропа 96,6 %), а чаще в смеси с бензином (так называемый газохол) или дизельным топливом. Производство и использование биоэтанола увеличивается в большинстве стран мира, как более экологичная и возобновляемая альтернатива нефти.
Полноценно использовать биоэтанол способны лишь автомобили с соответствующим двигателем или с универсальным Flex-Fuel (способен потреблять смеси бензин/этанол с любым соотношением). Бензиновый двигатель способен потреблять бензин с добавкой этанола не более 30 %, возможно также переоборудование обычного бензинового двигателя, но это экономически нецелесообразно.
Проблемой является недостаточная смешиваемость бензина и дизельного топлива с этанолом, из-за чего последний нередко выслаивается (при низких температурах всегда). Особенно эта проблема актуальна для России. Решения этой проблемы на данный момент не найдено.
Преимуществом смесей этанола с другими видами топлива перед «чистым» этанолом является лучшая зажигаемость, благодаря низкому содержанию влаги, тогда как «чистый» этанол (марка E100, с практическим содержанием C2H5OH 96,6 %) является неразделяемым дистилляцией азеотропом. Разделение же иными способами невыгодно. При добавлении этанола к бензину или дизелю происходит выслаивание воды.
В разных странах действуют следующие государственные программы применения этанола и содержащих его смесей на транспорте с двигателями внутреннего сгорания:
| Страна | Требования |
|---|---|
| Бразилия | 22—25 % этанола в бензине, 2 % в дизельном топливе, доступны высокоэтанольные марки (E85, E100), их процент на рынке плавно увеличивают. Основной источник — сахарный тростник. Около 45 % мирового производства. |
| США | На США приходится 44,7 % мирового производства топливного спирта. Внедряются марки смеси этанола и бензина (E85, E10). Предполагается ввести 20 % к 2020 году. |
| Венесуэла | 10 % этанола в бензине. |
| Евросоюз | До 6 % добавляется в обязательном порядке, внедряются этанольные марки E10 и выше. |
| Китай | Производит ежегодно 3 млн тонн к 2010 году. |
| Аргентина | Обязательна 5 % добавка этанола в любых марках бензина, внедряются марки с большим содержанием. |
| Таиланд | 5 % этанола является минимальным допустимым содержанием в бензине. |
| Украина | Законодательно установлено содержание 5 % этанола в бензине с 2013, и 7 % с 2014 года. На заправках широко продается топливо с содержанием биоэтанола от 30 до 37,2 % |
| Колумбия | 10%-я смесь в больших городах к сентябрю 2005 года. |
| Канада | 5%-я смесь с сентября 2010 года |
| Япония | Разрешено 3%-е содержание этанола в бензине и менее. |
| Индия | 20 % биотоплив к 2017 году. Сейчас 5 %. Производится из самого различного сырья, в частности из древесной стружки. |
| Австралия | Этанола в бензине не более 10 %, марка E10. |
| Индонезия | 10 % спирта в бензине. |
| Филиппины | E10 постепенно внедряется. |
| Ирландия | Марки E5-E10 достаточно широко применяются и продолжат внедряться. |
| Дания | Аналогично Ирландии. |
| Чили | Разрешено 2 % содержание этанола в автомобильном топливе. |
| Мексика | 3,2 % биотоплива в автомобильном топливе к 2012 году обязательно. В Америке самая неохотно внедряющая биотопливо страна. |
В США «Энергетический билль», подписанный президентом Бушем в августе 2005 года, предусматривает производство к 2012 году ежегодно 30 миллиардов литров этанола из зерна и 3,8 миллиардов литров из целлюлозы (стебли кукурузы, рисовая солома, отходы лесной промышленности).
Внедрение производства биотоплива является затратным процессом, однако дает экономике преимущества впоследствии. Так, например, строительство завода по производству этанола мощностью 40 млн галлонов даёт экономике (на примере США):
В 2006 г. этаноловая индустрия дала экономике США:
В 2006 году в США было переработано в этанол 2,15 миллиарда бушелей кукурузы, что составляет 20,5 % годового производства кукурузы. Этанол стал третьим по величине потребителем кукурузы после животноводства и экспорта. На этанол перерабатывается 15 % урожая сорго США.
Производство барды этаноловой промышленностью США, метрических тонн в сухом весе.
| 1999 | 2000 | 2001 | 2002 | 2003 | 2004 | 2005 | 2006 | 2020 прогноз |
|---|---|---|---|---|---|---|---|---|
| 2,3 млн. | 2,7 млн. | 3,1 млн | 3,6 млн. | 5,8 млн. | 7,3 млн. | 9,0 млн. | 12 млн. | 20 млн. |
Барда является вторичным кормовым сырьём, а также может быть использована для получения биогаза.
Автомобильный парк, работающий на этаноле
Смесь этанола с бензином обозначается буквой Е. Цифрой у буквы Е обозначается процентное содержание этанола. Е85 означает смесь из 85 % этанола и 15 % бензина.
Смеси до 20 % содержания этанола могут применяться на любом автомобиле. Однако некоторые производители автомобилей ограничивают гарантию при использовании смеси с содержанием более 10 % этанола. Смеси, содержащие более 20 % этанола, во многих случаях требуют внесения изменения в систему зажигания автомобиля.
Автопроизводители выпускают автомобили, способные работать и на бензине, и на Е85. Такие автомобили называются «Flex-Fuel». В Бразилии такие автомобили называют «гибридными». В русском языке названия нет. Большинство современных автомобилей либо изначально поддерживают использование такого топлива, либо опционально, по соответствующему запросу.
В 2005 году в США более 5 млн автомобилей имели гибридные двигатели. В конце 2006 г. в США эксплуатировалось 6 млн автомобилей с такими двигателями. Общий автопарк составляет 230 млн автомобилей.
1200 заправочных станций продают Е85 (май 2007). Всего в США автомобильное топливо продают около 170 000 заправочных станций.
В Бразилии около 29 000 заправочных станций продают этанол.
Экономичность
Себестоимость бразильского этанола (около 0,19 долларов США за литр в 2006 г.) делает его использование экономически выгодным.
Экологические аспекты
Биоэтанол как топливо часто называют «нейтральным» в качестве источника парниковых газов. Он обладает нулевым балансом диоксида углерода, поскольку при его производстве путём брожения и последующем сгорании выделяется столько же CO2, сколько до этого было взято из атмосферы использованными для его производства растениями. Однако ректификация этанола требует дополнительных затрат энергии, вырабатываемой одним из «традиционных» способов (в том числе и сжиганием ископаемого топлива).
В 2006 году применение этанола в США позволило сократить выбросы около 8 млн тонн парниковых газов (в CO2 эквиваленте), что примерно равно годовым выхлопам 1,21 млн автомобилей.
Безопасность и регулирование
Действие этанола на организм человека
В биохимии этанола существенную роль играет тот факт, что он образует растворы в широком диапазоне пропорций как с водой, так и с жирами. Является побочным продуктом метаболизма глюкозы, в крови здорового человека может содержаться до 0,01% эндогенного этанола.
В зависимости от дозы, концентрации, пути попадания в организм и длительности воздействия этанол также может обладать наркотическим и токсическим действием. Под наркотическим действием обозначается его способность вызвать кому, ступор, нечувствительность к боли, угнетение функций ЦНС, алкогольное возбуждение, привыкание, а также его наркозное действие. Под действием этанола происходит выделение эндорфинов в прилежащем ядре (Nucleus accumbens), у страдающих алкоголизмом также в орбитофронтальной коре (поле 10). Тем не менее с юридической точки зрения этиловый спирт наркотиком не признан, так как это вещество не включено в международный список контролируемых веществ конвенции ООН 1988 года. В определённых дозах к массе тела и концентрациях приводит к острому отравлению и смерти (смертельная разовая доза — 4—12 граммов этанола на килограмм массы тела).
Основной метаболит этанола ацетальдегид является токсичным, мутагенным и канцерогенным веществом. Существуют доказательства канцерогенности ацетальдегида в экспериментах на животных; кроме того, ацетальдегид повреждает ДНК.
Длительное употребление этанола может вызвать такие заболевания, как цирроз печени, гастрит, некротизирующий панкреатит, язва желудка, рак груди, рак желудка и рак пищевода (то есть является канцерогеном), гемолитическая анемия, артериальная гипертензия, инсульт, стать причиной внезапной смерти людей, страдающих ишемической болезнью сердца; может вызвать серьёзные нарушения обмена веществ. Алкоголь может увеличить риск рождения ребёнка с врождёнными аномалиями нервной системы и обусловить задержку роста.
Употребление этанола может вызвать оксидативное повреждение нейронов головного мозга, а также их гибель вследствие повреждения гемато-энцефалического барьера.
Злоупотребление алкогольными напитками может привести к клинической депрессии и алкоголизму.
Приём алкогольных напитков на фоне приёма лекарств очень нежелателен, так как алкоголь извращает действие лекарственных средств и вследствие этого становится опасен для жизни человека. Отрицательное влияние алкогольных напитков на результаты фармакотерапии многообразно и зависит от различных факторов: индивидуальных свойств больного, его чувствительности, тяжести заболевания, но во всех случаях у пациентов, принимающих лекарства и потребляющих алкоголь, эффективность фармакотерапии ослабляется, а порой и сводится на нет.
Этанол может в небольших количествах синтезироваться в просвете желудочно-кишечного тракта в результате процессов ферментации углеводной пищи микроорганизмами (условный эндогенный алкоголь). Существование биохимических реакций с синтезом этанола в тканях организма человека (истинно эндогенный алкоголь) полагается возможным, но не доказано к настоящему моменту. Количество эндогенного алкоголя редко превышает 0,18 промилле, что находится на границе чувствительности самых современных приборов. Обычный алкотестер такие количества определить не может.
Виды и марки этанола
Этимология названий
Для обозначения данного вещества используется несколько наименований. Технически наиболее правильным является термин этанол или этиловый спирт. Однако значительное распространение получили названия алкоголь, винный спирт или просто спирт, хотя спирты, или алкоголи — это более широкий класс веществ.
Этимология термина «этанол»
Названия этанол и этиловый спирт указывают на то, что данное соединение содержит в своей основе этил — радикал этана. При этом слово спирт (суффикс -ол) в названии указывает на содержание гидроксильной группы (-OH), характерной для спиртов.
Этимология названия «алкоголь»
Название алкоголь происходит от араб. الكحل аль-кухуль, означающего мелкий порошок, полученный возгонкой, порошкообразная сурьма, порошок для подкрашивания век. В средневековой латыни словом лат. alcohol обозначали порошки, дистиллированную воду.
Этимология слова «спирт»
В английском языке слово «спирт» в данном значении использовалось уже в середине XIII века, и только начиная с 1610 года слово «спирт» стало употребляться алхимиками для обозначения летучих веществ, что соответствует основному значению слова «spiritus» (испарения) в латинском языке. К 1670-м годам значение слова сузилось до «жидкостей с высоким процентным содержанием алкоголя», а летучие жидкости получили название эфиров.
См. также Этимология названия в статье «Спирты».