Для чего используют этан
Этан: способы получения и свойства
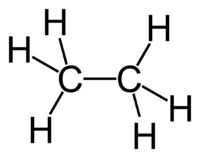
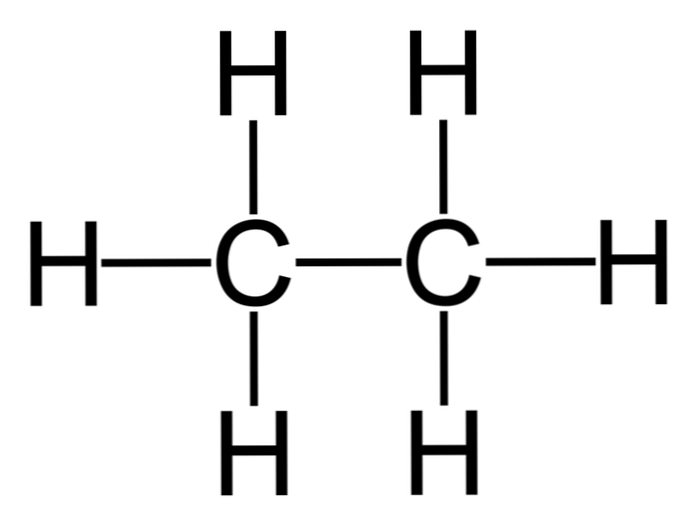
Этан C2H6 – это предельный углеводород, содержащий два атома углерода в углеродной цепи. Бесцветный газ без вкуса и запаха, нерастворим в воде и не смешивается с ней.
Гомологический ряд этана
Все алканы — вещества, схожие по физическим и химическим свойствам, и отличающиеся на одну или несколько групп –СН2– друг от друга. Такие вещества называются гомологами, а ряд веществ, являющихся гомологами, называют гомологическим рядом.
Продолжить гомологический ряд можно, последовательно добавляя группу –СН2– в углеводородную цепь алкана.
| Название алкана | Формула алкана |
| Метан | CH4 |
| Этан | C2H6 |
| Пропан | C3H8 |
| Бутан | C4H10 |
| Пентан | C5H12 |
| Гексан | C6H14 |
| Гептан | C7H16 |
| Октан | C8H18 |
| Нонан | C9H20 |
| Декан | C10H22 |
Общая формула гомологического ряда алканов CnH2n+2.
Первые четыре члена гомологического ряда алканов – газы, C5–C17 – жидкости, начиная с C18 – твердые вещества.
Строение этана
В молекулах алканов встречаются химические связи C–H и С–С.
Связь C–H ковалентная слабополярная, связь С–С – ковалентная неполярная. Это одинарные σ-связи. Атомы углерода в алканах образуют по четыре σ-связи. Следовательно, гибридизация атомов углерода в молекулах алканов – sp 3 :
Поэтому четыре гибридные орбитали углерода в алканах направлены в пространстве под углом 109 о 28′ друг к другу:
Это соответствует тетраэдрическому строению молекулы.
| Например, в молекуле этана C2H6 атомы водорода располагаются в пространстве в вершинах двух тетраэдров, центрами которых являются атомы углерода |
Изомерия этана
Для этана не характерно наличие изомеров – ни структурных (изомерия углеродного скелета, положения заместителей), ни пространственных.
Химические свойства этана
Этан – предельный углеводород, поэтому он не может вступать в реакции присоединения.
Для метана характерны реакции:
Разрыв слабо-полярных связей С – Н протекает только по гомолитическому механизму с образованием свободных радикалов.
Поэтому для этана характерны радикальные реакции.
Этан устойчив к действию сильных окислителей (KMnO4, K2Cr2O7 и др.), не реагирует с концентрированными кислотами, щелочами, бромной водой.
1. Реакции замещения
В молекулах алканов связи С–Н более доступны для атаки другими частицами, чем менее прочные связи С–С.
1.1. Галогенирование
Этан реагирует с хлором и бромом на свету или при нагревании.
При хлорировании этана сначала образуется хлорэтан:
Хлорэтан может взаимодействовать с хлором и дальше с образованием дихлорэтана, трихлорэтана, тетрахлорметана и т.д.
1.2. Нитрование этана
Этан взаимодействует с разбавленной азотной кислотой по радикальному механизму, при нагревании и под давлением. Атом водорода в этане замещается на нитрогруппу NO2.
Например. При нитровании этана образуется преимущественно нитроэтан:2. Дегидрирование этанаДегидрирование – это реакция отщепления атомов водорода. В качестве катализаторов дегидрирования используют никель Ni, платину Pt, палладий Pd, оксиды хрома (III), железа (III), цинка и др. При дегидрировании алканов, содержащих от 2 до 4 атомов углерода в молекуле, разрываются связи С–Н у соседних атомов углерода и образуются двойные и тройные связи.
3. Окисление этанаЭтан – слабополярное соединение, поэтому при обычных условиях он не окисляется даже сильными окислителями (перманганат калия, хромат или дихромат калия и др.). 3.1. Полное окисление – горениеЭтан горит с образованием углекислого газа и воды. Реакция горения этана сопровождается выделением большого количества теплоты. Уравнение сгорания алканов в общем виде: При горении этана в недостатке кислорода может образоваться угарный газ СО или сажа С. Получение этана1. Взаимодействие галогеналканов с металлическим натрием (реакция Вюрца)Это один из лабораторных способов получения этана из хлорметана или бромметана. При этом происходит удвоение углеродного скелета. 2. Декарбоксилирование солей карбоновых кислот (реакция Дюма)Реакция Дюма — это взаимодействие солей карбоновых кислот с щелочами при сплавлении. R–COONa + NaOH → R–H + Na2CO3 Декарбоксилирование — это отщепление (элиминирование) молекулы углекислого газа из карбоксильной группы (-COOH) или органической кислоты или карбоксилатной группы (-COOMe) соли органической кислоты. При взаимодействии пропионата натрия с гидроксидом натрия при сплавлении образуется этан и карбонат натрия: CH3–CH2 –COONa + NaOH → CH3–CH2 –H + Na2CO3 3. Гидрирование алкенов и алкиновЭтан можно получить из этилена или ацетилена: При гидрировании этилена образуется этан: При полном гидрировании ацетилена также образуется этан: 4. Синтез Фишера-ТропшаИз синтез-газа (смесь угарного газа и водорода) при определенных условиях (катализатор, температура и давление) можно получить различные углеводороды: Это промышленный процесс получения алканов. Синтезом Фишера-Тропша можно получить этан: 5. Получение этана в промышленностиДля чего используют этанНа нашем сайте собрано более 100 бесплатных онлайн калькуляторов по математике, геометрии и физике. Основные формулы, таблицы и теоремы для учащихся. Все что нужно, чтобы сделать домашнее задание! Не можете решить контрольную?! Характеристики и физические свойства этанаНе имеет вкуса. Не растворим в воде. Проявляет слабое наркотическое действие. Рис. 1. Строение молекулы этана. Таблица 1. Физические свойства этан. Плотность (20 o С), кг/м 3 Температура плавления, o С Температура кипения, o С Получение этанаВ больших объемах этан получают из попутного нефтяного газа и газов нефтекрекинга. В лабораторных условиях этан получают следующими способами: — гидрированием непредельных углеводородов — по реакции щелочного плавления солей одноосновных органических кислот — взаимодействием галогеналканов с металлическим натрием (реакция Вюрца) Химические свойства этанаВ обычных условиях этан не реагирует с концентрированными кислотами, расплавленными и концентрированными щелочами, щелочными металлами, галогенами (кроме фтора), перманганатом калия и дихроматом калия в кислой среде. Для этана наиболее характерны реакции, протекающие по радикальному механизму. Энергетически более выгоден гомолитический разрыв связей C-H и C-C, чем их гетеролитический разрыв. Все химические превращения этана протекают с расщеплением: Применение этанаЭтан используется как сырье в химической промышленности в основном для получения этилена. Примеры решения задач
Найдем количество вещества этана: Согласно уравнению реакции n(C2H6) : n(Cl2) = 1:1, значит,количество моль хлора равно: Тогда, масса хлора будет равна (молярная масса – 71 г/моль): | |||||
| Ответ | Масса хлора равна 14 г. |
| Задание | Рассчитайте объемы хлора и этана, приведенные к нормальным условиям, которые потребуются для получения дихлорэтана массой 10,5 г. |
| Решение | Запишем уравнение реакции хлорирования этана до дихлорэтана (реакция происходит под действием УФ-излучения): |
Рассчитаем количество вещества дихлорэтана (молярная масса равна – 99 г/моль):
По уравнению реакции найдем количество вещества хлора. n(C2H4Cl2) : n(Cl2) = 1:2, т.е. n(Cl2) = 2 × n(C2H4Cl2) = 2 × 0,12 = 0,24 моль. Тогда объем хлора будет равен:
Для чего используют этан
Содержание
Свойства
Физические свойства
Этан при н. у. — бесцветный газ, без запаха и вкуса. Молярная масса — 30,07. Температура плавления −182,81 °C, кипения −88,63 °C. Плотность ρгаз.=0,001342 г/см³ или 1,342 кг/м³ ( н. у. ), ρжидк.=0,561 г/см³ (T=-100 °C). Давление паров при 0 °С — 2,379 МПа.
Химические свойства
Химическая формула C2H6 (рациональная СН3СН3). Наиболее характерны реакции замещения водорода галогенами, проходящие по свободно радикальному механизму.
Физиологическое действие
Обладает слабым наркотическим действием (ослаблено за счет низкой растворимости в жидкостях организма).
Получение
В промышленности
В промышленности получают из нефтяных и природных газов, где он составляет до 10 % по объему. В России содержание этана в нефтяных газах очень низкое. В США и Канаде (где его содержание в нефтяных и природных газах высоко) служит основным сырьем для получения этилена.
В лабораторных условиях
Получение этана из иодметана:
Применение
Основное использование этана в промышленности — получение этилена.
Интересные факты
Предположительно, что на поверхности Титана (спутник Сатурна) в условиях низких температур (−180 °C) существуют целые озёра и реки из жидкой метано-этановой смеси.
Этан структура, свойства, использование и риски
этан простой углеводород формулы C2H6 с природой бесцветного газа без запаха, который имеет очень ценное и разнообразное применение в синтезе этилена. Кроме того, это один из земных газов, который также был обнаружен на других планетах и звездных телах вокруг Солнечной системы. Он был открыт ученым Майклом Фарадеем в 1834 году.
Среди большого количества органических соединений, образованных атомами углерода и водорода (известных как углеводороды), есть те, которые находятся в газообразном состоянии при температурах и давлениях окружающей среды, которые чрезвычайно используются во многих отраслях промышленности..
Химическая структура
Этан является молекулой с формулой С2H6, обычно рассматривается как объединение двух метильных групп (-CH3) с образованием углеводорода простой углерод-углеродной связи. Это также самое простое органическое соединение после метана, представленное следующим образом:
Также существует внутреннее явление этана, которое основано на одинаковом вращении молекулярной структуры и минимальной энергии, необходимой для вращения связи на 360 градусов, которое ученые назвали «этановым барьером»..
По этой причине этан может встречаться в различных конфигурациях в зависимости от его вращения, даже если существует более стабильная конформация, когда атомы водорода находятся напротив друг друга (как показано на рисунке)..
Синтез этана
Этан может быть легко синтезирован из электролиза Колбе, органической реакции, в которой происходят две стадии: электрохимическое декарбоксилирование (удаление карбоксильной группы и выделение углекислого газа) двух карбоновых кислот и комбинация продуктов промежуточные соединения с образованием ковалентной связи.
Точно так же электролиз уксусной кислоты приводит к образованию этана и углекислого газа, и эта реакция используется для синтеза первого.
Окисление уксусного ангидрида под действием пероксидов, концепция, аналогичная концепции электролиза Колбе, также приводит к образованию этана.
Таким же образом он может быть эффективно отделен от природного газа и метана процессом сжижения с использованием криогенных систем для улавливания этого газа и отделения его от смесей с другими газами..
Уже на этом этапе компоненты смеси могут быть дифференцированы, так что жидкий этан будет отделен от газообразного метана и других видов, связанных с использованием перегонки.
свойства
Растворимость в этаноле
Молекулы этана имеют симметричную конфигурацию и имеют слабые силы притяжения, которые удерживают их вместе, называемые силами рассеивания.
Когда пытаются растворить этан в воде, силы притяжения, возникающие между газом и жидкостью, очень слабы, поэтому очень трудно соединить этан с молекулами воды..
По этой причине растворимость этана является значительно низкой, слегка увеличиваясь при повышении давления в системе..
Кристаллизация этана
Этан может затвердеть, что приводит к образованию нестабильных кристаллов этана с кубической кристаллической структурой.
Сжигание этана
Этот углеводород, даже если он широко не используется в качестве топлива, может использоваться в процессах сжигания для производства углекислого газа, воды и тепла, который представлен следующим образом:
Существует также возможность сжигания этой молекулы без избытка кислорода, который известен как «неполное сгорание» и который приводит к образованию аморфного углерода и оксида углерода в нежелательной реакции, в зависимости от количества применяемого кислорода. :
Это будет зависеть от условий, при которых протекает реакция, и от участия свободнорадикальных реакций. Этилен также может образовываться при высоких температурах (600-900 ºC), что является продуктом, весьма востребованным промышленностью..
Этан в атмосфере и небесных телах
Этан присутствует в атмосфере планеты Земля в следах, и есть подозрение, что человеку удалось удвоить эту концентрацию с тех пор, как он начал заниматься производственной деятельностью.
Ученые считают, что большая часть присутствия этана в атмосфере обусловлена сжиганием ископаемого топлива, хотя глобальные выбросы этана сократились почти вдвое с тех пор, как были усовершенствованы технологии добычи сланцевого газа ( источник природного газа).
Этан существует в жидком состоянии на поверхности Титана, одной из лун Сатурна. Это происходит в большем количестве в реке Вид Флумина, которая течет более 400 километров к одному из своих морей. Также было обнаружено, что это соединение на кометах и на поверхности Плутона.
приложений
Производство этилена
Использование этана основано главным образом на производстве этилена, наиболее широко используемого органического продукта в мире, посредством процесса, известного как паровой крекинг..
Этот процесс состоит из подачи подачи этана, разбавленного паром, в печь, быстрого нагревания без кислорода.
Реакция происходит при очень высокой температуре (между 850 и 900 ºC), но время пребывания (время, которое этан проводит в печи) должно быть коротким, чтобы реакция была эффективной. При более высоких температурах вырабатывается больше этилена.
Обучение основным химическим веществам
Этан также был изучен в качестве основного компонента в образовании основных химических веществ. Окислительное хлорирование является одним из процессов, предложенных для получения винилхлорида (компонента из ПВХ), заменяя менее дорогие и более сложные.
холодильный
Наконец, этан используется в качестве хладагента в обычных криогенных системах, также показывая способность замораживать небольшие образцы в лаборатории для анализа..
Это очень хороший заменитель воды, который занимает больше времени для охлаждения деликатных образцов, а также может привести к образованию вредных кристаллов льда.
Этан рискует
-Этан обладает способностью воспламеняться, особенно когда он связывается с воздухом. При процентном содержании этана в воздухе от 3,0 до 12,5% может образоваться взрывоопасная смесь.
-Он может ограничивать содержание кислорода в воздухе, в котором он находится, и по этой причине представляет собой фактор риска удушья для людей и животных, которые присутствуют и подвергаются воздействию.
-Этан в замороженной жидкой форме может сильно обжечь кожу, если он вступает в непосредственный контакт с ней, а также действовать как криогенная среда для любого объекта, к которому он прикасается, мгновенно замораживая его.
-Пары жидкого этана тяжелее воздуха и концентрируются на земле, это может представлять опасность воспламенения, которое может вызвать цепную реакцию горения.
Для чего используют этан
Содержание
Свойства
Физические
Химические
Химическая формула C2H6 (рациональная CН3СН3). Наиболее характерны реакции замещения водорода галогенами, проходящие по свободно радикальному механизму.
Термическое дегидрирование этана при 550—650 °С приводит к этилену, при температурах свыше 800 °С — к ацетилену (образуются также бензол и сажа). Прямое хлорирование при 300—450 °С — к этилхлориду, нитрование в газовой фазе дает смесь (3:1) нитроэтана и нитрометана.
Физиологическое действие
Обладает слабым наркотическим действием (ослаблено за счет низкой растворимости в жидкостях организма).
Получение
В промышленности
В промышленности получают из нефтяных и природных газов, где он составляет до 10 % по объему. В России содержание этана в нефтяных газах очень низкое. В США и Канаде (где его содержание в нефтяных и природных газах высоко) служит основным сырьем для получения этилена.
В лабораторных условиях
Получают из иодметана по реакции Вюрца, из ацетата натрия электролизом по реакции Кольбе, сплавлением пропионата натрия с щелочью, из этилбромида по реакции Гриньяра, гидрированием этилена (над Pd) или ацетилена (в присутствии Никель Ренея).
Применение
Основное использование этана в промышленности — получение этилена.
Интересные факты
Интересно, что на поверхности Титана (спутник Сатурна) в условиях низких температур (−180 °C) существуют целые озёра и реки из жидкой метано-этановой смеси.
Примечания
Полезное
Смотреть что такое «Этан» в других словарях:
Этан-де-То — Étang de Thau Координаты: Координаты … Википедия
этан — а, м. éthan m., нем. Äthan < aither эфир, воздух. Органическое соединение, насыщенный углеводород алифатического ряда, бесцветный горючий газ, содержащийся в в нефтяных и природных газах. Крысин 1998. Лекс. Брокг. этан; СИС 1937: эта/н … Исторический словарь галлицизмов русского языка
ЭТАН — (С2Н6), бесцветный, лишенный запаха газ, второй из ряда АЛКАНОВЫХ УГЛЕВОДОРОДОВ. Является одним из компонентов природного газа. см. также НАСЫЩЕННЫЕ СОЕДИНЕНИЯ … Научно-технический энциклопедический словарь
ЭТАН — ЭТАН, этана, мн. нет, муж. (от греч. aithér эфир) (хим.). Бесцветное горючее газообразное вещество, содержащееся в светильном и нефтяном газе. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
этан — сущ., кол во синонимов: 2 • алкан (37) • газ (55) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
Этан — углеводород предельного ряда С2Н6; встречается в природе, ввыделениях из почвы нефтеносных местностей. Искусственно получен впервый раз Кольбе и Франкландом в 1848 г. при действии металлическогокалия на пропионнитрил, ими же в следующем 1849 году … Энциклопедия Брокгауза и Ефрона
ЭТАН — газообразный углеводород С2Н6 метанового ряда. tкип минус 88,5 °С. 1 л. Э. при 0 °С и 760 мм давления весит 0.357 г. Присутствует во всех нефтяных газах. Геологический словарь: в 2 х томах. М.: Недра. Под редакцией К. Н. Паффенгольца и др.. 1978 … Геологическая энциклопедия
Этан — – газообразное горящее вещество без цвета и запаха. В природе встречается в составе природного газа, нефти и других углеводородах. Обладает наркотическим действием. В промышленности получают из нефтяных и природных газов. Основное… … Нефтегазовая микроэнциклопедия
ЭТАН — (CH3CH3) насыщенный углеводород; бесцветный горючий газ. Содержится в нефти, природном горючем газе, газах нефтепереработки. Применяется в органическом синтезе … Российская энциклопедия по охране труда