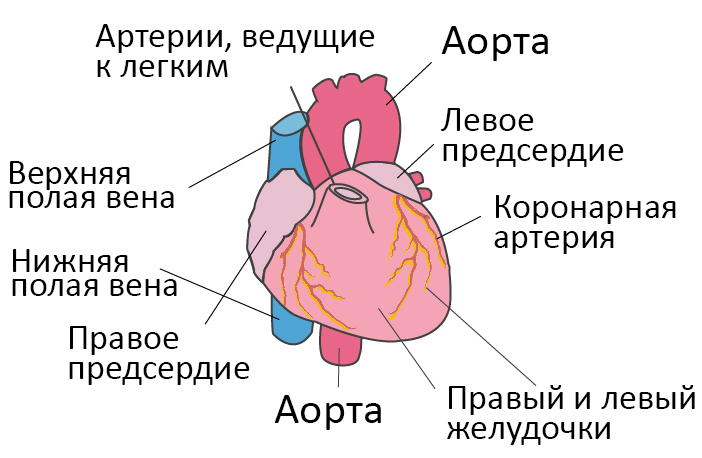
Дистрофия левого желудочка сердца что это симптомы лечение у женщин
Гипертрофия левого желудочка
Гипертрофия левого желудочка: виды, причины, симптомы, диагностика, лечение и профилактика
Гипертрофия левого желудочка представляет собой заболевание, характеризующееся уплотнениями в левых стенках органа сердечного желудочка. В случае обнаружения у пациентов различных уплотнений, расположенных в перегородках в межпограничной области правого, а также левого желудочка. Данная патология влияет на процесс потери былых эластичных свойств желудочковых стенок организма.
Современная медицина классифицирует заболевание по следующим разновидностям недомоганий:
Причины
В основном недуг провоцируется наследственным фактором. У людей, имеющих родственников в любом поколении с наличием сердечных болезней, существует риск генетической предрасположенности к отклонению. Это говорит о том, что у них растет вероятность уплотнения в стенке. Недуг вызывается:
Все эти факторы повышают кровяную пульсацию, из-за которой утолщаются сердечные мышцы. Именно поэтому и возникают уплотнения в органе.
Симптомы
В зависимости от стадии патологии, возраста пациента и функциональных способностей его организма дефект может не иметь никаких признаков.
В основном заболевание не имеет никаких признаков на первой стадии, когда увеличение веса миокарда не становится препятствием и не мешает его кровообращению.
Если обнаружено несоответствие в размере органа и кровоснабжении, то видны первые проявления дефекта. Недуг характеризуется кардиалгией (болями в грудной клетки), быстрой утомляемостью, головокружениями и обмороками.
Нарушения в нервной системе способствуют развитию аритмий и блокад. При присоединении недостаточности в левом предсердии появляется одышка как при покое, так и при физических нагрузках. Это отмечается на поздних стадиях.
Диагностика
Провести осмотр пациента может только кардиолог, который руководствуется сбором анамнеза и осмотром. Одним из эффективных способов считают электрокардиографию., позволяющую измерить толщину сердечной мышцы.
При гипертрофии на ЭКГ видны следующие изменения:
Помимо указанных выше методов диагностики, врач проводит обследование с помощью магнитно-ядерного резонанса, компьютерной томографии и рентгена грудной клетки.
Лечение
Терапию проводят бета-блокаторами в комплексе с верапамилом. Этим методом удается уменьшить симптоматику, провоцируемую сердечно-сосудистой патологией. В качестве дополнений к терапии медикаментозными средствами рекомендуют соблюдать диету. Также нужно отказаться от привычек, наносящих вред организму, если они имеются.
Чтобы лечение было эффективным необходимо: отказаться от сигарет, понизить уровень потребления пищевой соли, сбросить лишнюю массу тела.
Рацион должен быть обогащен молочными и кисломолочными продуктами, морепродуктами, свежими овощами и фруктами. Потребуется сократить количество употребления изделий из муки, ограничить сладости и животные жиры. Физическая активность должна быть умеренного характера.
Врачи не исключают вероятность того, что понадобится оперативное вмешательство, чтобы удалить участок мышцы сердца, которая подверглась гипертрофии. Важно отметить, что развитие данного недуга часто происходит на протяжении нескольких лет жизни.
Профилактика
Риск заболевания можно снизить путем полного отказа от спиртных напитков, кофе и сигарет, активного образа жизни, осуществления систематического контроля над работой сердца, сокращения потребления соли в пищу, отказа от жирных продуктов и введения в рацион большого количества фруктов и овощей.
Миокардит
Миокардит — совокупность морфологических изменений тканей сердечной мышцы воспалительного характера. Протекает болезнь в острой и хронической форме и является чаще следствием инфекционных заболеваний, реже — неинфекционных. Отличается значительной вариабельностью клинических проявлений, выраженность которых во многом зависит от степени поражения миокарда, локализации патологического очага, особенностей протекания воспалительного процесса.
«Клиника АВС» — многопрофильный медицинский центр, который оказывает специализированную помощь пациентам с заболеваниями сердца. Здесь работает опытный медицинский персонал, врачи высшей категории, кандидаты медицинских наук. Клиника оснащена современным высокоинформативным диагностическим оборудованием, что в комплексе позволяет поставить точный диагноз в кратчайшие сроки и оказать грамотную медицинскую помощь независимо от сложности и стадии развития заболевания.
Общие сведения
Миокардит сердца развивается в разном возрасте (но чаще в 30-40 лет). Часто протекает под видом инфекционного процесса, которым был вызван, поэтому может оставаться незамеченным длительное время. В дальнейшем возможны рецидивы заболевания, развитие тяжелой острой симптоматики и серьезных осложнений.
Воспаление миокарда сопровождается повреждением кардиомиоцитов, в результате воздействия инфекционного или другого кардиотоксического агента. Помимо этого в воспалительный процесс могут быть вовлечены клетки соединительнотканной структуры, проводящей системы и пр.
Причины миокардита
Классификация миокардитов
По нозологической принадлежности миокардиты классифицируется на:
Симптомы миокардита
Степень поражения сердечной мышцы, локализация воспалительного очага, наличие распространения на перикард — во многом определяют клиническую картину. Симптомы миокардита заключаются в недостаточной сократительной способности сердечной мышцы и нарушениях ритма сердца.
Миокардит сердца может иметь слабовыраженные симптомы, протекать скрыто или остро. Чаще пациенты жалуются на боли в сердце, ощущение нехватки воздуха, повышенную потливость, быструю утомляемость. Внешние признаки: бледность эпидермиса с синим оттенком, увеличение вен шеи, отечность.
В результате обследования выявляется артериальная гипотония, увеличение сердца, нарушение пульса, кровоснабжения органов, внутрисердечной проводимости, аритмия, систолический шум на верхушке сердца, приглушенность I тона.
Осложнения миокардита
Следствием воспаления становится разрастание соединительной ткани, развитие кардиосклероза. При тяжелой форме развивается сердечная недостаточность (ухудшается доставка крови к тканям). Возможно развитие тромбоэмболии, приводящей к инсульту, инфаркту. Патология может стать причиной внезапного летального исхода.
Диагностика миокардита
Симптоматика неспецифична, что усложняет постановку диагноза. Врачи собирают анамнез, а также изучают данные лабораторных и инструментальных исследований.
Для постановки диагноза могут понадобиться данные следующих показателей/анализов:
Лечение миокардита
Терапия зависит от первопричины и стадии болезни. При легкой форме рекомендуется снижение двигательной активности, коррекция рациона (ограничение соли, воды, увеличение потребления витаминизированных, белковых продуктов).
В более тяжелых состояниях необходим постельный режим. Фармакотерапия может включать:
Лечение миокардита также может включать установку кардиостимулятора, трансплантацию сердца.
Прогноз при миокардите
При латентном и малосимптомном протекании патологии возможно самоизлечение. Если клиническая картина выражена, прогноз ухудшается: выздоровление наблюдается в половине случаев, в остальных — развивается дилатационная кардиомиопатия. Сердечная аритмия может спровоцировать летальный исход. В клинической практике имеются случаи тяжелого протекания патологии с быстрым прогрессированием сердечной недостаточности и внезапной смертью.
Профилактика миокардита
Специфической профилактики не существует. Но рекомендуется соблюдать ряд мер, которые помогут предупредить развитие патологии: своевременно и полностью лечить инфекционные заболевания, избегать укусов клещей, соблюдать правила личной гигиены, не пропускать плановую вакцинацию, вести ЗОЖ, периодически проходить профилактическое обследование у кардиолога.
Миокардит имеет в каждом случае разные симптомы и лечение у взрослых. В «Клинике АВС» высококвалифицированные кардиологи, ангиохирурги, флебологи и другие специалисты окажут полный спектр медицинской помощи кардиохирургического профиля.
Сердечная недостаточность: симптомы, причины, лечение
Сердечная недостаточность связана со снижением функции сердца. Сердечная мышца не может выработать энергию, необходимую для прокачки необходимого количества крови по всему организму.
Только в России около 7 миллионов человек страдают сердечной недостаточностью. У людей старше 70 лет страдает каждый четвертый человек, причем мужчины, как правило, поражаются в значительно более молодом возрасте, чем женщины. Риск для мужчин примерно в полтора раза выше, чем для женщин. В России болезни системы кровообращения являются самой распространенной причиной смерти.
Что такое сердечная недостаточность?
Со здоровым сердцем богатая кислородом кровь из левого желудочка перекачивается через тело к органам, обеспечивая их кислородом и питательными веществами. После снабжения органов кровь с низким содержанием кислорода возвращается из организма в правую часть сердца, откуда она транспортируется в легкие. В легких кровь обогащается кислородом, так что она снова может перекачиваться по всему телу через левый желудочек.
Сердечная недостаточность – это ослабление насосной функции сердца. Как правило, поражается либо правая сторона сердца (правосторонняя сердечная недостаточность), либо левая сторона сердца (левосторонняя сердечная недостаточность). При прогрессирующей сердечной недостаточности могут быть затронуты обе стороны сердца (глобальная сердечная недостаточность). Сердечная недостаточность также может быть хронической или острой по своей природе. Хроническая сердечная недостаточность встречается чаще острой сердечной недостаточности, которая возникает внезапно и неожиданно. Острая сердечная недостаточность может возникнуть внезапно на фоне острой сердечно-сосудистой катастрофы и/или декомпенсации сердечной недостаточности.
Что вызывает сердечную недостаточность?
Сердечная недостаточность вызвана болезнями, которые затрагивают или повреждают сердечную мышцу. Наиболее распространенной причиной хронической сердечной недостаточности является заболевание коронарной артерии.
Ишемическая болезнь сердца (ИБС) вызывается сужением коронарных сосудов (коронарных артерий), чаще всего из-за атеросклероза. Коронарные артерии – это сосуды, которые обеспечивают сердце кислородом и другими важными питательными веществами. Прогрессирующее сужение (также называемое стенозом) артерий приводит к нарушениям кровообращения сердечной мышцы. ИБС часто диагнастируется, когда присутствует стенокардия (боль и напряжение в груди), но в остальном она остается незамеченной.
Инфаркт происходит из-за уменьшения циркуляции крови, богатой кислородом, к сердечной мышце, что приводит к необратимой гибели ткани. Это повреждение влияет на насосную функцию сердца, приводя к сердечной недостаточности. Большая часть пациентов также страдает от высокого кровяного давления, что дополнительно усугубляет ситуацию.
Высокое кровяное давление (гипертония) является единственной причиной сердечной недостаточности у почти 20% людей, что делает его второй наиболее распространенной причиной этого заболевания. Высокое кровяное давление заставляет сердце постоянно работать сильнее. Сердце не может работать под дополнительной нагрузкой в течение длительного периода времени, и поэтому деградирует.
Подобный эффект может быть вызван проблемой с сердечным клапаном. При суженных или протекающих аортальных клапанах сердце должно работать сильнее или биться чаще, что также ведет к увеличению нагрузки.
Брадикардия – нарушения сердечного ритма при котором снижена частота сердечных сокращений также может быть причиной сердечной недостаточности, поскольку циркулирует слишком мало крови. Слишком быстрое сердцебиение (тахикардия) связано с уменьшением ударного объема и, следовательно, может также привести к сердечной недостаточности.
Наследственные заболевания сердца, беременность, аутоиммунные расстройства, алкоголь, наркотики или злоупотребление медикаментами, гиперактивность щитовидной железы и нарушения обмена веществ (сахарный диабет) могут быть причинами сердечной недостаточности.
Какие виды сердечной недостаточности и каковы их симптомы?
Каждый тип сердечной недостаточности имеет разные симптомы, и симптомы могут различаться по интенсивности. Тем не менее, основным симптомом сердечной недостаточности является затруднение дыхания при физической нагрузке или в покое. Предупреждающие признаки могут включать потоотделение при легкой физической нагрузке, неспособность лежать ровно, стеснение в груди или наличие отечности ног.
Левосторонняя сердечная недостаточность
Левая сторона сердца отвечает за перекачку богатой кислородом крови по всему телу к органам. При левосторонней сердечной недостаточности насосная функция левого желудочка ограничена, что приводит к недостаточному количеству крови, обогащенной кислородом, для прокачки по всему организму. Вместо этого кровь остается в легочной циркуляции, что может привести к образованию жидкости в легких (отек легких), затрудненному дыханию, раздражению горла, «дребезжащему» звуку при дыхании, слабости или головокружению.
Это чаще всего вызвано ишемической болезнью сердца (ИБС), высоким кровяным давлением или сердечным приступом и реже – нарушением сердечной мышцы или сердечных клапанов.
Левосторонняя сердечная недостаточность может проявляться остро или развиваться со временем. Обычно впервые замечают по одышке от физической активности. При тяжелом состоянии это может даже привести к гипотонии (низкому кровяному давлению) в состоянии покоя.
Правосторонняя сердечная недостаточность
Правая сторона сердца отвечает за возврат крови с низким содержанием кислорода обратно в легкие. При правосторонней сердечной недостаточности правый желудочек не работает должным образом. Это вызывает повышенное давление в венах, вытесняя жидкость в окружающие ткани. Это приводит к отекам, особенно в ступнях, пальцах ног, лодыжках и голенях. Это также может привести к острой необходимости мочиться ночью, когда почки получают лучшее кровообращение.
Причиной чаще всего является острое или хроническое увеличение сопротивления легочного кровообращения. Обусловлено легочными заболеваниями, такими как легочная эмболия, астма, выраженная эмфизема, хроническое обструктивное заболевание легких (ХОЗЛ, чаще всего вследствие употребления табака) или левосторонней сердечной недостаточностью. Редкие причины включают проблемы с сердечным клапаном или заболевания сердечной мышцы.
Глобальная сердечная недостаточность
Когда поражены как левая, так и правая стороны сердца, это называется глобальной сердечной недостаточностью. Присутствуют симптомы левой и правой сердечной недостаточности.
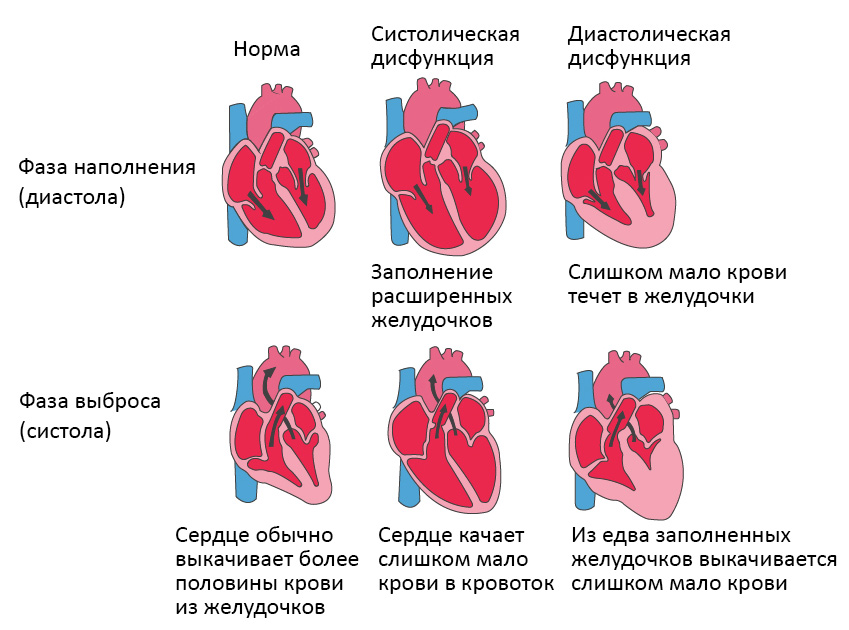
Систолическая и диастолическая сердечная недостаточность
Систолическая сердечная недостаточность связана с потерей нормального функционирования клеток сердечной мышцы или внешних нарушений насосной функции. Кровь попадает в легкие, а органы не получают достаточного количества кислорода.
При диастолической сердечной недостаточности теряется эластичность желудочка, из-за чего он не расслабляется и не наполняется соответствующим образом. Одной из наиболее распространенных причин диастолической дисфункции является высокое кровяное давление. Из-за повышенного сопротивления в артериях сердце должно работать сильнее. Эластичность сердечной мышцы снижается, и между сокращениями из желудочков в организм может перекачиваться меньше крови. Это приводит к тому, что организм не получает достаточного количества крови и питательных веществ.
Болезнь клапана сердца также может привести к утолщению сердечной мышцы. Мускулатура сердца становится более жесткой и менее эластичной из-за накопления белков. Симптомы от кашля до одышки.
Хроническая и острая сердечная недостаточность
Хроническая сердечная недостаточность – это прогрессирующее заболевание, которое развивается месяцами или годами и встречается чаще, чем острая сердечная недостаточность. При хронической сердечной недостаточности симптомы часто не воспринимаются всерьез, поскольку организм способен компенсировать это в течение длительного периода времени или симптомы связывают с увеличением возраста. Симптомы отражают либо левую, либо правостороннюю сердечную недостаточность.
Острая сердечная недостаточность возникает внезапно, через несколько минут или часов, после сердечного приступа, когда организм больше не может это компенсировать. Некоторые симптомы включают в себя:
На какие классы делится сердечная недостаточность?
Существует несколько классификаций сердечной недостаточности:
Согласно функциональной классификации Нью-Йоркской кардиологической ассоциации (NYHA), сердечная недостаточность подразделяется на классы I-IV в зависимости от выраженности симптомов и ограничения физической активности.
Сердечная недостаточность делится на четыре класса в зависимости от выраженности симптомов:
Сердечная недостаточность значительно снижает качество жизни. Больные часто испытывают большое разочарование в связи с физическими ограничениями и имеют тенденцию уходить из общественной жизни. По этой причине психологические расстройства, такие как депрессия, часто присутствуют в дополнение к ожидаемым физическим симптомам.
Как диагностируется сердечная недостаточность?
Диагностика начинается с комплексной оценки истории болезни человека, уделяя особое внимание симптомам (начало, продолжительность, проявление). Это помогает классифицировать тяжесть симптома. Сердце и легкие обследуются. Если есть подозрение на сердечный приступ или нарушение ритма, выполняется ЭКГ покоя с 12 отведениями. Кроме того, эхокардиография и общий анализ крови. Необходимость в катетеризации определяется индивидуально.
Как лечится сердечная недостаточность?
При хронической сердечной недостаточности применяются медикаменты (такие как ингибиторы АПФ, бета-блокаторы и диуретики). Лекарства используются для предотвращения осложнений и улучшения качества жизни. Ингибиторы АПФ и бета-блокаторы могут продлевать жизнь, но для достижения положительного эффекта их следует принимать регулярно.
Кроме того, используются ритм-терапии (для лечения нарушений ритма сердца), имплантация трехкамерного кардиостимулятора. Последнее обеспечивает своевременную активацию предсердий и обоих желудочков. Дефибриллятор также часто имплантируется как часть кардиостимулятора для противодействия опасным нарушениям сердечного ритма в условиях тяжелой сердечной недостаточности. Это лечение также известно как ресинхронизационная терапия. Важной частью успешного лечения является физиотерапия.
Каковы шансы на выздоровление от сердечной недостаточности?
Сердечная недостаточность не может быть «излечена». Тем не менее, ожидаемая продолжительность жизни пациента может быть значительно увеличена. Это зависит от типа сердечной недостаточности, а также от возраста, сопутствующих заболеваний и образа жизни человека. Если лечить сопутствующие заболевания (например, высокое кровяное давление), вести здоровый образ жизни и соблюдать рекомендации врача, возможен хороший долгосрочный прогноз.
Гипертрофия левого желудочка неясной этиологии
В статье приведены клинические наблюдения и рассматриваются некоторые причины гипертрофии миокарда неясной этиологии, в том числе гипертрофическая кардиомиопатия (ГКМП), болезнь Фабри, AL и ATTR-амилоидоз. Важность своевременной диагностики трех последних заболеваний связана с тем, что сегодня стало возможным патогенетическое их лечение, позволяющее затормозить прогрессирования поражения сердца. Важное значение в диагностике ГКМП, болезни Фабри, наследственного ATTR-амилоидоза и некоторых других генетических заболеваний имеют изучение семейного анамнеза и молекулярно-генетическое исследование. При обследовании пациентов с необъяснимой гипертрофией левого желудочка необходимо обращать внимание на экстракардиальные проявления, которые могут оказаться ключом к правильному диагнозу, например, полиневропатия и нефротический синдром при системном амилоидозе, ангиокератомы и нейропатическая боль при болезни Фабри, прогрессирующая мышечная слабость и повышение активности креатинфосфокиназы при болезни Помпе, птоз век при митохондриальных заболеваниях и др. Для подтверждения диагноза амилоидоза следует проводить гистологическое исследование биоптата сердца или других органов и тканей.
С.В. Моисеев. Гипертрофия левого желудочка (ГЛЖ) часто встречается в практике кардиолога. Она может быть заподозрена на основании ЭКГ, однако более надежными методами оценки массы миокарда являются эхокардиография и особенно магнитно-резонансная томография (МРТ). При эхокардиографии критерием ГЛЖ считают увеличение индекса массы миокарда левого желудочка, соответственно, >115 г/м2 у мужчин и >95 г/м2 у женщин (с поправкой на площадь поверхности тела) или >50 г/м2,7 у мужчин и >47 г/м2,7 у женщин (с поправкой на рост) [1], а при МРТ – >85 г/м2 у мужчин и >81 г/м2 у женщин [2]. В зависимости от относительной толщины стенки (ОТС) левого желудочка [(2 × толщина задней стенки)/ конечный диастолический размер левого желудочка] выделяют концентрическую (ОТС≥0,43) и эксцентрическую (ОТС Е.В. Привалова. ГКМП – это наследственное заболевание, которое передается по аутосомно-доминантному типу [4]. В соответствии с рекомендациями Евро пейского общества кардиологов 2014 г., ГКМП может быть диагностирована при наличии гипертрофии миокарда ≥15 мм по крайней мере в одном сегменте левого желудочка, которую нельзя объяснить другими причинами, а у родственников пациента с установленным диагнозом – при наличии гипертрофии миокарда ≥13 мм [3]. Гипертрофия миокарда при ГКМП может быть как асимметричной (рис. 1), так и симметричной. У 4060% пациентов с ГКМП определяются мутации генов, кодирующих белки саркомеров сердца, прежде всего тяжелой цепи бета-миозина (MYH7) и миозин-связывающего белка С (MYBPC3). Реже встречаются мутации генов, кодирующих тропонины I и T (TNNI3, TNNT2), α1-цепи тропомиозина (TPM1) и легкой цепи миозина 3 (MYL3). В целом у пациентов с мутациями генов саркомерных белков выше частота семейного анамнеза ГКМП и внезапной смерти и отмечаются более выраженные ГЛЖ и миокардиальный фиброз, чем у пациентов без мутаций [5]. При обследовании пациента важно оценить наличие обструкции выносящего тракта левого желудочка [6]. Критерием ее является градиент давления в выносящем тракте, который измеряют допплеровским методом, ≥30 мм рт. ст. в покое или после провокационных проб (проба Вальсальвы, физическая нагрузка). Гемодинамически значимым считают увеличение этого показателя ≥50 мм рт. ст. [3].

В.Ю. Каплунова. Пациент К., 45 лет, обследован в клинике госпитальной терапии имени А.А. Остроумова в октябре 2018 г. Старший брат пациента внезапно умер в возрасте 54 лет. ГКМП была диагностирована у другого брата, умершего в возрасте 54 лет, и 29-летней дочери пациента. С 18-летнего возраста у больного выслушивался систолический шум по левому краю грудины при отсутствии клинических проявлений и хорошей переносимости физической нагрузки. В возрасте 27 лет появились одышка, сердцебиение, перебои в работе сердца, головокружение и дурнота, дискомфорт в области сердца при умеренной физической нагрузке. В возрасте 33 лет обнаружена асимметричная ГЛЖ (толщина межжелудочковой перегородки – 20 мм, задней стенки – 12 мм) с признаками обструкции выносящего тракта левого желудочка и градиентом давления в покое 45 мм рт. ст. Диагностирована обструктивная форма ГКМП. С 44-летнего возраста отмечает пароксизмы фибрилляции предсердий с последующим переходом аритмии в постоянную форму. При эхокардиографии было выявлено нарастание гипертрофии межжелудочковой перегородки до 31 мм и увеличение градиента давления до 94 мм рт. ст. в покое. В Научном центре сердечно-сосудистой хирургии им. А.Н. Баку ле ва выполнена миэктомия доступом из правого желудочка, которая привела к уменьшению степени обструкции выносящего тракта левого желудочка и диастолической дисфункции. При молекулярно-генетическом исследовании у пробанда и его дочери выявлена миссенс мутация в 22 экзоне гена, кодирующего тяжелую цепь β миозина (MYHT A870C).
Представленное наблюдение иллюстрирует типичные проявления и течение ГКМП: асимметричная гипертрофия межжелудочковой перегородки, которая была выявлена в молодом возрасте, медленно нарастала и длительное время не сопровождалась клиническими симптомами, в частности застойной сердечной недостаточностью, обструкция выносящего тракта левого желудочка с высоким градиентом давления в его полости, семейный анамнез (диагноз ГКМП и/или случаи внезапной сердечной смерти у близких родственников), мутация гена, кодирующего саркомерный белок, которая была обнаружена как у пробанда, так и его дочери. Лечение ГКМП обычно начинают с β-адреноблокаторов, не обладающих вазодилатирующей активностью, которые уменьшают градиент давления в полости левого желудочка и клинические симптомы. При их неэффективности могут быть использованы дизопирамид или верапамил. При выраженной гипертрофии межжелудочковой перегородки и высоком градиенте давления в левом желудочке может быть выполнена миэктомия, которая более чем в 90% случаев позволяет ликвидировать или значительно уменьшить обструкцию выносящего тракта, улучшить переносимость физической нагрузки и выживаемость [7].
Е.В. Привалова. Дифференциальная диагностика ГКМП с другими заболеваниями, сопровождающимися ГЛЖ, может представлять трудности, например, при наличии умеренной гипертрофии миокарда, особенно симметричной, не сопровождающейся обструкцией выносящего тракта левого желудочка, и при отсутствии семейного анамнеза. Мутации генов саркомерных белков определяются не у всех пациентов с ГКМП, а у части больных с необъяснимой ГЛЖ молекулярно-генетическое исследование не проводится по экономическим причинам. Следует учитывать, что асимметричная гипертрофия межжелудочковой перегородки, характерная для ГКМП, встречается и при других заболеваниях, в том числе вторичной гипертрофии миокарда при артериальной гипертонии. Причиной ГЛЖ могут быть не только перегрузка левого желудочка давлением, но и физические тренировки, хотя в крупном исследовании увеличение толщины стенки левого желудочка более 12 мм было выявлено всего у 1,7% из 947 спортсменов, занимающихся различными видами спорта, а толщина стенки не превышала 16 мм. Более частым эхокардиографическим признаком “сердца спортсмена» была дилатация полости левого желудочка, которая определялась в 38% случаев [8]. Важное значение для диагностики некоторых заболеваний, сопровождающихся ГЛЖ, имеет тщательный анализ клинической картины, позволяющий выявить те или иные экстракардиальные проявления болезни, которые отсутствуют при ГКМП. Проведение биопсии миокарда для подтверждения диагноза ГКМП не требуется, однако гистологическое исследование может быть обоснованным для исключения инфильтративных заболеваний, сопровождающихся утолщением стенки левого желудочка.
Е.А. Каровайкина. Болезнь Фабри – это редкое заболевание, которое характеризуется нарушением обмена гликофосфолипидов вследствие недостаточности или отсутствия лизосомного фермента – α-галактозидазы А [9]. Причиной дефицита этого фермента являются мутации гена GLA, расположенного на Х-хромосоме, поэтому типичные клинические проявления болезни Фабри наблюдаются чаще и более выражены у гемизиготных мужчин, однако они нередко встречаются и у гетерозиготных женщин. При классическом фенотипе болезни Фабри первые симптомы, в частности нейропатическая боль (эпизоды жгучей боли в кистях и стопах, возникающей при лихорадке, физической нагрузке, стрессе и быстрых изменениях температуры окружающей среды), ангиокератомы (поверхностные ангиомы, локализующиеся на передней брюшной стенке, в частности внутри или вокруг пупка, в паховой области, на ягодицах, верхних конечностях, губах; рис. 2), снижение или отсутствие потоотделения, желудочно-кишечные нарушения, появляются в детском или подростковом возрасте, а в возрасте 20-40 лет развивается поражение внутренних органов, в том числе сердца, почек (протеинурия и прогрессирующее снижение скорости клубочковой фильтрации) и центральной нервной системы (транзиторные ишемические атаки и инсульт). При атипичном “кардиальном» варианте заболевания ГЛЖ развивается в возрасте 40-50 лет и старше при отсутствии ранних симптомов. Результаты нескольких крупных скрининговых исследований свидетельствуют о том, что патогенные мутации гена GLA, ассоциирующиеся с развитием болезни Фабри, могут быть обнаружены у 0,5-1% пациентов с диагнозом ГКМП [10].

А.С. Моисеев. Иллюстрацией ГЛЖ, обусловленной болезнью Фабри, могут служить следующие два наблюдения. Пациент Л., 48 лет, был обследован в клинике им. Е.М. Тареева в октябре 2016 года. С 19 лет выраженная лимфедема нижних конечностей и снижение потоотделения. В возрасте 47 лет появились редкие боли за грудиной, не связанные с физической нагрузкой, а при эхокардиографии выявлено утолщение межжелудочковой перегородки и стенки левого желудочка до 14 мм при отсутствии дилатации камер сердца и нарушений систолической функции. Наблюдался у кардиолога с диагнозом ГКМП. Через 1 год при скрининге обнаружено снижение активности α-галактозидазы А в высушенных пятнах крови, увеличение уровня глобо триазилсфингозина (Lyso-GL3) до 117 нг/мл (в норме G), которые позволили установить диагноз болезни Фабри. На ЭКГ отмечались признаки ГЛЖ (рис. 3). При МРТ сердца наблюдались увеличение индекса массы миокарда левого желудочка до 123 г/м2 и признаки интрамиокардиального фиброза. Кроме того, имелись симптомы поражения почек – снижение расчетной скорости клубочковой фильтрации до 62 мл/мин/1,73 м2 при отсутствии протеинурии.

Одновременно мы обследовали 67-летнюю мать пациента, у которой за 2 года до госпитализации в клинику также была выявлена необъяснимая ГЛЖ, сопровождавшаяся постоянной формой фибрилляции предсердий, частой желудочковой экстрасистолией и сердечной недостаточностью, в связи с чем принимала β-адреноблокаторы, мочегонные средства, дигоксин, антикоагулянты. При МРТ сердца определялись утолщение межжелудочковой перегородки (19 мм) и задней стенки левого желудочка (12 мм), увеличение индекса массы миокарда левого желудочка до 141 г/м2 и участки интрамиокардиального фиброза. При МРТ головного мозга выявлены многочисленные очаги в белом веществе, а при осмотре окулистом – воронковидная кератопатия, характерная для болезни Фабри, диагноз которой подтверждался результатами молекулярногенетического исследования (мутация с.145C>G), повышением уровня Lyso-GL3 до 23 нг/мл и снижением активности α-галактозидазы А. Пациент и его мать в течение 1,5 лет получают ферментозаместительную терапию.
Представленные наблюдения демонстрируют важность скрининга в диагностике болезни Фабри у пациентов с необъяснимой ГЛЖ, так как клинически заподозрить правильный диагноз было сложно в связи с отсутствием типичных ранних симптомов – нейропатической боли и ангиокератом. С целью диагностики болезни Фабри у мужчин необходимо определять активность α-галактозидазы А и/или уровень Lyso-GL3 в высушенных пятнах крови. У женщин активность фермента нередко остается нормальной или снижается незначительно, поэтому более информативным считают определение уровня Lyso-GL3. Для подтверждения диагноза проводят молекулярно-генетическое исследование с целью выявления патогенной мутации гена GLA (в Российской Федерации все эти исследования выполняются бесплатно).
Н.Р. Носова. При анализе клинической картины обращали на себя внимание позднее развитие ГЛЖ и наличие ее не только у пробанда, но и его матери. Как указано выше, поражение внутренних органов при болезни Фабри, в отличие от некоторых других наследственных болезней, у мужчин обычно отмечается в возрасте 30-40 лет, а у женщин – в более старшем возрасте. Наследование болезни Фабри сцеплено с Х-хромосомой, поэтому у матери пациента обычно наблюдаются те или иные проявления заболевания, хотя фенотип его может отличаться. У пробанда с 18-летнего возраста отмечались снижение потоотделения, которое встречается у большинства мужчин с болезнью Фабри, и лимфедема. По данным регистра Fabry Outcomes Survey (n=714), частота лимфедемы при этом заболевании составила 16% у мужчин и 6% у женщин [11]. У матери пробанда была выявлена вихревидная кератопатия (коричнево-золотистые отложения в роговице в виде волнообразных линий, исходящих из одной центральной точки), которая является одним из клинических критериев диагноза болезни Фабри. По нашим данным, частота вихревидной кератопатии у 69 взрослых пациентов с болезнью Фабри составила 65,2%, в том числе 56,4% у мужчин и 76,7% у женщин [12]. В отличие от ГКМП, гипертрофия миокарда как у пробанда, так и его матери была выражена умеренно и не сопровождалась обструкцией выносящего тракта левого желудочка. У взрослых пациентов с болезнью Фабри обычно наблюдается поражение не только сердца, но и почек (альбуминурия/протеинурия, снижение скорости клубочковой фильтрации) и головного мозга (очаговые изменения в белом веществе при МРТ, транзиторные ишемические атаки/инсульт).
Е.А. Каровайкина. При болезни Фабри проводят заместительную терапию рекомбинантными препаратами α-галактозидазы А (агалсидазой альфа в дозе 0,2 мг/кг или агалсидазой бета в дозе 1 мг/кг), которые вызывают регресс ГЛЖ или по крайней мере замедляют прогрессирование кардиомиопатии. По данным D. Ger main и соавт., у пациентов с болезнью Фабри, начавших лечение в более молодом возрасте (18-30 лет), средняя масса миокарда левого желудочка снижалась на 3,6 г в год, в то время как без лечения у мужчин того же возраста она увеличивалась на 9,5 г в год (р В.В. Рамеев. Причиной утолщения стенок сердца мо жет быть не только гипертрофия кардиомиоцитов, но и инфильтрация миокарда нерастворимым фибриллярным гликопротеидом – амилоидом. В настоящее время известно около 30 амилоидогенных белков, однако более 95% случаев амилоидоза сердца обусловлены ALамилоидозом или реже транстиретиновым (ATTR) амилоидозом. AL-амилоидоз развивается при отложении моноклональных иммуноглобулинов у больных лимфоплазмаклеточными дискразиями, в том числе множественной миеломой. ATTR-амилоид (мутантный и дикого типа) образуется из транстиретина, синтезируемого в основном печенью и выполняющего функции транспортного белка тироксина и витамина А. Причи ной развития ATTR-амилоидоза дикого типа (стар ческого) считают возрастное снижение активности ферментных систем гепатоцитов, что приводит к пре имущественнои секреции нестабильных мономерных форм транстиретина, которые легко агрегируют в тканях с образованием амилоида. В основе наследственного ATTR-амилоидоза лежат мутации в гене TTR, сопровождающиеся синтезом транстиретина, который не способен образовывать тетрамеры и обладает очень высокой амилоидогенностью.
А.С. Рамеева. Пациентка Б., 50 лет, впервые обследована в клинике им. Е.М. Тареева в январе 2015 года. В течение года беспокоили боли в области сердца и нарастающая сердечная недостаточность. При эхокардиографии выявлено утолщение межжелудочковой перегородки и задней стенки левого желудочка до 14 мм, нарушение диастолической функции по рестриктивному типу. При коронарографии обнаружен умеренный стеноз правой коронарной артерии (50%). При обследовании в российском кардиологическом научном центре в декабре 2014 года определялись небольшая протеинурия (0,14 г/л), снижение вольтажа зубцов ЭКГ (рис. 4), увеличение толщины межжелудочковой перегородки и задней стенки левого желудочка до 18 мм, дилатация левого предсердия при отсутствии дилатации левого желудочка и снижения фракции выброса, при МРТ сердца – диффузное неравномерное субэндокардиальное накопление контрастного вещества. Выс ка зано предположение об амилоидозе, диагноз которого был подтвержден при биопсии миокарда. При исследовании крови методом Freelite отмечено резкое увеличение концентрации свободных легких цепей лямбда типа до 1383 мг/л (в норме 5,7-26,3 мг/л), указывавшее на наличие AL-амилоидоза. При трепанобиопсии диагностирована множественная миелома (увеличение числа плазматических клеток до 20%). Пациентке проводилась терапия бортезомибом, мелфаланом и дексаметазоном, на фоне которой нормализовалась концентрация свободных легких цепей лямбда типа и достигнута компенсация сердечной недостаточности.

В.В. Рамеев. Таким образом, у пациентки был диагностирован AL-амилоидоз с поражением сердца в рамках множественной миеломы. Заподозрить амилоидоз сердца позволяли возраст пациентки, быстрое развитие тяжелой сердечной недостаточности, которая плохо поддавалась симптоматической терапии, эхокардиографические признаки рестриктивного поражения сердца (увеличение левого предсердия при отсутствии дилатации левого желудочка и снижения фракции выброса), симметричное утолщение межжелудочковой перегородки и стенки левого желудочка без обструкции выносящего тракта, снижение вольтажа зубцов комплекса QRS на ЭКГ. Последний признак отличает амилоидоз сердца от ГЛЖ, хотя истинное снижение амплитуды QRS (менее 5 мм в отведениях от конечностей и менее 10 мм в грудных отведениях) наблюдается только у половины больных AL-амилоидозом сердца [14]. Однако даже при отсутствии низкого вольтажа комплексов QRS следует учитывать возможное его несоответствие степени ГЛЖ при эхокардиографии. Важное диагностическое значение имеют результаты МРТ сердца, которая позволяет не только измерить массу миокарда левого желудочка, но и выявить диффузное накопление гадолиния в субэндокарде [15].
В представленном наблюдении диагноз был подтвержден при биопсии миокарда, хотя для гистологического исследования могут быть использованы и другие ткани, более доступные для биопсии, в том числе слизистая оболочка прямой или двенадцатиперстной кишки, подкожно-жировая клетчатка, почка. На наличие AL-амилоидоза указывала моноклональная секреция лямбда-цепей иммуноглобулинов, выявленная с помощью метода Freelite, а также снижение отношения каппа- и лямбда-цепей до 0,01 (для AL-амилоидоза характерна величина этого показателя 1,65). У 7-10% больных AL-амилоидоз развивается в рамках множественной миеломы, для исключения которой всем пациентам следует проводить биопсию костного мозга.
Данный случай демонстрирует возможность “изолированного» поражения сердца при AL-амилоидозе, хотя у большинства пациентов наблюдаются и другие проявления, в том числе протеинурия/нефротический синдром, увеличение печени и селезенки, макроглоссия, периорбитальная пурпура, диарея, невропатия и/или ортостатическая гипотензия. У пациентки имелась небольшая протеинурия, однако она могла быть связана с застоем крови по большому кругу кровообращения.
Современная химиотерапия, включающая в себя ингибитор протеасом бортезомиб, позволяет добиться полного или частичного гематологического ответа у значительной части больных AL-амилоидозом, предупредить отложение амилоида в других органах и прогрессирование сердечной недостаточности.
П.П. Тао. Пациент В., 65 лет, русский, был обследован в клинике им. Е.М. Тареева в декабре 2015 года. В течение трех лет отмечается нарастающее снижение болевой, температурной и тактильной чувствительности в области кистей и стоп по типу “перчаток» и “носков», а в течение одного года – прогрессирующая застойная сердечная недостаточность. При электромиографии выявлены грубые аксонально-демиелинизирующие нарушения, наиболее выраженные в малоберцовых нервах, а при эхокардиографии – картина рестриктивного поражения сердца: дилатация левого предсердия, утолщение стенок левого желудочка, зоны гипокинезии в межжелудочковой перегородке, уплотнение эндокарда, нормальная фракция выброса левого желудочка. Уровень мозгового натрийуретического пропептида был повышен в 30 раз по сравнению с верхней границей нормы. При коронарографии обнаружен стеноз передней межжелудочковой ветви (65%) и правой коронарной артерии (75%). Проведены чрескожная коронарная ангиопластика и стентирование правой коронарной артерии, однако после вмешательства сердечная недостаточность сохранялась, появилась ортостатическая артериальная гипотензия. По данным эхокардиографии, толщина межжелудочковой перегородки достигла 22 мм, определялись множественные очаги зернистости в миокарде, фракция выброса левого желудочка снизилась с 57% до 45%. При МРТ сердца с контрастированием гадолинием на фоне выраженного утолщения стенок левого желудочка отмечено циркулярное субэндокардиальное диффузное накопление контрастного вещества в миокарде левого и передней стенки правого желудочков (рис. 5). Проводилась повторная биопсия слизистой оболочки прямой кишки, однако амилоид выявить не удалось. При иммунохимическом исследовании исключена моноклональная секреция легких цепей иммуноглобулинов, характерная для AL-амилоидоза. При молекулярно-генетическом исследовании обнаружена мутация гена TTR (Val30Met), подтверждающая диагноз наследственного ATTR-амилоидоза. При сцинтиграфии миокарда с 99mTcPYP выявлено накопление радиоизотопного препарата 2 степени, в связи с чем от биопсии миокарда было решено воздержаться. С целью восстановления тетрамерной структуры мутантного транстиретина пациент в течение 2 лет получает тафамидис 20 мг/сут. Переносимость лечения удовлетворительная, существенного прогрессирования амилоидоза не произошло.

В.В. Рамеев. Как и в предыдущем наблюдении, заподозрить амилоидоз у 65-летнего пациента позволяло типичное рестриктивное поражение левого желудочка, характеризующееся развитием тяжелой сердечной недостаточности при отсутствии дилатации и существенного снижения фракции выброса левого желудочка. При эхокардиографии определялись множественные очаги зернистости, которые нередко выявляют у пациентов с амилоидной инфильтрацией миокарда, а при МРТ сердца – диффузное накопление гадолиния в субэндокарде. В пользу системного амилоидоза свидетельствовала и периферическая полиневропатия, которая встречается как при AL-, так и семейном ATTR-амилоидозе и может предшествовать поражению сердца. В большинстве случаев развивается неуклонно прогрессирующая, симметричная дистальная невропатия, начинающаяся с сенсорных расстройств, в первую очередь болевой и температурной чувствительности, с последующим присоединением нарушений вибрационной и позиционной чувствительности и двигательных нарушений. Ранними симптомами невропатии бывают парестезии или мучительные дизестезии. Часто встречается синдром запястного канала, проявляющийся болями и парестезиями в I-III пальцах кисти с постепенной атрофией мышц тенара и обусловленный сдавлением срединного нерва в запястном канале амилоидом, откладывающимся в связках запястья [16].
Учитывая отсутствие моноклональной секреции легких цепей иммуноглобулинов и наличие мутации гена TTR, был установлен диагноз наследственного ATTRамилоидоза [17]. Диагноз амилоидоза должен быть подтвержден при гистологическом исследовании, однако результаты повторной биопсии прямой кишки оказались отрицательными. Тем не менее, наличие ATTRамилоидоза не вызывало сомнения с учетом типичной клинической картины и результатов молекулярно-генетического исследования. Кроме того, при сцинтиграфии было выявлено накопление 99mTcPYP в миокарде 2 степени (т.е. умеренное накопление, соответствующее таковому в костной ткани). В 2016 году в многоцентровом исследовании было показано, что накопление в миокарде 99mTcPYP 2-3 степени (рис. 6) при отсутствии моноклональной гаммапатии обладает 100% специфичностью в диагностике ATTR-амилоидоза сердца и фактически позволяет отказаться от биопсии миокарда [18]. Более того, сцинтиграфия с 99mTcPYP дает возможность дифференцировать ATTR-амилоидоз от AL-амилоидоза, при котором накопление радиоактивного препарата в миокарде отсутствует или не превышает 1 степени.

С середины 90-х годов ХХ века для лечения ATTRамилоидоза применяли трансплантацию печени, позволяющую восстановить синтез нормального транс тиретина. В последние годы более перспективной тактикой лечения считают медикаментозную стабилизацию тетрамерной структуры транстиретина и предотвращение образования амилоидогенных мономеров белка. Первый такой препарат – тафамидис – уже применяется в Европе и в Российской Федерации.
С.В. Моисеев. Представленные наблюдения иллюстрируют широкий спектр причин ГЛЖ неясной этиологии, которые включают в себя не только истинную гипертрофию миокарда, но и некоторые инфильтративные заболевания, такие как системный амилоидоз, имитирующие ГКМП. Разработать четкий алгоритм дифференциальной диагностики ГКМП достаточно сложно, учитывая вариабельность течения заболеваний, сопровождающихся ГЛЖ. Например, некоторые тяжелые генетические заболевания, такие как болезнь Помпе (гликогеноз II типа, связанный с дефицитом фермента кислой α-глюкозидазы в лизосомах), могут проявиться в возрасте 40-50 лет и старше, в то время как при системных заболеваниях, в том числе болезни Фабри или амилоидозе, экстракардиальные симптомы иногда отсутствуют. Ключевую роль в диагностике наследственных заболеваний, таких как ГКМП, ATTRамилоидоз, болезни Фабри, Помпе, Данона и др., играют изучение семейного анамнеза и молекулярногенетическое исследование.