Диклофенак или ортофен чем отличается
Обезболивающие мази: грамотная консультация
Отвечаем на вопросы покупателей о топических НПВС — про их эффективность, нанесение и безопасные сочетания
Нестероидные противовоспалительные средства (НПВС) — один из наиболее ходовых товаров аптечного ассортимента. Их назначают в ходе терапии целого ряда заболеваний и состояний, причем зачастую целыми курсами. Даже имея четкие указания лечащего врача, многие соотечественники сомневаются и ищут информацию об ЛС в интернете. А затем приходят в аптеку и задают вопросы провизору, надеясь оправдать свои догадки или развеять сомнения. В этой ситуации первостольнику необходимо, с одной стороны, помочь посетителю аптеки, а с другой — не брать на себя роль врача. Именно в этом ключе мы и раскроем сегодня тему топических НПВС — в виде грамотных ответов на вопросы покупателей.
Нестероидные противовоспалительные средства помогают от боли только в виде таблеток или уколов, а все эти мази неэффективны, баловство одно. Ведь так?
Нет, здесь вы не правы, топические НПВС помогают, а в ряде случаев даже имеют сопоставимую с пероральными формами эффективность. Обезболивающий эффект топических форм НПВС, в особенности диклофенака и кетопрофена, многократно доказан в сравнении с плацебо при острых и хронических костно-мышечных болях. Считается, что при правильном использовании эффективность НПВС в форме мази не уступает «таблеткам», при этом частота развития серьезных побочных эффектов, вроде язв ЖКТ, значительно ниже при использовании местных форм препаратов. Это отражено как в отечественных, так и международных официальных рекомендациях по лечению остеоартрита: первый «медикаментозный» шаг в контроле болевого синдрома — применение противовоспалительных мазей (совместно с приемом парацетамола) [1–5].
Что значит — «при правильном использовании»? Помазал, да и всё.
Топические формы НПВС желательно некоторое время втирать, а не просто нанести. Обезболивающий и противовоспалительный эффект мази будет значительно выше, если не просто «помазать», а некоторое время активно втирать средство в кожу над больным местом. В ходе соответствующих исследований было выяснено, что даже 45‑секундное втирание геля диклофенака диэтиламина в пять раз увеличивало чрескожное поступление препарата по сравнению с простым нанесением на кожу. И нужно помнить, что обезболивающие мази на основе НПВС действуют на очаги боли, расположенные сразу под кожей. Если говорить о суставах — то это колени, локти и мелкие суставы кистей. До тазобедренного сустава местная форма, скорее всего, «не достанет». Втирать следует «по окружности» конечности, например, не только в тыльную, но и в ладонную поверхность межфалангового сустава [6, 7].
Какой из топических НПВС лучше?
Всё индивидуально. Если обезболивающий эффект пероральных и инъекционных форм НПВС еще более-менее удается ранжировать, то объективная сравнительная оценка топических средств сильно затруднена. Причина этого заключается в том, что, наряду с, собственно, действующим веществом, немалую роль играют интенсивность втирания, вспомогательные вещества (например, диметилсульфоксид) и эффект плацебо. Большинство исследований эффективности топических НПВС сосредоточено на диклофенаке и кетопрофене. Повышенное внимание к ним обусловлено тем, что диклофенак — единственное НПВС, чьи топические формы выпуска одобрены американским Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA), а кетопрофен, соответственно, разрешен в большинстве других стран мира. Заслуживающих доверия данных по сравнению этих двух препаратов между собой пока не опубликовано. Эффективность других нестероидных противовоспалительных средств для наружного применения (ибупрофена, фенилбутазона, пироксикама, нимесулида и др.) никто под сомнение не ставит, каждому из них в свое время были посвящены по нескольку клинических испытаний, но география их использования значительно скромнее и часто ограничена несколькими развивающимися странами [2, 8].
Вспомогательные вещества в составе местной формы НПВС имеют значение?
Да, они улучшают проницаемость кожи и, возможно, определенным образом усиливают терапевтический эффект. В отдельных исследованиях было продемонстрировано, что, например, местные препараты диклофенака с диметилсульфоксидом (ДМСО) и диклофенака диэтиламин 1,16 % проникают через кожу быстрее, чем «обычные» гели с диклофенаком натрия. Кроме того, ДМСО сам по себе способен оказывать небольшой противовоспалительный эффект. Твердых доказательств увеличения обезболивающего эффекта за счет перечисленных добавок нет, однако их использование как минимум помогает преодолевать индивидуальные особенности кожи [7, 9–11].
Можно ли одновременно принимать таблетки НПВС и использовать топическую форму?
Прямо инструкциями по применению это не запрещено, но не рекомендуется, и, по‑видимому, не имеет смысла. По данным единственного заслуживающего доверия исследования на эту тему, значимого усиления обезболивающего эффекта при комбинации местной и системной форм НПВС не было. При этом такое применение ЛС несколько повысило частоту ректальных кровотечений. В клинических испытаниях пероральный прием диклофенака и ибупрофена в дозах, превышающих рекомендуемые в 2 и 3 раза, также не приводил к усилению обезболивания. Эффект от комбинации таблеток и топической формы НПВС, скорее всего, не будет выражен. При этом вероятность появления нежелательных реакций немного, но повышается. Поэтому такое сочетание не рекомендуется. Обычно если местное средство не помогает, то врач его отменяет и переводит пациента на пероральный прием [12, 13].
Можно ли употреблять топические НПВС при эрозиях или язвах желудка?
Согласно инструкциям, можно «с осторожностью». Концентрация активного вещества в плазме крови после использования топических НПВС составляет менее 10 % от той, что достигается пероральным приемом. Частота развития побочных реакций со стороны ЖКТ при использовании местных форм НПВС не отличается от таковой при втирании плацебо и значительно ниже, чем при использовании системных средств. Тем не менее, эти препараты на всякий случай не рекомендуется наносить на кожу при желудочно-кишечных кровотечениях и обострении язвенной болезни желудка или двенадцатиперстной кишки [5, 14].
Можно ли использовать топические формы НПВС при наличии аллергии на тот же препарат в пероральной и/или парентеральной форме?
Нельзя, причем даже в том случае, если есть аллергия на другое НПВС. Несмотря на низкое поступление активного вещества в системный кровоток при местном использовании, при наличии сенсибилизации к какому‑либо НПВС риск развития серьезных аллергических реакций сохраняется. Это правило действует и в обратном порядке: при развитии контактного дерматита после применения какого‑либо местного НПВС, не рекомендуется использовать его системные формы [15, 16].
Можно наносить мази нестероидные противовоспалительные под повязку?
Не рекомендуется, если нет прямых врачебных указаний. Использование марлевых, а тем более окклюзионных повязок приводит к значительному и непрогнозируемому поступлению активного вещества в подлежащие ткани. Это может несколько усилить терапевтический эффект, но и увеличивает шансы развития нежелательных реакций.
Через какое время после использования топического НПВС разрешены водные процедуры?
Сколько раз в день и как долго можно мазать такие ЛС?
Как правило, три-четыре раза в день в течение двух недель. Топические НПВС действуют довольно быстро — эффект наступает в течение часа — и помогают контролировать острую соматическую боль средней интенсивности. С хронической болью они справляются хуже. Если эффекта нет в течение двух недель правильного использования, стоит обратиться к врачу. Есть вероятность, что он порекомендует перейти на пероральные формы либо другую группу препаратов.
0 комментариев 42098 просмотров
Нашли ошибку? Выделите текст и нажмите Ctrl+Enter.
Разумный выбор НПВП при сочетанной патологии: заболеваниях суставов и гипертонической болезни
Нестероидные противовоспалительные препараты (НПВП) являются одной из основных групп лекарственных средств, применяемых при лечении ревматоидного артрита (РА). Противовоспалительный и анальгетический эффект данной группы препаратов связан с подавлением а
Нестероидные противовоспалительные препараты (НПВП) являются одной из основных групп лекарственных средств, применяемых при лечении ревматоидного артрита (РА). Противовоспалительный и анальгетический эффект данной группы препаратов связан с подавлением активности циклооксигеназы-2 (ЦОГ-2) в очаге воспаления — ключевого фермента синтеза простагландинов провоспалительной активности, а подавление изоформы ЦОГ-1 приводит к нарушению физиологических реакций: в частности, к нарушению синтеза простагландинов класса Е в слизистой оболочке желудка и развитию НПВП-гастропатии.
Большинство «стандартных» НПВП способно подавлять активность обеих изоформ ЦОГ, поэтому их применение часто ограничено из-за развития побочных эффектов, в первую очередь — со стороны желудочно-кишечного тракта (ЖКТ). Субъективные симптомы со стороны ЖКТ встречаются примерно у трети больных, а в 5% случаев представляют серьезную угрозу жизни пациентов. Именно поэтому в последние годы особо пристальное внимание привлекает проблема безопасного применения НПВП. Полагают, что препараты более селективные в отношении ЦОГ-2 реже вызывают развитие НПВП-гастропатии. Изучение механизмов действия НПВП послужило толчком к созданию новых препаратов, обладающих всеми положительными свойствами стандартных НПВП, но менее токсичных, — это специфические ингибиторы ЦОГ-2 [3, 4, 13].
В последние годы особую актуальность приобрела проблема взаимодействия НПВП и гипотензивных препаратов, а также связи между применением НПВП и развитием гипертонической болезни (ГБ). Неселективные НПВП могут привести к повышению АД (преимущественно диастолического) не только у больных артериальной гипертензией (АГ), но и у лиц с нормальным АД за счет ингибиции системного и локального, внутрипочечного синтеза простагландинов. Известно, что постоянный прием НПВП вызывает у пациентов увеличение АД в среднем на 5,0 мм рт. ст. Характерным свойством НПВП является также взаимодействие с гипотензивными препаратами, в основе гипотензивного действия которых лежат преимущественно простагландин-зависимые механизмы. Назначение НПВП пациентам, получающим по поводу АГ β-адреноблокаторы, ингибиторы АПФ и диуретики, приводит к снижению гипотензивного эффекта [8, 9].
Нимесулид был разработан еще в 1985 г. и является одним из первых НПВП, при изучении которого продемонстрирована более высокая селективность в отношении ЦОГ-2 и накоплен большой клинический опыт. В многочисленных исследованиях in vitro и in vivo было показано, что нимесулид примерно в 5–20 раз более селективно ингибирует ЦОГ-2, чем ЦОГ-1. Большой интерес представляет и тот факт, что нимесулид обладает широким спектром ЦОГ-независимых эффектов, которые могут определять его противовоспалительную, анальгетическую и хондропротективную активность [1, 2, 5, 7, 11, 12].
Нимесулид хорошо переносится больными и редко вызывает развитие серьезных побочных эффектов, требующих отмены препарата. По результатам ряда исследований, частота побочных эффектов, развивающихся на фоне приема нимесулида, достоверно не отличается от плацебо или ниже, чем при приеме других НПВП. Например, по данным мета-анализа, у больных, получавших нимесулид, общая частота побочных реакций со стороны ЖКТ была значительно ниже (8,7%), чем при назначении других НПВП (16,8%). Низкую частоту поражения ЖКТ на фоне лечения нимесулидом связывают не только с ЦОГ-2-селективностью препарата, но и с антигистаминным действием, приводящим к снижению секреции соляной кислоты в желудке [6, 10, 13].
Таким образом, нимесулид относится к селективным ингибиторам ЦОГ-2, сравним по эффективности с «классическими» НПВП, но отличается более благоприятным профилем токсичности. Фармакоэкономический анализ свидетельствует о преимуществах нимесулида по сравнению с диклофенаком, в первую очередь в связи с более низкой частотой поражения ЖКТ.
Целью нашего исследования явилось изучение эффективности и переносимости найза (нимесулида) у больных РА в сравнении с ортофеном (диклофенаком).
Материалы и методы
Оба НПВП назначались случайным способом 40 больным с момента первого установления диагноза РА, согласно критериям Американской коллегии ревматологов. Найз применялся в виде таблеток по 100 мг дважды в день, ортофен — в виде таблеток по 25 мг в суточной дозе 150 мг. Одновременно всем больным проводилась базисная терапия, преимущественно метотрексатом или сульфасалазином. Эффективность и переносимость НПВП оценивались через 3 нед. от начала лечения, т. е. в те сроки, когда эффект базисных препаратов еще не имел клинической значимости.
В I группе из 20 пациентов, получавших найз, было 14 женщин и 6 мужчин, средний возраст пациентов составил 55,1 года, длительность суставного синдрома к моменту установления диагноза — от 3 до 14 мес., в среднем — 7,25 мес. Во II группе из 20 больных, получавших ортофен, было 18 женщин и 2 мужчин, средний возраст больных — 42,75 года, длительность суставного синдрома — от 2 до 14 мес., в среднем — 5,65 мес. Клиническая характеристика обеих групп представлена в таблице 1.
Результаты лечения оценивались по динамике показателей суставного синдрома (суставной индекс Ричи (СИ), счет болезненных суставов (СБС), счет припухших суставов (СПС), продолжительность утренней скованности (мин), выраженность боли по визуально-аналоговой шкале (ВАШ)) и на основании общей оценки эффективности лечения, по мнению врача и больного. Кроме того, у всех больных оценивалась динамика АД на фоне лечения НПВП.
Результаты
В I группе на фоне лечения найзом в суточной дозе 200 мг за 3 нед. лечения достигнута достоверная динамика показателей суставного синдрома. При этом эффективность терапии оценена 17 пациентами (85%) как хорошая и 3 (15%) — как удовлетворительная. По мнению врача, в 16 случаях (80%) наблюдалась хорошая эффективность препарата, в 4 случаях (20%) — удовлетворительная (рис. 1). Переносимость найза у 85% была хорошей, только у 2 больных (10%) отмечались изжога и гастралгии, у 1 больного (5%) — чувство тяжести в эпигастральной области. Однако при фиброгастроскопии у этих пациентов не выявлено эрозивного повреждения слизистой оболочки желудка. В группе больных, принимавших найз, не потребовалось отмены препарата ни у одного больного.
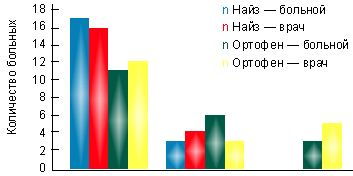 |
| Рисунок. Оценка эффективности препаратов на основании мнения больного и врача |
Во II группе на фоне терапии ортофеном в суточной дозе 150 мг через 3 нед. также отмечена существенная динамика показателей суставного синдрома. Однако оценка эффективности терапии показала, что только 11 пациентов (55%) оценили эффективность препарата как хорошую, 6 (30%) — как удовлетворительную и трое больных (15%) признали ее неудовлетворительной. По мнению лечащего врача, достаточная эффективность ортофена, соответствующая градации «хорошая», отмечалась в 12 случаях (60%), удовлетворительная — в 3 (15%) и неудовлетворительная — в 5 (25%) случаях (рис.).
Переносимость препарата ортофен была хуже, чем у найза: у 9 пациентов (45%) отмечались симптоматические побочные эффекты, причем у 3 больных (15%) потребовалась отмена препарата через 2 нед. от начала лечения в связи с выявленным при ФГДС эрозивным поражением слизистой оболочки антрального отдела желудка. В целом из побочных эффектов чаще отмечались изжога — у 7 (35%) пациентов, гастралгии — у 8 (40%), тошнота — у 4 (20%) и диарея — у 2 (10%) больных.
Особый интерес представляет влияние исследуемых НПВП на уровень АД, так как из 40 больных у 15 имелась сопутствующая ГБ, по поводу которой проводилась гипотензивная терапия. Динамика уровня АД в обеих группах на фоне лечения найзом и ортофеном представлена в таблице 2. Следует отметить, что терапия найзом не требовала усиления проводимой гипотензивной терапии (β-блокаторами, ингибиторами АПФ, диуретиками) и не вызывала повышения АД у ранее нормотензивных пациентов. В то же время лечение ортофеном потребовало коррекции доз гипотензивных препаратов у 4 (66,7%) из 6 больных ГБ и вызвало повышение АД у 5 (25%) женщин в постменопаузе с исходно высоконормальным АД. Данный эффект неселективного НПВП — ортофена — следует считать предсказуемым, особенно с учетом характера проводимой гипотензивной терапии. Все больные ГБ получали в разных комбинациях β-адреноблокаторы, ингибиторы АПФ и диуретики; при этом ни одному пациенту не был назначен дигидропиридиновый антагонист Са — амлодипин, который является препаратом выбора для лечения АГ в условиях терапии НПВП.
Таким образом, результаты открытого клинического исследования показали, что препарат найз у больных РА проявляет выраженную противовоспалительную активность, превосходящую диклофенак. При этом найз характеризуется хорошей переносимостью, малым числом симптоматических побочных эффектов и превосходит с этой точки зрения наиболее широко применяемый в клинической практике ортофен. Дополнительным преимуществом препарата найз можно считать менее выраженное влияние на уровень АД. При назначении найза не требовалось увеличения дозы гипотензивных препаратов. С учетом высокой распространенности эссенциальной гипертензии в популяции, взаимодействие НПВП с наиболее часто используемыми гипотензивными средствами представляется актуальной проблемой. Ревматические заболевания, требующие постоянной терапии НПВП, часто сочетаются с АГ. При этом у большинства больных ГБ коррекция АД может достигаться только благодаря комбинированной антигипертензивной терапии, а монотерапия дигидропиридиновыми антагонистами Са признается недостаточно эффективной. Следовательно, в большинстве случаев при лечении воспалительных ревматических заболеваний у лиц, страдающих ГБ, невозможно полностью нивелировать отрицательное взаимодействие «стандартных» НПВП с основными кардиологическими препаратами — β-адреноблокаторами, ингибиторами АПФ и диуретиками. В такой ситуации представляется рациональным выбор для проведения противовоспалительной терапии специфических ингибиторов ЦОГ-2, представителем которых является найз.
Литература
И. М. Марусенко, кандидат медицинских наук
Н. Н. Везикова, кандидат медицинских наук, доцент
В. К. Игнатьев, доктор медицинских наук, профессор
Петрозаводский университет, кафедра госпитальной терапии
Нестероидные противовоспалительные препараты для наружного применения в лечении скелетно-мышечных болевых синдромов
Боль в спине, шее, суставах является ведущим симптомом при заболеваниях опорно-двигательного аппарата и относится к наиболее частой причине обращения к врачу. В лечении скелетно-мышечных болей наиболее часто применяются нестероидные противовоспалительные
Боль в спине, шее, суставах является ведущим симптомом при заболеваниях опорно-двигательного аппарата и относится к наиболее частой причине обращения к врачу. В лечении скелетно-мышечных болей наиболее часто применяются нестероидные противовоспалительные средства (НПВС). В практической деятельности врача, занимающегося лечением болевых синдромов, определяющим критерием выбора лекарственного средства является его анальгетическая эффективность, индивидуальная непереносимость, вероятность возникновения осложнений или побочных эффектов [1, 3].
Применение НПВС внутрь или парентерально часто сопровождается у пациентов развитием побочных эффектов и осложнений, в первую очередь со стороны желудочно-кишечного тракта, почек, центральной нервной системы. Возможность применять лекарственные средства местно (наружно) позволяет доставлять активное вещество максимально близко к источнику болевого ощущения, не вызывая системного воздействия, что значительно уменьшает риск развития побочных эффектов и осложнений.
В настоящее время арсенал препаратов для местного применения, содержащих НПВС, при заболеваниях опорно-двигательного аппарата достаточно широк, в том числе в связи с выпуском одних и тех же препаратов разными производителями под разными (патентованными) названиями.
Все НПВС для местного применения можно разделить на следующие группы по основному действующему лекарственному веществу, входящему в состав многокомпонентных или комбинированных препаратов [2].
1. Действующее вещество — диклофенак.
2. Действующее вещество — ибупрофен.
- — Нурофен гель.
— Долгит.
— Долгит крем.
3. Действующее вещество — индометацин.
4. Действующее вещество — кетопрофен.
- — Артрозилен.
— Быструмгель.
— Кетонал.
— Кетопрофен Врамед.
— Фастум.
— Феброфид.
— Флексен.
5. Действующее вещество — нимесулид.
6. Действующее вещество — пироксикам.
Основным механизмом действия препаратов монокомпонентного состава с действующим веществом диклофенаком является неселективное ингибирование активности циклооксигеназы (ЦОГ): ЦОГ-1 и ЦОГ-2, что приводит к нарушению метаболизма арахидоновой кислоты и подавлению синтеза простагландинов в очаге воспаления. При наружном применении данных препаратов возникают ослабление болей в месте их нанесения, уменьшение отечности и увеличение объема движений в пораженных суставах.
Показаниями для применения служат болевой синдром при воспалительных и дегенеративных заболеваниях суставов и позвоночника, ревматических поражениях мягких тканей, посттравматическом болевом синдроме, невралгии.
Побочные действия могут наблюдаться в виде местных кожных проявлений, при длительном применении препаратов возможны резорбтивное действие и развитие системных реакций (крапивница, бронхоспазм, ангионевротический отек).
Противопоказаниями для применения являются язвенная болезнь желудка и двенадцатиперстной кишки в стадии обострения, нарушение кроветворения, нарушение целостности кожных покровов, беременность, лактация, возраст до 6 лет, повышенная чувствительность к диклофенаку.
При сочетании диклофенака с ментолом в препарате Диклофенакол также дополнительно оказывается местное раздражающее и слабовыраженное анальгезирующее действие.
При сочетании диклофенака с метилсалицилатом, ментолом, льняным маслом в препарате Диклоран плюс противовоспалительное и анальгетическое действие диклофенака усиливается вторым препаратом из группы НПВС — метилсалицилатом, а также a-линоленовой кислотой, входящей в состав льняного масла; ментол оказывает местное раздражающее и слабовыраженное анальгезирующее действие.
Основным фармакологическим эффектом препаратов с действующим веществом ибупрофеном является местное анальгезирующее и противовоспалительное действие, механизм которого связан с торможением синтеза простагландинов за счет неселективного блокирования фермента ЦОГ.
Показаниями к применению являются миалгии, боли в спине, артриты, повреждения и растяжения связок, спортивные травмы, невралгии.
Побочные эффекты чаше всего отмечаются в виде небольшого покраснения кожи, жжения или покалывания. Системные реакции в виде аллергических реакций и бронхоспазма возникают чрезвычайно редко.
Противопоказанием к применению являются «аспириновая» астма, возраст до 12 лет, повышенная чувствительность к компонентам препарата. С осторожностью препарат применяют при сопутствующих заболеваниях печени и почек, желудочно-кишечного тракта, крапивнице, рините, беременности и лактации.
Основным фармакологическим эффектом препаратов монокомпонентного состава с действующим веществом индометацином является местное выраженное противовоспалительное и анальгетическое действие за счет неселективного блокирования фермента ЦОГ и подавления синтеза простагландинов. Показаниями к применению служат болевой синдром и местные воспалительные реакции при ревматоидных заболеваниях, острых скелетно-мышечных болях, подагре, невралгиях.
Побочные эффекты наблюдаются в виде местных кожных реакций (гиперемия, шелушение, крапивница и др.). Системные реакции в виде диспепсии, тошноты, головокружения, атаксии возможны при длительном, более 10 дней, применении либо при нанесении препарата на большой участок кожных покровов.
Препарат противопоказан при желудочно-кишечных заболеваниях, заболеваниях почек, центральной нервной системы, инфекционных заболеваниях, в период беременности и лактации, не назначается детям.
При сочетании индометацина с троксерутином в препарате Индовазин дополнительно оказывается местное противоотечное и ангиопротекторное действие.
Основным механизмом действия препаратов с действующим веществом кетопрофеном (производное пропионовой кислоты) является подавление активности ЦОГ-1 и ЦОГ-2, регулирующей синтез простагландинов. Противовоспалительная и анальгезирующая активность кетопрофена сходна с таковой индометацина и выше активности ибупрофена в 20 раз. Кетопрофен обладает антибрадикининовой активностью, стабилизирует лизосомальные мембраны, вызывает значительное торможение активности нейтрофилов у больных с ревматоидным артритом, подавляет агрегацию тромбоцитов.
Показаниями к применению являются острые и хронические воспалительные и дегенеративно-дистрофические заболевания опорно-двигательного аппарата, травмы.
Побочные действия наблюдаются в виде гиперемии кожи в месте нанесения препарата, фотосенсибилизации пурпуры. При длительном применении редко возможны системные реакции: боли в животе, рвота, астения, транзиторная дизурия.
Противопоказан к применению у пациентов с экземой, инфицированными ранами, у детей до 12 лет, при индивидуальной непереносимости препарата. С осторожностью возможно применение при беременности и в период лактации.
Основным механизмом действия препаратов с действующим веществом нимесулидом является селективное подавление активности ЦОГ-2, регулирующей синтез простагландинов. Нимесулид обратимо ингибирует синтез простагландина Е2 как в области воспаления, так и в восходящих путях ноцицептивой системы. Подавляет агрегацию тромбоцитов, высвобождение гистамина и фактора некроза опухоли a, обладает антиоксидантной активностью. Препарат хорошо переносится при длительной терапии. При местном применении вызывает уменьшение или исчезновение болей в месте нанесения геля, уменьшает отечность, утреннюю скованность суставов, способствует увеличению объема движений.
Показаниями к применению служат воспалительные заболевания с болевым синдромом умеренной интенсивности: заболевания опорно-двигательного аппарата, в том числе артриты, остеохондроз, остеоартроз, артралгии, миалгии, бурситы, травматические повреждения.
Побочные эффекты связаны с местными реакциями при нанесении геля — зуд, крапивница, шелушение, преходящее изменение цвета кожи — и не требуют отмены препарата.
Противопоказания: дерматозы, инфекции кожи в области применения геля, возраст до 2 лет, повышенная чувствительность к препарату, беременность и лактация.
Основным механизмом действия препаратов с действующим веществом пироксикамом является подавление синтеза простагландинов вследствие неселективного ингибирования ферментов ЦОГ-1 и ЦОГ-2. Применение препарата уменьшает отек, воспаление, мышечную и суставную боль, не вызывает сухости кожи.
Показаниями к применению является болевой синдром при спортивных травмах, анкилозирующем спондилоартрите, остеоартрозе, плечелопаточном периартрозе, тендините.
Побочные эффекты связаны с местными реакциями и проявляются в виде покраснения и шелушения, местного зуда, крапивницы.
Противопоказаниями для применения служат почечная недостаточность, возраст до 14 лет, беременность, индивидуальная непереносимость препарата.
Литература
Л. Е. Корнилова, кандидат медицинских наук
Е. Л. Соков, доктор медицинских наук, профессор
РУДН, Клиника лечения боли, ГКБ № 64, Москва