Диклофенак или кетопрофен что лучше
Кетопрофен (флексен) и диклофенак в лечении дорсалгий
Опубликовано в журнале:
«Лечение нервных болезней»
Проф. О. В. Воробьева, проф. Г. В. Ковров, Д.Л. Поздняков, Р. Б. Шаряпова
В терапии дорсопатий приоритетным является купирование острого болевого синдрома. Чем раньше начато лечение и быстрее достигнут значимый аналгетический эффект, тем меньше вероятность хронизации боли и лучше общий прогноз.
С позиций доказательной медицины золотым стандартом лечения патологических состояний, проявляющихся острой болью или острой болью с последующей хронизацией, являются нестероидные противовоспалительные препарты (НПВП).
Фундаментальный механизм действия НПВП связан с ингибицией синтеза циклооксигеназы (ЦОГ) — ключевого фермента метаболизма арахидоновой кислоты, предшественника простагландинов (ПГ). Накопление ПГ коррелирует с развитием интенсивности гипералгезии. Однако ПГ не являются модераторами боли, они лишь повышают чувствительность ноцицепторов к различным стимулам (повышение порога болевой чувствительности). Некоторые НПВП подавляют синтез ПГ очень сильно, другие слабо. При этом прямой связи между степенью подавления синтеза ПГ, с одной стороны, и аналгетической активностью, с другой, не выявлено.
В начале 90-х годов XX века было обнаружено существование двух изоформ ЦОГ (ЦОГ-1 и ЦОГ-2), играющих различную роль в норме и при патологии. Изофермент ЦОГ-1 вырабатывается в организме в непрерывном режиме (конституционная форма) и отвечает за физиологические реакции (текучесть крови, тонус сосудов, состояние слизистой оболочки желудочно-кишечного тракта, реабсорбция мочи, развитие плода). Напротив, ЦОГ-2 синтезируется только при воздействии патогенных факторов, приводящих к воспалительной реакции. Согласно современным исследованиям механизма действия НПВП, ингибиция ЦОГ-2 рассматривается как один из ведущих механизмов противовоспалительной активности, а ЦОГ-1 — развития побочных эффектов.
Несмотря на многолетний опыт применил НПВП, при индивидуальном подборе препарата врач испытывает определенные трудности, связанные как с широким ассортиментом лекарственных препаратов, так и с существенными колебаниями эффективности одного и того же лекарственного средства у отдельных больных со сходной формой заболевания. Тем не менее, одним из главных ориентиров в выборе оптимального НПВП является индивидуальная интенсивность болевых ощущений и прогнозируемая длительность применения НПВП. Сравнительные исследования эффективности НПВП весьма многочислены. Однако, в связи с дозозависимостью эффектов НПВП. применением их на различных клинических моделях, отсутствием единого стандарта оценки эффективности задача ранжирования НПВП по выраженности анальгетического эффекта крайне сложна. В целом для большинства препаратов этого класса прослеживается тенденция к преобладанию противовоспалительного эффекта при назначении высоких доз и аналгетического — при приеме низких.
Считается, что наиболее высокой аналгетической активностью после кеторолака обладают производные пропионовой кислоты (флурбипрофен, ибупрофен, кетопрофен, напроксен). В свою очередь, среди производных пропионовой кислоты лидирующее положение по аналгетической активности занимает кетопрофен. Высокий аналгетический эффект кетопрофена обусловлен способностью: быстро проникать через гемато-энцефалический барьер благодаря высокой жирорастворимости; селективно блокировать NMDA-рецепторы; контролировать уровень нейротрансмиттеров (серотонина); уменьшать выработку субстанции Р. Кетопрофен широко используется в качестве аналгетического препарта для лечения различных болевых синдромов [1].
Настоящее исследование посвящено сравнению аналгетического эффекта кетопрофена (флексена) и диклофенака. Диклофенак считается лучшим препаратам по сочетанию выраженности противовоспалительного и болеутоляющего действия, поэтому рассматривается как «эталон» в ревматологии. Кетопрофен, уступая диклофенаку по противовоспалительному эффекту, превосходит его по аналгетическому. Учитывая механизм развития болевых синдромов, связанных с дорсопатиями, можно прогнозировать, что аналгетический эффект НПВП при данной патологии будет играть более существенную роль, чем противовоспалительный.
Целью настоящего исследования была сравнительная оценка аналгетической эффективности флексена (кетопрофена) с диклофенаком при лечении острых болей в спине. В исследовании решались следующие задачи:
Материал исследования
В зависимости от интенсивности болевого синдрома все пациенты были разделены на две группы. Интенсивность болевого синдрома считалась высокой, если болевой синдром ограничивал двигательные возможности пациентов.
Группу А составили 30 человек, имевших острые боли в спине высокой интенсивности, обусловленные вертеброгенными рефлекторными мышечно-тоническими синдромами (болевой синдром ограничивал двигательные возможности пациентов), лечившиеся стационарно.
Группу Б составили 20 человек, имевших острые боли в спине, обусловленные вертеброгенными рефлекторными мышечно-тоническими синдромами (болевой синдром не ограничивал двигательные возможности пациентов), лечившиеся амбулаторно.
Пациенты с выраженным болевым синдромом (группа А) получали инъекционные и капсулированные формы препарата. Пациенты группы Б использовали гелевую форму препарата местно в виде аппликаций.
Критерии включения были: острые боли в спине вертеброгенного происхождения, возраст от 18 до 60 лет, согласие пациента на участие в исследовании.
Критерии исключения: эрозивно-язвенные поражения желудочно-кишечного тракта, применение каких-либо аналгетических средств в течение 14 дней до момента включения в исследование, нарушение функции почек и печени, непереносимость салицилатов, заболевания сердца, необходимость применения диуретиков и антикоагулянтов, дерматит.
Методы исследования
После проведения скрининговых исследований пациентам группы А случайным образом назначался флексен либо диклофенак. В первые 5 дней лечения пациенты получали препарат в инъекционной форме (путь введения внутримышечный): флексен в суточной дозе 100-200 мг (1-2 ампулы) по усмотрению лечащего врача или диклофенак в дозе 75-150 мг (1-2 ампулы) по усмотрению лечащего врача.
Затем пациенты получали капсулированную форму препарата в течение последующих 14 дней или меньшим курсом при условии полного регресса болевого синдрома: флексен в суточной дозе 150 мг (3 капсулы) или диклофенак в дозе 150 мг (3 таблетки).
Терапия проводилась на фоне традиционного лечения дорсалгий вертеброгенного генеза. После курса терапии проводилось повторное обследование с использованием вышеперечисленных методов, а также оценка интенсивности болевого синдрома на 3, 5, 7, 14, 19 день лечения.
Ответ на терапию мы оценивали как: положительный при субъективном отчете о полном исчезновении боли или уменьшении боли на 75% и более по ВАШ и полном восстановлении двигательной активности; умеренный — при уменьшении боли на 75-50% по ВАШ при полном или значительном восстановлении двигательной активности (остаточное ограничение менее 25% от полного объема); неудовлетворительный (неэффективный) — при сохранении болевого синдрома, его усилении или уменьшении менее чем на 50% от исходного уровня по ВАШ.
После проведения скрининговых исследований пациентам группы Б случайным образом назначался флексен либо диклофенак. В течение 14 дней или менее, в случае стойкого купирования болевого синдрома, они получали локальные аппликации с препаратом. Больные наблюдались амбулаторно. Терапия проводилась на фоне традиционного лечения дорсалгий вертеброгенного генеза. После курса терапии проводилось повторное обследование с использованием вышеперечисленных методов, а также оценка интенсивности болевого синдрома на 3, 5, 7, 14 день лечения.
Ответ на терапию мы оценивали как: положительный при субьективном отчете о полном исчезновении боли; умеренный — при уменьшении боли на 75-50% по ВАШ; неудовлетворительный (неэффективный) при сохранении болевого синдрома, его усилении или уменьшении менее чем на 50% от исходного уровня по ВАШ.
Переносимость препарата определяли на основании клинического осмотра, также использовались самоотчеты пациентов.
Результаты
В группу А вошли 32 пациента, из них 20 пациентов получали флексен, 12 — диклофенак по вышеописанной схеме. Демографическая характеристика пациентов представлена в таблице 1.
Таблица 1. Демографические показатели пациентов.
| Группа / Показатели | Флексен | Диклофенак |
| Количество пациентов | 20 | 12 |
| Пол (м/ж) | 14/6 | 7/5 |
| Возраст (годы) | от 27 до 58 (52,2) | от 38 до 60 (55,1) |
По демографическим показателям пациенты, получавшие флексен и диклофенак, между собой не различались.
Все пациенты данной группы поступили на стационарное лечение в связи с выраженным болевым синдромом, ограничивающим двигательные возможности пациентов. Клинические характеристики пациентов до начала лечения представлены в таблице 2, значимых различий по тяжести состояния у пациентов, получавших флексен и диклофенак, не отмечалось.
Таблица 2. Клинические характеристики пациентов группы А.
Все пациенты положительно отреагировали на проведенное лечение. После окончания курсового лечения не наблюдалось различий по степени эффекта между пациентами, получавшими флексен и диклофенак (соответственно, положительный эффект наблюдался у 85% и 83%, умеренный эффект — 15% и 17%). После купирования болевого синдрома существенно возросло качество жизни пациентов. После окончания лечения качество жизни в среднем было снижено на 12,6% у пациентов, получавших флексен, и на 17,8% у пациентов, получавших диклофенак (сравнение с фоновыми показателями высокодостоверны, рДинамика интенсивности болевого синдрома в процессе лечения выявила более быстрое наступление аналгетического эффекта у пациентов, получавших флексен. Данные представлены в таблице 3.
Таблица 3. Подневная динамика интенсивности болевого синдрома по ВАШ (баллы).
На 7-14 день флексен продемонстрировал более выраженный аналгетический эффект по сравнению с диклофенаком. При использовании флексена у большинства больных положительный эффект наблюдался к 7-14 дню лечения, в то время как при использовании диклофенака — к 14-19 дню лечения (Х=4,1).
После однократного введения 100 мг флексена интенсивность боли в среднем снизилась на 51% по ВАШ, и обьем движений увеличился на 42,3%. После однократного введения диклофенака — соответственно на 33,2% и 29,1% (р Переносимость как флексена, так и диклофенака в исследуемой выборке была высокой; 5 % пациентов, леченных флексеном, и 10%, леченных диклофенаком, в процессе лечения отмечали изжогу и гастралгии, но ни в одном из этих случаев не было зафиксировано клинически значимых изменений при ЭГДС-исследовании. Ухудшения лабораторных параметров в процессе лечения как диклофенаком, так и флексеном, не было зарегистрировано. Все пациенты полностью прошли весь курс лечения.
В группу Б вошли 20 пациентов, из них 8 пациентов получали флексен, 12 — диклофенак по вышеописанной схеме. По демографическим и клиническим показателям, в частности, интенсивности болевого синдрома, пациенты, получавшие флексен и диклофенак, между собой не различались.
Оба препарата продемонстрировали высокую эффективность к 14 дню от начала терапии. Лишь у одного пациента среди больных, получавших флексен, и у трех среди больных, получавших диклофенак, сохранялся болевой синдром минимальной интенсивности (различия между группами недостоверны).
Однако, подневная динамика интенсивности боли показала более быстрое наступление аналгетического эффекта флексена. Данные представлены в таблице 4.
Таблица 4. Подневная динамика интенсивности болевого синдрома по ВАШ (баллы).
На 7 день лечения болевой синдром был полностью купирован у 5 (62%) пациентов, получавших флексен, и лишь у 2 (17%), получавших диклофенак (χ=4,27).
Среди данной выборки пациентов ни один человек не отмечал побочных явлений препарата.
Основные выводы исследования
Нестероидные противовоспалительные препараты для наружного применения в лечении скелетно-мышечных болевых синдромов
Боль в спине, шее, суставах является ведущим симптомом при заболеваниях опорно-двигательного аппарата и относится к наиболее частой причине обращения к врачу. В лечении скелетно-мышечных болей наиболее часто применяются нестероидные противовоспалительные
Боль в спине, шее, суставах является ведущим симптомом при заболеваниях опорно-двигательного аппарата и относится к наиболее частой причине обращения к врачу. В лечении скелетно-мышечных болей наиболее часто применяются нестероидные противовоспалительные средства (НПВС). В практической деятельности врача, занимающегося лечением болевых синдромов, определяющим критерием выбора лекарственного средства является его анальгетическая эффективность, индивидуальная непереносимость, вероятность возникновения осложнений или побочных эффектов [1, 3].
Применение НПВС внутрь или парентерально часто сопровождается у пациентов развитием побочных эффектов и осложнений, в первую очередь со стороны желудочно-кишечного тракта, почек, центральной нервной системы. Возможность применять лекарственные средства местно (наружно) позволяет доставлять активное вещество максимально близко к источнику болевого ощущения, не вызывая системного воздействия, что значительно уменьшает риск развития побочных эффектов и осложнений.
В настоящее время арсенал препаратов для местного применения, содержащих НПВС, при заболеваниях опорно-двигательного аппарата достаточно широк, в том числе в связи с выпуском одних и тех же препаратов разными производителями под разными (патентованными) названиями.
Все НПВС для местного применения можно разделить на следующие группы по основному действующему лекарственному веществу, входящему в состав многокомпонентных или комбинированных препаратов [2].
1. Действующее вещество — диклофенак.
2. Действующее вещество — ибупрофен.
- — Нурофен гель.
— Долгит.
— Долгит крем.
3. Действующее вещество — индометацин.
4. Действующее вещество — кетопрофен.
- — Артрозилен.
— Быструмгель.
— Кетонал.
— Кетопрофен Врамед.
— Фастум.
— Феброфид.
— Флексен.
5. Действующее вещество — нимесулид.
6. Действующее вещество — пироксикам.
Основным механизмом действия препаратов монокомпонентного состава с действующим веществом диклофенаком является неселективное ингибирование активности циклооксигеназы (ЦОГ): ЦОГ-1 и ЦОГ-2, что приводит к нарушению метаболизма арахидоновой кислоты и подавлению синтеза простагландинов в очаге воспаления. При наружном применении данных препаратов возникают ослабление болей в месте их нанесения, уменьшение отечности и увеличение объема движений в пораженных суставах.
Показаниями для применения служат болевой синдром при воспалительных и дегенеративных заболеваниях суставов и позвоночника, ревматических поражениях мягких тканей, посттравматическом болевом синдроме, невралгии.
Побочные действия могут наблюдаться в виде местных кожных проявлений, при длительном применении препаратов возможны резорбтивное действие и развитие системных реакций (крапивница, бронхоспазм, ангионевротический отек).
Противопоказаниями для применения являются язвенная болезнь желудка и двенадцатиперстной кишки в стадии обострения, нарушение кроветворения, нарушение целостности кожных покровов, беременность, лактация, возраст до 6 лет, повышенная чувствительность к диклофенаку.
При сочетании диклофенака с ментолом в препарате Диклофенакол также дополнительно оказывается местное раздражающее и слабовыраженное анальгезирующее действие.
При сочетании диклофенака с метилсалицилатом, ментолом, льняным маслом в препарате Диклоран плюс противовоспалительное и анальгетическое действие диклофенака усиливается вторым препаратом из группы НПВС — метилсалицилатом, а также a-линоленовой кислотой, входящей в состав льняного масла; ментол оказывает местное раздражающее и слабовыраженное анальгезирующее действие.
Основным фармакологическим эффектом препаратов с действующим веществом ибупрофеном является местное анальгезирующее и противовоспалительное действие, механизм которого связан с торможением синтеза простагландинов за счет неселективного блокирования фермента ЦОГ.
Показаниями к применению являются миалгии, боли в спине, артриты, повреждения и растяжения связок, спортивные травмы, невралгии.
Побочные эффекты чаше всего отмечаются в виде небольшого покраснения кожи, жжения или покалывания. Системные реакции в виде аллергических реакций и бронхоспазма возникают чрезвычайно редко.
Противопоказанием к применению являются «аспириновая» астма, возраст до 12 лет, повышенная чувствительность к компонентам препарата. С осторожностью препарат применяют при сопутствующих заболеваниях печени и почек, желудочно-кишечного тракта, крапивнице, рините, беременности и лактации.
Основным фармакологическим эффектом препаратов монокомпонентного состава с действующим веществом индометацином является местное выраженное противовоспалительное и анальгетическое действие за счет неселективного блокирования фермента ЦОГ и подавления синтеза простагландинов. Показаниями к применению служат болевой синдром и местные воспалительные реакции при ревматоидных заболеваниях, острых скелетно-мышечных болях, подагре, невралгиях.
Побочные эффекты наблюдаются в виде местных кожных реакций (гиперемия, шелушение, крапивница и др.). Системные реакции в виде диспепсии, тошноты, головокружения, атаксии возможны при длительном, более 10 дней, применении либо при нанесении препарата на большой участок кожных покровов.
Препарат противопоказан при желудочно-кишечных заболеваниях, заболеваниях почек, центральной нервной системы, инфекционных заболеваниях, в период беременности и лактации, не назначается детям.
При сочетании индометацина с троксерутином в препарате Индовазин дополнительно оказывается местное противоотечное и ангиопротекторное действие.
Основным механизмом действия препаратов с действующим веществом кетопрофеном (производное пропионовой кислоты) является подавление активности ЦОГ-1 и ЦОГ-2, регулирующей синтез простагландинов. Противовоспалительная и анальгезирующая активность кетопрофена сходна с таковой индометацина и выше активности ибупрофена в 20 раз. Кетопрофен обладает антибрадикининовой активностью, стабилизирует лизосомальные мембраны, вызывает значительное торможение активности нейтрофилов у больных с ревматоидным артритом, подавляет агрегацию тромбоцитов.
Показаниями к применению являются острые и хронические воспалительные и дегенеративно-дистрофические заболевания опорно-двигательного аппарата, травмы.
Побочные действия наблюдаются в виде гиперемии кожи в месте нанесения препарата, фотосенсибилизации пурпуры. При длительном применении редко возможны системные реакции: боли в животе, рвота, астения, транзиторная дизурия.
Противопоказан к применению у пациентов с экземой, инфицированными ранами, у детей до 12 лет, при индивидуальной непереносимости препарата. С осторожностью возможно применение при беременности и в период лактации.
Основным механизмом действия препаратов с действующим веществом нимесулидом является селективное подавление активности ЦОГ-2, регулирующей синтез простагландинов. Нимесулид обратимо ингибирует синтез простагландина Е2 как в области воспаления, так и в восходящих путях ноцицептивой системы. Подавляет агрегацию тромбоцитов, высвобождение гистамина и фактора некроза опухоли a, обладает антиоксидантной активностью. Препарат хорошо переносится при длительной терапии. При местном применении вызывает уменьшение или исчезновение болей в месте нанесения геля, уменьшает отечность, утреннюю скованность суставов, способствует увеличению объема движений.
Показаниями к применению служат воспалительные заболевания с болевым синдромом умеренной интенсивности: заболевания опорно-двигательного аппарата, в том числе артриты, остеохондроз, остеоартроз, артралгии, миалгии, бурситы, травматические повреждения.
Побочные эффекты связаны с местными реакциями при нанесении геля — зуд, крапивница, шелушение, преходящее изменение цвета кожи — и не требуют отмены препарата.
Противопоказания: дерматозы, инфекции кожи в области применения геля, возраст до 2 лет, повышенная чувствительность к препарату, беременность и лактация.
Основным механизмом действия препаратов с действующим веществом пироксикамом является подавление синтеза простагландинов вследствие неселективного ингибирования ферментов ЦОГ-1 и ЦОГ-2. Применение препарата уменьшает отек, воспаление, мышечную и суставную боль, не вызывает сухости кожи.
Показаниями к применению является болевой синдром при спортивных травмах, анкилозирующем спондилоартрите, остеоартрозе, плечелопаточном периартрозе, тендините.
Побочные эффекты связаны с местными реакциями и проявляются в виде покраснения и шелушения, местного зуда, крапивницы.
Противопоказаниями для применения служат почечная недостаточность, возраст до 14 лет, беременность, индивидуальная непереносимость препарата.
Литература
Л. Е. Корнилова, кандидат медицинских наук
Е. Л. Соков, доктор медицинских наук, профессор
РУДН, Клиника лечения боли, ГКБ № 64, Москва
Сравнительная эффективность нестероидных противовоспалительных препаратов при болях в спине
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
В настоящее время боли в спине (БС) широко распространены, а в развитых странах, по данным экспертов ВОЗ, сравнимы с неинфекционной эпидемией, что в большинстве случаев связано с возрастающими нагрузками на человека [4]. Высокая инвалидизация лиц трудоспособного возраста вследствие поражений опорно-двигательного аппарата возводит проблему лечения БС в ранг актуальной. Популяционные исследования выявили ассоциацию болей в нижней части спины (БНС) с такими факторами, как пол и возраст, осанка, мышечная сила, подвижность позвоночника. В недавно проведенном в Швеции популяционном исследовании спинальных болей среди лиц в возрасте 35-45 лет установлено, что частота возникновения болей за последний год составила 66,3%, причем данный показатель среди женщин был незначительно выше, чем среди мужчин. У 25% респондентов возникли существенные проблемы с трудоспособностью, степенью нарушения функционального статуса. В Великобритании вследствие болей в спине в 1992 г. было потеряно 90 миллионов рабочих дней, что уступало только заболеваниям органов дыхания и кровообращения. При этом 75% больных составили пациенты от 30 до 59 лет, то есть в период максимальной трудоспособности.
Все случаи болей в спине делятся на первичные и вторичные.
Вторичный синдром БС может быть связан с врожденными аномалиями, травматическими поражениями позвоночника, опухолевыми и инфекционными процессами, остеопорозом, заболеваниями внутренних органов.
БС чаще всего развивается в возрасте от 20 до 50 лет (пик заболеваемости в возрасте от 35 до 45 лет). Именно в этой возрастной группе обычно диагностируют первичный (механический) синдром БС, тогда как у больных моложе 20 лет и старше 50 лет преобладает вторичный синдром БС (табл. 1).
Диагностика БС требует участия врачей разных специальностей: терапевта, ревматолога, невропатолога, ортопеда и хирурга, задачей которых, в частности, является исключение вторичного характера болей в нижней части спины.
Провоцирующими факторами острого течения БС могут быть травма, подъем непосильного груза, неподготовленные движения, длительное пребывание в нефизиологической позе, переохлаждения. Хроническая боль может возникать как после регресса острой боли, так и независимо от нее.
Лечение проводится с учетом формы заболевания и варианта его течения с использованием консервативного и хирургического подходов.
В настоящее время показания к хирургическому лечению сужены, поскольку накопились факты о том, что даже при очень хорошей методике хирургической декомпрессии и стабилизации заболевание склонно рецидивировать.
При обострении клинических проявлений БС ранее рекомендовался отдых в течение нескольких недель. Однако во всех исследованиях последних лет подчеркивается, что не постельный режим, а ранняя активизация больных должна быть главным компонентом программы лечения, что способствует улучшению питания межпозвонкового диска, в связи с чем постельный режим при остром течении ограничивается несколькими днями.
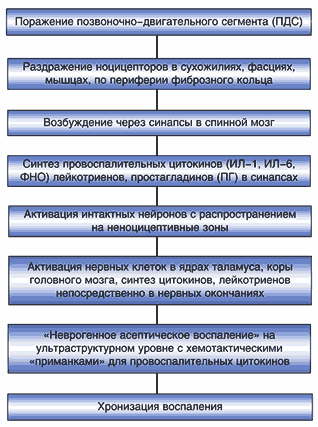
Дегенеративный процесс в межпозвонковом диске активирует ноцицепторы по периферии фиброзного кольца, в сухожилиях, фасциях, мышцах с последующей передачей импульсов в спинной мозг. При этом запускаются иммунные и биохимические реакции, завершающиеся формированием асептического нейрогенного воспаления. В связи с этим целесообразность назначения НПВП обоснована (схема 1) [3].
Схема 1. Механизмы асептического неврогенного воспаления при спондилоартрозе (Borenstein D., 2000).
В настоящее время появилась возможность применения такого НПВП, как кетопрофен (Кетонал) при остеоартрозе, а также при лечении болей в спине. Кетопрофен является производным пропионовой кислоты. Особенностью его противовоспалительного действия является не только ингибирование синтеза простагландинов на уровне циклооксигеназы; он также ингибирует липооксигеназу, обладает антибрадикининовой активностью, стабилизирует лизосомальные мембраны. При приеме внутрь препарат быстро и максимально полно абсорбируется из желудочно-кишечного тракта. Максимальная концентрация в крови достигается через 1-2 часа. Кетонал хорошо проникает в синовиальную жидкость и соединительную ткань. Значимые уровни концентраций достигаются уже через 15 минут после однократного внутримышечного введения 100 мг кетопрофена. Важным преимуществом препарата является то, что он представлен различными лекарственными формами: капсулами, таблетками форте и ретард, раствором для внутримышечных инъекций, кремом и суппозиториями.
Кетонал обладает «сбалансированной» активностью в отношении ингибиции ЦОГ-1 и ЦОГ-2, что позволяет оптимально сочетать высокую эффективность с хорошей переносимостью, сравнимой, по данным ряда авторов, с переносимостью селективных НПВП [3,5]. Исследователи связывают мощный болеутоляющий эффект Кетонала с его доказанным центральным воздействием, которое реализуется на уровне задних рогов спинного мозга, а также за счет непосредственного влияния на таламические центры болевой чувствительности, что, по-видимому, связано с угнетением синтеза простагландинов в ЦНС [4,5].
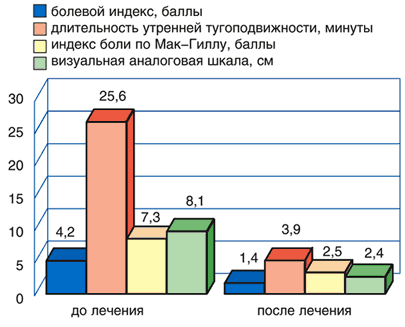
Рис. 1. Динамика клинических показателей у пациентов с болями в спине до и после лечения Кетоналом форте
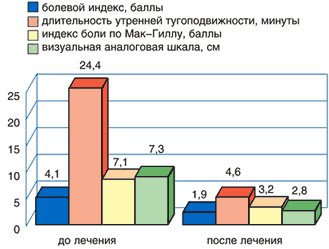
Рис. 2. Динамика клинических показателей у пациентов с болями в спине до и после лечения диклофенаком
Оценки эффективности лечения больным и врачом практически не отличались друг от друга и свидетельствовали о выраженной клинической эффективности препаратов. Высокая эффективность отмечена у 93,3% пациентов, принимавших Кетонал форте, у 73,3% пациентов, принимавших диклофенак.
Переносимость препарата «хорошая» или «очень хорошая» была отмечена у 80% больных, принимавших Кетонал, и у 64% принимавших диклофенак. Основными побочными эффектами при приеме как диклофенака, так и Кетонала были изжога, дискомфорт в эпигастральной области. Прекращение лечения потребовалось лишь в 1 случае, когда у пациента развилась крапивница на фоне приема диклофенака, которая была расценена, как побочный эффект средней степени тяжести.
Таким образом, в настоящее время лечение болей в спине оптимизировано использованием препаратов группы НПВП, в частности, Кетонала, в силу его высокой эффективности, проявляющейся отчетливо выраженной положительной динамикой с регрессом болевых проявлений у пациентов с БС.
1. Клинические рекомендации для практических врачей, основанные на доказательной медицине. Изд. дом «ГЭОТАР-МЕД», 2001, с. 606-611.
2. Насонов Е.Л. Нестероидные противовоспалительные препараты (перспективы применения в медицине). М., 2000, 262.
3. Насонов Е.Л., Чичасова Н.В., Шмидт Е.И. Перспективы применения неселективных нестероидных противовоспалительных препаратов (на примере кетопрофена) и селективных ингибиторов ЦОГ-2 в клинической практике. Русский медицинский журнал, том 10, №22, 2002, с 1014-1017.
4. Ветшев П.С., Ветшева М.С. Принципы аналгезии в раннем послеоперационном периоде. Хирургия, 2002, №12, с. 49-52.
5. Чичасова Н.В., Насонов Е.Л., Имаметдинова Г.Р. Применение кетопрофена (кетонал) в медицинской практике. Фарматека, 2003, №5, с. 30-32.
6. Borenstein D. «Эпидемиология, этиология, диагностическая оценка и лечение поясничной боли». Междун. Медиц. Журнал, 2000, №35, с. 36-42.
7. WHO. Department of noncomunicable disease menagement. Low back pain iniciative. Geneve.1999.