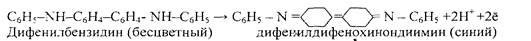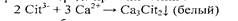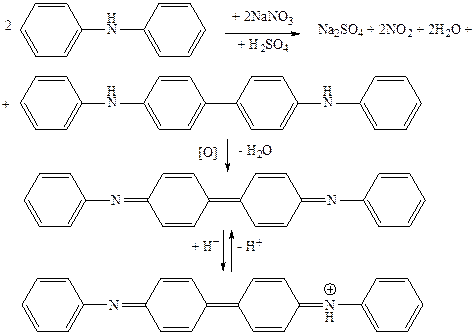Дифениламин с чем реагирует
Дифениламин
Дифениламин ((N-фенил)-анилин) — вещество с формулой (С6Н5)2NН, молярная масса которого равна 169,23.
Содержание
Физические свойства
Бесцветные кристаллы, темнеющие на свету; Температура плавления 54-55 °C, Температура кипения 302 °C, 179 °C/22 мм рт. ст.; 




Химические свойства
С концентрированными минеральными кислотами дифениламин образует соли, гидролизующиеся разбавленными кислотами и водой. Атом Н, связанный с N, может быть замещен на атом щелочного металла; замена его на алкил, арил или ацил происходит труднее, чем у анилина, например N-ацетилдифениламин образуется при ацетилировании дифениламин уксусным ангидридом в присутствии НClO4 при 80-100 °C. Дифениламин легко нитрозируется при взаимодействии с HNO2 до N-нитрозодифениламина, нитруется значительно легче бензола до тринитропроизводных, галогенируется до тетра- и гексагалогенопроизводных, легко алкилируется в присутствии кислотных катализаторов в параположение.
Получение
В промышленности дифениламин получают взаимодействием эквимолярных количеств анилина с гидрохлоридом анилина (катализатор — HCl, АlСl3, NH4BF4 или другие) в автоклаве при 300 °C (выход 50-60 %) или пропусканием паров анилина (400 °C) через Аl2О3, очищают фракционной перегонкой или перекристаллизацией из бутанола.
Использование
Дифениламин — исходный продукт в производстве антиоксидантов для полимеров; стабилизатор и флегматизатор термо- и атмосферостойкости нитратов целлюлозы, в том числе пироксилиновых порохов; промежуточный продукт в синтезе триарилметановых и азокрасителей, инсектицидов; ингибитор коррозии мягких сталей. Используется в аналитической химии для обнаружения ионов 


Сведения о безопасности
tвсп. 153 °C, tсамовоспл. 633 °C, нижний КПВ 5 г/м3. ПДК 10 мг/м3, ЛД50 2,9 г/кг (белые мыши, перорально).
Использованная литература: Химическая энциклопедия.
Полезное
Смотреть что такое «Дифениламин» в других словарях:
дифениламин — дифениламин … Орфографический словарь-справочник
дифениламин — кристаллическое вещество со слабым запахом, с температурой плавления 54°С, получаемое из анилина; промежуточное вещество при изготовлении красок; применяется также в производстве взрывчатых веществ Большой словарь иностранных слов. Издательство… … Словарь иностранных слов русского языка
дифениламин — сущ., кол во синонимов: 1 • ингибитор (9) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
дифениламин — (C6H5)2NH>, бесцветные кристаллы, темнеющие на свету, tпл 54 55°C. Сырьё для синтеза красителей, антиоксидантов, инсектицидов, ингибитор коррозии, стабилизатор пластмасс и пироксилиновых порохов, используется в аналитической химии. * * *… … Энциклопедический словарь
Дифениламин — ароматический амин, C6H5NHC6H5; бесцветные, темнеющие на свету кристаллы со слабым характерным запахом; tпл 54°С, tkип 302°С. Д. нерастворим в воде, растворим в большинстве органических растворителей. В промышленности Д. получают при… … Большая советская энциклопедия
Дифениламин — NH(C6H5)2 первый член гомологического ряда вторичных ароматических аминов (анилинов, см. Анилин). Д. получается: при нагревании до 210° 240° соляно кислого анилина с анилином (de Laire, Giràrd, Chapoteaut, 1866): NH(C6H5).HCl + NH2(C6H5) =… … Энциклопедический словарь Ф.А. Брокгауза и И.А. Ефрона
дифениламин — дифениламин, дифениламины, дифениламина, дифениламинов, дифениламину, дифениламинам, дифениламин, дифениламины, дифениламином, дифениламинами, дифениламине, дифениламинах (Источник: «Полная акцентуированная парадигма по А. А. Зализняку») … Формы слов
ДИФЕНИЛАМИН — (С 6 Н 5)2NН, мол. м. 169,23; бесцв. кристаллы, темнеющие на свету; т. пл. 54 55°С, т. кип. 302 °С, 179°С/22мм рт. ст.; d4641,0513, d4251,159: nD64 1,6189; h 4,66 мПа. с (55 °С); g 0,0367 Н/м (77,2 °С); С 0p 1,412 Дж/(г. К)… … Химическая энциклопедия
ДИФЕНИЛАМИН — (C6H5)2NH белые кристаллы, темнеющие на свету; tnn 54 °С. Сырьё для произ ва нек рых красителей, инсектицидов, стабилизаторов порохов и пластмасс, индикатор в аналитич. химии … Большой энциклопедический политехнический словарь
Реакция с дифениламином (фармакопейная)
1. Реакция с дифениламином (фармакопейная).
Реакцию проводят в концентрированной серной кислоте. Вначале происходит необратимое окисление дифениламина в дифенилбензидин:
дифениламин дифенилбензидин (бесцветный)
Две молекулы дифениламина отдают окислителю два электрона и теряют два иона водорода. Затем происходит обратимое окисление молекулы бензидина присутствующим окислителем до окрашенного в синий цвет дифенилдифенохинондиимина, при котором молекулы дифенилбензидина также отдает окислителю два электрона и теряет два иона водорода:
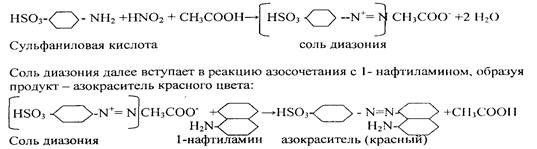
2. Реакция с сильными кислотами (фармакопейная).
В результате раствор окрашивается в красный цвет.
Аналогична реакция с карбамидом:>
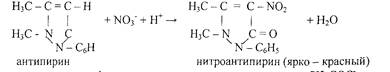
7. Реакция с антипирином (фармакопейная)
Реакцию проводят в слабокислой среде.
В отличие от нитритов, нитраты не обесцвечивают подкисленные водные растворы перманганата калия (фармакопейный тест).
1.Реакция с дифениламином (фармакопейная).
2.Реакция с металлической медью (фармакопейная).
Реакцию проводят в среде концентрированной H2SO4 при нагревании.
3.Реакция с сульфатом железа (II) и концентрированной серной кислотой.
Реакцию проводят при нагревании:
4.Реакция с металлическим алюминием или цинком.
5.Реакция с антипирином. Реакцию проводят в кислой среде.
Ацетаты аммония, щелочных и большинства других металлов хорошо растворяется в воде. Ацетаты серебра CH3COOAg и ртути (I) менее ацетатов других металлов растворимы в воде.
1.Реакция с хлоридом железа (III) (фармакопейная).
В водном растворе он частично гидролизуется; подкисление раствора минеральными кислотами подавляет гидролиз и приводит к исчезновению красной окраски раствора.
При кипячении из раствора выпадает красно-бурый осадок основного ацетата железа (III):
2.Реакция с серной кислотой.
3.Реакция образования уксусноэтилового эфира (фармакопейная).
Реакцию проводят в сернокислой среде. С этанолом:
Выделяющийся этилацетат обнаруживают по характерному приятному запаху. Соли серебра катализируют эту реакцию, поэтому при ее проведении рекомендуется добавлять небольшое количество AgNO3.
Аналогично при реакции с амиловым спиртом С5НцОН образуется также обладающий приятным запахом амилацетат СН3СООС5Ни (-грушевая-) Ощущается характерный запах этилацетата, усиливающийся при осторожном нагревании смеси.

I. Реакция с хлоридом калия (фармакопейная).
2. Реакция с резорцином в кислой среде (фармакопейная).
3.Реакции с аммиачным комплексом серебра. Выпадает черный осадок металлического серебра.
4.Реакция с сульфатом железа (II) и пероксидом водорода.
Прибавление разбавленного водного раствора FeSO4 и Н2О2 к раствору, содержащему тартраты. приводит к образованию к образованию неустойчивого комплекса железа жатого цвета. Последующая обработка раствором щелочи NaOH приводит к кяншиовению комплекса голубого цвета.
Средний нитрат натрия растворяется в воде. Средняя кальциевая соль лимонной свеклы мало растворима в горячей воде, но хорошо растворяется в холодной воде, что используется на практике. I. Реакция с хлоридом кальция (фармакопейная). Реакцию проводят в нейтральной среде при кипячении:
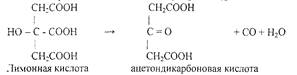
Вначале в сернокислом растворе происходит окисление лимонной кислоты до апгтондикарбоновой кислоты О = С (CitCOOH)2:
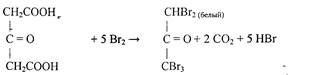
Затем ацетондикарбоновая кислота бромируется и переходит в пентабромацетон:
Проведению реакции мешают органические кислоты и фенолы, дающие осадки продуктов бромирования.
Характерные реакции. 1. С дифениламином в среде концентрированной H2SO4



Нитрат-ион NO
1. С дифениламином в среде концентрированной H2SO4.
Дифениламин окисляется азотной кислотой вначале в бесцветный
N,N-дифенилбензидин, затем в «дифенилбензидин фиолетовый»:
2. С металлической медью в среде концентрированной H2SO4.
Методика: к сухому веществу (0,002-0,005 г нитрата-иона) прибавляют по 2-3 капли воды и концентрированной серной кислоты, кусочек металлической меди и нагревают, выделяются бурые пары оксида азота (IV).
3. С сульфатом железа (II).
4. С раствором КМnО4 в сернокислой среде. Наблюдают неисчезающую розовую окраску раствора (в отличие от NO 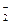
Обнаружению NO 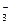
Амины: способы получения, строение и свойства
Амины – это органические производные аммиака NH3, в молекуле которого один, два или три атома водорода замещены на углеводородные радикалы.
Строение аминов
Также атом азота в аминах имеет неподелённую электронную пару, поэтому амины проявляют свойства органических оснований.
Классификация аминов
По количеству углеводородных радикалов, связанных с атомом азота, различают первичные, вторичные и третичные амины.
По типу радикалов амины делят на алифатические, ароматические и смешанные.
| Амины | Первичные | Вторичные | Третичные | |||||||||||
| Алифатические | Метиламин CH3-NH2 | Диметиламин CH3-NH-CH3 | Триметиламин (CH3)3N | |||||||||||
| Ароматические | Фениламин C6H5-NH2 | Дифениламин (C6H5)2NH | Трифениламин (C6H5)3N | |||||||||||
| Смешанные | Метилфениламин CH3-NH-C6H5 | ДиметилфениламинНоменклатура аминовПри наличии одинаковых радикалов используют приставки ди и три. В этом случае аминогруппа указывается в названии приставкой амино-: Например, N-метиланилин: Символ N- ставится перед названием алкильного радикала, чтобы показать, что этот радикал связан с атомом азота, а не является заместителем в бензольном кольце. Изомерия аминовДля аминов характерна изомерия углеродного скелета, изомерия положения аминогруппы и изомерия различных типов аминов. Изомерия углеродного скелетаДля аминов характерна изомерия углеродного скелета (начиная с С4H9NH2).
Изомерия положения аминогруппыДля аминов характерна изомерия положения аминогруппы (начиная с С3H9N).
Изомерия между типами аминов
(первичный амин) | Метилэтиламин (вторичный амин) | Триметиламин (третичный амин) | ||||||||||
 |  |  |
Физические свойства аминов
При обычной температуре низшие алифатические амины CH3NH2, (CH3)2NH и (CH3)3N – газы (с запахом аммиака), средние гомологи – жидкости (с резким рыбным запахом), высшие – твердые вещества без запаха.
Ароматические амины – бесцветные жидкости с высокой температурой кипения или твердые вещества.
Первичные и вторичные амины образуют слабые межмолекулярные водородные связи:
Это объясняет относительно более высокую температуру кипения аминов по сравнению с алканами с близкой молекулярной массой.
Амины также способны к образованию водородных связей с водой:
Поэтому низшие амины хорошо растворимы в воде.
С увеличением числа и размеров углеводородных радикалов растворимость аминов в воде уменьшается. Ароматические амины в воде не растворяются.
Химические свойства аминов
| Амины имеют сходное с аммиаком строение и проявляют подобные ему свойства. |
Как в аммиаке, так и в аминах атом азота имеет неподеленную пару электронов:


| Поэтому амины и аммиак обладают свойствами оснований. |
1. Основные свойства аминов
| Алифатические амины являются более сильными основаниями, чем аммиак, а ароматические — более слабыми. |
Это объясняется тем, что радикалы СН3–, С2Н5– увеличивают электронную плотность на атоме азота:
Это приводит к усилению основных свойств.
| Основные свойства аминов возрастают в ряду: |
1.1. Взаимодействие с водой
В водном растворе амины обратимо реагируют с водой. Среда водного раствора аминов — слабощелочная:
1.2. Взаимодействие с кислотами
Амины реагируют с кислотами, как минеральными, так и карбоновыми, и аминокислотами, образуя соли (или амиды в случае карбоновых кислот):
При взаимодействии аминов с многоосновными кислотами возможно образование кислых солей:
1.3. Взаимодействие с солями
Амины способны осаждать гидроксиды тяжелых металлов из водных растворов.
| Например, при взаимодействии с хлоридом железа (II) образуется осадок гидроксида железа (II): |
2. Окисление аминов
Амины сгорают в кислороде, образуя азот, углекислый газ и воду. Например, уравнение сгорания этиламина:
3. Взаимодействие с азотистой кислотой
Первичные алифатические амины при действии азотистой кислоты превращаются в спирты:
| Это качественная реакция на первичные амины – выделение азота. |
Вторичные амины (алифатические и ароматические) образуют нитрозосоединения — вещества желтого цвета:
4. Алкилирование аминов
Первичные амины способны взаимодействовать с галогеналканами с образованием соли вторичного амина:
Из полученной соли щелочью выделяют вторичный амин, который можно далее алкилировать до третичного амина.
Особенности анилина
Анилин С6H5-NH2 – это ароматический амин.
| Анилин – бесцветная маслянистая жидкость с характерным запахом. На воздухе окисляется и приобретает красно-бурую окраску. Ядовит. В воде практически не растворяется. |
При 18 о С в 100 мл воды растворяется 3,6г анилина. Раствор анилина не изменяет окраску индикаторов.
| Для анилина характерны реакции как по аминогруппе, так и по бензольному кольцу. |
Анилин не реагирует с водой, но реагирует с сильными кислотами, образуя соли:
Реакция с галогенами идёт без катализатора во все три орто- и пара- положения.
| Качественная реакция на анилин: реагирует с бромной водой с образованием 2,4,6-триброманилина (белый осадок ↓). |
Получение аминов
Восстановление нитросоединений
Первичные амины можно получить восстановлением нитросоединений.
Алюминий реагирует с щелочами с образованием гидроксокомплексов.
В щелочной и нейтральной среде получаются амины.
Восстановлением нитробензола получают анилин.
При этом образуются не сами амины, а соли аминов:
Амины из раствора соли выделяют с помощью щелочи:
Алкилирование аммиака и аминов
При взаимодействии аммиака с галогеналканами происходит образование соли первичного амина, из которой действием щелочи можно выделить сам первичный амин.
Если проводить реакцию с избытком аммиака, то сразу получится амин, а галогеноводород образует соль с аммиаком:
Гидрирование нитрилов
Таким образом получают первичные амины. Возможно восстановление нитрилов водородом на катализаторе:
.
Соли аминов
Соль амина с более слабыми основными свойствами может реагировать с другим амином, образуя новую соль (более сильные амины вытесняют менее сильные из солей):
12 комментариев
Добавить ваш
Да, спасибо, поправил. В узком смысле реакцией Зинина называют получение именно ароматических аминов, в широком смысле так называют восстановление любых нитросоединений сульфидом аммония.
Здравствуйте! Скажите, пожалуйста, реагируют ли третичные амины с галогеналканами? Если да, то как идет реакция и что получается? Например,при взаимодействии триметиламина с хлорметаном?
Здравствуйте! Реагируют, но дальнейшее замещение по связям N-H не идет.
Здравствуйте! Не показано взаимодействие аминов со спиртами.
Третичные амины с алкилгалогенидами реагируют. Получаются четвертичные аммониевые соли. Говорить, что они вообще не реагируют, неправильно. Они не вступают в реакцию алкилирования.
По такой схеме за счет пары электронов на азоте реагируют алифатические амины, ароматические амины, пиридин с получением N-алкилпиридинийхлорида (иодида) и пр.
Да, спасибо за комментарий. Я имел в виду, что не идет дальнейшее замещение.
спасибо, отличная идея!
для полноты информации я бы добавил оптическую изомерию и примеры этой изомерии ко всем классам органических веществ, потому что на егэ это есть
На ЕГЭ пока оптической изомерии нет.
Admin>Здравствуйте! Реагируют, но дальнейшее замещение по связям N-H не идет.
что значит «дальнейшее»? у триметиламина — и так уже нет N-H связей, может вы имели в виду протонированный триметил-амин (скажем) солянокислый, что в форме соли он останется третичным амином например до момента щелочного депротонирования(высвобождения основания амина)
—
а что кстати, есть способ галоидным алкилом моноалкилирование первичного ароматического амина до вторичного осуществить, избежав образования третичного амина — диалкилированного уже
на этилировании уже проще, а вот метиллирование нейромедиаторов не удавалось остановить на стадии N,N-ДиМет.(например в ацетоне с карбонатом калия, или с DIPEA), выход третичного целевого амина всегда оказывался либо самым низким из продуктов реакции, либо просто очень низким(10% в сложной смеси аминов с преобладанием четвертичной соли триметиламмония метилиодида, а сейчас подумал — если при N-метилировании первичного ароматического амина метилиодидом, образуется гидроиодид N-метил…исх.пер.амина, он же даже во второе метиллирование уже не должен входить, усиленным основанием став (скажем адреналином, основнее норадреналина исходного как я понимаю за счет появившегося электроннодонороного метила) и так будет выведен из реакционной среды(например выпав осадком соли, не солватированной в неполярной РС)
получается в отсутствие основного катализа алкилирование первичных аминов ограничивается моно-алкилированием — не далее чем до вторичного амина? или на практике соли не так надёжны как в оптимистичных прогнозах теоретизирующего учащегося?
Добавить комментарий Отменить ответ
Этот сайт использует Akismet для борьбы со спамом. Узнайте, как обрабатываются ваши данные комментариев.