Диэтаноламин в лекарствах для чего вред и польза
Диэтаноламин
| Диэтаноламин | |
|---|---|
 | |
| Систематическое наименование | Диэтаноламин |
| Сокращения | ДЭА |
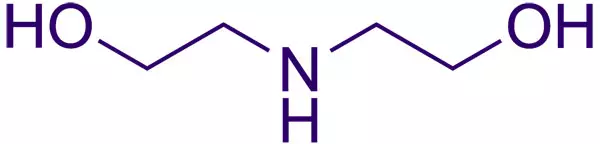
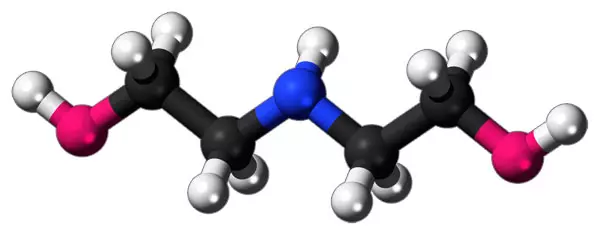
| Хим. формула | (HOCH2CH2)2NH |
| Молярная масса | 105,14 г/моль |
| Плотность | 1,0966 г/см³ |
| Динамическая вязкость | 0,580 Па·с |
| Т. плав. | 27 °C |
| Т. кип. | 280 °C |
| Т. разл. | 516 ± 1 °F |
| Т. всп. | 148,9 °C |
| Пр. взрв. | 1,6 ± 0,1 об.% |
| Давление пара | 0,01 ± 0,01 мм рт.ст. |
| Растворимость в воде | неограниченно |
| Растворимость в гептан | 0,1 г/100 мл |
| Показатель преломления | 1,4776 |
| ГОСТ | ТУ 2423-178-00203335-2007 ТУ 2423-151-00203335-2003 |
| Рег. номер CAS | 111-42-2 |
| PubChem | 8113 |
| Рег. номер EINECS | 203-868-0 |
| SMILES | |
| RTECS | KL2975000 |
| ChEBI | 28123 |
| ChemSpider | 13835604 |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Диэтаноламин — органическое соединение, представитель класса аминоспиртов, густая маслянистая жидкость, смешивается с водой во всех отношениях, обладает сильными основными свойствами.
Содержание
Получение
Диэтаноламин получают действием аммиака на этиленхлоргидрин (2-хлорэтанол):
В промышленности синтез диэтаноламина проводится присоединением аммиака к этиленоксиду:
Наряду с диэтаноламином получаются также этаноламин и триэтаноламин.
Применение
Применяются в технике в качестве эмульгатора и поверхностно-активного вещества, а также в различных процессах газоочистки, в том числе для извлечения углекислого газа из топочных газов при производстве сухого льда, также применяется в процессе обработки древесины, при производстве иминов. Является исходным веществом в промышленном синтезе лекарственного средства таурина.
Диэтаноламин способен вызвать раздражение слизистых оболочек, токсичен для сердечно-сосудистой системы, почек, желудочно-кишечного тракта.
Диэтаноламин — что таит в себе это соединение? Почему от таких «гостей» нужно избавляться?
Диэтаноламин (ДЭА) – представитель огромного класса органических соединений, не имеющих ароматических связей (алифатические соединения). Он относится к классу аминоспиртов. Их отличительной чертой является не только отсутствие ароматических связей в молекуле, но и расположение гидроксильной и аминогруппы у разных атомов углерода.
В получении любого аминоспирта участвует аммиак. Процесс получения диэтаноламина может проходить двумя способами: либо воздействием на этиленхлоргидрин аммиака (в этом случае побочным продуктом выделяется соляная кислота), либо присоединением всё того же аммиака к этиленоксиду. В ходе этой реакции побочными продуктами являются моноэтаноламин и триэтаноламин.
Используют диэтаноламин в промышленности в области газообработки, переработки древесины. В фармацевтической промышленности диэтаноламин выступает исходным продуктом в синтезе таурина. В сельском хозяйстве ДЭА известен как составляющее, необходимое для быстрого уничтожения сорняков и других растений. Также этот аминоспирт широко применяют в составах косметических средств.
Список свойств диэтаноламина для косметической промышленности невелик:
Безопасность диэтаноламина
Но так ли безопасен этот компонент, тем более для использования в косметических целях? Концентрат ДЭА, как и концентрат его молекулярного собрата, триэтаноламина (ТЭА), в чистом виде – опаснейшее вещество. На производствах, где используются эти вещества, введены обязательные меры безопасности. К ним относится защита слизистых оболочек глаз, рта, защита органов дыхания. Также обязательны специальные рабочие костюмы для предотвращения попадания состава на кожу.
Недопустимо хранение концентрата и раствора ДЭА в неплотно закрытых, негерметичных резервуарах. При транспортировке вещества ёмкости прочно укупоривают и фиксируют, проставляя соответствующие пометки об опасности содержимого.
Европейский Союз летом 2013 года принял новый регламент, касающийся косметических продуктов. ЕС №1223/2009 усиливает контроль над использованием в косметике токсичных, мутагенных, канцерогенных компонентов. ДЭА фигурирует в списках, поставленных на особый контроль. Для него установлена максимальная дозировка в 1,5% как для компонента косметических средств. Такая концентрация допустима в случае, если средство смываемое. Если предполагается длительный контакт кожи с ДЭА, его допустимая дозировка в 10 раз меньше.
Помимо негативного воздействия на слизистые оболочки и кожные покровы, ДЭА способен:
Общей рекомендацией можно считать максимальный отказ от средств и продуктов, содержащих диэтаноламин в составе.
Диэтаноламин. Свойства и область применения
Диэтаноламин — органическое соединение, относящееся к аминоспиртам с сильными основными свойствами. Оно представляет собой маслянистую жидкость, которая способно смешиваться с водой в любых соотношениях. В промышленности это соединение используется как эмульгатор и поверхностно-активное вещество, участрует в процессах очистки газов, находит применение в фармацевтической области.
Получение
Диэтаноламин образуется в результате действия аммиака на 2-хлорэтанол. Одновременно с ним получается этаноламин и триэтаноламин.
Промышленное синтезирование диэтаноламина происходит путем присоедиения аммика к этиленоксиду.
Общая характеристика
Диэтаноламин (ДЭА) — жидкость, обладающая аммиачным запахом, которая может иметь желтый или белый цвет, либо лишенная цвета. Соединение способно смешиваться с водой в любой пропорции. Оно растворимо в бензоле и эфире, и смешивается с ацетоном, хлороформом, глицерином и метанолом.
Химическая формула диэтаноламина — (HOCH2CH2)2NH. Вещество относится к классу аминоспиртов.
Применение
Диэтаноламин находит широкое применение в различных отраслях промышленности, сельском хозяйстве и фармацевтике. С участием этого реактива осуществляются технологические процессы газоочистки. ДЭА используется в технике в качестве эмульгатора.
Диэтаноламин входит в состав гербицидов и препаратов, предназначенных для уничтожения растений. Соединение используется для технических нужд как эмульгатор и поверхностно-активное вещество. В газоочистке вещество играет роль сорбента. При производстве сухого льда ДЭА участвует в процессе извлечения диоксида углерода из топочных газов. Диэтаноламин служит сырьем для промышленного синтеза таурина, и входит в состав фармацевтических препаратов. Органическое соединение необходимо для обработки древесины, производства чистяще-моющих средств, косметики и используется при борьбе с коррозией.
Диэтаноламин необходим в косметических средствах как:
Это органическое соединение практически не используется в чистом виде, а входит в состав других веществ. Доля диэтаноламина в косметике и лекарственных средствах не превышает 1,5 %.
Транспортировка и хранение
Для перевозки диэтаноламина используется железнодорожный и автомобильный транспорт. Вещество относится к опасным грузам, поэтому транспортировка его осуществляется с соблюдением соответствующих мер безопасности.
Хранение ДЭА осуществляется в герметичных емкостях, которые не пропускают солнечный свет. Складирование допускается в сухом и прохладном месте.
Безопасность
Чистый концентрированный диэтаноламин — опасное для здоровья вещество. При контакте со слизистыми оболочками вызывает раздражение, и поражает органы человека. К основным мерам безопасности при работе с ДЭА относится защита глаз и кожи от попадания вещества.
Диэтаноламина фузидат
Показания к применению
Бактериальные инфекции: сепсис, остеомиелит, септический эндокардит, пневмония, абсцесс легких, эмпиема плевры, отит, инфекции кожи и мягких тканей (фурункулез, пиодермия, сикоз, инфицированные раны, ожоги).
Возможные аналоги (заменители)
Действующее вещество, группа
Лекарственная форма
Гранулы для приготовления суспензии для приема внутрь, порошок для приготовления раствора для инфузий, суспензия для приема внутрь, таблетки, таблетки покрытые оболочкой
Противопоказания
Гиперчувствительность, гиперпротромбинемия, беременность.C осторожностью. Печеночная недостаточность, заболевания желчевыводящих путей (в т.ч. обструктивные).
Как применять: дозировка и курс лечения
Фармакологическое действие
Побочные действия
Отрыжка, боль в животе, тошнота, рвота, диарея, аллергические реакции (кожная сыпь, эозинофилия), обратимая желтуха (при использовании высоких доз или при быстрой в/в инфузии), острая почечная недостаточность (обычно вместе с желтухой). Флебит, перифлебит в месте в/в введения.
Особые указания
Антибиотик резерва при инфекциях, вызванных штаммами стафилококка, резистентными к пенициллину и др. антибиотикам. При тяжелом течении заболевания и необходимости длительной терапии рекомендуется использовать в составе комбинированной терапии с полусинтетическими пенициллинами или тетрациклинами.
Взаимодействие
Изучено недостаточно и данные неоднозначны.
Антациды замедляют всасывание.
Колестирамин снижает концентрацию в плазме.
Фармацевтически несовместим с канамицином, гентамицином, ванкомицином, карбенициллином, растворами аминокислот, кровезамещающих и Ca2+-содержащих ЛС.
Снижает (взаимно), не изменяет или усиливает эффект рифампицина в отношении ряда штаммов.
Бета-лактамы снижают (взаимно) или не изменят эффект.
Гликопептиды, фторхинолоны снижают (взаимно) эффект.
Возможен синергидный эффект при комбинировании с макролидами, тетрациклинами, аминогликозидами, хлорамфениколом, пенициллинами.
Препарат для симптоматической терапии заболеваний опорно-двигательного аппарата и способ его получения
Владельцы патента RU 2614958:
Изобретение относится к области химико-фармацевтической промышленности и медицины, а именно к препаратам для лечения заболеваний опорно-двигательного аппарата. Способ получения набора для получения средства для лечения заболеваний опорно-двигательного аппарата в форме инъекционного раствора, характеризующийся тем, что получают воду для инъекций, высокоочищенную методом электронной ионизации с последующей ультрафильтрацией, стерилизацией и дополнительной очисткой с помощью парового колонного дистиллятора, отдельно готовят растворы А и Б, где раствор А включает натрия дисульфит, глюкозамина сульфат натрия хлорид, лидокаина гидрохлорид, трометамол или 1 М раствор серной кислоты для корректировки pH раствора, и раствор Б содержит воду для инъекций и диэтаноламин, каждый из полученных растворов А и Б подвергают стерилизующей фильтрации и ампулированию. Задачей изобретения является разработка набора для получения импортозамещающего эффективного средства для лечения заболеваний опорно-двигательного аппарата. 1 з.п. ф-лы, 3 пр.
Изобретение относится к области химико-фармацевтической промышленности и медицины, а именно к препаратам для лечения заболеваний опорно-двигательного аппарата.
Лечение заболеваний опорно-двигательного аппарата, особенно хронических форм, является сложной врачебной проблемой. Преимущественно пожилой возраст больных, наличие сопутствующих заболеваний и необходимость в связи с этим соответствующего лечения осложняют проведение противовоспалительной и обезболивающей терапии. Чаще всего в данной области применяют классические нестероидные противовоспалительные средства. Однако они помимо положительного лечебного действия часто вызывают развитие побочных эффектов со стороны желудочно-кишечного тракта, печени, почек, бронхов, что значительно лимитирует проведение адекватной терапии.
В современной терапии широко используются соли глюкозамина, такие как гидрохлорид или сульфат. Глюкозамин является природным сахаридом, который в высоких концентрациях содержится в суставах и является естественным метаболитом, т.е. не чужеродным для организма веществом. В отличие от нестероидных противовоспалительных препаратов, глюкозамин рассматривается как более безопасное эффективное средство, которое может назначаться на длительный период времени.
Например, известен патент РФ 2118156, опубл. 27.08.1998, описывающий препарат глюкозамина гидрохлорида в форме 20%-ного раствора для внутримышечного и внутрисуставного введения. Раствор получают смешением двух растворов: раствора А и раствора Б.
Раствор А содержит:
| Глюкозамина гидрохлорид | 20,0% |
| Тримекаин | 0,5% |
| Натрия метабисульфит | 0,22% |
| Натрия сульфит | 0,1% |
| Вода для инъекций до общего объема | Остальное 1000 мл 100% |
Раствор Б содержит:
Способ получения заключается в том, что метабисульфит и сульфит натрия растворяют в воде, выдерживают 15 ч, затем добавляют глюкозамина гидрохлорид, тримекаин, перемешивают до растворения и фильтруют через бумажный фильтр (черная лента). Затем раствор фильтруют через мембранный фильтр для стерилизующей фильтрации с диаметром пор 0,1 мкм. Раствор А разливают в ампулы шприцевым наполнением по 2 мл и запаивают в токе азота и стерилизуют при 100°C 30 мин. Получают прозрачный раствор слабо-желтоватого цвета.
Также известны препараты на основе глюкозамина сульфата, имеющего более выраженный эффект по сравнению с хлористоводородной солью. Например, промышленностью выпускается препарат ХОНДРОЛОН (ВФС 42-2535-95).
Однако исследованиями было установлено, что глюкозамина сульфат нестабилен.
Поэтому были предприняты попытки по созданию его более стабильной формы. В частности, были разработаны кристаллические модификации, представляющие собой двойные соли глюкозамина с хлоридом натрия или калия (патент США 4642340, опубл. 10.02.1987 или патент США 5843923, опубл. 01.12.1998). На основе подобных субстанций основан ряд препаратов.
Например, известен препарат Дона в форме двух растворов (http://www.piluli.kharkov.ua/drugs/drug/dona/):
Известен также препарат Сустагард Артро (http://grls.rosminzdrav.ru/Grls_View_v2.aspx?idReg=761325&t=) для внутримышечного введения, который включает две ампулы Ампула А. Одна ампула (2 мл) содержит:
Не обнаружено описание способов получения данных препаратов.
В качестве ближайшего аналога может быть указан патент RU 2118156.
Задачей настоящего изобретения является разработка набора для получения импортозамещающего эффективного средства для лечения заболеваний опорно-двигательного аппарата и способа его получения.
Задача решается набором, включающим:
| Глюкозамина сульфата натрия хлорид | 477,3-528,0 мг |
| Трометамол или 1 М раствор серной кислоты | До pH 2,0-3,0, предпочтительно 2,7 до 2,8 |
| Натрия дисульфит | 1,0 мг |
| Лидокаина гидрохлорид | 9,5-10,5 мг |
| Вода для инъекций (ФС 42-2620-97) | До 2,0 мл |
Содержание глюкозамина сульфата в 1 мл препарата должно быть от 190 до 210 мг.
И Ампулу Б (растворитель) состава:
Способ получения предложенного набора заключается в том, что получают воду для инъекций высокоочищенную методом электронной ионизации с последующей ультрафильтрацией, стерилизацией и дополнительной очисткой с помощью парового колонного дистиллятора, отдельно готовят растворы А и Б, где для получения раствора А в полученной воде, насыщенной азотом при температуре (40-45)°C, растворяют при перемешивании натрия дисульфит, вносят глюкозамина сульфат натрия хлорид и перемешивают до его полного растворения, затем вносят субстанцию лидокаина гидрохлорида и перемешивают до его полного растворения, охлаждают до температуры (20-25)°C, корректируют pH с помощью 2% раствора трометамола или 1 М раствора серной кислоты до значения 2,7-2,8, перемешивают в течение 20-30 минут, для получения раствора Б воду для инъекций охлаждают до температуры (20-25)°C, и насыщают азотом, вносят диэтаноламин и перемешивают до его полного растворения, каждый из полученных растворов А и Б подвергают стерилизующей фильтрации с использованием сначала фильтрующего элемента патронного типа размером пор от 1,0 до 0,45 мкм, а затем фильтрующий элемент с размером пор 0,20 мкм, под давлением азота не выше 0,08-0,13 МПа, фасуют раздельно в предварительно простерилизованные ампулы с последующим запаиванием и формированием набора.
Технический результат: получение набора, обеспечивающего эффективное безопасное средство в форме высокочистого раствора для инъекций.
В качестве активного вещества используют Глюкозамина сульфат натрия хлорид. Активное начало обладает противовоспалительным действием и обезболивающим действием, восполняет эндогенный дефицит глюкозамина, стимулирует синтез протеогликанов и гиалуроновой кислоты синовиальной жидкости; способствует фиксации серы в процессе синтеза хондроитинсерной кислоты, тормозит развитие дегенеративных процессов в суставах, восстанавливает их функцию. Глюкозамин способствует предотвращению процессов разрушения хряща, стимулирует восстановление хрящевой ткани. Улучшает подвижность суставов, уменьшает потребность в нестероидных противовоспалительных препаратах (НПВП).
Показания к применению: средство для симптоматической терапии заболеваний опорно-двигательного аппарата (в частности, первичный и вторичный остеоартрит, спондилоартроз).
Для получения средства смешивают составные части набора: раствор Б (растворитель) с раствором А (раствор препарата) в одном шприце. Приготовленный раствор препарата вводят внутримышечно по 3 мл (растворы А+Б) 3 раза в неделю на протяжении 4-6 недель.
Возможность осуществления изобретения может быть продемонстрирована с помощью ниже представленных примеров.
Глюкозамина сульфата натрия хлорид
| («Биоиберика С.А.», Испания; «ВИРУД ГмбХ», Германия либо другого производителя имеющего регистрацию субстанции в РФ) | 502,5 мг |
| (соответствует глюкозамина сульфата 400,0 мг и натрия хлорида 102,5 мг) | |
| Трометамол (EP) или 1 М раствор серной кислоты до pH | 2,7-2,8 |
| Натрия дисульфит (USP или EP) | 1,0 мг |
| Лидокаина гидрохлорид («Дишман Фармасьютикалс энд Кемикалс Лимитед», Индия либо другого производителя, имеющего регистрацию субстанции в РФ) | 10,0 мг |
| Вода для инъекций (ФС 42-2620-97) | до 2,0 мл |
Пример 2. Способ получения
1. Подготовка сырья и материалов
Полученные сырье и материалы подвергаются входному контролю на соответствие требованиям НД, для чего от каждой серии (партии) контролер ОКК отбирает пробы для контроля в ОКК.
2. Подготовка воды для инъекций
Подготовка воды для инъекций осуществляется с помощью установки водоподготовки модель «SEPTRON® Line» (УС-69) и системы «COMBIT-RON», модель «KT 1500-4-450-Р» (УС-70), фирма «CHRIST AQUA PHARMA & BIOTECH».
Питьевая вода, подаваемая на установку «SEPTRON® Line» (УС-69), проходит следующие стадии подготовки:
— фильтрация через фильтры «MSF 25/24», предназначенные для удаления из воды ионов железа и марганца и ее осветление;
— фильтрация через двухколоночный умягчитель, который снаряжен натрий-катионитными фильтрами «RONDOMAT 95Е DWZ 330» с сильнокислотным катионитом в Na-форме и работает в маятниковом режиме, что обеспечивает непрерывную подачу умягченной воды на установку;
— ультрафиолетовую стерилизацию с помощью установки «Bewades 80 W80/11 LC».
Подготовленная таким образом умягченная вода подается в патентованный модуль «SEPTRON®», где осуществляются следующие ступени ее очистки: фильтрация, обратный осмос и электрическая деионизация, последняя происходит под воздействием электрического тока, без применения химикатов и при незначительной мощности потребления.
Умягченная вода поступает в камеру, заполненную ионообменным веществом. Приложенный к электродам электрический потенциал создает заряженные ионы в виде ионов натрия и хлорида, которые через мембрану ионного обмена поступают в сборную камеру для утилизации. Ионообменное вещество в модуле «SEPTRON®» уменьшает электрическое сопротивление воды.
Метод электродиализации позволяет удалять ионные компоненты из воды без увеличения в ней общего содержания солей.
Вода высокоочищенная, полученная на установке водоподготовки «SEPTRON® Line», подвергается ультрафильтрации и подается в сборник-накопитель.
Вода высокоочищенная из сборника подается на установку системы «COMBITRON»
Установка «COMBITRON» представляет собой паровой 4-колонный дистиллятор, в основе работы которого заложен принцип многократного выпаривания и конденсации. Установка обеспечивает получение стерильной, свободной от пирогенов воды для инъекций и чистого пара на базе одной технологической установки. Первая колонна установки имеет увеличенные размеры по сравнению с остальными, что дает возможность одновременно производить достаточное количество воды для инъекций и чистого пара.
Для приготовления воды для инъекций может быть использована другая система водоподготовки, способная производить воду для инъекций аналогичного качества.
3. Приготовление раствора для ампулы А
Через открытый люк в реактор вносят натрия дисульфит (0,50 кг/0,25 кг) и перемешивают в течение 20-30 мин до его полного растворения.
Затем в реактор через открытый люк порционно вносят субстанцию глюкозамина сульфат натрия хлорид (125,625 кг/62,812 кг), что соответствует 100,0 кг/50,0 кг глюкозамина сульфата, и перемешивают при скорости вращения мешалки 320-450 об/мин не менее 30 мин до его полного растворения.
Далее в реактор вносят субстанцию лидокаина гидрохлорида (2,5 кг/1,25 кг) и перемешивают не менее 30 мин до его полного растворения с барботированием азота.
Охлаждают содержимое реактора до температуры (20-25)°C, пропуская через рубашку реактора питьевую воду.
Доводят объем раствора препарата в реакторе водой для инъекций до метки (500,0 л/250,0 л) и дополнительно перемешивают не менее 20 мин с барботированием азота.
Отбирают пробу раствора препарата из реактора и измеряют величину pH. Корректируют pH с помощью 2,0% раствора трометамола или 1 М раствора серной кислоты до значения 2,7-2,8.
После окончания корректировки величины pH раствора препарата его перемешивают не менее 20 мин.
Стерилизующую фильтрацию раствора препарата осуществляют через систему стерилизующей фильтрации, состоящей из двух последовательно соединенных фильтродержателей: для фильтров предварительной (с размером пор от 0,45 до 1,0 мкм) и стерилизующей фильтрации (с размером пор 0,2 мкм). Система фильтрации расположена на материальной линии в помещении наполнения и запайки (класс чистоты В/А).
Перед началом стерилизующей фильтрации и по ее окончании проводят проверку целостности мембраны фильтрующего элемента патронного типа с размером пор 0,2 мкм с помощью прибора «Техночек-1» либо аналогичного.
Процесс фильтрации раствора осуществляется стерильным азотом, при давлении не более 0,15 МПа. Контроль давления осуществляют по манометру, установленному на крышке реактора.
Раствор из реактора подается на розлив через систему стерилизующей фильтрации, в промежуточную емкость и далее на систему дозирования машины наполнения и запайки. Из насосов-дозаторов и трубок системы дозирования вначале удаляют воздух, прокачивают стерильно отфильтрованный раствор через всю систему дозирования, до полного вытеснения воздуха.
Наполнение и запайка ампул с раствором А
Стерильные депирогенизированные ампулы поступают на накопительный стол машины наполнения и запайки ампул из стерилизационного туннеля где:
— 1 этап: осуществляется подача азота в пустую ампулу (вытесняет воздух);
— 2 этап: происходит наполнение ампул раствором препарата;
— 3 этап: осуществляется подача азота;
— 4 этап: запайка ампул.
4. Получение раствор для Ампулы Б
В реактор вместимостью 1000,0 л, снабженный магнитной мешалкой, паровой рубашкой, системой охлаждения и герметичной крышкой и термометром, подают 260,0 л (130,0 л) свежеприготовленной воды для инъекций, проконтролированной в лаборатории ОКК в соответствии с нормативной документацией. Воду для инъекций охлаждают до температуры (20-25)°C, пропуская через рубашку реактора питьевую воду, и насыщают азотом в течение 30 мин (расход азота 0,048 л/мин).
В реактор через открытый люк вносят расчетное количество диэтаноламина (6,48 кг/3,24 кг), прошедшего контроль по всем показателям НД в лаборатории ОКК.
Содержимое реактора перемешивают при скорости вращения мешалки от 320 до 450 об/мин не менее 20 мин до его полного растворения.
Доводят объем раствора в реакторе до 270,0 л (135,0 л) водой для инъекций.
Содержимое реактора перемешивают не менее 30 мин при скорости вращения мешалки 320-450 об/мин.
Стерилизующую фильтрацию раствора препарата осуществляют через систему стерилизующей фильтрации, состоящей из двух последовательно соединенных фильтродержателей: для фильтров предварительной (с размером пор от 0,45 до 1,0 мкм) и стерилизующей фильтрации (с размером пор 0,2 мкм). Система фильтрации расположена на материальной линии в помещении наполнения и запайки (класс чистоты В/А).
Перед началом стерилизующей фильтрации и по ее окончании проводят проверку целостности мембраны фильтрующего элемента патронного типа с размером пор 0,2 мкм с помощью прибора «Техночек-1» либо с помощью аналогичного прибора.
Процесс фильтрации раствора осуществляется стерильным азотом, при давлении не более 0,15 МПа. Контроль давления осуществляют по манометру, установленному на крышке реактора.
Растворитель (ампула Б) из реактора подается на розлив через систему стерилизующей фильтрации в промежуточную емкость и далее на систему дозирования машины наполнения и запайки. Из насосов-дозаторов и трубок системы дозирования вначале удаляют воздух, прокачивают стерильно отфильтрованный раствор через всю систему дозирования, до полного вытеснения воздуха.
5. Формирование набора
6 ампул А с препаратом помещают в контурную ячейковую упаковку из пленки поливинилхлоридной (ПВХ) 6 ампул Б с растворителем помещают в контурную ячейковую упаковку из пленки поливинилхлоридной (ПВХ), либо 6 ампул А с препаратом и 6 ампул Б с растворителем помещают в контурную ячейковую упаковку из пленки поливинилхлоридной (ПВХ), которые вместе с инструкцией по применению помещают в пачку из картона для потребительской тары.
Пример 3 Изучение стабильности и степени чистоты раствора
Полученные растворы прозрачные в соответствии с требованиями ГФ.
Цветность. Окраска не интенсивнее эталона 4б (ГФ X1, вып. 1, с. 194).
Пирогенность. Смешивают содержимое двух ампул с растворами А и Б.
Полученный раствор является апирогенным.
Механические включения. Препарат выдерживает требования «Инструкции по контролю на механические включения инъекционных лекарственных средств» РД 42-501-98. Механические включения отсутствуют.
Посторонние примеси определяют методом ТСХ. Ампула А. На хроматограмме испытуемого раствора обнаруживается одно пятно, находящееся на уровне пятна на хроматограмме раствора СОВС глюкозамина сульфата. Ампула Б. На хроматограмме испытуемого раствора обнаруживается одно пятно, находящееся на уровне пятна на хроматограмме раствора СОВС диэтаноламина.
Минимальный срок годности набора, определенный методом ускоренного старения при 60°C составляет 2 года.
1. Способ получения набора для получения средства для лечения заболеваний опорно-двигательного аппарата в форме инъекционного раствора, характеризующийся тем, что получают воду для инъекций высокоочищенную методом электронной ионизации с последующей ультрафильтрацией, стерилизацией и дополнительной очисткой с помощью парового колонного дистиллятора, отдельно готовят растворы А и Б, где для получения раствора А в полученной воде, насыщенной азотом при температуре (40-45)° C растворяют при перемешивании натрия дисульфит, вносят глюкозамина сульфат натрия хлорид и перемешивают до его полного растворения, затем вносят субстанцию лидокаина гидрохлорида и перемешивают до его полного растворения, охлаждают до температуры (20-25)°C, корректируют рН с помощью 2,0% раствора трометамола или 1 М раствора серной кислоты, перемешивают не менее 20 минут, для получения раствора Б воду для инъекций охлаждают до температуры (20-25)°C и насыщают азотом, вносят диэтаноламин и перемешивают до его полного растворения, каждый из полученных растворов А и Б подвергают стерилизующей фильтрации с использованием сначала фильтрующего элемента патронного типа размером пор от 1,0 до 0,45 мкм, а затем фильтрующий элемент с размером пор 0,20 мкм, под давлением азота не выше 0,08-0,13 МПа, фасуют раздельно в предварительно простерилизованные ампулы с последующим запаиванием и формированием набора.
2. Способ получения по п. 1, характеризующийся тем, что скорость вращения мешалки составляет от 320 до 450 об/мин.