Диагноз пги что это
Гиперпластические процессы эндометрия
К гиперпластическим процессам эндометрия (ГПЭ) относят различные варианты гиперплазии эндометрия и полипы эндометрия.
Синонимы: полип тела матки, железистая гиперплазия эндометрия, аденоматозная гиперплазия эндометрия.
ЭПИДЕМИОЛОГИЯ
Гиперплазию эндометрия отмечают примерно у 5% гинекологических больных. Полипы эндометрия обнаруживают у 5,3-25% гинекологических больных всех возрастных групп, но наиболее часто в пре и постменопаузе.
КЛАССИФИКАЦИЯ
В 1994 г. ВОЗ приняла классификацию гиперплазии эндометрия. Согласно этой классификации, гиперплазию эндометрия разделяют на гиперплазию без атипии и гиперплазию с атипией.
Приведённая классификация имеет значение для определения тактики ведения пациентки. Комплексная, или сложная, атипическая гиперплазия, в отличие от высокодифференцированной аденокарциномы, не имеет признаков инвазивного роста.
В зависимости от гистологического строения полипы эндометрия делят
К предраку эндометрия относят:
ЭТИОЛОГИЯ И ПАТОГЕНЕЗ
К возникновению патологической трансформации эндометрия приводят гормональные нарушения, затрагивающие все звенья нейрогуморальной регуляции организма женщины. Эндометрий — орган мишень для половых гормонов из-за присутствия в нём специфических рецепторов. Сбалансированное гормональное воздействие обеспечивает физиологические циклические превращения слизистой оболочки матки. Нарушение гормонального гомеостаза женщины может привести к изменению роста и дифференцировки клеточных элементов эндометрия и повлечь за собой развитие гиперпластических или неопластических процессов в эндометрии. Ведущее место в патогенезе занимает гиперэстрогения.
КЛИНИЧЕСКАЯ КАРТИНА
Основные клинические проявления ГПЭ — маточные кровотечения. При полипах эндометрия больших размеров могут быть схваткообразные боли внизу живота, небольшие полипы эндометрия протекают бессимптомно.
Учитывая, что патогенетическую основу гиперплазии эндометрия составляет ановуляция, ведущим симптомом больных репродуктивного возраста считают бесплодие; при обследовании женщин с бесплодием у 24% обнаруживают также и полипы эндометрия.
ДИАГНОСТИКА
Трансвагинальное ультразвуковое исследование — скрининговый высокоинформативный метод диагностики патологии половых органов. При внутриматочной патологии применяют трансвагинальную эхографию с контрастированием полости матки (гидросонография), информативность которой при ГПЭ составляет 78-99%. Гидросонография позволяет дифференцировать полипы эндометрия, внутриматочные синехии, субмукозную миому, точно определить топографию патологического процесса.
Среди инструментальных исследований гистероскопию считают наиболее информативным методом диагностики состояния полости матки и эндометрия. Визуальный осмотр полости матки позволяет с большой точностью обнаружить внутриматочную патологию и, при необходимости, выполнить прицельную биопсию.
Окончательным методом диагностики патологии эндометрия является гистологическое исследование удалённой ткани при диагностическом выскабливании. Информативность гистероскопии в диагностике гиперплазии эндометрия составляет 63-97,3%.
Как проводится гистологическое исследование: виды, методы, особенности
Злокачественные новообразования — это группа заболеваний, насчитывающая несколько тысяч видов опухолей разных типов и разной степени злокачественности. Они подразделяются на большие группы в зависимости от того из каких тканей они развиваются: если из эпителиальных (барьерных) — то это раки, если из соединительных тканей (мягких тканей и костей) – саркомы, если из лимфоидных (иммунных) – лимфомы/лейкозы. От того насколько правильно верифицирована опухоль (определен ее тип, степень злокачественности и другие характеристики) зависит правильность и эффективность лечения. Важную роль в этом играют гистологические исследования.
О том, как проходят гистологические исследования, какие задачи кроме диагностических они позволяют решать, что влияет на сроки их выполнения рассказывает заведующая патологоанатомическим отделением с прозектурой НМИЦ онкологии им. Н.Н. Петрова, к.м.н. Анна Сергеевна Артемьева.
Что служит материалом для патоморфологических (гистологических) исследований?
Процесс получения фрагмента ткани (биоптата) — биопсия – это несколько разных способов забора материала для гистологического исследования.
Биопсию внутренних органов делают под УЗИ-навигацией, либо с помощью хирургического вмешательства.
Как обрабатывают эти материалы для проведения гистологического исследования?
1 Этап. Фиксация — «консервирование» биоптата в формалине — специальном химическом растворе, который предотвращает гниение, позволяет сохранить структуры ткани.
Фиксация биоптата может занимать от 6 до 24 часов – в зависимости от его вида и размера.
Операционный материал фиксируется дольше, в несколько этапов. Сначала предварительная фиксация, которая занимает примерно 12 часов. Затем вырезка нужных фрагментов и повторная фиксация еще 24 часа.
Соотношение объема материала к объему формалина должно быть 1:20.
2 Этап. Процессинг — процесс обезвоживания, обезжиривания и пропитки материала парафином. Автомат перемещает кусочек материала из раствора в раствор.
В качестве растворов применяются: абсолютированный изопропиловый спирт (6-8 смен), ксилол (2 смены), расплавленный парафин (2 смены).
Программа разнится для «жирного» материала (к которым относятся, например, ткани молочной железы) и «нежирного» – 36 и 24 часа соответственно.
Процесс получения парафиновых блоков.
3 Этап. Изготовление парафинового блока. Кусок материала помещается в форму с расплавленным парафином (уже другим нежели во время процессинга – с более высокой температурой плавления) и охлаждается. Выполняется вручную, сложно ускорить.
4 Этап. Изготовление срезов. Толщина образца — кусочка ткани, залитого в парафин – 1-3 мм. Толщина каждого среза 4-5 мкм (0,004-0,005 мм). Выполняет лаборант с использованием специального инструмента – микротома.
Срезы монтируются на стекла и должны высохнуть.
Несмотря на то, что часть материала теряется при выравнивании в микротоме, при должном профессионализме, из одного образца — материала от одной биопсии, операционного материала от одной опухоли, возможно изготовить около 100 стекол (микропрепаратов).
Для чего делаются срезы?
Срезы делаются для рутинной окраски гематоксилинном и эозином, иммуногистохимического исследования и других видов исследований.
Срезы для всех исследований используются одинаковые, различается окраска, могут отличаться стекла, на которые они монтируются, так для ИГХ и FISH нужны специальные адгезивные стекла или заряженные стекла.
Блоки и стекла способны храниться долгие годы и использоваться для проведения дополнительных гистологических исследований, пересмотров, а также в научных целях.
Архив гистологических материалов собирается в НМИЦ онкологии им. Н.Н. Петрова с 1927 года и содержит более 10 млн единиц хранения (микропрепараты — стекла, парафиновые блоки, архивные карточки, влажный архив).
Какие виды гистологических исследований наиболее информативны?
Что позволяют определить разные виды гистологических исследований
Гистологическое исследование – что это такое?
Позволяет верифицировать опухоль – то есть определить из каких клеток она состоит (из какой ткани она развивается), степень ее дифференцировки (зрелости).
Рутинная окраска, выполняющаяся при гистологическом исследовании, позволяет выявить патологический процесс в анализируемом материале (биоптате, операционном материале):
Также, в большинстве случаев, благодаря рутинной окраске, можно определить степень злокачественности опухоли и, если она достаточно зрелая, то какова ее природа.
Окрашенные срезы под микроскопом
 |
Инвазивный протоковый рак er 100%.
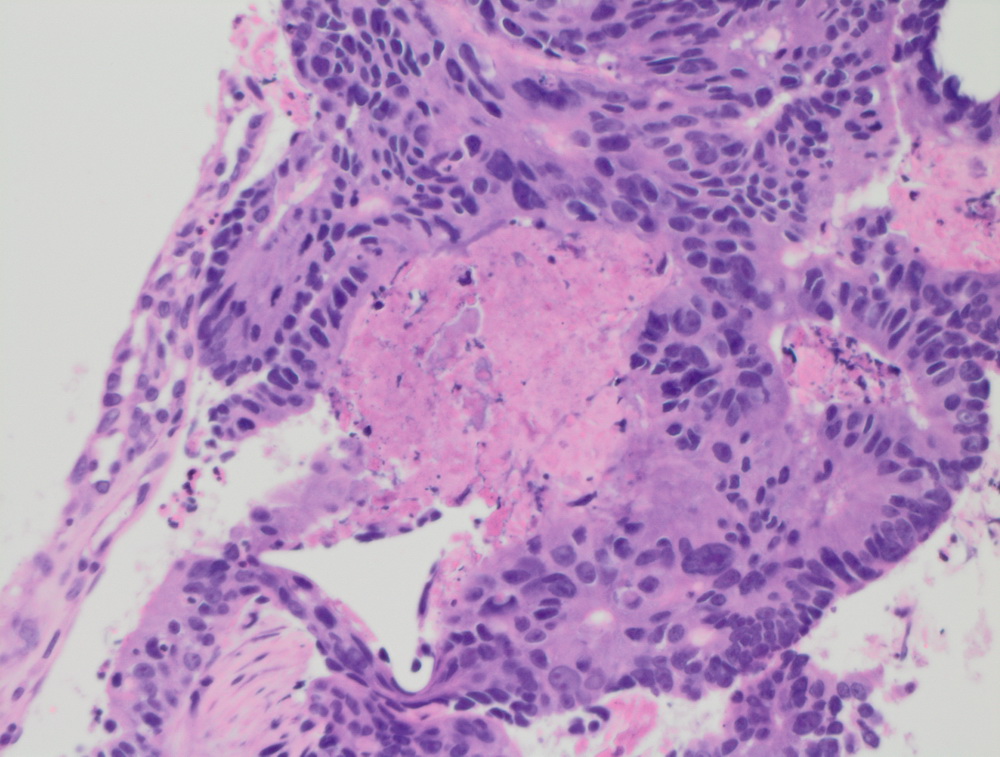
Карцинома сигмовидной кишки.
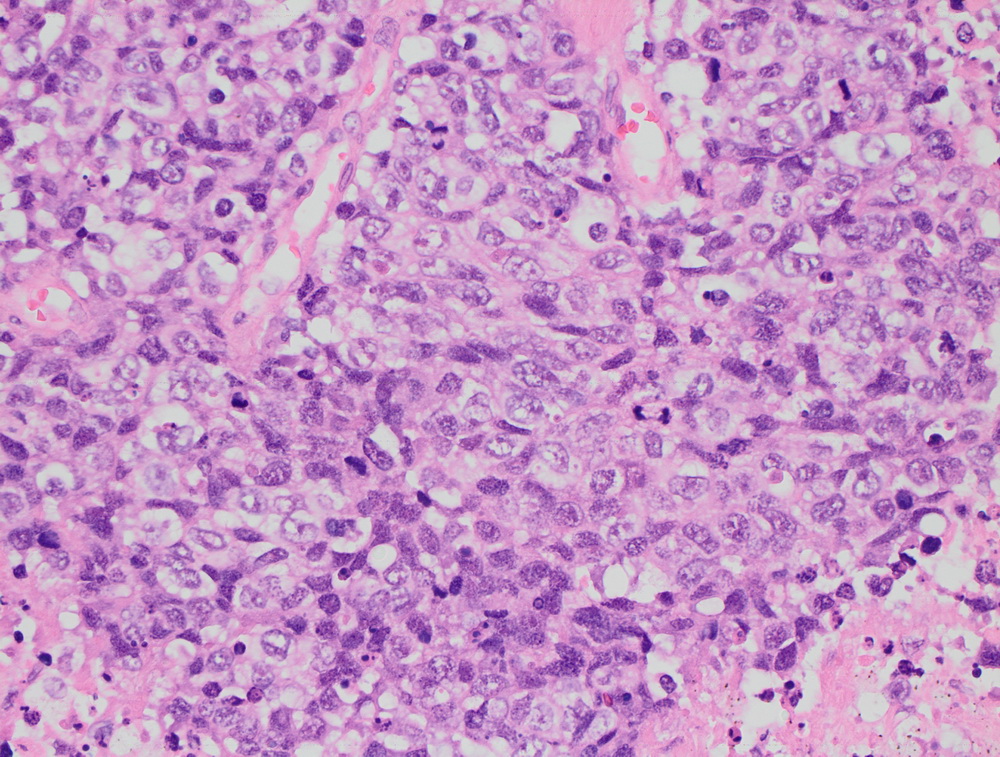
Крупноклеточная нейроэндокринная опухоль.
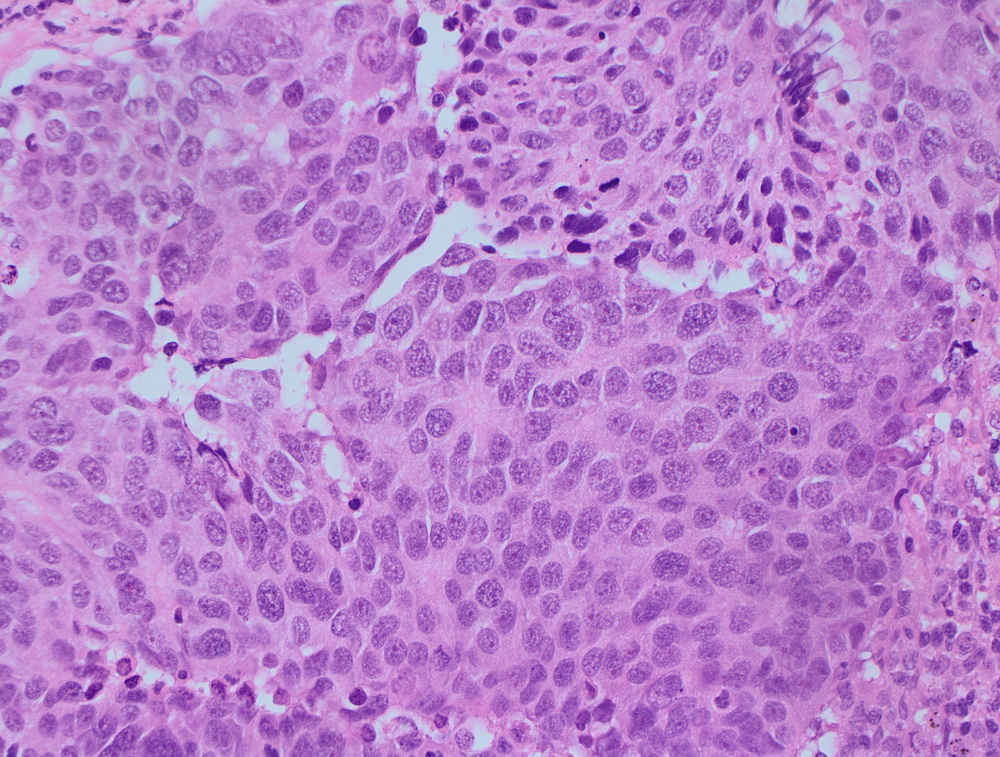
МТС крупноклеточной нейроэндокринной опухоли.
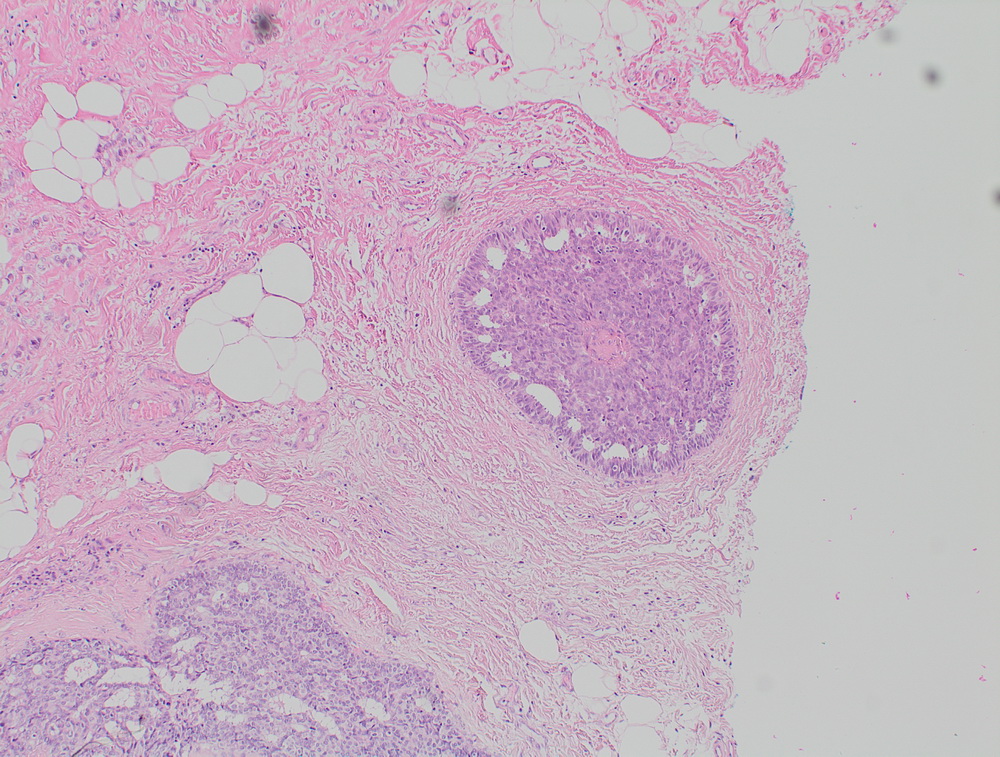
Неспецифический рак молочной железы. Участок in situ карциномы внутри протока, криброзного типа.
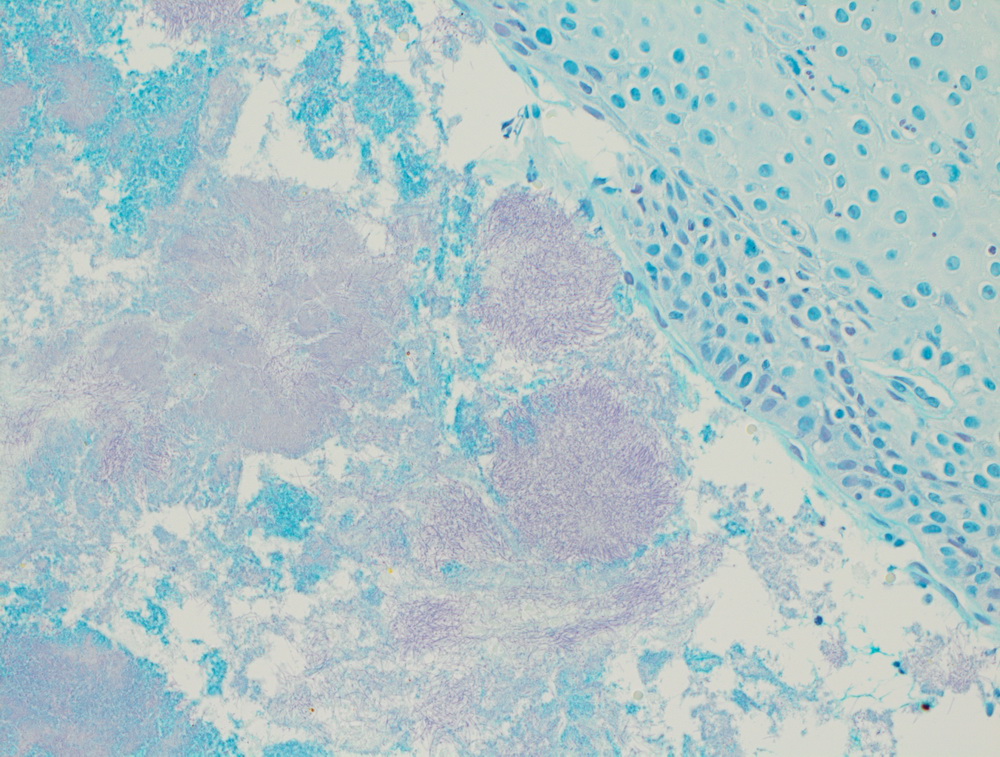
Низкодифферинцированный рак пищевода.
При гистологическом исследовании биоптата и операционного материала можно оценить распространенность: размер опухоли и прорастание в окружающие ткани, насколько затронуты лимфоузлы и есть ли метастазы в отдаленные органы (если эти все структуры присланы для гистологического исследования). При консультации готовых микропрепаратов – стекол, это, как правило, невозможно, если опухоль больше размеров гистологической кассеты или рассечена предыдущим исследователем и не предоставлены данные макроскопического исследования.
Во время гистологического исследования изучаются все стекла от одного образца – материала, полученного от одного вмешательства — одной операции или одной биопсии, вне зависимости от их количества, это считается одной консультацией.
Сроки выполнения гистологического исследования зависят от количества микропрепаратов и от категории сложности того процесса, который в них обнаруживается, сроки могут удлиняться, особенно при необходимости использования дополнительных методов исследования и анализа дополнительных сведений. На сроки выполнения гистологического исследования влияет полнота предоставленной пациентом клинической информации, в том числе данных уже проведенных исследований.
Иммуногистохимия (ИГХ)
Сложное многоэтапное исследование, выполняется после гистологического исследования на том же материале. Опухолевые срезы окрашиваются антителами, которые способны связываться антигенами (белками), которые несут опухолевые клетки. Разные опухолевые клетки несут разные антигены, к каждому из которых подобно ключа к замку подходит антитело.
Один из этапов ИГХ
ИГХ исследование — это комбинаторика. 100% специфичных и чувствительных к какой-то опухоли маркеров не существует, но есть набор антигенов, которые в определенном типе опухоль должны быть и набор тех, которых там быть не должно, таким образом ИГХ-панель строится так чтобы включать несколько антител, которые должны быть позитивны и несколько, которые должны быть негативны. Для разных опухолей различаются эти наборы позитивных/негативных маркеров.
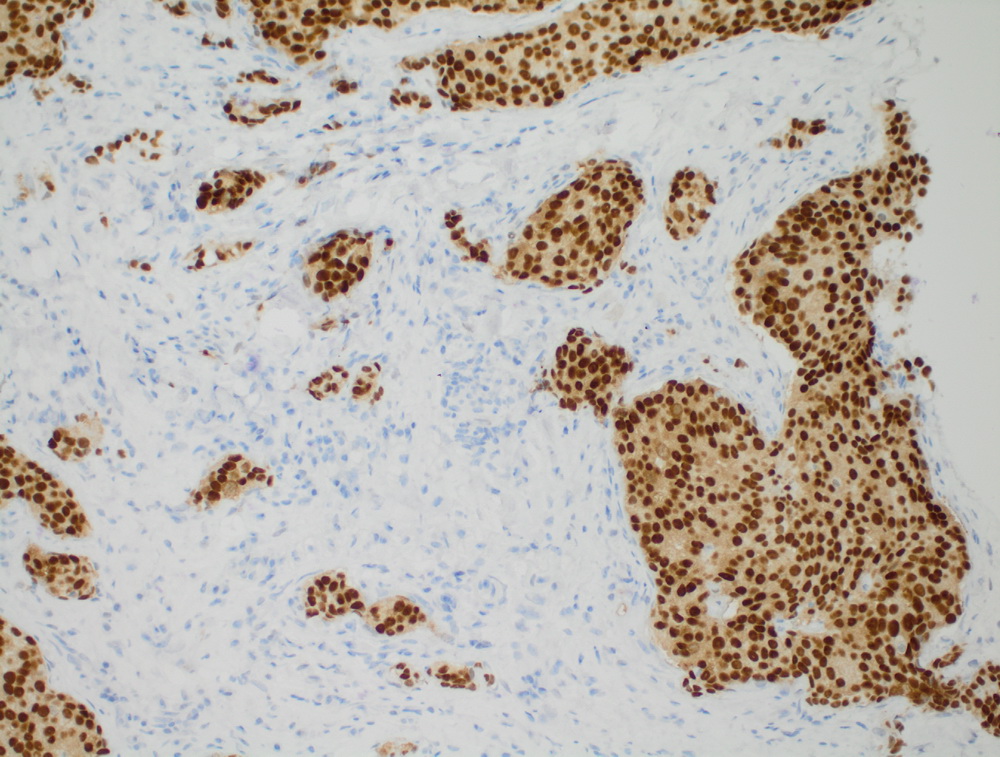
При проведении прогностической ИГХ – выявлении маркеров чувствительности к терапии определяется набор таких маркеров для конкретных опухолей, например, рака молочной железы: рецепторы стероидных гормонов (эстроген, прогестерон), рецептор эпидермального фактора роста (HER2) и индекс пролиферативной активности Ki67 (скорости деления клеток).
Стекла окрашиваются последовательно — различными антителами красятся наборы маркеров в несколько этапов, процесс окраски стекол одним антителом занимает 48 часов.
Таким образом, каждое антитело наносится на отдельный срез ткани, монтированный на отдельное стекло, как правило с соответствующим внешним контролем, количество реакций (используемых антител) и этапов окраски может существенно варьировать в зависимости от конкретной диагностической ситуации, все зависит от индивидуальных особенностей опухоли. Проводится такое количество окрасок, которое необходимо для того, чтобы выявить наиболее характерный для определенной опухоли набор позитивных и негативных маркеров.
Кому-то для этого будет достаточно 5 антител, а кому-то необходимо сделать 20 окрасок и более. Максимальное количество окрасок, которое нам приходилось делать – 212.
Поэтому точные сроки и стоимость этого исследования невозможно определить заранее. Разные по течению и прогнозу опухоли могут быть очень похожи друг на друга, только минимальные различия в окрашивании, с учетом клинических данных и данных других методов обследования, могут позволить установить верный диагноз.
Есть целый ряд доброкачественных опухолей, симулирующих злокачественные, в том числе высокоагрессивные, а некоторые злокачественные высоко дифференцированные опухоли трудно отличить от воспалительных и реактивных процессов. В таких ситуациях только опыт и квалификация патоморфолога, анализ всего комплекса доступной информации (снимки КТ, МРТ, рентген, протокол операции, и др.) позволяют поставить диагноз.
В грамотной интерпретации результатов ИГХ очень важна роль эксперта, ведь те случаи, с которыми приходится работать, в большинстве своем, сложные. Практически не существует антител, которые могут выступать в качестве 100%-х маркеров той или иной опухоли, врачу всегда приходится взвешивать различные вероятности.
Что определяется с помощью ИГХ?
Иммуногистохимия позволяет оценить потенциальный темп роста опухоли, ответ на химио-, таргетную, гормональную терапию.
Флуоресцентная гибридизация in situ (FISH-тест)
Это метод молекулярно-генетической диагностики в ткани.
FISH проводится в срезе ткани и позволяет привязать генетическую перестройку к конкретной опухолевой клетке.
В этом тесте также используются специальные красители, которые связываются только с определенными участками хромосом. Их называют зондами, которые могут быть помечены флуоресцентным или хромогенным красителем, визуализирующимися при помощи флуоресцентного или светового микроскопа.
Технические операции по подготовке гистологических стекол к этому исследованию занимает 2 рабочих дня.
Анализ препарата с помощью многоголового микроскопа.
Полученные микропрепараты очень чувствительны к внешней среде – они могут выцвести со временем, чтобы избежать потерь информации все FISH-препараты сканируются, создается их цифровая копия, которая доступна для внешнего пересмотра. Специалисты просматривают флуоресцирующий материал в темном поле, в анализе препарата принимают участие как минимум 2 специалиста. При необходимости используется и цифровой анализ.
Что определяется с помощью FISH-теста?
FISH-тест позволят диагностировать некоторые виды опухолей, определяет целесообразность использования некоторых химиотерапевтических препаратов.
Проведение гистологического исследования, и в первую очередь FISH-теста — это экспертная работа, которая зависит от квалификации специалиста. Очень многие мутации, которые выявляются в опухолях, не всегда являются метками опухолей, они могут находиться и в доброкачественных образованиях или нормальных тканях.
За год патологоанатомическое отделение НМИЦ онкологии имени Н.Н. Петрова выполняет около 20000 гистологических исследований (пациентов), из них около 5000 консультативных случаев (пересмотров), более 30000 ИГХ исследований, а также участвует в программе внешнего контроля качества ИГХ исследований NordIQ.
Специалисты отделения обладают огромным опытом проведения гистологических исследований и экспертными компетенциями.
Скорость выполнения гистологических исследований и адекватность гистологического заключения зависят от ряда факторов:
После выполнения гистологического исследования пациент получает гистологическое заключение/протокол исследования гистологического материала.
Расшифровка гистологического исследования: на что обратить внимание?
Гистологическое заключение включает в себя несколько рубрик (полей):
Макроскопическое описание
Заполняется как для биоптатов — не обязательно, так и для операционного материала, для которого имеет крайне важное значение в ряде случаев.
Микроскопическое описание
Описание изменений на микроскопическом уровне, не обязательно к заполнению, так как вся необходимая информация может быть отражена в поле «заключение».
Результаты иммуногистохимического исследования
В этом поле описано какие антитела использовались в данном случае и каков результат окрашивания: наличие окрашивание или его отсутствие, локализация в клетке при необходимости, а также процент позитивных клеток и интенсивность реакции, когда это имеет значение.
Патологоанатомическое заключение
Содержит нозологическую/классификационную единицу, если ее возможно установить по исследованному материалу, то есть дает ответы на вопросы:
Также приводятся все необходимые прогностические данные: степень дифференцировки, параметры, влияющие на стадию, состояние краев резекции, если возможно их оценить и т.п.
Дополнительные замечания и рекомендации
Поле может содержать комментарии, относительно возможного направления дальнейшего обследования, вероятности того или иного диагноза, необходимости ознакомиться с теми или иными клиническими данными и др.
Мы не рекомендуем пациентам самостоятельно заниматься расшифровкой показателей гистологического исследования, используя информацию, полученную на различных Интернет-сайтах и форумах пациентов, так как на интерпретацию данных влияет большое количество факторов, в том числе, возраст пациента, данные других исследований и др.
Расшифровкой исследования может заниматься только специалист – врач онколог по профилю заболевания!
Авторская публикация:
АРТЕМЬЕВА АННА СЕРГЕЕВНА
заведующий патологоанатомического отделения с прозектурой ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России, кандидат медицинских наук
Патогистологические исследования
Патогистологическое исследование подразумевает проведение микро- или макроскопии биоматериала тканей, изъятых различными методами из патологических образований или внутренних органов для последующего их изучения их.
Такой метод диагностики считается весьма показательным для точного определения диагноза. Особо важен он для определения онкологических новообразований, наблюдения за их развитием в динамике и контроля эффективности лечения в Турции.
Основные цели патогистологического исследования
Патогистологическое исследование начинается с того, что из организма пациента извлекают небольшой образец внутренних тканей, требующих изучения на предмет отклонений. Такой анализ позволяет точно определить строение тканей, патологические процессы, которые в них происходят, а также проконтролировать действие лечения. Ткани берут во время хирургического вмешательства или посредством биопсии, а дальше изучают под микроскопом.
Диагностика может назначаться по ряду причин:
В современной медицинской практике для онкологических больных не проводят химиотерапию или лучевое облучение без предварительного гистологического анализа тканей. Помимо этого подробное изучение необходимо для выявления малейших отклонений в ходе развития болезни и лечения.
Проведение биопсии и анализ тканей играет важную роль в подборе эффективного лечения в разных отраслях медицины: гематологии, нефрологии, гастроэнтерологии, гинекологии, пульмонологии, оториноларингологии, урологии и др.
Помимо этого патогистологическое исследование часто применяется в торакальной и абдоминальной хирургии. Разновидности биопсии по способу забора биоматериалов для обследования Обычно материал для анализа берется под визуальным контролем, для этого может использоваться ультразвуковой аппарат или хирургический доступ к тканям.
В качестве биоматериала могут быть изъяты:
Биопсия может выполняться открытым методом (наружная), когда биоматериал для изучения берется посредством мазков и смывов. Также она бывает диагностической и лечебной. Последний вариант подразумевает полное удаление патологических тканей с их последующим изучением.
Поражение головного мозга. Перивентрикулярный геморрагический инфаркт (ПГИ)
Поражение головного мозга. Перивентрикулярный геморрагический инфаркт
Перивентрикулярный геморрагический инфаркт (ПГИ), называемый также «распространенным красным размягчением», «венозным инфарктом», «церебральной геморрагической энцефалопатией», «перивентрикулярным геморрагическим поражением» и «геморрагической перивентрикулярной лейкомаляцией», встречается преимущественно у глубоко недоношенных детей (20—35 недель беременности) и возникает в результате нарушения оттока крови (стаза-тромбоза) в системе внутренних мозговых вен. При тромбозе вены Галена возникают массивные билатеральные геморрагические размягчения полуовальных центров. Однако чаще встречаются менее значительные поражения. ПГИ часто наблюдаются у детей с инфекциями, которые играют важную роль в их патогенезе.
Термин ПГИ еще не вошел в широкую практику клиницистов, которые чаще используют понятие «перивентрикулярное кровоизлияние» (ПВК). Так, при НСГ-исследовании у детей с перинатальными поражениями ЦНС ПВК обнаруживаются в 11 % случаев. Вероятно, часть ПВК — это ПГИ, другая же часть может быть представлена перивентрикулярными ВМК и ОГЛ.
Макроскопическое исследование: в перивентрикулярных областях боковых желудочков обычно в симметричных отделах обнаруживаются обширные участки дряблой ткани темно-красного цвета. ПГИ — это не простое кровоизлияние, это «пропитывание» кровью перивентрикулярного белого вещества мозга в сочетании с его отеком и неполным некрозом.
По периферии поражений выявляются гипертрофированные астроциты, тучные астроциты Ниссля и иногда очаги ПЛ. В ранней фазе процесса вокруг кровоизлияний обнаруживаются гибнущие глиоциты (скорее всего, олигодендроциты), ядра которых приобретают формы крючков и запятых. В субэпендимальных и корковых венах, а также в областях инфарктов нередко обнаруживаются тромбы. Вокруг кровоизлияний могут выявляться единичные лейкоциты. ПГИ, в отличие от ВМК, является билатеральным, симметричным и в большей или меньшей степени вовлекает все доли мозга. Изредка процесс распространяется на весь полуовальный центр. ПГИ может быть причиной смерти. ПГИ обычно сочетаются с СЭК, ишемическими поражениями нейронов коры и ствола мозга.
Микроскопически определяются многочисленные кроной.шил ния, нередко вокруг тромбов мелких сосудов, чередующиеся с участками отека и фокусами некробиоза мозговой ткани ПГИ может осложниться внутримозговым кровоизлиянием (гематомой) и ВЖК. У выживших детей на месте ПГИ образуются многочисленные кисты с гемосидерозом и глиоз белого вещества мозга.
Вопросы этиологии, патогенеза и клиники ПГИ еще в начальной стадии изучения. Поэтому следует остановиться на исследовани ях А. Товбина, посвятившего ПГИ наибольшее количество работ. Автор выделяет «перивентрикулярные венозные инфаркты» у недоношенных детей и «корковые инфаркты» у доношенных новорожденных. Он считает, что в результате анте- и интра- натальной гипоксии или дыхательных нарушений у новорожденных (гиалиновые мембраны, пневмония) возникают циркуляторные нарушения в головном мозге с венозным застоем и стазом-тромбозом в венах, которые ведут к геморрагическим некрозам мозга и внутри- желудочковым кровоизлияниям. Перивентрикулярную лейкомаляцию А. Товбин рассматривает как одну из форм инфарктов или как микроинфаркты. Автор полагает, что, когда гипоксия и нарушения мозгового кровообращения менее выражены, в перивентрикулярных участках мозга возникают небольшие повреждения в виде двух форм: фокусов кровоизлияний в субэпендимальном матриксе и фокусов перивентрнкулярной лейкомаляции. Патогенез их такой же, как и больших геморрагических венозных инфарктов. Поскольку очаги ПЛ нередко обнаруживались вокруг геморрагических инфарктов, то А. Товбин называет их «спутниками» последних. Таким образом, хотя А. Товбин рассматривает ПЛ в рамках венозных инфарктов, но он все же дифференцирует эти два вида некрозов. Венозные геморрагические инфаркты резко отличаются от ПЛ уже макроскопически: представляют большие поля дряблой мозговой ткани, пропитанной кровью. В то же время их следует дифференцировать с таким осложнением, как массивные кровоизлияния в очаги ПЛ.
У выживших детей в областях ПГИ формируются глиоз и кисты, расширяются боковые желудочки мозга. Развивается ДЦП с гемиплегией, квадриплегией и задержкой психического развития.
Проблемы терминологии. Следует отметить, что, описывая рас-сматриваемое поражение, другие авторы используют иные термины. Так, С. В. Courville называет подобный патологический процесс «распространенным красным размягчением» и «церебральной геморра-гической энцефалопатией», считая его смертельным поражением, быстро приводящим к смерти. R. L. Friede отмечает, что при тромбозе вены Галена возникают массивные билатеральные геморрагические размягчения в полуовальном центре. J. К. Larroche описывает перивентрикулярные геморрагические инфаркты в разделе мозговых кровоизлияний, связывая их с лейкомаляцией или с ишемией глубоких отделов белого вещества полушарий мозга. J. В. Wigglesworth, К. Е. Раре считают, что перивентрикулярные венозные инфаркты в большинстве случаев являются вторичными по отношению к массивным субэпендим алы шм кровоизлияниям. J. Volpe подобные поражения относит к «перивентрикулярно-внутрижелудочковому кровоизлиянию». Поражения, имеющие вид перивентрикулярных геморрагических инфарктов, называют также «геморрагической перивентри- кулярной лейкомаляцией», к которой относят случаи сочетания ПЛ с кровоизлияниями различных размеров. Таким образом, налицо не только терминологическая путаница, но и недостаточное понимание сущности рассматриваемого патологического процесса. Полагаю, что ПГИ следует дифференцировать с перивентрикулярными ВМК, а также со случаями кровоизлияний в очаги перивентрикулярной лейкомаляции.







