Децидуоподобная ткань что это
Децидуоподобная ткань что это
Децидуальная оболочка представляет собой трансформированный в связи с беременностью функциональный слой эндометрия. К моменту имплантации эндометрий находится в секреторной фазе. Он состоит из двух слоев: компактного и спонгиозного. Компактный слой, обращенный в полость матки, содержит выводные протоки маточных желез и клетки стромы эндометрия, превратившиеся во время беременности в децидуальный спонгиозный слой в основном состоит из желез.
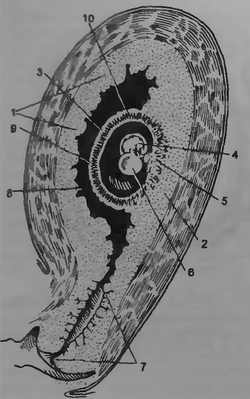
В соответствии с локализацией плодного яйца в децидуальной оболочке можно различить три части:
• выстилающая полость матки (decidua parietalis);
• покрывающая плодное яйцо со стороны полости матки (decidua capsularis);
• расположенная между плодным яйцом и стенкой матки (decidua basalis). Указанные взаимоотношения различных частей децидуальной оболочки представлены на рис. 3.7.
В процессе роста плодного яйца decidua parietalis и decidua capsularis растягиваются, истончаются и приближаются друг к другу. На 4—5-м месяце беременности плодное яйцо занимает уже всю полость матки, и decidua parietalis сливается с decidua capsularis. Наоборот, decidua basalis значительно гипертрофируется и превращается в материнскую часть плаценты. В этой части плаценты находятся многочисленные ворсины хориона, вокруг которых формируется межворсинчатое пространство.
Децидуальная оболочка является для плода питательным и защитным слоем: трофическая функция ее в основном осуществляется на ранних этапах внутриутробного развития, защитная роль наиболее полно проявляется высокой фагоцитарной активностью. Децидуальная ткань лизирует микроорганизмы и инактивирует их токсины, принимает также участие в синтезе углеводов, липидов и белков В ней происходит синтез пролактина и простагландинов. Таким образом, децидуальной оболочке принадлежит очень важная роль в имплантации и дальнейшем развитии эмбриона и плода.
Децидуальный полип
Децидуальный полип – это новообразование в виде небольшого выроста, выступающее в просвет канала шейки матки или за его пределы. В период беременности гормональный фон женщины подвергается мощным изменением, в результате чего слизистая канала начинает разрастаться, то есть происходит ее децидуализация. Избыточное разрастание децидуальной (хориальной) ткани в результате приводит к ее проникновению в цервикальный канал в виде небольших наростов (полипов).
По данным научных исследований, практически 22% беременных женщин сталкиваются с доброкачественными патологическими процессами шейки матки, в частности, с полиповидными образованиями эндоцервикса (слизистой оболочки, выстилающей шейку матки изнутри).
Различают два вида полиповидных образований шейки матки:
Образование таких полипов сложно назвать заболеванием, поскольку в большинстве случаев они проходят самостоятельно после рождения ребенка и стабилизации гормонального фона. Однако такие образования способны вызвать беспокойство женщины, поскольку характеризуются наличием большого количества сосудов и начинают кровоточить при малейшем механическом воздействии, например, во время половой близости или медицинского обследования.
Травмированный полип представляет собой серьезную опасность, поскольку может быть инфицирован, а это способно вызвать серьезные воспалительные процессы в организме женщины. Необходимо срочно обратиться к специалисту, если обнаружили у себя любой из симптомов, указывающий на наличие полипа.
Симптомы и причины возникновения
Как уже было отмечено, поскольку тело децидуального полипа пронизано большим количеством кровеносных сосудов, он может начать кровить даже при малейшем повреждении. То есть кровянистые выделения из влагалища могут возникнуть в результате активных физических нагрузок или в процессе планового обследования в кабинете врача.
На что следует обращать внимание, если специалисты диагностировали наличие полипа:
Любой из данных симптомов может свидетельствовать об инфицировании полипа и возникновении воспалительного процесса. Если новообразование постоянно кровоточит, следует пройти полное обследование, на основании которого специалист назначит адекватное лечение.
Этиология полипов до конца не изучена, но современная медицина выделяет несколько основных причин развития таких новообразований:
Особенно важно отслеживать децидуальный полип при беременности, и поскольку основными показателями состояния образования являются выделения, о любом изменении их состава необходимо сообщать гинекологу.
Децидуальный полип при беременности: диагностика и лечение
Децидуальные новообразования образуются из ткани плаценты или хориона и располагаются в шейке матки. Диагностика таких полипов не представляет особой сложности, поскольку они обнаруживаются при обычном исследовании шейки матки и цервикального канала – кольпоскопии. Процедура занимает всего несколько минут и является безболезненной. Обязательными являются общеклинические и бактериологические лабораторные исследования.
Обнаружив полип, врач проводит дифференциальную диагностику с паппиломой шейки матки, пролабирующими железами и травмированными кусочками ткани шейки матки, которые могут быть приняты за полип. С помощью мазка на онкоцитологию и в редких случаях биопсии определяется состояние полипа. Также выполняется УЗИ органов малого таза с допплеометрическим картированием сосудов и эхоскопией полиповидного образования. После проведения полной диагностики и постановки точного диагноза назначается эффективное лечение.
В большинстве случаев децидуальные образования не нуждаются в каком-либо лечении и самостоятельно проходят после нормализации гормонального фона. Естественному ходу родов такие полипы также не мешают, поэтому чаще всего после постановки диагноза специалисты просто наблюдают за развитием образования, контролируют внутреннюю флору влагалища и при необходимости могут назначить противовоспалительное лечение.
Однако децидуальный полип при беременности подлежит немедленному удалению, если наблюдаются такие симптомы:
Удаляют полип методом откручивания с применением лазера, эндоскопа, с последующей термо- и криокоагуляцией образования. Данный способ оперативного вмешательства является малоинвазивным и не требует выскабливания цервикального канала, поэтому может использоваться при беременности.
Диагностика и лечение децидуального полипа в ОН КЛИНИК
Большинство женщин обращаются к гинекологу лишь при возникновении болезненных или дискомфортных ощущений. Но, чтобы сохранить собственное здоровье и выявить заболевание на самой ранней стадии развития, следует проводить регулярные гинекологические осмотры. Если у Вас возникли любые сомнения по поводу здоровья или появились тревожные симптомы, свидетельствующие о каких-либо нарушениях, рекомендуем незамедлительно обратиться к специалистам нашей клиники.
Медицинский центр ОН КЛИНИК – это команда профессионалов с огромным практическим опытом и прогрессивной диагностической базой. В своей работе наши гинекологи используют уникальные методы диагностики и лечения любых женских заболеваний, что позволит в короткий срок справиться с патологией и полностью устранить все проявления болезни на самом раннем этапе развития.
Ультразвуковая диагностика с объемным сканированием позволяет точно определить наличие и локализацию образований, а современные безоперационные методы позволяют проводить малоинвазивные вмешательства без риска возникновения каких-либо осложнений.
ОН КЛИНИК: тысячи женщин вернулись к здоровой жизни благодаря профессиональной работе наших врачей. Присоединяйтесь!
Синдром потери плода
Основной задачей современного акушерства является снижение числа репродуктивных потерь, и актуальность невынашивания беременности (НБ) не вызывает сомнения, так как является наиболее частым ее осложнением.
Основной задачей современного акушерства является снижение числа репродуктивных потерь, и актуальность невынашивания беременности (НБ) не вызывает сомнения, так как является наиболее частым ее осложнением. Несмотря на достигнутые в последние годы успехи в профилактике и лечении данной патологии, частота НБ остается стабильной и достаточно высокой. Так, по данным разных авторов, она составляет от 2% до 55%, достигая в первом триместре 80% [2, 3, 11, 12, 13]. Отсутствие снижения частоты НБ указывает на трудности, возникающие при ведении этой группы пациенток. С одной стороны, они обусловлены многофакторностью этиологии и патогенетических механизмов заболевания. С другой — несовершенством применяемых диагностических методик и отсутствием адекватного мониторинга осложнений, возникающих во время беременности.
Синдром потери плода — это новый термин, появившийся в последнее время и включающий в себя [4]:
Этиология синдрома потери плода чрезвычайно разнообразна и зависит от многих факторов. Одни из них непосредственно приводят к закладке аномального эмбриона, другие создают неблагоприятные условия для его нормального развития.
Основные причины потерь беременности: генетические, эндокринные нарушения, инфекционно-воспалительные заболевания, иммунологические механизмы и тромбофилии.
Под генетическими факторами чаще подразумевают хромосомные аномалии эмбриона, которые появляются в результате слияния двух родительских клеток с точечными мутациями в хромосомном наборе, возникающими из-за нарушения процесса мейоза.
Около 50% спорадических ранних потерь беременности обусловлены хромосомными дефектами. При проведении исследований материала ранних выкидышей генетические аномалии обнаружены в 82% случаев до 6–7 недель и не менее 70% — до 12 недель беременности [17]. По данным разных авторов [11, 12, 22] в первые 6–7 недель беременности аномальный кариотип имеют 60–75% абортусов, в 12–17 недель — 20–25%, 17–28 недель — только 2–7%. На данном факте основан отказ от «сохраняющей» терапии до 11–12 недель беременности в ряде стран Евросоюза.
В структуре привычного НБ (ПНБ) генетические факторы составляют 3–6%, при этом наибольшее значение приобретают структурные изменения хромосом супружеской пары (в 7% обнаруживаются сбалансированные хромосомные перестройки) [10].
При наличии аберраций эмбриогенез либо вообще невозможен, либо резко нарушается на самых ранних стадиях развития. Это связано со сниженной способностью к делению клеток в целом. При этом возникает резкая диссинхронизация процессов развития зародыша, развития плаценты и индукции дифференциации и миграции клеток. Недостаточное и запоздалое формирование плаценты может приводить к нарушению питания и к гипоксии зародыша, а также — к снижению гормональной продукции плаценты, что может быть дополнительной причиной потери беременности.
В этиологии синдрома потери плода эндокринные нарушения матери составляют от 30% до 78,2%. Эндокринная патология независимо от своего генеза, в конечном счете, реализуется структурно-функциональной недостаточностью желтого тела яичника. Неполноценная лютеиновая фаза может быть обусловлена гипотиреозом, поликистозными яичниками, ожирением, дефицитом массы тела, эндометриозом, хроническим эндометритом, сальпингоофоритом, наличием пороков развития матки и генитальным инфантилизмом.
При этом возникает состояние гипопрогестеронемии, которое обуславливает незавершенную гравидационную трансформацию эндометрия. В патогенезе имеет значение как абсолютное содержание стероидных гормонов в плазме крови, так и морфологическая структура эндометрия как органа-мишени, то есть количество функционально полноценных рецепторов. В этих условиях невозможно осуществление полноценной имплантации, вследствие чего формируется первичная плацентарная недостаточность (ПН), которая выражается в нарушении васкуляризации, формирования хориона и приводит к потере беременности в I триместре. Неполноценная имплантация также часто осложняется развитием гестоза, который в свою очередь приводит к формированию вторичной ПН; несовершенство компенсаторных реакций незрелой плаценты способствует формированию абсолютной ПН. При абсолютной ПН внутриутробная гибель плода происходит во II половине беременности [5]. Кроме того, эстрогенный дефицит яичников и гиперандрогения может реализоваться нарушением фолликулогенеза, поломками в процессе мейоза, перезреванием яйцеклетки и, соответственно, потерей беременности.
Учитывая то, что при эндокринных механизмах потери беременности ключевую роль играет патология эндометрия, лечение целесообразно начинать именно с воздействия на это основополагающее звено благоприятного развития беременности.
Хотя результаты современных исследований [18, 20, 21, 24], касающихся прогестеронотерапии НБ, не подтвердили уменьшение риска самопроизвольного аборта, мертворождаемости или неонатальной гибели у женщин с синдромом потери плода при применении прогестагенов, в России [10] сохраняется тактика гормональной поддержки ранних сроков беременности при подтвержденной эндокринной этиологии НБ.
Целью терапии является нормализация гормонального статуса либо медикаментозная компенсация до показателей, необходимых для вынашивания беременности на прегравидарном этапе. Заместительная гормонотерапия способствует полноценной секреторной трансформации эндометрия, оказывает иммуномодулирующее действие, подавляя реакции отторжения со стороны иммунокомпетентных клеток в эндометрии [10]. В России наиболее используемыми являются препараты Утрожестан и Дюфастон, которые обладают выраженным прогестагенным эффектом и имеют свои особенности: Утрожестан обладает седативным и антиатерогенным эффектом, оказывает токолитическое, антиальдостероновое, антиандрогенное, положительное нейротропное действие, не влияет на углеводный обмен, незаменим у женщин с гиперандрогенией, нарушениями углеводного обмена, сахарным диабетом, метаболическим синдромом, гиперхолестеринемией, с патологией желудочно-кишечного тракта (вагинальная форма).
Дюфастон не имеет андрогенной, эстрогенной и кортикостероидной активности, не вызывает сонливость, активен при пероральном применении, обладает выраженными иммуномодулирующими свойствами, регулирует цитокиновый баланс, наиболее целесообразен у женщин с хроническими воспалительными заболеваниями органов малого таза (ВЗОМТ), в том числе с хроническим эндометритом, у пациенток с совместимостью по системе HLA с супругом, при аутоиммунных нарушениях, а также при вождении беременной автотранспорта, влагалищном дисбиозе, вагините. В соответствии с Российскими рекомендациями [10], начатую гормонотерапию на прегравидарном этапе целесообразно продолжить при наступлении беременности до 12–16 недель. Утрожестан применяется по 300–400 мг до 800 мг в сутки до 12–14 недель беременности. Дюфастон назначают по 10–30 мг до 16 недель беременности [10].
Среди ведущих этиологических факторов синдрома потери плода следует отметить инфекционный. ВЗОМТ одна из актуальных проблем современной гинекологии. В структуре гинекологической патологии ВЗОМТ занимают первое место, и их частота не имеет тенденции к снижению. Последнее десятилетие характеризовалось не только сменой возбудителей генитальной инфекции (на первое место вышли представители условно-патогенной микрофлоры), но и изменением клиники воспалительных процессов (первично-латентное течение, без клинических проявлений). Проблема персистирующей инфекции при НБ сложна и дискутабельна. В настоящее время установлено отсутствие строго определенных микроорганизмов, провоцирующих привычную потерю беременности. Однако, даже в случае отсутствия прямого специфического воздействия инфекционных агентов на плод, морфофункциональные нарушения репродуктивной системы, вызванные персистенцией микроорганизмов в эндометрии, с формированием хронического эндометрита, ведут к нарушению развития эмбриона. Микробиологические и морфологические исследования эндометрия выявили наличие хронического эндометрита и персистенции условно-патогенных бактерий у 67,7% женщин с инфекционным генезом НБ.
При неразвивающейся беременности условно-патогенные микроорганизмы выявлены у 20% пациенток, а вирусно-бактериальные ассоциации — у 70% [5]. По данным литературы, у пациенток с хроническими воспалительными процессами чаще обнаруживают стафилококк (15%); стафилококк в ассоциации с кишечной палочкой (11,7%); этерококки (7,2%); вирус простого герпеса (ВПГ) (20,5%); хламидии (15%); микоплазмы (6,1%); уреаплазмы (6,6%); гарднереллы (12,5%) [8]. Бактериально-вирусная контаминация эндометрия является, как правило, следствием неспособности иммунной системы и неспецифических защитных сил организма (системы комплимента, фагоцитоза) полностью элиминировать инфекционный агент наряду с ограничением его распространения за счет активации Т-лимфоцитов (Т-хелперов, естественных киллеров) и макрофагов.
В результате возникает персистенция микроорганизмов, характеризующаяся привлечением в очаг хронического воспаления мононуклеарных фагоциотов, естественных киллеров, Т-хелперов, синтезирующих различные цитокины. Подобное состояние эндометрия препятствует созданию локальной иммуносупресии в предимплантационный период, необходимой для формирования защитного барьера и предотвращения отторжения наполовину чужеродного плода [10].
Некоторые исследователи ведущим этиологическим фактором хронического эндометрита считают вирусы, особенно в тех случаях, когда у женщины зарегистрирована неразвивающаяся беременность [2, 3, 4, 19]. Многие вирусные инфекции как острого, так и латентного течения способны вызвать в организме развитие тромбофилического состояния вследствие поражения эндотелия сосудов (ВПГ, аденовирус), развитие вторичного антифосфолипидного синдрома и/или иммунологических нарушений [4].
Так, по данным В. М. Сидельниковой [11], частота женщин с ПНБ, имеющих цитомегаловирусную инфекцию (ЦМВИ) и ВПГ, колеблется от 55% до 85%. По результатам наших исследований, наличие различных вариантов течения герпетической инфекции у женщин, перенесших неразвивающуюся беременность, зарегистрировано у 67,6% [14]. Комплекс всех этих изменений нарушает процесс инвазии и развития трофобласта, оказывает прямое и опосредованное эмбриотоксическое действие, приводит к формированию первичной и вторичной ПН, что в конечном итоге заканчивается потерей беременности. Нами была разработана математическая модель прогнозирования неразвивающейся беременности у пациенток с герпетической инфекцией на основании показателей функционального состояния эндотелия и гемостазиограммы, позволяющая с высокой чувствительностью и специфичностью выделить среди пациенток группу женщин высокого риска потери беременности [14].
По данным литературы [5, 8], хронический эндометрит гистологически верифицирован у 62% пациенток с ПНБ и у 83% с неразвивающейся беременностью; при антенатальной гибели плода морфологические проявления воспаления в последе встречаются в 85,01 ± 1,32%, при ранней неонатальной смертности — в 85,71 ± 2,70%. На Международном конгрессе «Контраверсии в акушерстве и гинекологии» (Барселона, 2007) постановили ставить диагноз и лечить хронический эндометрит у всех женщин, перенесших хотя бы одну неразвивающуюся беременность.
В России внутриутробные инфекции занимают от 11% до 45% в структуре перинатальной смертности [13], в том числе при антенатальной гибели плода. В результате проведенных нами морфологических исследований последов группы женщин с клинико-аппаратными маркерами внутриутробной инфекции в 25% случаев был выявлен плацентит, острое нарушение плацентарного кровообращения на фоне хронической компенсированной недостаточности в 42%. У 10% — восходящая инфекция, гнойно-некротический мембранит, 32% — слабо выраженные компенсаторно-приспособительные реакции, соответствующие сроку гестации, 25% — признаки замедленного созревания, 8% — склероз ворсин хориона, многочисленные кальцинаты [15].
Бактериологический анализ плацент у женщин из группы риска по ВУИ показал наличие в 51% бактериальной флоры, которая представлена стрептококками — 28%, стафилококками — 22%, пептострептококками — 50%. В 20% случаев происходит ассоциация представленной флоры с уреаплазмой и герпесвирусной инфекцией; моноинфекция: ВПГ (5,8%), ЦМВ (2,2%), Ureaplasma urealyticum parvo (9,6%) [15].
Для снижения роли инфекционно-воспалительных факторов невынашивания проводится лечение на прегравидарном этапе: 1) антибактериальная терапия во время менструации (строго на основании антибиотикограммы); 2) антимикотики; 3) системная энзимотерапия (Вобэнзим, Флогэнзим); 4) иммуномодуляторы с учетом показателей интерферонового статуса; 5) восстановление нормального биоценоза. При наличии вирусной инфекции (ВПГ) в проведение прегравидарной подготовки необходимо включать противовирусные препараты (ацикловир, валацикловир (Валтрекс), фамцикловир) в лечебном и супрессивном режиме [10]. При часто рецидивирующей вирусной инфекции назначается Валтрекс по 500 мг с сутки длительно от 4–6 месяцев до 1–2 лет (супрессивный режим) [10]. При бессимптомном течении герпетической инфекции и вирусовыделении в период прегравидарной подготовки возможно назначение Валтрекса в супрессивном режиме на 3–4 месяца. При беременности необходим контроль состояния биоценоза влагалища, микробиологический и вирусологический контроль. В I триместре беременности у пациенток с инфекционным генезом невынашивания методом выбора является иммуноглобулинотерапия (10% иммуноглобулин человека нормальный для внутривенного введения по 50 мл в/в через день № 3) [10]. Обязательно в I триместре проводить профилактику ПН (метаболические комплексы, нормализация параметров гемостаза). Во II и III триместрах проводят повторные курсы иммуноглобулинотерапии с одновременным лечением ПН.
Иммунологические механизмы потери беременности. Среди них различают аутоиммунные и аллоиммунные процессы. Аутоиммунные реакции направлены против собственных тканей матери, а плод страдает вторично, либо от реакции материнского организма на аутоантитела, либо от идентичности антигенов, на которые у матери возникли аутоантитела [11].
Примером таких аутоиммунных реакций является системная красная волчанка, миастения, аутоиммунный тиреоидит, антифосфолипидный синдром (АФС). При АФС в крови женщины определяются антифосфолипидные антитела (АФА), препятствующие фосфолипид-зависимой коагуляции, без угнетения активности специфических коагуляционных факторов, клиническое проявление данного процесса заключается в развитии тромбоэмболических состояний, в частности избыточного тромбирования в маточно-плацентарной системе кровообращения. Кроме того, АФА подавляют синтез сосудистого кофактора тромбомодуллина, который синтезируется ворсинами хориона, что вызывает снижение образования сосудов и гипоплазию плаценты [7]. АФА изменяют адгезивные характеристики предимплантационной морулы (заряд); усиливают протромботические механизмы и десинхронизируют процессы фибринолиза и фибринообразования, что приводит к дефектам имплантации и снижению глубины децидуальной инвазии трофобласта. АФА напрямую взаимодействуют с синцитиотрофобластом и цитотрофобластом и ингибируют межклеточное слияние клеток трофобласта. Кроме того, АФА подавляют продукцию хорионического гонадотропина и усиливают тромботические тенденции за счет предоставления матриц для реакций свертывания [7].
Основой лечения АФС является коррекция системы гемостаза антикоагулянтами и антиагрегантами: монотерапия ацетилсалициловой кислотой, монотерапия гепарином натрия, низкомолекулярными гепаринами (НМГ), курсы плазмафереза для удаления волчаночного антикоагулянта.
Примером аллоиммунных воздействий могут служить: гемолитическая болезнь новорожденного в связи с Rh- или АВО-сенсибилизацией; неспособность материнского организма выработать антитела, защищающие плод от ее иммунной системы, вследствие совместимости супругов по системе HLA, повышенное содержание в крови и эндометрии матери естественных киллерных клеток (NK-клеток CD56, CD16).
Основная идея совместимости супругов по системе HLA состоит в том, что при этом в организме женщины не вырабатываются антитела, играющие роль блокирующего фактора, что приводит к неэффективному «камуфляжу» плаценты, отсутствию роста и деления плацентарных клеток и к их гибели. При совместимости супругов более чем по двум антигенам HLA риск потери беременности составляет практически 100% [11].
При несовместимости по системе HLA при беременности показано продолжение начатой в периоде предгестационной подготовки иммунотерапии отцовскими или донорскими лимфоцитами [11]. К настоящему времени, однако, не проведены полноценные контролируемые исследования эффективности применения данной методики, кроме того, количественно не определены возможные осложнения использования лимфоцитотерапии [23]. В качестве альтернативной терапии возможно применение высоких доз иммуноглобулина (Human normal immunoglobulini по 50 мл трижды через день внутривенно капельно через каждые 4 недели) [10].
При избыточном содержании в периферической крови и в эндометрии лимфоцитов с фенотипом CD56 во время беременности происходит их патологическая активация, что приводит к избыточному синтезу ими провоспалительных цитокинов, которые нарушают процесс имплантации и способствуют развитию некроза децидуальной ткани и повреждению желточного мешка [16]. При патологической активации CD19+CD5+ В-лимфоцитов в избыточном количестве начинается продукция аутоантител к гормонам, имеющим важное значение для нормального развития беременности: эстрадиола, прогестерона, хорионического гонадотропина [16]. Следствием этого является недостаточность подготовительных к имплантации реакций в эндометрии и децидуальной ткани. Это выражается в децидуальном воспалении и некрозе, в нарушении образования фибриноида и избыточном отложении фибрина. Отмечаются медленный прирост хорионического гонадотропина человека (ХГЧ), повреждение желточного мешка, субхориальные гематомы [11]. Другими продуктами CD19+CD5+ являются антитела к нейротрансмиттерам (серотониту, энкефалинам, эндорфинам), играющим важную роль в процессе подготовки эндометрия к имплантации [16]. В результате воздействия этих антител затрудняется стимуляция яичников, отмечается истончение эндометрия и ослабление в нем ангиогенеза.
Лечение пациенток с сенсибилизацией к ХГЧ состоит в коррекции тромбофилии НМГ под контролем гемостазиограммы и назначении кортикостероидной терапии в дозах 5–15 мг в сутки в расчете на преднизолон. Лечение должно начинаться в первом триместре беременности, так как пик выработки ХГЧ и, как следствие, антител приходится на первые недели беременности [10].
В настоящее время уделяется большое внимание генетически детерминированным формам тромбофилий [7, 17], которые, подобно АФС, сопровождаются тромбоэмболическими осложнениями при беременности и ведут к потере беременности на любом ее этапе. Генетически обусловленные аномалии свертывающей системы крови могут быть связаны с недостаточностью ингибиторов коагуляции, фибринолитических факторов и избыточным уровнем прокоагулянтных факторов. К наиболее часто встречаемым формам наследственных тромбофилий относят: мутацию метилентетрагидрофолатредуктазы — MTHFR, полиморфизм 677 C->T; мутацию фактора Лейдена — F5, полиморфизм 1691 G->A; протромбина (F2), полиморфизм 20210 G->A; ингибитора активатора плазминогена — PAI-1, полиморфизм 675 5G->4 G.
На начальном, аваскулярном, этапе имплантации, который является наиболее уязвимым к действию неблагоприятных факторов (инфекционные агенты, токсины, антитела и др.), важна полноценность системы гемостаза. В условиях наличия тромбофилий (как наследственных, так и приобретенных) и вызванного ими гипофибринолиза происходит десинхронизация локальных процессов фибринолиза и фибринообразования при имплантации. В такой ситуации протеаз, синтезируемых бластоцистой, становится относительно недостаточно, чтобы разрушить экстрацеллюлярный матрикс в эндометрии и внедриться на достаточную глубину. В дальнейшем развивается микротромбообразование и нарушение микроциркуляции, что играет существенную роль в развитии патологии спиральных артерий и акушерских осложнений, связанных с изменением маточно-плацентарного кровообращения [7].
По результатам анализа факторов риска неэффективности методов экстракорпорального оплодотворения и подсадки эмбриона, в результате наших исследований выявлено, что ведущей причиной преэмбрионических потерь является хронический эндометрит, а эмбрионических — патология системы гемостаза [9].
При наличии врожденных тромбофилий начиная с фертильного цикла и в течение всей беременности проводят лечение НМГ и антиагрегантами. В случае гипергомоцистеинемии — необходимо назначение больших доз фолиевой кислоты и витаминов группы В [10].
Для успешной имплантации плодного яйца и прогрессирования беременности необходимы наличие генетически полноценного эмбриона, адекватного развития эндометрия, готового к рецепции бластоцисты и создание в организме матери локальной иммуносупрессии.
Сразу после выхода бластоцисты в полость матки (4–5 день после оплодотворения) она оказывается в секрете, поступающем из многочисленных устьев эндометриальных желез; бластоциста начинает «молекулярный диалог» с маточным эпителием для достижения максимальной рецептивности с «окном имплантации». Важно подчеркнуть, что свободная бластоциста в течение 1,5–2 суток находится в окружении муцина (Мисс-1) и различных эндометриальных белков, которые защищают от инфекций, других вредных воздействий и осуществляют ее иммунную защиту. Поэтому огромное значение в настоящее время отводится изучению микроокружения зародыша в процессе имплантации. Особое внимание уделяется изучению эндометриальных белков [1, 3, 6].
Альфа-2-микроглобулин фертильности (АМГФ) — белок, выделяемый эпителиоцитами маточных желез уже на 5–6 день после овуляции, то есть к тому моменту, когда при состоявшемся оплодотворении бластоциста попадает в полость матки. АМГФ обладает мощной иммуносупрессивной активностью, обеспечивая локальное подавление иммунного ответа матери на развивающийся эмбрион. АМГФ вызывает увеличение продукции интерлейкина-6 эпителием эндометрия, подавляет активность естественных киллеров, что может влиять на формирование системы мать — плацента — плод. АМГФ рассматривают как показатель функциональной активности маточных желез, как маркер секреторной трансформации эндометрия [1, 6].
В процессе погружения бластоцисты в функциональный слой эндометрия появляется принципиально новый механизм репродукции — цитотрофобластическая инвазия. Клетки цитотрофобласта продуцируют каскад особых цинк-зависимых металлопротеаз, которые «протравливают» дорогу для погружающейся бластоцисты. Темпы и глубина цитотрофобластической инвазии определяются местной пара- и аутокринной регуляцией. Одним из паракринных ингибиторов цитотрофобластической инвазии является плацентарный альфа-микроглобулин (ПАМГ), то есть местный эндометриальный белок, синтезируемый децидуальными клетками промежуточного типа [16].
При неполноценности эндометрия эндокринного генеза, на фоне хронического эндометрита, развивается дефицит продукции АМГФ, что приводит к нарушению метаболических и иммунных взаимоотношений эмбриона с материнским организмом, а снижение продукции ПАМГ способствует нарушению трофобластической инвазии, что ведет к гибели эмбриона. В то же время у пациенток с неразвивающейся беременностью на фоне аутоиммунных и генетических нарушений продукция АМГФ и ПАМГ в эндометрии повышена [3].
Необходимо отметить, что к потерям беременности на разных сроках способствуют различные этиологические факторы. В частности: на сроках гестации 5–6 недель преобладают генетические и иммунологические факторы; в 7–9 недель наибольшее значение имеют гормональные нарушения, в том числе и наличие антител к гормонам; в 10–16 недель основными этиологическими факторами являются аутоиммунные нарушения (АФС) и тромбофилии; а при сроках беременности более 16 недель основные причины репродуктивных потерь инфекции, истмикоцервикальная недостаточность, тромбофилии.
По данным литературы [8] у 88% женщин, с наличием репродуктивных потерь в анамнезе, выявляются те или иные значимые структурные изменения в репродуктивной системе. Этот факт дает основание проводить стандартное обследование всем пациенткам с наличием синдрома потери плода, включающее: бактериологическое исследование отделяемого из влагалища и полости матки, ПЦР-диагностику инфекций, передаваемых половым путем, исследование гормонального фона, системы гемостаза с определением наличия полиморфизма генов, определение иммунореактивности, УЗИ органов малого таза, медико-генетическое консультирование с определением кариотипа родителей.
Начало третьего тысячелетия вновь актуализировало проблему НБ, так как частота данной патологии стала увеличиваться практически во всех странах мира [8], широкое внедрение к практику новых диагностических и лечебных методов, основанных на достижениях современной науки, не улучшает ситуацию. Дискуссии на тему «Почему результаты антенатальной терапии меньше ожидаемых?» не могут определить основные детерминанты имеющегося неблагополучия, но ставят перед исследователями ряд перспективных, жизненно важных для человечества вопросов, без решения которых дальнейший прогресс перинатальной медицины невозможен.