Десмопластическая реакция вокруг опухоли что это
СОДЕРЖАНИЕ
Признаки и симптомы
Есть несколько ранних признаков того, что у пациента есть DSRCT. Пациенты часто молоды и здоровы, поскольку опухоли беспрепятственно растут и распространяются в брюшной полости. Это редкие опухоли, и врачи часто неправильно диагностируют симптомы. Образования в брюшной полости могут вырасти до огромных размеров, прежде чем их заметит пациент. Опухоли можно почувствовать как твердые круглые образования при пальпации живота.
Другие зарегистрированные симптомы включают неизвестные опухоли, заболевания щитовидной железы, гормональные нарушения, свертывание крови, проблемы с почками и урологией, образования яичек, груди, матки, влагалища и яичников.
Генетика
Факторов риска, специфичных для данного заболевания, нет. Опухоль, по-видимому, возникает из примитивных клеток детства и считается детским раком.
Патология
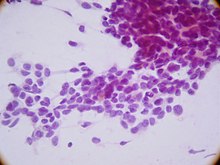
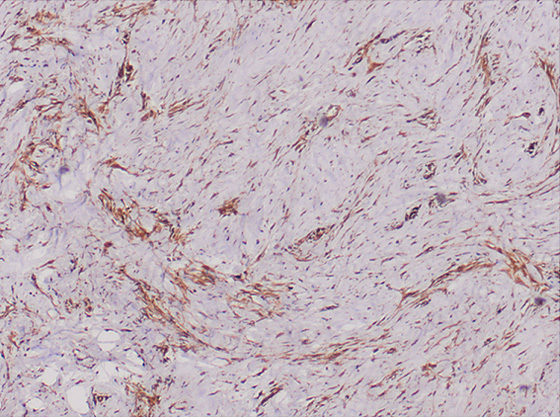
По данным иммуногистохимии, эти клетки обладают трилинейной коэкспрессией, включая эпителиальный маркер цитокератин, мезенхимальные маркеры десмин и виментин и нейрональный маркер нейрон-специфической энолазы. Т.о., хотя первоначально предполагалось, что оно имеет мезотелиальное происхождение из-за сайтов презентации, теперь предполагается, что он возникает из клетки-предшественника с мультифенотипической дифференцировкой.
Диагностика
Дифференциальная диагностика
Прогноз
Прогноз для DSRCT остается плохим. Прогноз зависит от стадии рака. Поскольку болезнь может быть неправильно диагностирована или оставаться невыявленной, опухоли часто разрастаются в брюшной полости и метастазируют или распространяются на другие части тела.
Орган или место происхождения неизвестны. DSRCT может метастазировать через лимфатические узлы или кровоток. Места метастазирования включают селезенку, диафрагму, печень, толстую и тонкую кишку, легкие, центральную нервную систему, кости, матку, мочевой пузырь, гениталии, брюшную полость и мозг.
Мультимодальный подход, состоящий из высокодозной химиотерапии, агрессивной хирургической резекции, лучевой терапии и спасения стволовых клеток, улучшает выживаемость некоторых пациентов. Отчеты показали, что пациенты сначала реагируют на химиотерапию и лечение первой линии, но рецидивы являются обычным явлением.
Некоторым пациентам, находящимся в стадии ремиссии или с неоперабельной опухолью, по-видимому, помогает долгосрочная химиотерапия в низких дозах, что превращает DSRCT в хроническое заболевание.
Исследовать
В настоящее время Stehlin Foundation предлагает пациентам DSRCT возможность бесплатно отправлять образцы своих опухолей для тестирования. Ученые-исследователи выращивают образцы на голых мышах и тестируют различные химические вещества, чтобы найти наиболее эффективные против опухоли человека.
В 2002 году Нишио и др. Создали новую линию опухолевых клеток человека, полученную из плеврального выпота пациента с типичным внутрибрюшным DSRCT, названным JN-DSRCT-1, который теперь можно использовать в исследованиях.
В 2018 году Детская исследовательская больница Сент-Джуда предоставила ресурсы из Сети по изучению солидных опухолей у детей, которая по запросу предоставляет доступ к ортотопическим ксенотрансплантатам, полученным от пациентов.
Альтернативные названия
Это заболевание также известно как: десмопластическая маленькая круглая голубоклеточная опухоль; внутрибрюшная десмопластическая мелкая круглая синеклеточная опухоль; десмопластическая мелкоклеточная опухоль; десмопластический рак; десмопластическая саркома; DSRCT.
Десмоидные фибромы
В зависимости от локализации выделяют:
Причины возникновения десмоидных фибром
Как правило, пациенты обращаются к врачу по поводу безболезненного опухолевого образования, болевые ощущения и другие симптомы обычно связаны с вовлечением в опухолевый процесс близлежащих структур. Большинство пациентов с десмоидными фибромами экстраабдоминальной локализации связывают появление опухоли с предшествующей травмой. Десмоидные фибромы абдоминальной локализации зачастую развиваются у женщин после беременности или кесарева сечения. Интраабдоминальные десмоидные фибромы чаще всего сочетаются с полипозом толстой кишки (синдрома Гарднера).
Десмоидные фибромы-диагностика
Десмоидная фиброма-лечение
Группа специалистов (хирурги, радиологи, онкологи, морфологи) задействованы в лечении опухоли. После постановки диагноза десмоидная фиброма вариант лечения подбирается индивидуально для каждого пациента. К числу доступных вариантов лечения пациентов относятся динамическое наблюдение, хирургическое лечение, лучевая терапия и системная терапия (гормональные препараты, химиотерапия).
В зависимости от локализации опухоли возможны различные варианты хирургического лечения. Для достижения лучших онкологических и косметических результатов применяются различные виды пластики послеоперационного дефекта после удаления опухли.
При абдоминальных десмоидных фибромах пластика производится композитной сеткой. При экстраабдоминальной локализации опухоли в качестве пластического компонента могут быть использованы местные ткани, перемещенные или пересажанные лоскуты, а также различные виды модульных эндопротезов в случае вовлечения кости в опухолевый процесс. Помимо хирургического лечения в нашем Институте изучены и внедрены в практику эффективные схемы системного лекарственного лечения, а также лучевая терапия. Все описанные выше методы лечения могут применятся как отдельно, так и в комбинации для достижения наилучшего результата.
Десмоидная фиброма-прогноз заболевания
Так как десмоидные фибромы не относятся к злокачественным опухолям, прогноз заболевания благоприятный. Проведение радикальной операции позволяет снизить риск рецидива.
Филиалы и отделения, где лечат десмоидные фибромы
МНИОИ им. П.А. Герцена – филиал ФГБУ «НМИЦ радиологии» Минздрава России.
Отделение хирургического лечения центральной нервной и костно-мышечной систем
Врач-онколог ЯДРИНА Анна Викторовна
Меланома
БЕСПЛАТНАЯ КОНСУЛЬТАЦИЯ: поможем врачам и владельцам клиник выбрать оборудование для диагностики меланомы
Оглавление
Меланома — это опухоль, вызванная злокачественной трансформацией пигмент-продуцирующих клеток (меланоцитов). Меланоциты происходят из нервного гребня, клетки которого обладают высокой способностью к миграции в организме. Поэтому, хотя меланомы обычно возникают на коже, они также могут появляться и в других местах, куда мигрируют клетки нервного гребня — например, в желудочно-кишечном тракте или головном мозге.
В нашей компании Вы можете приобрести следующее оборудование для диагностики меланомы:
Меланома преимущественно поражает взрослых людей, половой принадлежности у заболевания не выявлено. На международном уровне частота возникновения меланомы сильно варьируется. Так, белые группы населения в Австралии, Новой Зеландии, Южной Африке и на юге США имеют самые высокие показатели этой злокачественной опухоли, тогда как азиатские группы населения в Гонконге, Сингапуре, Китае, Индии и Японии — самые низкие. Это говорит о том, что люди с I–III фототипами кожи, которые живут в солнечных регионах мира, подвергаются значительному риску развития этой злокачественной опухоли.
В одном из исследований было установлено, что период с 1995 по 2012 годы в Европе частота случаев инвазивной меланомы в среднем за год росла на 4,0% у мужчин и на 3,0% у женщин, а частота меланомы in situ — на 7,7% и 6,2% соответственно. Также отмечено, что риск появления второй меланомы после обнаружения первой составляет 3–5%.
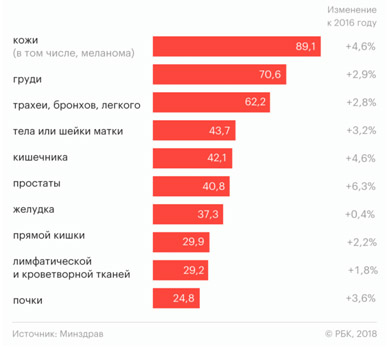
В России ситуация с меланомой, равно как и с другими злокачественными новообразованиями кожи, достаточно сложная — причем из года в год она не становится легче. Так, в 2016 году рак кожи был выявлен у 74 700 человек, а меланома — у 10 500 человек. Уже в следующем, 2017 году зафиксировано 78 000 случаев рака кожи и 11 200 случаев меланомы — прирост 4,6% (рис. 1).
Интересно, что в 2016 году распространенность меланомы составляла 59,3 случая на 100 000 населения, а в 2006 году (10 лет назад) — только 39,7 случаев на 100 000 населения. Всего же в России на данный момент около 500 000 человек имеют диагноз рака кожи, что составляет 0,347% населения страны.
Рис. 1. Статистика онкологических заболеваний в России по состоянию на 2017 год (Минздрав РФ, РБК)
Этиология и патогенез меланомы
Факторы риска появления меланомы:
Решающее значение в патогенезе многих меланом имеют молекулярные сигнальные пути MAPK (митоген-активируемых протеинкиназ) и PI3K-AKT (фосфоинозитид-3-киназа + киназы семейства AKT) — они обеспечивают пролиферацию и выживание раковых клеток. Появление мутаций в любой точке путей MAPK и PI3K-AKT приводит к стимуляции клеточного деления и получению опухолевыми клетками особых преимуществ, которые помогают им не только выживать, но и передавать эти свойства новым генерациям.
Клинические проявления меланомы
Злокачественное лентиго и лентиго-меланома
Злокачественное лентиго обычно возникает у пожилых людей с I–III фототипами при наличии признаков фотоповреждения кожи. Его появление начинается с рыжевато-коричневого пятна неправильной формы, которое быстро увеличивается в размерах (рис. 2). Сама лентиго-меланома довольно большая (3–6 см в диаметре и более), с узловой областью шириной от 0,1 до 2 см (рис. 3).
Точный процент злокачественных лентиго, которые прогрессируют до лентиго-меланомы, неизвестен, но, по разным оценкам, он составляет менее 30–50%. Хотя лентиго-меланома имеет продолжительную фазу радиального роста, начало инвазии в ткани является неблагоприятным прогностическим фактором. Считается, что наибольший риск трансформации злокачественного лентиго в лентиго-меланому возникает именно при длительном одномоментном пребывании на солнце, а не при множественной прерывистой инсоляции.
Несмотря на то, что заболеваемость лентиго-меланомой растет, эта опухоль все еще остается достаточно редким видом рака кожи, составляя от 4% до 15% всех меланом. Средний возраст пациентов на момент постановки диагноза — 65 лет.
Поверхностно распространяющаяся меланома
Это самый частый тип меланомы (до 70%). Он встречается в том числе и у молодых людей, хотя пик заболеваемости сегодня находится на четвертом-пятом десятилетиях жизни. Поверхностно распространяющаяся меланома обычно возникает на открытых частях тела, подвергающихся воздействию солнца, а также в областях с наибольшей концентрацией невусов — это верхняя треть спины у обоих полов и голени у женщин.
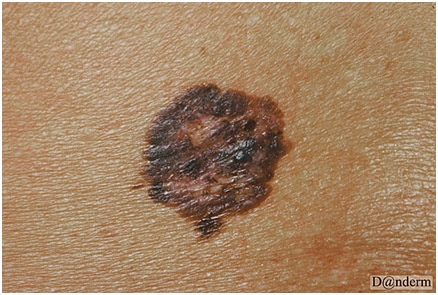
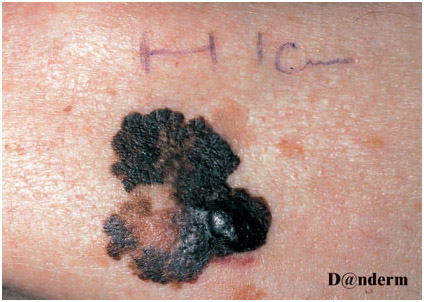
Сперва опухоль выглядит как плоский или слегка приподнятый неравномерно окрашенный участок кожи с асимметричной границей. Он медленно расширяется и меняет свой цвет — например, можно увидеть оттенки коричневого, черного, синего, красного, розового или белого (рис. 4). Данный процесс длится несколько лет, после чего становится инвазивным и дает метастазы. Поверхностно распространяющаяся меланома может регрессировать — на это указывает исчезновение пигментации.
Узловая меланома кожи
Второй по частоте встречаемости тип меланомы (10–15%) и одновременно самый агрессивный. Клинически узловая меланома проявляется в виде узелка однородного сине-черного, сине-красного или розово-красного цвета, который чаще начинается с нормальной кожи, а не с меланоцитарного невуса (рис. 5). Около 5% опухолей не имеют пигмента (амеланотическая меланома). Наиболее распространенными местами появления опухолей являются туловище, голова и шея. К сожалению, на момент постановки диагноза узловая меланома обычно находится в стадии инвазии.
Акральная лентигиозная меланома
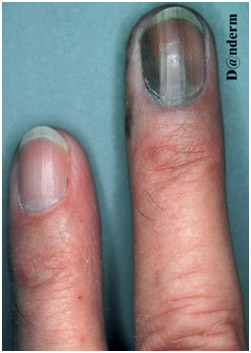
Достаточно редко встречается у светлокожих людей, зато часто — у японцев, африканцев и латиноамериканцев. Считается, что ее развитие напрямую не связано с длительным пребыванием на солнце. Средний возраст появления опухоли — 65 лет, с равным распределением по полу. Клинически акральная лентигиозная меланома проявляется участками черного или коричневого цвета на ладонях, подошвах или под ногтями (рис. 6). Наиболее распространенным местом локализации являются стопы, причем у 60% пациентов имеются подногтевые или подошвенные поражения.
Меланома слизистых
Нетипичный вариант меланомы, который может появляться в полости носа или рта, а также на слизистых половых органов, в аноректальной области и даже на сетчатке.
Десмопластическая меланома
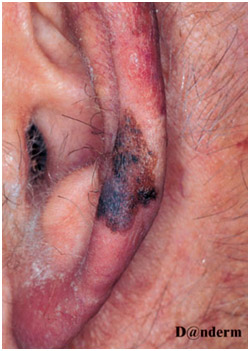
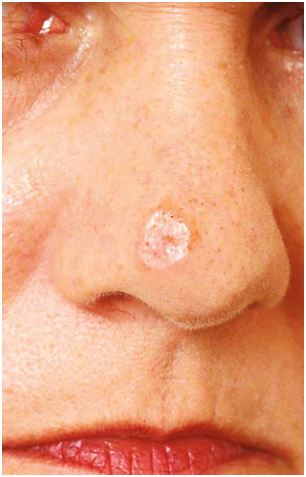
Очень агрессивная, хотя и достаточно редкая опухоль с высокой частотой рецидивов. Обычно развивается на открытых участках головы и шеи пожилых людей. Около половины десмопластических меланом сочетаются со злокачественным лентиго. Клинически проявляется в виде бесцветной (оттенка окружающей кожи) макулы, папулы или узелка (рис. 7). Зачастую она распространяется периневрально, поэтому может давать болевой синдром и чувство покалывания. На момент постановки диагноза десмопластическая меланома почти всегда является глубоко инвазивной (не менее 5–6 мм).
Рис. 2. Злокачественное лентиго (Danish national service on dermato-venereology)
Рис. 3. Лентиго-меланома (Danish national service on dermato-venereology)
Рис. 4. Поверхностно распространяющаяся меланома (Danish national service on dermato-venereology)
Рис. 5. Узловая меланома (Danish national service on dermato-venereology)
Рис. 6. Акральная лентигиозная меланома под ногтем (Danish national service on dermato-venereology)
Рис. 7. Десмопластическая меланома (Cleveland Clinic Center for Continuing Education)
Уровни инвазии меланомы
Уровни инвазии опухоли в кожу и другие ткани по Бреслоу:
Уровни инвазии по Кларку:
TNM классификация меланомы
Характеристика первичной опухоли (Т):
Характеристика регионарных лимфоузлов (N):
Характеристики метастазов (M):
Диагностическая визуализация меланомы
Основной принцип успешного лечения меланомы заключается в ранней диагностике — чем раньше была найдена опухоль, чем выше шансы пациента на полное выздоровление или хотя бы значительное продление жизни. Так, пятилетняя выживаемость для пациентов с меланомой в стадии 0 составляет 97%, в стадии IV — около 10%. Поэтому и врач, и косметолог должны крайне ответственно подходить к осмотру любых кожных образований.
Кроме визуального наблюдения опухоли и традиционной дерматоскопии, сегодня существуют мощные технические решения на основе искусственного интеллекта. Они позволяют не только диагностировать минимальные патологические изменения в здоровых тканях, но и проводить осмотр всего тела в динамике — такими возможностями обладает цифровой комплекс FotoFinder (FotoFinder Systems GmbH).
Комплекс FotoFinder с автоматическим картированием тела
FotoFinder может иметь разные комплектации, но чаще всего он состоит из фотокамеры высокого разрешения, роботизированного штатива, лазерного указателя, цифрового видеодерматоскопа и компьютера с набором специальных программ.
Цифровой видеодерматоскоп medicam 1000 используется для прицельного изучения подозрительных новообразований и фиксации результатов с их привязкой к конкретному пациенту. В medicam 1000 применяется целый ряд запатентованных технологий — например, FullHD CrystallVew для получения изображений высочайшего качества, возможность увеличения снимков до 140 раз, а также специальные аксессуары для флуоресцентной диагностики и капилляроскопии. Вместе с удобной сортировкой снимков и быстрым поиском это обеспечивает качественную и раннюю диагностику меланомы и успешные методы лечения меланомы кожи и других новообразований.
Система автоматического картирования тела ATBM (Automatic Total Body Mapping) включает в себя фотокамеру, роботизированный штатив и лазерный указатель. С помощью лазерного указателя оператор (как врач, так и средний медперсонал) устанавливает штатив на рекомендованное расстояние между камерой и пациентом. Далее на компьютере открывается программа-гид — она подсказывает оператору, какую позу следует принять пациенту для съемки.
Для максимально точного воспроизведения поз используется технология Ghost — на мониторе отображается «призрачный-контур» первого снимка человека, которого нужно придерживаться для получения единообразия всех последующих фотографий. Оператор видит, где именно пациент не попадает в контур, и может направлять его словами «поднимите чуть выше правую руку», «выпрямите спину» и так далее. Сама съемка ведется в полуавтоматическом режиме, что также обеспечивает единообразие результатов.
В итоге получаются 20 стандартных снимков, каждый из которых анализируется модулем Bodyscan на предмет динамических изменений. Он фиксирует все новообразования данного пациента, присваивая им уникальный индекс. При последующих съемках Bodyscan выявляет изменения и подсвечивает их для привлечения внимания врача. Кроме предварительного анализа, Bodyscan обладает широкими возможностями по сортировке и сквозному поиску изображений, помогая врачу создать удобную базу снимков своих пациентов.
Программный комплекс с искусственным интеллектом Moleanalyser pro прицельно изучает микроснимки подозрительных новообразований. Данный комплекс был предварительно обучен на сотнях тысяч фотографий с подтвержденными диагнозами, что позволяет ему с точностью до 95% выявлять меланому и другие злокачественные новообразования кожи. В итоге врач получает личного самообучающегося ассистента, обладающего огромной базой знаний и не пропускающего ни единой точки на теле пациента. В свою очередь, пациент получает гарантию действительно качественной ранней диагностики меланомы, что повышает его шансы на успешное лечение.
Мобильная дерматоскопия и телемедицина Handyscope
Более простой альтернативой комплексу FotoFinder является мобильная дерматоскопия и телемедицина Handyscope. Handyscope представляет собой небольшое устройство, которое устанавливается на камеру iPhone, а также специальное приложение для этого смартфона. Врач получает широкие возможности для иммерсионной и поляризационной дерматоскопии, точнейший захват и «заморозку» изображения, 20-кратный оптический зум и высочайшее качество снимков благодаря мощной камере iPhone.
Приложение Handyscope 3 устанавливается на iPhone и работает совместно с устройством Handyscope. Приложение позволяет быстро делать снимки новообразований, хранить их в удобной базе данных, запрашивать их оценку при помощи искусственного интеллекта или стороннего специалиста. В последнем случае используется Сервис второго мнения — телемедицина для связи с дерматологами и гистологами по всему миру. Теперь можно получить консультацию ведущих экспертов для максимально точной диагностики и выбора метода лечения меланомы кожи.
Десмоидная опухоль молочной железы
1) Институт Онкологии и Радиологии Сербии, Белград
2) Университет Медицинской Школы Белграда
В статье представлен клинический случай десмоидной опухоли молочной железы у 38-летней пациентки.
Материалы и методы. У 38-летней пациентки диагностирована опухоль в нижнемедиальном квадранте, в складке под левой молочной железой, с инфильтрацией мягких тканей и увеличенными подмышечными лимфатическими узлами. Клинически и радиографически опухоль была крайне подозрительна на рак.
Результаты. Приведены данные осмотра, ультрасонографии, маммографии и цитологического исследования опухоли, напоминающей рак молочной железы. Объем операции включал широкую резекцию нижнемедиального квадранта левой молочной железы с большой порцией большой грудной мышцы. Исследование замороженных срезов было неинформативно.
В этом клиническом примере гистологическое исследование не выявило рак молочной железы и возможное вовлечение кожи и большой грудной мышцы и подтвердило наличие фиброматоза без инфильтрации кожи и мышечной ткани. Это обусловило широкую резекцию молочной железы с чистыми краями резекции. В связи с подозрением на злокачественное поражение, клинически увеличенные лимфатические узлы I и II порядка в левой подмышечной области, подмышечная лимфаденэктомия была выполнена вместе с биопсией сторожевого лимфатического узла. Плановое гистологическое исследование показало фолликулярную дисплазию подмышечных лимфатических узлов.
Выводы. Фиброматоз молочной железы является крайне редкой патологией. Стандартное первичное лечение – хирургическое, когда оно возможно. Цель операции – получить чистые края резекции с сохранением функции и хорошим косметическим результатом. Принципы оперативного вмешательства включают резекцию единым блоком. Объем хирургического лечения различен, от широкой туморэктомии до радикальной мастэктомии с удалением грудной фасции и грудных мышц. Мы не рекомендуем выполнять подмышечную лимфаденэктомию до получения гистологического анализа биопсии сторожевого лимфатического узла, несмотря на наличие клинически суспициозной опухоли в молочной железе и увеличенных подмышечных лимфатических узлов.
Ключевые слова: десмоидная опухоль молочной железы, фиброматоз, сторожевой лимфатический узел.
Распространенность десмоидных опухолей молочной железы (агрессивного фиброматоза) составляет менее 0,2% первичных новообразований молочной железы [1, 2].
Фиброматоз – это инфильтративная пролиферация фибробластов и клеток мышечных волокон, не обладающая метастатическим потенциалом, но со склонностью к местному рецидивированию [3].
Десмоидная опухоль молочной железы является клинической дилеммой, поскольку клинически, по данным ультрасонографии, маммографии и цитологически ее трудно отличить от рака, и только гистологическое исследование может подтвердить диагноз. Лечение выбора – широкое иссечение с чистыми краями резекции 6.
В этой статье мы описываем 38-летнюю пациентку с опухолью в нижнемедиальном квадранте, в складке под левой молочной железой, с инфильтрацией мягких тканей и увеличенными подмышечными лимфатическими узлами. Клинически и радиографически опухоль была крайне подозрительна на рак. Новообразование было полностью иссечено с резекцией окружающей железистой тканью и клетчаткой с чистыми краями резекции. Мы, безусловно, превысили необходимый объем оперативного вмешательства в связи с клиническими и диагностическими подозрениями, но состояние пациента хорошее с отличными косметическими результатами, лечение прошло без каких-либо осложнений, без рецидива заболевания.
Пациентка 38 лет при самостоятельном осмотре обнаружила опухоль в левой молочной железе. У пациентки не было никаких оперативных вмешательств или травм в области груди. Семейный анамнез по злокачественным новообразованиям не отягощен.
При физикальном осмотре имелись признаки фиброзной дисплазии обеих молочных желез, выявлена опухоль около 1,5 см в диаметре, плотная, неподвижная, вовлекающая кожу и расположенная в складке под левой молочной железой, в нижнемедиальном квадранте, ближе к грудине. У пациентки имелись пальпируемые увеличенные лимфатические узлы I и II порядка в левой подмышечной области.
При ультрасонографии выявлена гетерогенная гипоэхогенная опухоль в складке под левой молочной железой, с неоднородным внутренним эхо и относительно нечеткими границами с затуханием кзади. Опухоль была диаметром 1,5 см, располагалась близко к грудной фасции, которая в других участках была гиперэхогенна и интактна (BI RADS 4-5).
При маммографии в нижнемедиальном квадранте левой молочной железы выявлено дольковое затемнение 16×8 мм.
Перед операцией выполнена лимфосцинтиграфия, коллоид с 99mTc вводили периареолярно. При лимфосцинтиграфии выявлен сторожевой узел в левой подмышечной области. В проекции внутренней грудной артерии фиксации радиоколлоида не было.
Пациентке выполнена широкая резекция нижнемедиального квадранта левой молочной железы с большой порцией большой грудной мышцы. Исследование замороженных срезов было неинформативно.
С помощью гамма-датчика верифицирован горячий лимфатический узел II уровня, который был удален через отдельный разрез и направлен на плановое гистологическое исследование. В связи с клинически увеличенными и суспициозными лимфатическими узлами в левой подмышечной области выполнена лимфодиссекция I и II уровней.
По данным гистологического исследования: фиброматоз молочной железы, опухоль 8×18×12 мм, хорошие края резекции и отсутствие элементов фиброматоза в краях резекции.
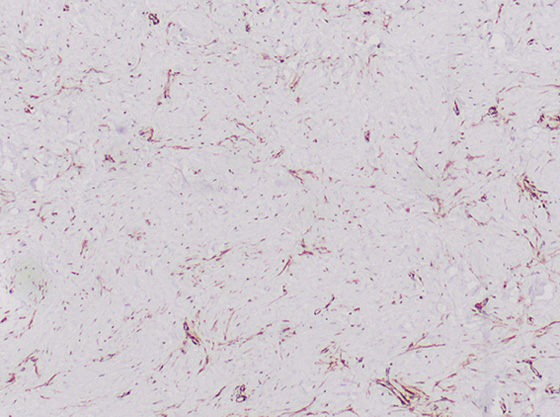
При иммуногистохимическом исследовании обнаружена положительная реакция на актин (рис.1), виментин (рис.2) и десмин, CD34 и CD 68, фолликулярная гиперплазия в лимфатических узлах (0/13) и сторожевом лимфатическом узле расценена как гистиоцитоз синусов и липоматоз лимфатических узлов.
Рис. 1. Гистологическая картина: положительная реакция на актин (гематоксилин и эозин, x4).
Рис. 2. Гистологическая картина: положительная реакция на виментин (гематоксилин и эозин, x4).
Десмоидная опухоль впервые была обнаружена MacFarlane в 1832 г. [7].
Термин «десмоид» происходит от греч. «desmos», что означает тяж или связка. Термин впервые был применен в 1800 г. для описания опухоли с консистенцией, похожей на связку [7].
Десмоидные опухоли составляют примерно 0,03% всех новообразований и менее 3% всех опухолей мягких тканей.
Предположительная ежегодная заболеваемость в общей популяции составляет 2-4 на 1 млн. населения [8].
Причина развития десмоидных опухолей полностью не объяснена, но выявлена связь с семейным аденоматозным полипозом (синдром Гарднера), протезированием молочной железы и хирургической травмой. Десмоидные опухоли встречаются у 10-15% пациентов с семейным аденоматозным полипозом, заболеванием, наследуемым по аутосомному типу, обусловленным мутацией в гене APC [9].
Отсутствие мутаций генов H-ras, K-ras и N-ras и генов p53 в этих опухолях свидетельствует о том, что инактивация генов APC играет роль в индукции агрессивного роста десмоидных опухолях с наивысшей частотой рецидивирования. Это составляет важную часть молекулярного механизма образования десмоидных опухолей [10].
Несмотря на повышенную встречаемость у молодых женщин детородного возраста, десмоидные опухоли также обнаруживают у мужчин, но редко [11].
Избыток эстрогенов, например, во время беременности, считают значимым предрасполагающим фактором развития десмоидных опухолей [3, 11].
В десмоидных опухолях обнаруживают хромосомные аномалии, включая делецию хромосомы 5q [12, 13], потерю хромосомы Y [13], трисомию 8 [14] и трисомию 20 [15]. Считают, что трисомия 8, в частности, служит прогностическим фактором рецидива.
Фиброматоз молочной железы проявляется клинически как крайне серьезное солитарное поражение, которое в некоторых случаях вовлекает грудную фасцию за счет локальной инфильтрации [16]. Он может также вызывать втяжение соска и имитировать рак молочной железы [11].
Эти доброкачественные мезенхимальные опухоли, исходящие из мышечной фасции или апоневроза, хотя и не обладают метастатическим потенциалом, но могут быть местно-агрессивными с частотой рецидивирования 23-40% [17].
Радикальное первичное хирургическое лечение играет важную роль для длительного контроля заболевания, при этом обязательны точная предоперационная диагностика и хорошо спланированная операция [18].
Наиболее эффективный метод лечения десмоидных опухолей – полное иссечение. Повторное иссечение рецидивных опухолей оправдано.
Высокодозная лучевая терапия также эффективна для контроля рецидива заболевания и также может подходить для первичного лечения, когда это служит единственной альтернативой калечащей операции [19].
В 1928 г. Ewing был первым, кто в качестве контроля десмоидных опухолей применил лучевую терапию [20].
Помимо лучевой терапии, к другим возможным методам лечения нерезектабельных опухолей или при необходимости удаления прилежащих структур относят гормональную терапию, лечение цитостатиками и противовоспалительными препаратами [11].
Ясно, что многие авторы высказываются в пользу ранней диагностики и широкого иссечения фиброматоза, ограниченного молочной железой и не вовлекающего соседние структуры грудной полости. Эта местная хирургическая стратегия приведет к излечению огромного числа пациентов с фиброматозом только молочной железы и может помочь избежать необходимости дальнейшей радикальной резекции для получения чистого края [21].
В этом клиническом примере гистологическое исследование не выявило рак молочной железы и возможное вовлечение кожи и большой грудной мышцы и подтвердило наличие фиброматоза без инфильтрации кожи и мышечной ткани. Это обусловило широкую резекцию молочной железы с чистыми краями резекции. В связи с подозрением на злокачественное поражение, клинически увеличенные лимфатические узлы I и II порядка в левой подмышечной области, подмышечная лимфаденэктомия была выполнена вместе с биопсией сторожевого лимфатического узла. Плановое гистологическое исследование показало фолликулярную дисплазию подмышечных лимфатических узлов.
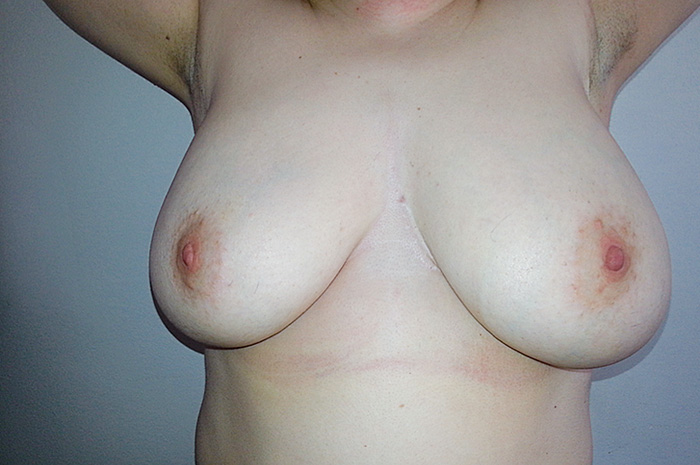
Мы, безусловно, превысили необходимый объем лечения нашей пациентки, но у нее нет каких-либо осложнений после подмышечной лимфаденэктомии, получен отличный косметический результат (рис. 3).
Рис. 3. Отличный косметический результат после операции.
Фиброматоз молочной железы является крайне редкой патологией. Стандартное первичное лечение – хирургическое, когда оно возможно. Цель операции – получить чистые края резекции с сохранением функции и хорошим косметическим результатом. Принципы оперативного вмешательства включают резекцию единым блоком. Объем хирургического лечения различен, от широкой туморэктомии до радикальной мастэктомии с удалением грудной фасции и грудных мышц. Мы не рекомендуем выполнять подмышечную лимфаденэктомию до получения гистологического анализа биопсии сторожевого лимфатического узла, несмотря на наличие клинически суспициозной опухоли в молочной железе и увеличенных подмышечных лимфатических узлов.
Нашей пациентке выполнена широкая (en bloc) резекция с удалением части грудной фасции и порции большой грудной мышцы. Пациентка находилась под динамическим наблюдением в течение 3 лет, у нее отсутствуют признаки рецидива, получен отличный косметический результат.
Согласен Данный веб-сайт содержит информацию для специалистов в области медицины. В соответствии с действующим законодательством доступ к такой информации может быть предоставлен только медицинским и фармацевтическим работникам. Нажимая «Согласен», вы подтверждаете, что являетесь медицинским или фармацевтическим работником и берете на себя ответственность за последствия, вызванные возможным нарушением указанного ограничения. Информация на данном сайте не должна использоваться пациентами для самостоятельной диагностики и лечения и не может быть заменой очной консультации врача.
Сайт использует файлы cookies для более комфортной работы пользователя. Продолжая просмотр страниц сайта, вы соглашаетесь с использованием файлов cookies, а также с обработкой ваших персональных данных в соответствии с Политикой конфиденциальности.