Десквамация эпидермиса что это
Что такое эксфолиативный кератолиз? Причины возникновения, диагностику и методы лечения разберем в статье доктора Похлебкиной А. А., педиатра со стажем в 5 лет.
Определение болезни. Причины заболевания
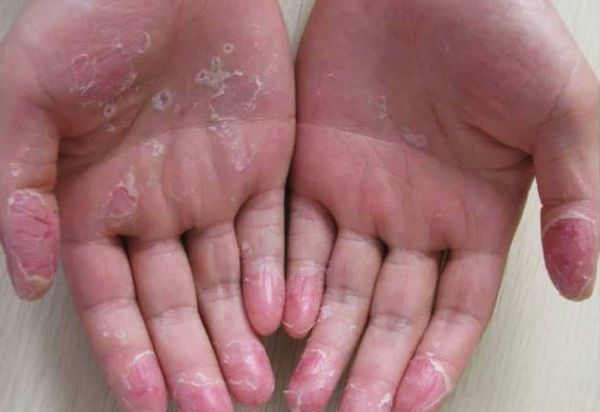
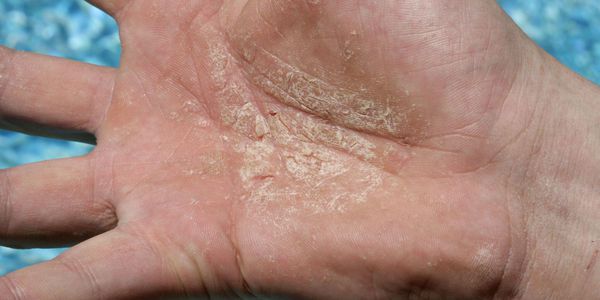
Эксфолиативный кератолиз — это очаговое симметричное шелушение кожи на ладонях, поверхности пальцев и, реже, на подошвах. Заболевание характеризуется сухостью кожи и поверхностными пузырями, заполненных воздухом.
Также эксфолиативный кератолиз называют рецидивирующей фокальной ладонной десквамацией, сухим пластинчатым дисгидрозом и рецидивирующей ладонной десквамацией.
Причины эксфолиативного кератолиза
Предполагалось, что экфолиативный кератолиз может быть вызван грибковым поражением, но в дальнейших исследованиях эта гипотеза не подтвердилась.
Возможные провоцирующие факторы эксфолиативного кератолиза:
Симптомы эксфолиативного кератолиза
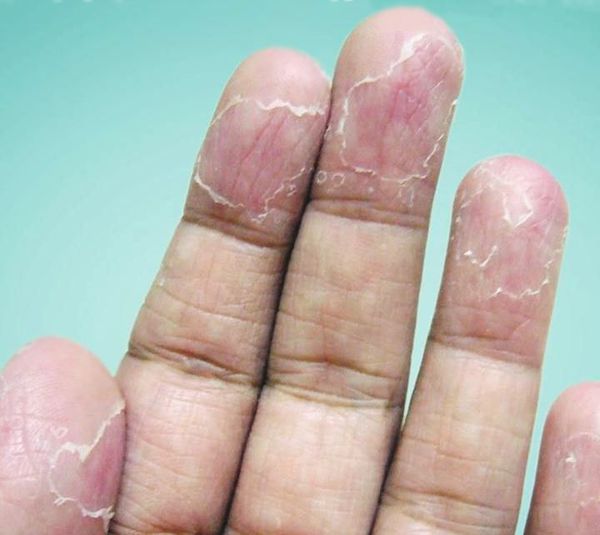
После вскрытия пузырей остаются широкие сетчатые, круглые или овальные очаги. Они шелушатся, распространяются по периферии и образуют большие округлые участки, напоминающие кружева.
Высыпания всегда симметричные. Иногда на кончиках пальцев образуются глубокие трещины, кожа становится жёсткой и немеет — в таком случае для полного заживления потребуется 1—3 недели. Эксфолиативный кератолиз может повториться через несколько недель после того, как на месте отшелушивания образовалась новая кожа.
Патогенез эксфолиативного кератолиза
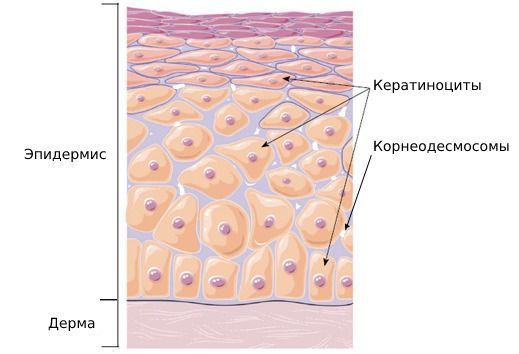
Эпидермис — верхний наружный слой кожи, состоящий из кератиноцитов. Эти клетки содержат белок кератин, необходимый для прочности и эластичности кожи. Когда кератин разрушается, прочность кожи снижается, из-за чего она начинает шелушиться.
Точный механизм развития эксфолиативного кератолиза неизвестен. Прояснить возможные генетические или приобретённые причины заболевания помогут дальнейшие исследования десквамационных ферментов и ингибиторов — веществ, подавляющих или задерживающих течение ферментативных процессов. К таким веществам относятся ингибитор секреторной лейкоцитарной протеазы (SLPI), альфа-2 макроглобулин-1 (A2ML1), сульфат холестерина и ион цинка.
Классификация и стадии развития эксфолиативного кератолиза
По МКБ-10 (Международной классификации болезней) дерматологи часто кодируют эксфолиативный кератолиз как L26, относя заболевание к «другим эксфолиативным состояниям».
Классификации и стадийности эксфолиативный кератолиз не имеет. Заболевание иногда может приобретать хроническое течение с периодами ремиссии и обострения.
Осложнения эксфолиативного кератолиза
Эксфолиативный кератолиз не вызывает системных проявлений или осложнений. При заболевании может повреждаться кожа, в результате чего присоединяется бактериальная инфекция. Её признак — красные пятна, которые превращаются в гнойнички и пузырьки. Пузырьки безболезненные и легко вскрываются, образуются желтоватые чешуйки, так называемые «медовые корочки». При этом может возникать зуд.
Диагностика эксфолиативного кератолиза
Эксфолиативный кератолиз, вероятно, распространён, но часто протекает бессимптомно, поэтому врачи его наблюдают редко.
При осмотре отмечаются симметричные округлые участки шелушения на ладонях и, реже, на стопах. При этом воспаление на коже отсутствует.
Обычно дополнительное диагностическое тестирование не требуется. Однако в более сложных случаях, при подозрении на грибковое поражение, может потребоваться исследование с гидроксидом калия (KOH).
Биопсия кожи при кератолизе показывает расщепление и частично разрушенные корнеодесмосомы в роговом слое.
Дифференциальную диагностику проводят со следующими заболеваниями:
Лечение эксфолиативного кератолиза
Причин возникновения эксфолиативного кератолиза может быть несколько, и не всегда они очевидны. Поэтому лечение болезни направлено на устранение симптомов и усугубляющих факторов. Это достигается защитой рук от физических или химических раздражителей ношением перчаток, когда это возможно.
Приём наружных гормональных препаратов (стероидов) не требуется, так как воспаление отсутствует.
PUVA-терапия заключается в приёме пациентом фотоактивного материала псоралена с последующим воздействием на кожу UVA лучей. Данных, подтверждающих пользу фототерапии при эксфолиативном кератолизе, на сегодняшний день недостаточно.
Прогноз. Профилактика
Прогноз благоприятный. Обычно симптомы эксфолиативного кератолиза проходят самостоятельно или после прекращения контакта с провоцирующим фактором. Спустя несколько недель или месяцев формируется здоровая кожа. Однако через несколько недель может возникнуть рецидив.
Роль продуктов питания в развитии эксфолиативного кератолиза не доказана, поэтому соблюдать диету не нужно.
Ксероз кожи. Часть 1: патогенез
Структурное и функциональное здоровье кожи во многом связано с содержанием и распределением в ней воды. Сухость кожи влечет за собой ее легкую проницаемость для токсичных и сенсибилизирующих веществ, способствует развитию иммунных нарушений и формированию
Структурное и функциональное здоровье кожи во многом связано с содержанием и распределением в ней воды. Сухость кожи влечет за собой ее легкую проницаемость для токсичных и сенсибилизирующих веществ, способствует развитию иммунных нарушений и формированию аллергического воспаления [1–3]. Нарушение гидратации рогового слоя эпидермиса является основной причиной патологической десквамации эпителия и ксероза. Поскольку корнеоциты представляют собой клетки, лишенные ядра, дерматологи до последнего времени не относились к роговому слою с должным вниманием. Но оказалось, что, воздействуя на роговой слой, можно не только добиться косметических эффектов, но и облегчить симптомы кожного заболевания, улучшить результат от медикаментозного лечения и повысить качество жизни больного.
Основа ухода за кожей при кожных заболеваниях — «корнеотерапия», система восстановления функционирования и целостности рогового слоя. В современных условиях грань между косметическими и лекарственными средствами постепенно стирается ввиду усложнения рецептуры косметологических препаратов. Современные косметические средства могут влиять на физиологические процессы в коже так же, как это делает фармацевтический препарат. Мастерство дерматолога основано на его умении использовать в терапии различные активные и индифферентные средства наружной терапии, добиваясь максимального успеха.
В поддержании водного баланса участвуют многочисленные структуры, регулирующие скорость трансэпидермальной потери воды и осуществляющие поступление воды из дермы в эпидермис. Очевидно, что для полноценного функционирования кожи необходима опорная структура корнеоцитов, при ее нарушениях увеличивается трансэпидермальная потеря воды, что ведет к гиперплазии эпидермиса и гиперкератозу. Роговой слой служит сенсором для подлежащих слоев [1]. В эпидермисе контроль за водным балансом осуществляет роговой слой и компоненты рогового слоя эпидермиса (натуральный увлажняющий фактор, липиды кожи, кожное сало и кератин) [3].
Кожа начинает обезвоживаться именно с эпидермиса. Происходит это из-за того, что эпидермис лишен кровеносных сосудов, которые могли бы пополнять в нем запасы влаги, поэтому основную часть жидкости эпидермис получает из дермы. До последнего времени считалось, что вода просачивается в верхние слои кожи по закону перфузии. Свободные аминокислоты, образующиеся при разрушении белка филагрина, поддерживают в корнеоцитах высокое осмотическое давление, что вызывает приток воды, которая сохраняется даже при пониженной влажности окружающей среды [4]. Однако в последние годы установлено, что в поддержании нормального уровня гидратации эпидермиса важное значение имеет также механизм облегченной диффузии, т. е. попадание молекул воды через водные каналы, названные аквапоринами. Аквапорины представляют собой мембранные белки, формирующие сквозные поры на поверхности клеток, через которые проходит вода, а также небольшие водорастворимые соединения, такие как глицерин и мочевина. За открытие этих белков в 2003 г. группе американских учёных во главе с Питером Эгром присуждена Нобелевская премия по химии [3].
Достигнув поверхности кожи, вода стремится к испарению, однако этому препятствует роговой слой. Несмотря на низкое содержание воды в роговом слое — 15–20%, сохранение влаги одна из основных его функций [5]. Непроницаемость рогового слоя обусловлена барьерными свойствами кератина, ацилцерамидов и кожного сала. Эпидермис достаточно хорошо проницаем по направлению к своей поверхности и почти непроницаем в обратном направлении. При этом вода и водорастворимые вещества сквозь эпидермис проникают с большим трудом, тогда как жирорастворимые вещества значительно легче [6, 7]. Чтобы оценить важную роль рогового слоя эпидермиса в сохранении влаги в коже, необходимо четко знать его строение.
Роговой слой представляет собой конечный продукт дифференцировки кератиноцитов эпидермиса. В тонкой коже он состоит из 15–20 слоев роговых чешуек, в толстой из сотен слоев. Чешуйки располагаются колонками друг над другом, и каждая чешуйка в проекции покрывает 9–10 клеток базального слоя [8]. Корнеоцит имеет 6-угольную форму и каждой из шести сторон контактирует с соседними корнеоцитами, такое строение можно сравнить со «стеганым одеялом» [4]. Роговой слой эпидермиса имеет уникальное строение, которое называют «briсk and mortar» («кирпич и цемент»), где роль «кирпичей» играют роговые клетки, а «цемента» — межклеточные липиды. На поперечном срезе роговой слой представляется рыхлым, пористым, однако это только видимость. Такое впечатление создается за счет межклеточных пространств, которые составляют значительную часть рогового слоя. Однако все они заполнены особым веществом, склеивающим их в непреодолимую преграду липидами-ацилцерамидами, которые относятся к классу сфинголипидов, или церамидов [6, 7]. Впервые сфинголипиды были выделены из мозговой ткани, поэтому свое второе название — церамиды — они получили от латинского слова cerebrum (мозг). Позже было установлено, что церамиды участвуют в построении эпидермального барьера, формируя липидную прослойку между роговыми чешуйками. Молекулы церамидов и фосфолипидов имеют гидрофильные «головы» (фрагменты, любящие воду) и липофильные «хвосты» (фрагменты, предпочитающие жиры). В водной среде молекулы полярных липидов самостоятельно группируются таким образом, чтобы гидрофобные хвосты были спрятаны от воды, а гидрофильные головы, напротив, были обращены в водную среду. Если таких липидов мало (и если смесь липидов и воды хорошо встряхнуть), то образуются шарики (липосомы). Это свойство полярных липидов используется в косметической промышленности при производстве липосом [5].
Церамиды состоят из жирного спирта сфингозина (образует «голову») и одной жирной кислоты («хвост»). Если в жирной кислоте имеются двойные связи, то она называется ненасыщенной, если двойных связей нет, то говорят, что кислота насыщенная. В зависимости от того, какая жирная кислота прикреплена к голове церамида, липидные пласты, построенные из них, получаются более или менее жидкими. Самые твердые (кристаллические) липидные пласты образованы церамидами с насыщенными хвостами. Чем длиннее хвост церамида и чем больше в нем двойных связей, тем более жидкими получаются липидные структуры [9–11]. Помимо рассмотренных выше межклеточных липидных пластов, в роговом слое обнаружены липиды, ковалентно связанные с корнеоцитами. Это особые длинноцепочечные церамиды, хвосты которых представлены жирными кислотами, имеющими в своей цепочке более 20 атомов углерода. Длинноцепочечные церамиды выполняют роль заклепок, скрепляя соседние липидные пласты. Благодаря им многослойная липидная прослойка не расслаивается и представляет собой целостную структуру. Церамиды в последнее время стали очень популярными ингредиентами в косметике. Популярность церамидов объясняется той ролью, которую они играют в поддержании целостности эпидермального барьера.
Благодаря наличию многослойной липидной прослойки между роговыми чешуйками, роговой слой способен эффективно защищать кожу не только от проникновения посторонних веществ извне, но и от обезвоживания. Диффузия воды через сухие полутвердые кератиновые пластинки, склеенные в сплошную массу церамидами, резко снижается, по сравнению с наполненными жидкостью живыми клетками.
Основными продуцентами межклеточного цемента являются гранулы Орланда клеток зернистого слоя [6, 7]. Именно они путем экзоцитоза выделяют свое содержимое в межклеточное пространство, где оно превращается в богатый липидами межклеточный цемент с пластинчатым строением. Таким образом, при ороговении происходит формирование гидрофобного эпидермального барьера, который не только препятствует проникновению в кожу вредных веществ, но и участвует в регуляции водного гомеостаза в дерме [4].
Кроме механизма биомеханической непроницаемости рогового слоя, влажность кожи поддерживают влагоудерживающие структуры.
Эпидермальные влагоудерживающие структуры кожи
1. Натуральный увлажняющий фактор (natural moisturizing factor, NMF) — это целый комплекс органических молекул на поверхности корнеоцитов, обладающий способностью связывать воду. К нему относятся свободные аминокислоты (40%); пироглутамат натрия (12%); мочевина (7%); аммиак, креатинин и др. органические соединения (17%); магний (1,5%); калий (4%); кальций (1,5%); натрий (5%); молочная и лимонная кислоты, ионы хлорида и фосфата (12%). Нарушение их баланса влечет за собой изменение состава NMF и, как следствие, неспособность кожи удерживать влагу. От количества влаги, связанной с NMF, зависит и эластичность рогового слоя. Доказано, что в жирной и нормальной коже больше NMF, чем в сухой [5].
Снижение синтеза филагрина, которое наблюдается, в частности, при ихтиозе и атопическом дерматите, приводит к уменьшению содержания аминокислот в составе NMF и уменьшению водоудерживающей способности кожи. Так как для работы ферментов, участвующих в гидролизе филагрина, необходимо достаточное количество влаги, при развитии сухости рогового слоя образование аминокислот NMF также снижается. В результате получается замкнутый круг, приводящий к хронической сухости кожного покрова.
Минеральный состав натурального увлажняющего фактора меняется в зависимости от времени года, и именно эти изменения вызывают снижение влажности рогового слоя в зимний период. В частности, в зимний период в роговом слое значительно понижается уровень калия, натрия, хлоридов и солей молочной кислоты [5].
При частом умывании горячей водой с мылом из NMF могут вымываться аминокислоты и минеральные вещества, что тоже приводит к развитию ксероза. Наиболее опасно сочетание «вымачивания», например длительного нахождения в горячей ванне, и воздействия растворителей и агрессивных поверхностно-активных веществ (ПАВ). Опасность ПАВ заключается в том, что они способны взаимодействовать с липидными пленками, поскольку в них, как и в полярных липидах, есть два участка — гидрофобный и гидрофильный, поэтому они могут встраиваться в липидный слой, обращаясь к ним своими гидрофобными «хвостами». При этом головы молекул ПАВ группируются вместе так, что в липидном слое оказываются гидрофильные, проницаемые для воды участки. Таким образом, первым следствием воздействия ПАВ на роговой слой является дегидратация липидных мембран, так называемый «Wash-Out-Effect» — эффект вымывания собственных липидов.
Длительное воздействие анионных ПАВ способствует их более глубокому проникновению вплоть до зернистого слоя эпидермиса, что приводит к разрушению клеточных мембран гранулоцитов — гранул Орланда, являющихся основной фабрикой межклеточных липидов. В результате снижается синтез липидов, необходимых для склеивания корнеоцитов [8].
Именно поэтому любые косметические процедуры, сопровождающиеся «отмачиванием» кожи с последующим ее очищением, должны завершаться применением увлажняющих средств на основе NMF [5, 14].
2. Эпидермальные межклеточные липиды (липидный барьер) — состоят из холестерола, церамидов и ненасыщенных жирных кислот (омега-3, омега-6), количество которых находится в строго определенной пропорции по отношению друг к другу. Если корнеоцит содержит лишь 3% липидов, то межклеточный цемент — 80%. По биохимическим данным в межклеточном матриксе обнаруживаются: церамиды —
40%, свободные жирные кислоты —
20%, холестерин и его эфиры —
10% [4]. Холестерин предотвращает избыточную ригидность и ломкость слоя церамидов. Свободные жирные кислоты расположены вокруг церамидов в липидном слое и способствуют поддержанию водоотталкивающей функции кожи, защищают водорастворимые компоненты рогового слоя от выщелачивания вследствие образования водно-масляной эмульсии [4, 9]. Если эта пропорция меняется, липидная прослойка между роговыми чешуйками нарушается и, как следствие, нарушается барьерная функция, влага испаряется более интенсивно. Пытаясь предотвратить избыточную потерю влаги, кожа замедляет процесс физиологической десквамации, и клетки начинают скапливаться на поверхности. Внешне это проявляется избыточным шелушением, утолщением рогового слоя, сероватым оттенком. Ярким примером такого процесса является себорея. При себорее в кожном сале уменьшается концентрация линолевой кислоты, что также приводит к нарушению целостности кожного барьера и возникновению адаптивной реакции в виде увеличения количества роговых клеток [12].
Среди липидов поверхности кожи выявляются эпидермальные липиды и липиды сальных желез. Эпидермальные липиды составляют меньшую часть. Главные компоненты эпидермальных липидов — свободный холестерин и его эфиры — образуются при распаде оболочек клеток рогового слоя. Доказано, что эпидермальные липиды поверхности кожи не оказывают большого влияния на гидратацию кожи, но представляют собой ограничивающую мембрану для водного обмена [4, 6, 7].
Интересно, что липидный состав рогового слоя неоднороден. Концентрация фосфолипидов уменьшается по направлению к поверхности, тогда как содержание нейтральных липидов и церамидов, наоборот, повышается [4].
Изменение состава эпидермальных липидов происходит при многих заболеваниях: атопическом дерматите, псориазе, контактном дерматите, себорее, а также при некоторых физиологических процессах. Например, при атопическом дерматите в коже нарушен обмен жирных кислот, а при ихтиозе наблюдается их снижение (табл.). В результате формируется неполноценный защитный гидролипидный слой, что также приводит к траскутанной потери воды и облегчению проникновения аллергенов и ирритантов.
3. Кожное сало. Функциональное значение кожного сала очень велико, выделяясь из секреторного отдела сальных желез, заполняя их выводные протоки и устья волосяных фолликул, секрет распределяется по бороздкам кожи и неравномерно покрывает практически всю ее поверхность слоем 7–10 мкм. За одну неделю у здорового человека выделяется 100–200 г секрета сальных желез, а при себорее 300 г и более. На поверхности кожи кожное сало смешивается с секретом потовых желез и эмульгируется. Таким образом, формируется тонкая водно-липидная эмульсионная пленка (sebum). Водно-липидная мантия подобно восковому налету предохраняет от избыточного солнечного излучения, переувлажнения, вредных воздействий внешней среды, инфекций, препятствует испарению воды и высвобождает глицерин, который связывает воду из атмосферного воздуха и удерживает у поверхности кожи [12, 13].
4. Кератин — конечный продукт жизнедеятельности эпидермиса, характеризуется стойкостью по отношению к механическим, физическим и химическим факторам. По мнению некоторых авторов, кератин, как все белки, является коллоидом — в воде набухает и связывает молекулы воды [14].
При нарушении одной или нескольких влагоудерживающих структур (дефицит компонентов, структурные изменения и т. д.) уровень воды в роговом слое падает. Происходит нарушение его структуры, что влечет за собой и нарушение барьерных свойств. Это означает, что роговой слой перестает быть непроницаемой преградой для воды и ее испарение усиливается. Через нарушенный барьер могут легче проникать микроорганизмы, химические факторы агрессии, которые дополнительно поддерживают раздражение и воспаление кожи. Сухость кожи — неизменный симптом различных кожных заболеваний, таких как атопический дерматит, псориаз, экзема и т. д. В последние годы стала преодолеваться необоснованная позиция среди практикующих врачей, касающаяся пренебрежения таким важным аспектом, как уход за кожей и восстановление ее барьерных функции у больных дерматозами. Поэтому во второй части статьи речь пойдет не только о вспомогательной терапии космецевтики во время обострения, но и об очень важном вопросе — закреплении ремиссии путем активного восстановления целостности кожи и ее нормальной функции с помощью лечебно-косметических средств.
Литература
Ю. А. Галлямова, доктор медицинских наук, профессор
О. А. Баринова
Этиопатогенетические механизмы десквамативных поражений кожи и обоснование терапии
Показано, что комбинированная терапия с применением этиотропных, энтеросорбирующих и иммунотропных средств для лечения десквамативных поражений кожи оказывает выраженный клинический эффект, удлиняет ремиссию и коррегирует иммунологические нарушения.
It was stated that combined therapy using etiotropic, enterosorbent and immunotropic medications for treatment of desquamative skin affections has a pronounced clinical effect, prolongs the remission and correct immunologic disorders.
Себорейный дерматит (СД) представляет собой хроническое рецидивирующее заболевание кожи волосистой части головы, лица и гладкой кожи тела, характеризующееся повышенным шелушением, гиперемией, сухостью кожных покровов и зудом.
Это распространенная патология, которая встречается как у детей грудного возраста, так и у пациентов старше 50 лет [1, 2]. Согласно современным данным ведущую роль в возникновении СД играет антропофильный гриб Malassezia furfur, относящийся к условно-патогенным микроорганизмам.
С дрожжеподобными грибами связывают возникновение и других кожных заболеваний. Показано, что этиологическим фактором экземы наружного слухового прохода у больных являются M. furfur, выделяемые из сухих серных пробок [3]. При таком заболевании, как фолликулит, из содержимого пустул высевают большое количество мицелиальных форм гриба M. furfur [4]. Также большой интерес вызывает M. furfur как микроорганизм, колонизирующий кожу у больных атопическим дерматитом, способный индуцировать высокий уровень специфических IgE-антител [5]. В других источниках сообщается о наличии специфичного гуморального ответа к антигенам M. furfur у больных псориазом [3].
Грибы рода M. furfur обитают на здоровой коже человека, потребляя жироподобные компоненты и выделяя антибактериальные и антигрибковые вещества. На сегодняшний день остаются не до конца выясненными причины трансформации Malassezia и переход ее из непатогенной формы бластоспоры в патогенную мицелиальную.
В последние годы проводятся многочисленные исследования по изучению роли специфического и гуморального иммунного ответа у больных десквамативными поражениями кожи. Выявлено увеличение в периферической крови интерлейкина (ИЛ) 10 на фоне депрессии интерферона гамма (ИНФ-γ) и снижения продукции провоспалительных интерлейкинов: ИЛ-1 альфа, ИЛ-2, ИЛ-6 и фактора некроза опухолей альфа (ФНО-альфа) у больных СД [6, 7]. В других работах обнаружено увеличение числа естественных киллеров (NK-клеток) и уровня антителообразования IgG и IgA. Показано, что у больных СД отмечается супрессия Т-клеточной функции [8, 9].
В пользу иммунной теории свидетельствуют факты о распространенности СД среди ВИЧ-позитивных пациентов и больных СПИДом, где частота встречаемости заболевания варьирует от 34% до 83% [10]. F. Ippolito и соавт. [11] рассматривают СД как клинический маркер ВИЧ-инфекции.
Среди многих причин развития СД существенная роль принадлежит нейроэндокринным нарушениям и гиперсекреции кожного сала. Повышенное салообразование, обнаруженное у пациентов с болезнью Паркинсона, способствует развитию дрожжей Malassezia [12], а механизм возникновения себорейного дерматита у пациентов с паркинсонизмом обусловлен нарушениями в эндокринной системе [13, 14].
К развитию заболевания предрасполагают изменения ферментативной активности органов желудочно-кишечного тракта и печени, вегетодистонические расстройства [15], нарушения гормонального равновесия [16].
Резюмируя данные литературы, следует все же отметить, что ни один из этиопатологических факторов не может считаться универсальным для обоснования механизмов развития СД.
Недостаточная изученность этиопатогенеза СД предопределяет трудности в лечении. Рекомендуемые лекарственные препараты остаются малоэффективными. В лучшем случае удается достичь временного улучшения и редко ремиссии. Ни одно из существующих средств не дает полного излечения.
Учитывая актуальность данной проблемы, целью настоящей работы явилось определить клинико-патогенетическое значение инфекционных патогенов и иммуногенетического статуса при десквамативных поражениях кожи, сформулировать концепцию патогенеза и разработать комплексную терапию.
Под наблюдением находилось 320 человек: у 146 (45,6%) пациентов был диагностирован себорейный псориаз (СП), у 174 (54,4%) — себорейный дерматит. По характеру клинической картины выделяли 2 разновидности СД: 79 пациентов с клиническими признаками жирной себореи, 95 — сухой себореи.
У 235 пациентов (73,4%) были выявлены сопутствующие заболевания, причем в 66,2% случаев относящиеся к категории хронических очаговых инфекций в виде гастрита, панкреатита, дискинезии желчного пузыря, холецистита.
С целью выявления микробиологических и иммунологических изменений у больных десквамативными поражениями кожи был проведен комплекс лабораторных методов исследования. Методы исследования подбирались таким образом, чтобы можно было раскрыть патогенетические механизмы формирования десквамативных заболеваний кожи.
Проведенное комплексное обследование позволило уточнить решенные и выявить нерешенные вопросы десквамативных поражений кожи, позволяющие по-новому представить патогенез этих заболеваний и выработать тактику к совершенствованию терапии.
Результаты проведенных исследований помогли выявить у больных себорейным дерматитом грубые изменения как в количественном, так и в качественном составе микробиоценоза кожи и кишечника. Сущность этих изменений в том, что в зоне себорейных поражений неизменно возрастает число S. capitis и S. epidermidis в 80% высева (lg КОЕ/см 2 = 4,91 ± 1,18) и в 53,3% (lg КОЕ/см 2 = 3,81 ± 0,89) соответственно. С меньшей частотой (26,6%), но довольно с высокой степенью обсемененности (lg КОЕ/см 2 = 4,79 ± 1,88) на пораженных участках кожи волосистой части головы присутствуют Micrococcus и Acinetobacter (13,3%) — типичные оппортунистические патогены.
Существенные различия в составе микрофлоры и степени обсемененности пораженных участков кожи головы были выявлены в зависимости от варианта течения СД. В группе больных СД, протекающим с признаками жирной себореи, чаще, чем у больных с признаками сухой себореи, на пораженных участках кожи волосистой части головы присутствовал S. epidermidis, Micrococcus spp. и Acinetobacter spp.
При сравнительном анализе частоты высева (%) и степени обсемененности (lg КОЕ/см 2 ) микрофлорой пораженных участков волосистой части головы у больных себорейным дерматитом в зависимости от распространенности патологического процесса существенных различий не выявлено, но при локализации процесса только на коже головы доминирующее место среди выделенной микрофлоры занимают S. capitis и Micrococcus spp. В то время как при распространении патологического процесса и на кожу лица существенно возрастает частота высева S. epidermidis.
При изучении дисбиотических изменений микрофлоры кишечника в зависимости от распространения процесса у больных десквамативными поражениями кожи волосистой части головы степень выраженности дисбиотических изменений микрофлоры кишечника с вовлечением в патологический процесс кожи лица и кожи головы становится более выраженной. В этой группе больных уровень концентрации бифидобактерий, E. coli lac+/hem был достоверно ниже по сравнению с группой пациентов с локализацией клинических проявлений на лице.
При сравнительном анализе выраженности дисбиотических изменений в зависимости от варианта течения заболевания, концентрация Lactobacterium spp., Bacteroides spp., Clostridium spp. (H2S+, Lec-) и Enterococcus spp. в группе больных с признаками жирной себореи присутствовали у больных в меньшем проценте случаев и в более низких концентрациях, чем у больных с признаками сухой себореи. Частота высева в этой группе Enterococcus spp. была снижена на 3–4 порядка от нормы.
Очевидно, что в условиях дисбиотических нарушений в коже волосистой части головы создаются условия для образования и действия биологически активных веществ, обеспечивающих прогрессирование патологического процесса, распространения его на кожу лица. Известно, что при дисбактериозе нарушается одна из главных функций нормальной микрофлоры — ее антагонистическая активность в отношении условно-патогенных микроорганизмов.
При исследовании микроэкологического статуса организма методом масс-спектрометрии выявлялись изменения, связанные с пятикратным ростом концентрации фузобактерий и более чем двадцатикратным увеличением концентрации Eubacterium moniliforme. Eubacterium — родственные клостридиям микроорганизмы, являющиеся одними из основных обитателей кишечника. Род Eubacterium в настоящее время насчитывает более 30 видов, из которых 28 являются сахаролитическими, т. е. способны ферментировать углеводы с накоплением смеси низкомолекулярных жирных кислот. Именно эта группа эубактерий является физиологической для организма-хозяина и представляет собой один из компонентов микробиоты, в норме сосуществующей с макроорганизмом на основе взаимовыгодных симбиотических отношений. Отдельные варианты сахаролитических эубактерий способны синтезировать витамины, в частности кобаламин, аминокислоты (аланин, валин, изолейцин), расщеплять целлюлозу, участвовать в обмене стероидных гормонов. Вместе с тем, как и в случае бактероидов, сахаролитический кластер эубактерий в кишечном биотопе поддерживается благодаря регулирующей деятельности ключевых эндогенных анаэробов из родов: Bifidobacterium, Lactobacillus, Propionibacterium. Следует отметить, что при данной патологии практически у всех больных (95,4%) существенно (в среднем в 2,1 раза) снижено количество лактобактерий, которые в тонкой кишке в кооперации с организмом хозяина являются основным микробиологическим звеном колонизационной резистентности.
Также более чем вдвое растет концентрация маркеров Clostridium ramosum и актинобактерий Streptomyces, почти у всех больных возрастает количество Clostridium perfringens, — до 10 и 100 раз в двух случаях. Хотя этот микроб не дает существенного абсолютного вклада в изменение микроэкологии больных СД в целом, его нельзя недооценивать в патологическом плане: Clostridium perfringens образует как минимум 12 токсинов и энтеротоксин. Мишени для основных токсинов — биологические мембраны в различных тканях. Поражения обуславливают ферментативные процессы, катализирующие гидролитическое расщепление и нарушение клеточной проницаемости с последующим отеком и аутолизом тканей, характерными для газовой гангрены.
При исследовании концентрации Malassezia оказалось, что и в самой культуре дрожжей Malassezia эти вещества присутствуют в большой концентрации, особенно 10h16 (10-гидрокси-пальмитиновая кислота), содержание которой достигает 10 мг/г биомассы. Она и была принята в качестве основного маркера при исследовании концентрации Malassezia в различных биоматериалах и ее изменении при заболеваниях кожи. В результате было найдено, что концентрация 10h16 на коже в норме у доноров (n = 15) составляет в среднем 14,4 нг/мл кожного сала, в крови — 6 нг/мл, ногтях — 2 нг/мл, фекалиях — 33 нг/мл. При акне (n = 50) содержание Malassezia не отличается от нормы и составляет 15,2 нг/мл, при алопеции (n = 30) — 5–8 нг/мл. При этом как у доноров, так и у больных отмечены единичные случаи высоких концентраций маркера Malassezia — до 200 нг/мл. Однако при СД в капиллярной крови с кожи головы (n = 10), равно как и в кожном сале (n = 15), получен устойчиво повышенный уровень его содержания 52,7 нг/мл в среднем. Измерения проведены одним методом в количественно сопоставимом режиме при биологической воспроизводимости 20% относительных. Этот опыт убедительно показывает, что только в случае себорейного дерматита дрожжи Malassezia можно рассматривать в качестве одного из инфекционных агентов.
Таким образом, у всех больных СД в зоне поражения отмечается чрезмерный рост отдельных микроорганизмов, что ведет за собой создание благоприятных условий для образования множества токсических метаболитов, которые оказывают повреждающее действие на биологические мембраны. Аналогичные изменения у этих больных возникают и в биоценозе кишечника, формируется пролонгированное состояние эндотоксинемии с фиксацией эндотоксинов на клетках кожи, что в конечном итоге приводит к хроническому воспалению, в том числе и за счет включения кожи в иммунопатологический процесс.
Для определения эндотоксинемии оценивались показатели эндотоксина у больных десквамативными заболеваниями кожи. Было выявлено увеличение интегральных показателей концентрации липополисахарида (ЛПС) в общем кровотоке у больных СП и СД (1,95 ± 1,4 EU/мл, где EU — единица эндотоксина (EU — Endotoxin Unit), и 1,45 ± 0,67 EU/мл соответственно при норме 0–1 EU/мл).
При изучении гуморального звена антиэндотоксинового иммунитета выявлено снижение титров антител к гликолипиду (ГЛП) хемотипа Re и к ЛПС Escherichia coli O14 c общим антигеном у больных СП на 30% (138,3 ± 33,2 у.е. О.П. (титры антиэндотоксиновых антител в условных единицах оптической плотности)) и 35% (259,4 ± 72,4 у.е. О.П.) соответственно, у больных СД на 26% (146,8 ± 57,1 у.е. О.П.) и 37% (251,0 ± 40,7 у.е. О.П.) соответственно.
Проведенный анализ средних показателей концентрации антибактериальных антител (АТ) в исследуемых группах показал, что для пациентов СП характерны следующие изменения: увеличение концентрации антител к стафилококку и бактероидам и синегнойной палочке, на фоне снижения концентрации АТ к пневмококку, E. coli, клебсиелле и ГЛП.
Для больных СД преимущественно изменения проявлялись в увеличении уровня концентрации АТ к C. albicans, синегнойной палочке, протею, а также к бактероидам, с уменьшением концентрации АТ к ГЛП, клебсиелле и E. coli.
Таким образом, у пациентов десквамативными поражениями кожи отмечается снижение активности гуморального антиэндотоксинового иммунитета (АЭИ), что свидетельствует о развитии эндотоксинемии, этиологическими факторами которой могут быть различные условно-патогенные и сапрофитные представители бактерий кишечной микрофлоры.
При изучении иммунного статуса больных СД выявлялись существенные нарушения в характере иммунологического реагирования: у 70% и 50% больных количество моноцитов и палочкоядерных нейтрофилов было выше, уровень спонтанной хемилюменинсценции, хемилюменинсценции, индуцированной зимозаном, и индуцированной форболмиристатацетатом хемилюменинсценции оказался выше нормы на 75%, 60% и 50% соответственно.
Нарушения в субпопуляции состава Т-клеток сопровождались активацией естественных киллеров на 45% и активированных NK-клеток, экспрессирующих HLA-DR-молекулы, на 65% и резким увеличением фенотипа NK-клеток CD16 + 56 + на 90%, что является характерными признаками хронической инфекции.
Анализ некоторых показателей гуморального звена иммунитета показал, что в 65% больных повышалось содержание IgG в крови, что свидетельствует об усиленной продукции антител в течение длительного времени. В то же время у 90% больных отмечалась усиленная экспрессия молекул CD25 (α-цепь рецептора интерлейкина-2) на CD4 + T-клетках, что свидетельствует об активной фазе инфекционно-воспалительного процесса.
Были исследованы изменения иммунного статуса в зависимости от степени выраженности клинических проявлений. Больных распределили на 2 группы: с обычными признаками неосложненного СД — десквамацией и зудом (1-я группа — 12 человек) и наличием эритемы наряду с десквамацией и зудом (2-я группа — 8 человек).
Увеличение площади распространения у больных СД коррелировало с достоверно более высоким уровнем экспрессии молекул HLA-DR на CD4 + Т-хелперах (p = 0,008), CD8 + Т-клетках (p = 0,06) и NK-клетках (p = 0,08). Также на 60% (p = 0,02) увеличена функциональная активность нейтрофильных гранулоцитов и достоверно повышена цитолитическая активность комплемента (p = 0,02).
Для изучения корреляционных связей между клиническими и иммунологическими показателями был изучен иммунный статус у больных СД в зависимости от продолжительности заболевания. Больные были распределены на 3 группы с длительностью заболевания от 1 до 5 лет, от 5 до 10 лет, более 10 лет.
У больных со сроком заболевания до 5 лет происходит активация иммунной защиты в виде накопления CD8 + Т-клеток-киллеров, содержащих в цитоплазме киллерный белок перфорин.
С увеличением длительности заболевания более 10 лет происходит истощение активированных звеньев иммунитета на фоне дополнительной компенсаторной активации экспрессии рецепторов интерлейкина-2 (CD25) на CD8 + и CD4 + Т-клетках и существенного нарастания продукции IgG и IgA, что характерно для хронического инфекционного воспаления эпителиальных покровов. Проведенное сравнение иммунологических сдвигов у больных СД, имевших сопутствующие заболевания желудочно-кишечного тракта (ЖКТ), с больными СД без сопутствующих заболеваний ЖКТ, показало отсутствие корреляционных связей описанных выше изменений иммунограмм.
Таким образом, результаты проведенного исследования свидетельствуют о нарастании изменений иммунограмм в зависимости от степени выраженности клинических симптомов болезни. В то же время динамика иммунологических показателей находится в корреляционной зависимости от продолжительности клинического процесса. Очевидно, что на начальных стадиях заболевания (до 5 лет) происходит активация иммунопатологических механизмов, за счет вовлечения в реакции иммунологического реагирования различных звеньев иммунной системы. При продолжительности заболевания более 10 лет возникают признаки недостаточности отдельных звеньев иммунитета, связанные с недостаточностью компенсаторных возможностей организма.
При исследовании полиморфизма генов системы HLA-I класса и специфичности DRB1, DQA1, DQB1 II класса у пациентов себорейным дерматитом было обнаружено, что степень вероятности развития болезни у пациентов выявлена по HLA-антигенам А2 (54,2% и 49,3%), А1 (41,7% и 23,4%), А3 (20,8% и 24%), А9 (37,5% и 22%) соответственно. Кроме того, при СД выявлена ассоциативная связь с конкретными антигенами А10 и А23. Изучение связей между антигенами системы HLA-I класса и СД по локусу В корреляций не выявило.
Анализ результатов проведенных исследований показал, что самыми распространенными в локусе DRB1 являются антигены DRB1 (4), (13) и (15). В локусе DQA1 c высокой частотой обнаруживаются гаплотипы DQA1 (501) и DQA1 (102). С наибольшей частотой 55% в локусе DQB1 встречается DQB1 (602).
При изучении достоверной связи исследуемых HLA специфичности II класса статистически значимая взаимосвязь аллелей локусов установлена не была.
Полученные результаты свидетельствуют о наличии ассоциативных связей системы HLA с СД, что позволяет относить заболевание к генетически детерминированным.
Очевидно также, что появление в крови бактериальных антигенов реализуется в условиях повышенной проницаемости сосудистой стенки, чему способствует снижение антибактериальных антител в крови, вследствие чего в общем кровотоке возрастает концентрация эндотоксина и реализуется механизм эндотоксиновой агрессии, исходом которой будет фиксация бактериальных антигенов на субстрате кожи волосистой части головы, что, очевидно, возможно в условиях генетической предрасположенности.
Исходя из представленной гипотезы патогенеза, становится очевидным, что для обеспечения эффективной терапии десквамативных заболеваний кожи волосистой части головы в высшей степени обосновано применять прежде всего этиотропные препараты, направленные на подавление бактериальной флоры, на восстановление нормального биоциноза кишечника и очагов поражения, на снижение факторов эндотоксиновой агрессии, подавление реакций иммунного восстановления, с одновременным усилением реакций иммунологического реагирования (иммунокорректоры) с целью элиминации факторов бактериологической агрессии.
Таким образом, все вышеперечисленные направления лечебных мероприятий позволяют предложить для терапии десквамативных поражений кожи следующие лекарственные средства: Гептрал (активное вещество — адеметионин (S-аденозил-L-метионин)) по 5 мл внутримышечно, ежедневно в течение 10 дней; Энтеросгель — (энтеросорбент) в дозе 1,5 г/кг в сутки; Бифидум № 791 — биологически активная добавка, которая представляет собой комплекс антагонистических активных бифидобактерий, а также витамины группы В, С, РР и незаменимые кислоты. Схема применения по 3 мл per os однократно на ночь; Виферон® — рекомбинантный aльфа-2b интерферон в сочетании с антиоксидантами (витаминами Е и С) в суппозиториях по 500 000 МЕ 2 раза день 3 раза в неделю; Виферон® — рекомбинантный aльфа-2b интерферон в виде геля, содержащий 36 000 МЕ в 1 г геля, и антиоксиданты (токоферол ацетат, бензойная и лимонная кислота).
Под наблюдением находились 65 пациентов, получавших различные виды терапии. 30 пациентов десквамативными поражениями кожи, из них 17 пациентов себорейным псориазом и 13 себорейным дерматитом получали комбинированную терапию с учетом всех вышеперечисленных лекарственных средств.
Остальные 35 (19 больных — СП и 16 — СД) находились на традиционной схеме лечения: сосудистые препараты, седативные и витаминные комплексы.
Наружно все больные, находившиеся на комбинированной и традиционной терапии, получали антимикотические и кератолитические средства в виде шампуней. Продолжительность лечения составила 21 день.
В результате проведенного лечения средние показатели концентрации эндотоксина в общем кровотоке у пациентов десквамативными поражениями кожи остались без каких-либо существенных изменений. Но интегральные показатели гуморального звена антиэндотоксинового иммунитета и титр антител к Re-гликолипиду в обеих группах, наоборот, имели тенденцию к нормализации на 20% и 19% при СП соответственно, при СД на 15% и 4,5% соответственно.
Также у больных СП прослеживалась тенденция к нормализации средних показателей АТ к бактериям: стафилококку и синегнойной палочке в сторону уменьшения на 39% (7,6 ± 2,1 МЕ/мл) и 53,1% (5,9 ± 4,0 МЕ/мл) соответственно, показатели к клебсиелле — в сторону увеличения.
У пациентов СД концентрация АТ к С. albicans имела тенденцию к нормализации, к протею и синегнойной палочке уменьшилась в 1,3 и 1,4 раза соответственно. Значение других грамотрицательных бактерий были без существенных изменений.
В результате проведения комбинированной терапии у больных СП произошла активация Th1 лимфоцитов CD4 хелперов и снижение CD8 + лимфоцитов, индекс иммунорегуляции составил 1,75. Следует отметить, что при применении иммунокорригирующей терапии отмечалось снижение уровня апоптоза (CD95) по сравнению с исходными данными с 15% до 10,9% и уменьшение содержания CD25 (ИЛ2r + клеток) с 4,6% до 1,7%. Кроме того, повысился уровень лимфоцитов с фетотипом цитотоксичности NK (CD16 + клеток) и В-лимфоцитов (CD19 + ). Концентрация иммуноглобулинов G, A и М осталась без значимых изменений. Абсолютный фагоцитарный показатель приближался к норме.
У больных СД до и после лечения изменения в иммунорегуляторном звене характеризовались повышением CD4 Т-хелперов, в то время как уровень CD8 + клеток не изменился. Индекс иммунорегуляции достиг нормативных значений, а уровень апоптоза клеток CD95 снизился с 24,3% до 7,73%. Первоначальные показатели субпопуляции лимфоцитов с фенотипом цитотоксичности ИЛ2r + клеток были снижены. После проведения курса терапии значения были изменены незначительно. Остальные показатели не отличались от исходных.
Оценку эффективности проводимой терапии у больных десквамативными поражениями кожи осуществляли по комплексу наиболее информативных клинических признаков, в том числе субъективных симптомов заболевания — эритемы, отека, папулы, зуда и других оценочных критериев.
В исследуемой группе больных десквамативными поражениями кожи, получавших комбинированную терапию, установлен достаточно быстрый регресс клинических признаков воспаления. Положительный эффект начинал проявляться с 3–5 дня после начала терапии. Клиническое выздоровление наступало в более поздние сроки.
Сравнительный анализ клинической эффективности выявил, что в группе больных СП, получавших комплексную терапию, клиническое выздоровление отмечалось у 18% пациентов, в то время как в группе сравнения клиническое выздоровление не было зарегистрировано ни у одного наблюдавшегося больного. Отсутствие эффекта у пациентов, находившихся на традиционной терапии, встречалось в 5,2 раза чаще, чем у больных, получавших комплексное лечение.
При сравнении клинической эффективности комплексной и традиционной терапии у больных СД клиническое выздоровление отмечалось в 30% и 6% случаев соответственно. Значительное улучшение — в 46% и 25% соответственно. В группе пациентов, получавших комплексное лечение, улучшение патологического процесса регистрировалось у 24%, отсутствие клинического эффекта не отмечали.
У 50% пациентов, находившихся на традиционной терапии, было диагностировано улучшение клинического процесса, а в 19% проводимое лечение оказалось не эффективным.
Таким образом, комбинированная терапия с применением этиотропных, энтеросорбирующих и иммунотропных средств оказывает выраженный клинический эффект, удлиняет ремиссию в среднем на 6–8 месяцев и корригирует иммунологические нарушения, что патогенетически обосновывает назначение комплексной терапии, которая может быть использована в качестве основы базисного лечения десквамативных поражений кожи.
Литература
И. В. Полеско, доктор медицинских наук, профессор
ГБОУ ВПО РНИМУ им. Н. И. Пирогова МЗ РФ, Москва



.gif)