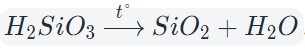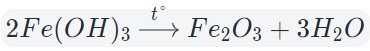Что такое высшие гидроксиды
Высшие оксиды и гидроксиды химических элементов третьего периода
Высшие оксиды и гидроксиды химических элементов третьего периода. Закономерности в изменении их свойств в связи с положением химических элементов в периодической системе.
Высшие оксиды и гидроксиды – это соединения, в состав которых входит элемент данной группы с высшей степенью окисления.
Высшие оксиды и гидроксиды химических элементов третьего периода
В периоде слева направометаллические свойства химических элементов ослабевают,
Основные оксиды взаимодействуют с водой, с кислотными оксидами, с кислотами.
гидроксид натрия сульфат натрия хлорид магния
Их гидраты (основания) взаимодействуют с кислотными оксидами, с кислотами, с солями.
NaOH + HCl = NaCl + H2O (хлорид натрия и вода)
Амфотерный оксид Al2O3 не взаимодействует с водой, реагирует со щелочами и кислотами.
Al2O3 + 2NaOH = 2NaAlO2+ H2O (при сплавлении оксида со щелочью получается соль
алюминат натрия и вода).
Кислотные оксиды реагируют с водой, с основными оксидами, с основаниями.
Гидраты кислотных оксидов (кислоты) реагируют с основными оксидами, с основаниями, ссолями более слабых, летучих и нерастворимых кислот, с металлами, стоящими в рядунапряжений до водорода. H2SO4 + CuO = CuSO4+ H2O (сульфат меди и вода).
Дата добавления: 2016-05-05 ; просмотров: 33977 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Основания (гидроксиды). Свойства, получение, применение

Номенклатура оснований
Названия оснований образуются весьма просто — сначала идёт слово «гидроксид», а затем название металла, который входит в данное основание. Если металл имеет переменную валентность, это отражают в названии.
KOH — гидроксид калия
Ca(OH)2 — гидроксид кальция
Fe(OH)2 — гидроксид железа (II)
Fe(OH)3 — гидроксид железа (III)
Классификация оснований
Основания можно классифицировать по следующим признакам:
Изменение цвета индикаторов:
метиловый оранжевый – желтый
Фенолфталеин придаёт раствору щёлочи малиновую окраску
Урок №44. Гидроксиды. Основания: классификация, номенклатура, получение
Гидроксиды
ОСНОВАНИЯ
NaOH – гидроксид натрия,
KOH – гидроксид калия,
Ca(OH) 2 – гидроксид кальция,
Fe(OH) 3 – гидроксид железа (III),
Ba(OH) 2 – гидроксид бария.
Классификация оснований
Щёлочи – это основания растворимые в воде.
К нерастворимым относят так называемые амфотерные гидроксиды, которые при взаимодействии с кислотами выступают как основания, а со щёлочью как кислоты.
Классификация оснований по числу групп ОН:
Физические свойства
Большинство оснований – твёрдые вещества с различной растворимостью в воде.
СПОСОБЫ ПОЛУЧЕНИЯ ОСНОВАНИЙ
1. Металл + H 2 O = ЩЁЛОЧЬ + Н 2 ↑
2Na + 2H 2 O = 2NaOH + H 2
2. ОКСИД МЕТАЛЛА + H 2 O = ЩЁЛОЧЬ
Na 2 O + H 2 O = 2 NaOH
Здесь, Металл – это щелочной металл (Li, Na, K, Rb, Cs) или щелочноземельный (Ca, Ba, Ra, Sr)
СОЛЬ(р-р) + ЩЁЛОЧЬ = ОСНОВАНИЕ↓ + СОЛЬ
Ме х А у + Ме * (OH) n = Me(OH) у ↓+Ме * х А n
CuSO 4 + 2 NaOH = Cu(OH) 2 ↓ + Na 2 SO 4
ВЫПОЛНИТЕ ЗАДАНИЯ:
№1. Классифицируйте формулы:
№2. Выпишите химические формулы оснований в два отдельных столбика: щёлочи и нерастворимые основания и назовите их : MnO, P 2 O 5 , Ca(OH) 2 , CO, Al(OH) 3 , BeO, Mg(OH) 2 , K 2 O, ZnO, KOH, CrO 3
№3. Приведите по два уравнения реакций получения следующих оснований:
Гидроксиды
Характеристики и физические свойства гидроксидов
Большинство оснований – твердые вещества с различной растворимостью в воде. Гидроксид меди (II) голубого цвета (рис. 1), гидроксид железа (III) бурого, большинство других белого цвета.
Рис. 1. Гидроксид меди (II). Внешний вид.
Получение гидроксидов
Растворимые основания (щелочи) в лаборатории можно получить при взаимодействии активных металлов и их оксидов с водой:
Щелочи гидроксид натрия и гидроксид кальция получают электролизом водных растворов хлорида натрия и хлорида калия.
Нерастворимые в воде основания получают по реакции солей с щелочами в водных растворах:
Химические свойства гидроксидов
Растворимые и нерастворимые основания имеют общее свойства: они реагируют с кислотами с образованием солей и воды (реакция нейтрализации):
NaOH + HCl = NaCl + H2O;
Растворы щелочей изменяют цвет некоторых веществ – лакмуса, фенолфталеина и метилового оранжевого, называемых индикаторами (табл. 1).
Таблица 1. Изменение цвета индикаторов под воздействием растворов кислот и оснований.
Цвет индикатора в среде
Кроме общего свойства, щелочи и нерастворимые в воде основания обладают также специфическими. Например, при нагревании голубого осадка гидроксида меди (II) образуется вещество черного цвета – это оксид меди (II):
Щелочи, в отличие от нерастворимых оснований, при нагревании обычно не разлагаются. Их растворы действуют на индикаторы, разъедают органические вещества, реагируют с растворами солей (если в их состав входит металл, способный образовать нерастворимое основание) и кислотными оксидами:
Применение гидроксидов
Гидроксиды находят широкое применение в промышленности и быту. Например, большое значение имеет гидроксид кальция. Это белый рыхлый порошок. При смешивании его с водой образуется так называемое известковое молоко. Так как гидроксид кальция немного растворяется в воде, то после отфильтровывания известкового молока получается прозрачный раствор – известковая вода, которая мутнеет при пропускании через неё диокисда углерода. Гашеную известь применяют дляприготовления бордосской смеси –средства борьбы с болезнями и вредителями растений. Известковое молоко широко используют в химической промышленности, например при производстве сахара, соды и других веществ.
Гидроксид натрия применяют для очистки нефти, производства мыла, в текстильной промышленности. Гидроксид калия и гидроксид лития используют в аккумуляторах.
Примеры решения задач
| Задание | В одном из гидроксидов олова массовая доля элементов равна: олова – 63,6%; кислорода – 34,2%; водорода – 2,2%. Определите формулу этого гидроксида. |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле: |
ω (Х) = n × Ar (X) / M (HX) × 100%.
Обозначим количество моль элементов, входящих в состав соединения за «х» (олово), «у» (кислород) и «z» (водород). Тогда, мольное отношение будет выглядеть следующим образом (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел):
x:y:z = ω(Sn)/Ar(Sn) : ω(O)/Ar(O) : ω(H)/Ar(H);
x:y:z = 63,6/119 : 34,2/16 : 2,1/1;
x:y:z = 0,53 : 2,14 : 2,1 = 1 : 4 : 4.
Значит формула гидроксида олова имеет вид Sn(OH)4.
| Задание | Определите массовую долю гидроксида бария в растворе, полученном при смешивании воды массой 50 г и оксида бария массой 1,2 г. |
| Решение | Массовая доля вещества Х в растворе рассчитывается по следующей формуле: |
ω (Х) = m(X) / msolution × 100%.
Масса раствора складывается из масс растворенного вещества и растворителя:
msolution = m(H2O) + m(BaO) = 50 + 1,2 = 51,2 г.
Запишем уравнение реакции получения гидроксида бария:
Рассчитаем количества моль исходных веществ:
n(H2O) = 50 / 18 = 2,8 моль.
n(BaO) = 1,2 / 153 = 0,008 моль.
Расчет ведем по соединению, находящемуся в недостатке (оксид бария). Согласно уравнению
n(BaO) :n(Ba(OH)2) = 1:1, т.е. n(Ba(OH)2) = n(BaO) = 1,04 моль.
Тогда масса образовавшегося гидроксида бария будет равна:
m(Ba(OH)2) = 0,008 ×171 = 1,368 г.
Найдем массовую долю гидроксида бария в растворе:
ω (Ba(OH)2) = 1,368 / 51,2 × 100% = 2,67%.
Копирование материалов с сайта возможно только с разрешения
администрации портала и при наличие активной ссылки на источник.
Оксиды
Определение оксидов
Оксиды — это сложные вещества, состоящие из двух химических элементов (т. е. бинарные соединения), один из которых — кислород в степени окисления −2.
Общая формула оксидов: ЭxOy, где Э – химический элемент, а x и y — индексы, определяемые степенью окисления химических элементов.
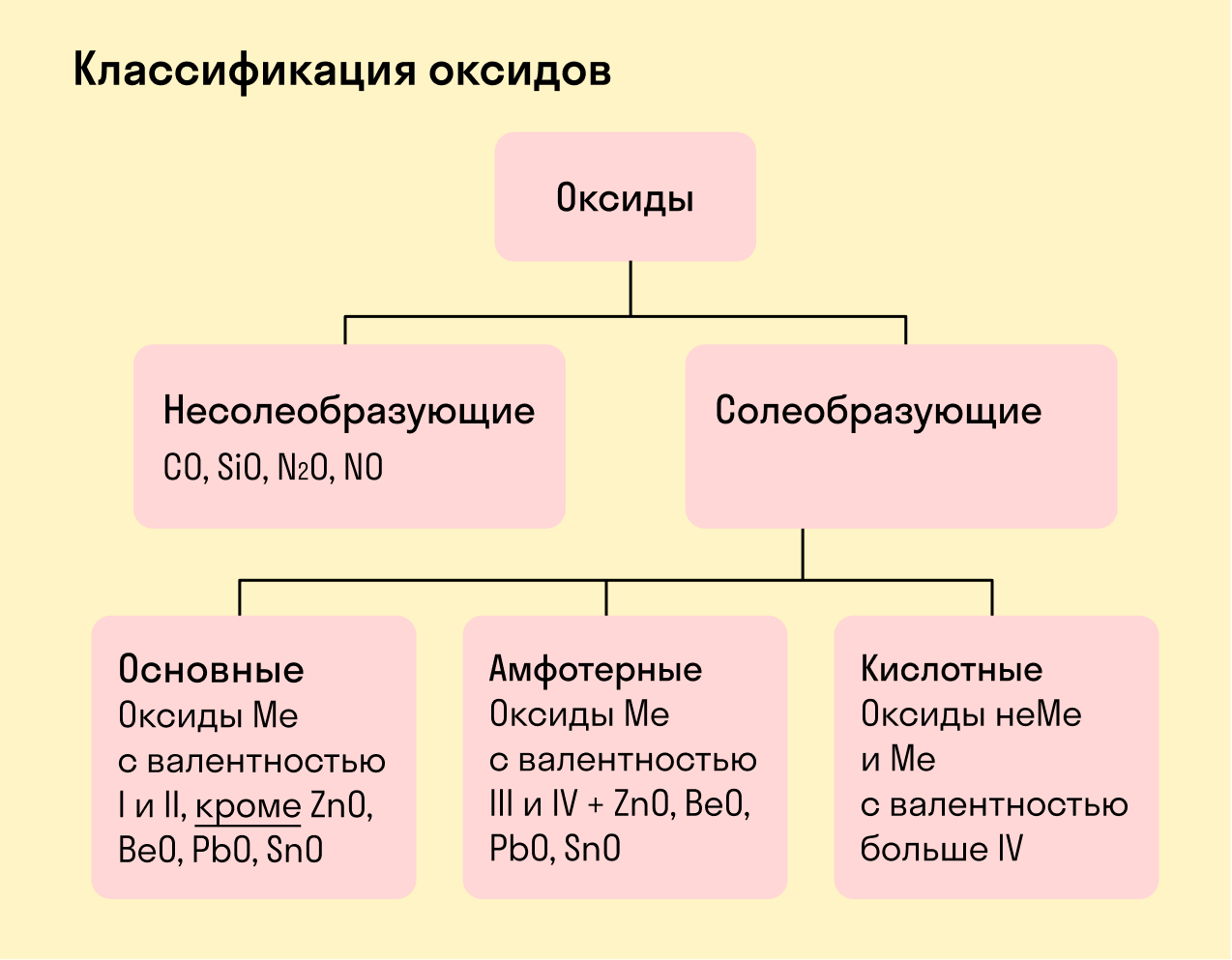
Виды оксидов
Все оксиды делятся на солеобразующие и несолеобразующие.
Несолеобразующие оксиды — это оксиды, которые не взаимодействуют с кислотами и щелочами, то есть не способны образовать соли.
К несолеобразующим оксидам относят: CO, SiO, N2O, NO.
Солеобразующие оксиды — это оксиды, которые взаимодействуют с кислотами и щелочами с образованием солей.
Солеобразующие оксиды делятся на три группы:
Основные оксиды — это оксиды, образованные металлами со степенью окисления +1 или +2.
Примеры основных оксидов: Na +1 2O, Ca +2 O, Ba +2 O.
Амфотерные оксиды — оксиды, образованные металлами со степенью окисления +3 или +4.
К амфотерным оксидам относят также: ZnO, BeO, PbO, SnO.
Несмотря на то, что эти металлы проявляют степень окисления +2 в данных соединениях, их оксиды проявляют амфотерные свойства.
Примеры амфотерных оксидов: Al +3 2O3, Fe2 +3 O3.
Кислотные оксиды — оксиды, образованные металлами с валентностью V и более или неметаллами с любой валентностью (за исключением несолеобразующих оксидов, то есть CO, SiO, N2O, NO).
Примеры кислотных оксидов: S +6 O3, N2 +5 O5, Mn2 +7 O7.
Если один и тот же химический элемент образовывает несколько оксидов, то с увеличением степени окисления основные свойства оксидов ослабевают и усиливаются кислотные.
CrO (оксид хрома (II)) — проявляет основные свойства;
Cr2O3 (оксид хрома (III)) — проявляет амфотерные свойства;
CrO3 (оксид хрома (VI)) — проявляет кислотные свойства.
Закрепим знания о типах оксидов, изучив схему:
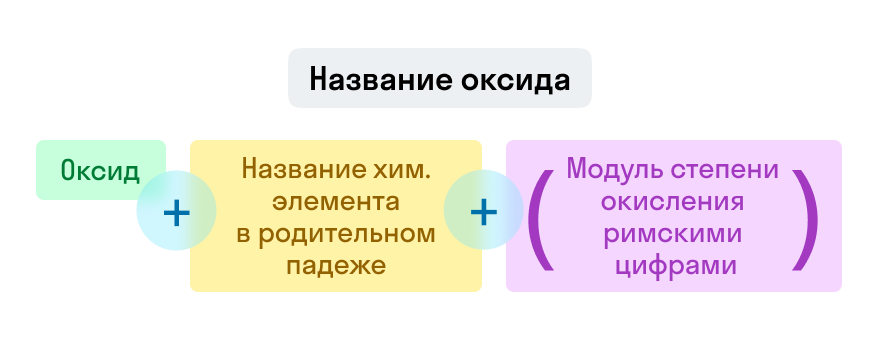
Номенклатура оксидов
Названия оксидов строятся по систематической номенклатуре следующим образом:
Указываем название второго химического элемента в родительном падеже.
Если этот элемент имеет переменную валентность, то указываем валентность элемента в этом соединении в скобках римской цифрой.
Примеры названий оксидов:
Fe2O3 — оксид железа (III). Читается: феррум два о три.
Na2O — оксид натрия. Читается: натрия два о.
SO3 — оксид серы (VI). Читается: эс о три.
До появления систематической номенклатуры вещества называли по присущим им специфическим свойства (цвету, запаху и т. д.). Такой способ названия веществ — тривиальная номенклатура. Некоторые названия используются и сейчас.
Названия некоторых оксидов: таблица
Химическая формула оксида
Бытовое (тривиальное название)
Возможное научное название
Химические свойства основных оксидов
1. Взаимодействие с водой
С водой способны реагировать оксиды тех металлов, которым соответствуют растворимые гидроксиды. То есть с водой реагируют только оксиды щелочных и щелочноземельных металлов.
Основный оксид + вода = основание
Оксид магния взаимодействует с водой только при нагревании.
2. Взаимодействие с кислотными оксидами и кислотами
Основные оксиды, соответствующие щелочам, взаимодействуют со всеми кислотными оксидами и кислотами. Оксиды неактивных металлов взаимодействуют только с кислотными оксидами, соответствующими сильным кислотам, или с сильными кислотами.
Основный оксид + кислотный оксид = соль
Основный оксид + кислота = соль + вода
3. Взаимодействие с амфотерными оксидами
В эту реакцию могут вступать только основные оксиды щелочных или щелочноземельных металлов. При сплавлении двух оксидов образуется соль.
Основный оксид + амфотерный оксид = соль
Как составлять такие соли: металл в этой соли берем из основного оксида, а кислотный остаток из амфотерного оксида (они проявляют более кислотные свойства).
Химические свойства кислотных оксидов
1. Взаимодействие с водой
Кислотные оксиды взаимодействуют с водой с образованием соответствующих кислот. За исключением SiO2, которому соответствует нерастворимая кремниевая кислота.
Кислотный оксид + вода = кислота
2. Взаимодействие с основными оксидами и щелочами
Кислотные оксиды сильных кислот способны взаимодействовать с любыми основными оксидами или основаниями.
Кислотный оксид + основный оксид = соль
Кислотный оксид + основание = соль + вода
Кислотные оксиды, соответствующие слабым кислотам (такие как CO2, SO2), способны взаимодействовать с основными оксидами, соответствующим щелочам, а также с щелочами.
3. Взаимодействие с амфотерными оксидами и гидроксидами
С амфотерными оксидами в реакцию вступают кислотные оксиды — как правило, сильных кислот.
Кислотный оксид + амфотерный оксид = соль
Кислотный оксид + амфотерный оксид = соль + вода
Химические свойства амфотерных оксидов
1. Взаимодействие с водой
Амфотерные оксиды не взаимодействуют с водой — даже при нагревании!
Амфотерный оксид + вода ≠
2. Взаимодействие с кислотными оксидами и кислотой
Амфотерные оксиды взаимодействуют только с сильными и средними кислотами и их оксидами.
Амфотерный оксид + кислотный оксид = соль
Амфотерный оксид + кислота = соль + вода
3. Взаимодействие с основными оксидами
Амфотерные оксиды взаимодействуют только с теми оксидами, которые соответствуют щелочам. Реакция протекает только в расплаве, так как в растворе такие оксиды взаимодействуют преимущественно с водой с образованием щелочей.
Амфотерный оксид + основный оксид (расплав) = соль
4. Взаимодействие со щелочами
Продукты взаимодействия амфотерных оксидов со щелочами зависят от условий проведения реакции. В растворе образуются комплексные соли, а при сплавлении – средние соли.
Амфотерный оксид + щелочь (раствор) + вода = комплексная соль
Амфотерный оксид + щелочь (расплав) = средняя соль + вода
Получение оксидов
1. Окисление металлов
Почти все металлы окисляются кислородом до устойчивых степеней окисления.
Металлы с переменной степенью окисления, как правило, образуют соединения в степени окисления +3:
При взаимодействии щелочных металлов (элемента IA группы) образуются пероксиды Me2O2 или надпероксиды MeO2, где Ме — щелочной металл.
2. Окисление простых веществ — неметаллов
При окислении неметаллов в избытке кислорода, как правило, образуются высшие оксиды (это оксиды, в которых неметалл проявляют высшую степень окисления):
При недостаточном количестве кислорода образуются оксиды неметаллов в промежуточной степени окисления:
Существуют и исключения. Например, сера окисляется лишь до оксида серы (IV) даже в избытке кислорода:
Или азот, который взаимодействует с кислородом только при температуре 2 000̊С или под действием электрического разряда с образованием оксида азота (II):
3. Разложение гидроксидов
Некоторые кислоты и гидроксиды неустойчивы и самопроизвольно разлагаются по схеме:
Гидроксид (кислота) = оксид + вода
Оксиды тяжелых металлов (нерастворимые гидроксиды) и кремниевая кислота разлагаются при нагревании по той же самой схеме.
4. Окисление сложных веществ
Сложные бинарные (состоящие из двух химических элементов) соединения окисляются с образованием двух оксидов этих элементов в устойчивых степенях окисления.
Также оксиды получают разложением солей, например, карбонатов, нитратов сульфатов и т. д.
Мы узнали, какие вещества в химии называют оксидами, какие бывают оксиды, а также разобрали свойства каждого вида. Осталось подкрепить теорию практикой — а сделать это можно на курсах по химии в онлайн-школе Skysmart!