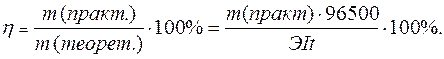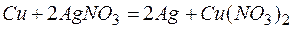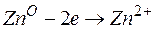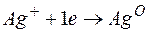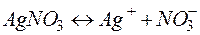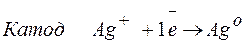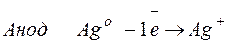Что такое выход по току химия
Законы Фарадея. Выход продукта по току
Количество веществ, образующихся при электролизе на электродах, можно рассчитать, пользуясь двумя законами электролиза, установленными Фарадеем в 1833 г. которые с учетом современной терминологии можно сформулировать в следующем виде:
1) количество вещества, испытавшего электрохимические превращения на электроде, прямо пропорционально количеству прошедшего электричества;
2) массы прореагировавших на электродах веществ при постоянном количестве электричества относятся друг к другу как молярные массы их эквивалентов.
Для расчетов используют математическое выражение обобщенного закона Фарадея:
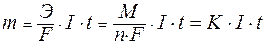
| где: | Э – эквивалентная масса вещества (молярная масса эквивалента); F– постоянная Фарадея, равная 96500 Кл/моль;. I – сила тока, А; t – время проведения электролиза, с; М – молярная масса вещества; n – число отданных или принятых электронов; К – электрохимический эквивалент вещества. |
Практический расход тока при электролизе вследствие протекания побочных процессов (взаимодействие полученных веществ с электродом или электролитом) превышает его количество, рассчитанное согласно закону Фарадея. Следовательно, практическая масса полученных веществ отличается от теоретически рассчитанной. Отношение массы практически полученного вещества к теоретически рассчитанной массе, выраженное в процентах, называется выходом вещества по току:
Примеры решения типовых задач.
Пример 1.Ряд активности металлов, электродных потенциалов.
Задача 1. Медная пластинка массой 10 г была погружена в раствор нитрата серебра, затем промыта водой и высушена. Масса ее оказалась равной 11,0 г. Сколько серебра из раствора выделилось на пластинке?
Решение. Для решения этой задачи необходимо знать стандартные электродные потенциалы металлов, т.е. место их в ряду напряжений (ряду активности металлов Бекетова).
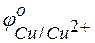
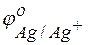
Из этих положительных потенциалов стандартный электродный потенциал меди менее положителен, следовательно, пойдёт реакция вытеснения:
Для того чтобы вычислить количество серебра, выделившегося на медной пластинке, надо помнить, что медная пластинка в этой реакции и сама растворяется, теряя в массе.
Обозначим количество растворившейся меди через x г, тогда масса медной пластинки с учётом её растворения будет (10-х) г, масса выделившегося серебра на основе реакции:
64,0 г Cu – 2 ∙ 108 г Ag
216х =64+64х, 152x=64, x=0,42 г.
Таким образом, в течение реакции растворилось 0,42 г меди и выделилось 1,0 + 0,42 = 1,42 г серебра.
Пример 2.Работа гальванического элемента и расчёт ЭДС.
Задача 1. Напишите уравнения реакций, происходящих при работе гальванического элемента, состоящего из цинковой и серебряной пластин, опущенных в растворы своих солей с концентрацией катионов, равной 1 моль/л.
Решение. Стандартные электродные потенциалы цинкового и серебряного электродов соответственно равны:
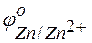
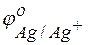
Металл, имеющий более отрицательное значение электродного потенциала при работе гальваничеcкого элемента, является анодом. В данном случае протекают реакции:
т.е. цинк, являясь анодом, растворяется при работе гальваничеcкого элемента, а серебро осаждается в виде металла на катоде. ЭДС гальванического элемента равна
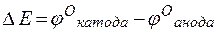
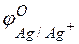
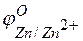
Пример 3. Зависимость электродных процессов от концентрации.
Задача 1. Рассчитайте, чему равна ЭДС элемента, составленного из медной и магниевой пластин, опущенных в растворы своих солей, если концентрация катиона у анода равна 0,1 моль/л, а у катода – 0,001 моль/л.
Решение. Стандартные электродные потенциалы магниевого и медного электродов соответственно равны:
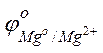
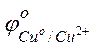
Следовательно, анодом будет магниевый электрод, катодом – медный. Электродный потенциал металла, опущенного в раствор с любой концентрацией катиона в растворе, определяют по формуле Нернста:
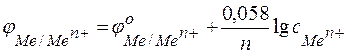
где: с – концентрация катиона, моль/л;
п – число электронов, принимающих участие в реакции.
Отсюда потенциал магниевого электрода
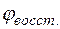
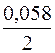
Потенциал медного электрода
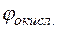
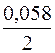
Тогда для гальванического элемента
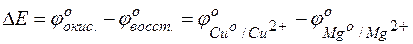
Пример 4. Определение возможности протекания реакции в гальвани-ческом элементе.
Задача 1. Исходя из величины стандартных электродных потенциалов и значения энергии Гиббса ΔG о 298, укажите, можно ли в гальваническом элементе осуществить следующую реакцию:
Решение. Надо составить схему гальванического элемента, отвечающего данной реакции. В этой реакции происходит восстановление ионов кадмия и окисление атомов железа:
Пользуясь таблицей стандартных электродных потенциалов, определяем ЭДС этого гальваничекого элемента:
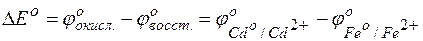
Изменение величины энергии Гиббса с величиной ЭДС связано соотношением:
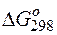
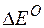
где: 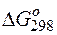
n – число электронов, принимающих участие в реакции;
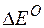
Находим 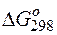
Так как 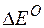
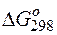
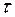
| 96500 Кл – 32 г |
| 1800 Кл – х г |
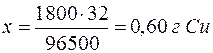 |
Пример 6. Определение электрохимического эквивалента и выхода по току.
Решение. Нитрат серебра диссоциирует:
Процессы, протекающие на электродах:
Молярная масса эквивалента Ag О =108 г/моль.
Определяем массу серебра, которая выделилась бы теоретически при прохождении через раствор данного количества электричества:
Закон фарадея электролиз выход по току
Первый закон
Если пропускать через раствор медного купороса электрический ток в течение определённого количества времени, то на катоде выделяется небольшое количество меди. Однако если пустить ток большей силы, за такое же количество времени на катоде образуется большее количество меди. При увеличении времени и одинаковой силе тока также увеличивается количество меди.
Рис. 1. Майкл Фарадей.
Фарадей установил взаимосвязь массы вещества, силы тока и времени. Математически эта взаимосвязь выражается следующим образом:
Электрохимический эквивалент – это масса вещества, образованная при прохождении через электролит тока в 1 А за одну секунду. Выражается как соотношение массы вещества к количеству электричества или г/Кл.
Произведение силы тока и времени выражает количество электричества: q = It. Это электрический заряд, измеряемый в кулонах (один ампер к одной секунде). Электрический заряд отражает способность тела быть источником электромагнитного поля и принимать участие в электромагнитном взаимодействии.
Соответственно, уравнение Фарадея приобретает вид:
Рис. 2. Первый закон Фарадея.
Первый закон электролиза Фарадея: масса вещества, выделившегося при электролизе, прямо пропорциональна количеству электрического тока, пропущенного через электролит.






ЭДС индукции. Закон электромагнитной индукции
Выше рассмотренные опыты показали, что в замкнутом контуре возникает индукционный ток при изменении магнитного потока, пронизывающего поверхность, ограниченную контуром. Как известно, ток в проводнике возникает в том случае, если на свободные заряды проводника действуют сторонние силы. Работу этих сил при перемещении единичного заряда вдоль замкнутого проводника называют электродвижущей силой. Следовательно, при изменении магнитного потока через поверхность, ограниченную контуром, в нем появляются сторонние силы (природу их выясним ниже: ЭДС индукции в движущихся проводниках), действие которых характеризуется ЭДС, называемой ЭДС индукции
Как показывает опыт, значение индукционного тока (а значит, и \(
\varepsilon_i\)) не зависит от причины изменения магнитного потока (изменяется ли площадь, ограниченная контуром, или его ориентация в пространстве, изменяется ли индукция магнитного поля при перемещении его источников или за счет изменения среды и т.д.). Существенное
значение имеет лишь
скорость изменения магнитного потока
\(
\frac <\Delta \Phi><\Delta t>\) (так, стрелка гальванометра в опытах Фарадея отклоняется тем больше, чем быстрее вдвигается магнит в катушку).
\(
среднее значение ЭДС индукции в проводящем контуре пропорционально скорости изменения магнитного потока через поверхность, ограничен ную контуром. Мгновенное значение ЭДС индукции равно взятой с противоположным знаком первой производной от магнитного потока по времени, т.е.
\mathcal h \varepsilon_i \mathcal i = <\Phi>‘(t)\).
Советуем изучить Варианты подсветки потолка в помещениях
Знак «-» учитывает правило Ленца, согласно которому при увеличении магнитного потока \(
(\frac <\Delta \Phi> <\Delta t>> 0)\) ЭДС индукции отрицательная \(
Сила индукционного тока в замкнутом контуре рассчитывается по закону Ома\ где R
Индукционный ток возникает не только в линейных проводниках, но и в массивных сплошных проводниках, помещенных в переменное магнитное поле. В соответствии с законом электромагнитной индукции любые изменения магнитного потока, пронизывающего проводящее тело, сопровождаются возникновением в нем индукционных токов. Эти токи оказываются замкнутыми в толще проводника и поэтому называются вихревыми (а также токами Фуко)
. Токи Фуко, как и индукционные токи в линейных проводниках, подчиняются правилу Ленца: их магнитное поле направлено так, чтобы противодействовать изменению магнитного потока, индуцирующего вихревые токи. Токи Фуко можно обнаружить на опыте с маятником (проводящей пластиной), колеблющемся в зазоре между полюсами электромагнита. До включения маятник совершает практически незатухающие колебания. При пропускании тока через катушку электромагнита маятник испытывает сильное торможение и очень быстро останавливается. Торможение маятника объясняется действием магнитного поля на индукционные токи, возникающие в пластине при ее движении в магнитном поле. Если в пластине сделать разрезы, то вихревые токи ослабляются и торможение почти отсутствует. Этот факт торможения используется для успокоения подвижных частей различных приборов.
Токи Фуко вызывают нагревание проводников (якоря генераторов и сердечников трансформаторов), выделяемая токами Фуко теплота используется в индукционных металлургических печах и в других случаях.
По закону Фарадея (1) определяется ЭДС индукции, возникающая и в движущемся проводнике, и в неподвижном (см. опыты, описанные в разделе Электромагнитная индукция). Но механизм происхождения ЭДС индукции в этих случаях различен.
Второй закон
Фарадей, пропуская электрический ток одинаковой силы через различные электролиты, заметил, что массы веществ на электродах неодинаковы. Взвесив выделившиеся вещества, Фарадей сделал вывод, что вес зависит от химической природы вещества. Например, на каждый грамм выделенного водорода приходилось 107,9 г серебра, 31,8 г меди, 29,35 г никеля.
На основе полученных данных Фарадей вывел второй закон электролиза: для определённого количества электричества масса химического элемента, образовавшегося на электроде, прямо пропорциональна эквивалентной массе элемента. Она равна массе одного эквивалента – количеству вещества, реагирующему или замещающему 1 моль атомов водорода в химических реакциях:
Для выделения одного моля эквивалента затрачивается одинаковое количество электричества – 96485 Кл/моль. Это число называется числом Фарадея и обозначается буквой F.
Согласно второму закону, электрохимический эквивалент прямо пропорционален эквивалентной массе вещества:
k = (1/F) μeq или k = (1/zF)μ.
Рис. 3. Второй закон Фарадея.
Два закона Фарадея можно привести к общей формуле: m = (q / F) ∙ (μ/z).
История
В 1820 году Ганс Христиан Эрстед показал, что протекающий по цепи электрический ток вызывает отклонение магнитной стрелки. Если электрический ток порождает магнетизм, то с магнетизмом должно быть связано появление электрического тока. Эта мысль захватила английского ученого М. Фарадея. «Превратить магнетизм в электричество», — записал он в 1822 году в своём дневнике. Многие годы настойчиво ставил он различные опыты, но безуспешно, и только 29 августа 1831 года наступил триумф: он открыл явление электромагнитной индукции. Установка, на которой Фарадей сделал своё открытие, состояла из кольца из мягкого железа примерно 2 см шириной и 15 см диаметром. На каждой половине кольца было намотано много витков медной проволоки. Цепь одной обмотки замыкала проволока, в её витках находилась магнитная стрелка, удаленная настолько, чтобы не сказывалось действие магнетизма, созданного в кольце. Через вторую обмотку пропускался ток от батареи гальванических элементов. При включении тока магнитная стрелка совершала несколько колебаний и успокаивалась; когда ток прерывали, стрелка снова колебалась. Выяснилось, что стрелка отклонялась в одну сторону при включении тока и в другую, когда ток прерывался. М. Фарадей установил, что «превращать магнетизм в электричество» можно и с помощью обыкновенного магнита.
Советуем изучить Выбираем вместе ночник для детской
В это же время американский физик Джозеф Генри также успешно проводил опыты по индукции токов, но пока он собирался опубликовать результаты своих опытов, в печати появилось сообщение М. Фарадея об открытии им электромагнитной индукции.








М. Фарадей стремился использовать открытое им явление, чтобы получить новый источник электричества.
Что мы узнали?
Фарадей, проводя реакцию электролиза разных веществ, вывел два закона. Согласно первому закону, масса вещества, осевшего на электрод, прямо пропорциональная количеству электричества, пропущенного через электролит: m = kq. Второй закон отражает взаимосвязь электрохимического эквивалента и эквивалентной массы вещества: k = (1/F) μeq. Электрохимический эквивалент – количество выделившегося вещества при прохождении единицы электричества. Эквивалентная масса – количество вещества, реагирующее с 1 молем водорода.
Процесс электролиза
Чтобы ясно понять суть законов Фарадея, следует разобраться с процессом, для которого они применяются. Электролизом принято называть разложение соединений в их расплавах или растворах под действием проходящего электрического тока. Поскольку речь идет об электрохимическом процессе, то в его результате происходит два типа реакций: окисление и восстановление. Для их существования необходимо наличие двух электродов: катода и анода.
Два электрода
Если к отрицательной клемме электрической батареи присоединить электрод, то называться он будет катодом. Второй электрод, который подсоединяется к положительному полюсу батареи, — это анод. Оба слова имеют древнегреческие корни:
Часто школьники и студенты путаются в знаке заряда этих электродов. Чтобы исключить ошибки, существует простой метод запоминания: катионы или положительные ионы вещества всегда движутся к катоду, то есть он является отрицательным электродом. В свою очередь, анионы или отрицательные ионы направляются под действием электрического поля к аниону, поэтому он является положительным.
Имеется еще один способ определения знака электродов. Поскольку на каждом из них проходит один из двух противоположных химических процессов (окисление или восстановление), то этот факт можно использовать таким образом:
Окислительно-восстановительные реакции
Именно благодаря им происходит выделение или растворение веществ на электродах. Реакция окисления часто приводит к образованию пузырьков газов на аноде. Процессы же восстановления на катоде сопровождаются присоединением к катионам электронов и образованием твердых веществ из растворов и расплавов. Следует для ясности привести несколько примеров:
Тип конкретной химической реакции на электродах определяется степенью «легкости» ее осуществления с энергетической точки зрения.
Применение в промышленности
Практически все активные химические элементы не содержатся в природе в чистом виде. Ввиду этого применение электролиза является достаточно полезным методом для получения многих металлов и газов:
Лекция 1. Законы Фарадея
Описание
4. Выход вещества по току.
5.Способы определения выхода по току при использовании постоянного и импульсного тока.
6.Второй закон Фарадея.
7.Кажущиеся случаи отклонения от законов Фарадея.
Оглавление
1. Первый закон Фарадея
Первый закон Фарадея устанавливает связь между количеством прошедшего через электрохимическую систему электричества и количеством прореагировавшего вещества.
Математически этот закон выражается уравнением:
2. Электрохимический эквивалент.
Электрохимический эквивалент представляет собой количество вещества, прореагировавшего в результате протекания единицы количества электричества.
Электрохимический эквивалент может быть получен расчетным путем, если известна электрохимическая реакция, т.е. исходные вещества и ее продукты. Уравнение для расчета электрохимического эквивалента выглядит следующим образом:

где М – молярная масса реагента, n – число электронов, участвующих в реакции, F – число или постоянная Фарадея: F = 96486 ≈96500 Кл/моль.
3. Кулонометры. Классификация кулонометров.
В серебряном кулонометре определяется масса серебра, выделяющаяся
В весовых кулонометрах (к ним относятся серебряные и медные) количество прошедшего в них электричества рассчитывается по изменению массы катода или анода. В объемных кулонометрах расчет производится на основании измерения объема получающихся веществ (газа в водородном кулонометре, жидкой ртути в ртутном кулонометре). В титрационныхкулонометрах количествоэлектричества определяется по данным титрования веществ, образующихся в растворе в результате электродной реакции.
Этиловый спирт добавляют в электролит для получения более мелкокристаллических, компактных катодных осадков и с целью предотвращения окисления медных электродов кулонометра.
О количестве прошедшего электричества судят по изменению массы катода, до и после электролиза.
катодом, а анод готовится из чистого серебра.
В качестве электролита в серебряном кулонометре используется нейтральный или слабокислый 30% раствор нитрата серебра.
Газовый водородно-кислородный кулонометр применяется для приближенных измерений малых количеств электричества. В нем измеряют общий объем водорода и кислорода, выделяющихся при электролизе водного раствора H2SO4или NaOH, а из этой величины вычисляют количество прошедшего электричества. Применяют эти кулонометры сравнительно редко, т.к. точность их небольшая, а в работе они менее удобны, чем весовые кулонометры.
Наиболее распространенные из титрационныхкулонометров – йодный
Йодныйкулонометр представляет собой сосуд с разделенными катодным и анодным пространствами платиновоиридиевыми электродами. В анодное отделение вводят концентрированный раствор иодида калия с добавлением соляной кислоты, в катодное отделение – раствор соляной кислоты. При пропускании тока на аноде выделяется йод, который затем титруют тиосульфатом натрия (Na2S2O3). По результатам титрования рассчитывают количество электричества.
4. Выход по току
Часто на электроде протекает не одна электрохимическая реакция, а несколько самостоятельных параллельных реакций. Например, при выделении Zn из кислого раствора ZnSO4наряду с разрядом ионов Zn:
протекает реакция восстановления ионов гидроксония: 2Н3О + +2ē → Н2 + 2H2O.
Если на электроде протекает несколькопараллельных электрохимических реакций, то I закон Фарадея будет справедлив для каждой из них.
Для практических целей, для того, чтобы учесть какая доля тока или количества прошедшего через электрохимическую систему электричества расходуется на каждую конкретную реакцию введено понятие выхода вещества по току.
Таким образом, ВТ позволяет определить часть количества прошедшего через электрохимическую систему электричества, которая приходится на долю данной электрохимической реакции.
Знание ВТ необходимо, как при решении теоретических вопросов: например, при построении парциальных поляризационных кривых и выяснении механизма электрохимической реакции, так и в практике электроосаждения металлов, неметаллов, сплавов, с целью оценки эффективности технологической операции. ВТ на практике чаще всего определяют делением практической массы вещества на теоретическую массу, определенную по закону Фарадея.
5. Способы определения ВТ при использовании импульсного тока
Если же через границу раздела фаз протекает импульсный ток, то при определении ВТ возникают большие трудности. Единой методики или прибора для определения ВТ при импульсномэлектролизе не существует. Сложность определения ВТ в условиях импульсногоэлектролиза обусловлена тем, что проходящий через систему ток расходуется не только на электрохимическую реакцию, но и на заряжение двойного электрического слоя. Электрический ток, проходящий через границу раздела и вызывающий электрохимическое превращение, называется часто фарадеевским током. Ток заряжения расходуется на заряжение двойного электрического слоя, реорганизацию растворителя, самого реагента, т.е. на все на то, что создает условия для протекания электрохимической реакции, поэтому выражение для общего тока, проходящего через электрохимическую систему, будет выглядеть следующим образом:
I = Iз + Iф, где Iз – ток заряжения, Iф – фарадеевский ток.
Если не требуется определения абсолютных значений ВТ, то в качестве критерия оценки эффективности импульсного электролиза можно использовать отношения количества электричества, затраченного на растворение осадка к количеству электричества, затраченного на его формирование.
6. Второй закон Фарадея.
Второй закон Фарадея является непосредственным следствием первого закона. Во втором законе Фарадея отражена связь, существующая между количеством прореагировавшего вещества и его химической природой.
Согласно второму закону Фарадея:
Математически этот закон выражается уравнением:
Второй закон Фарадея является непосредственным следствием первого закона. Во втором законе Фарадея отражена связь, существующая между количеством прореагировавшего вещества и его химической природой.
Согласно второму закону Фарадея:
7. Кажущиеся случаи отклонения от законов Фарадея
Количество образующегося газообразного хлора всегда меньше, чем это следует по закону Фарадея из-за того, что Cl2растворяется в электролите и вступает в реакцию гидролиза:
Если учесть массу хлора, прореагировавшего с водой, получим результат, соответствующий рассчитанному по закону Фарадея.
Часто на электроде протекает не одна электрохимическая реакция, а несколько самостоятельных параллельных реакций. Например, при выделении Zn из кислого раствора ZnSO4наряду с разрядом ионов Zn:
протекает реакция восстановления ионов гидроксония: 2Н3О + +2ē → Н2 + 2H2O.
Если на электроде протекает несколько параллельных электрохимических реакций, то I закон Фарадея будет справедлив для каждой из них.