Что такое вторичный иммунный ответ
Что такое вторичный иммунный ответ
На скорость образования антител ( АТ ) влияет ряд факторов: доза Аг (сила Аг-воздействия), частота Аг-стимуляции и состояние иммунной системы индивида (то есть его иммунный статус). Если организм впервые встречается с Аг, то развивается первичный иммунный ответ, а при повторном контакте — вторичный ответ (рис. 10-11).
Первичный иммунный ответ
Появлению антител ( АТ ) предшествует латентный период продолжительностью 3
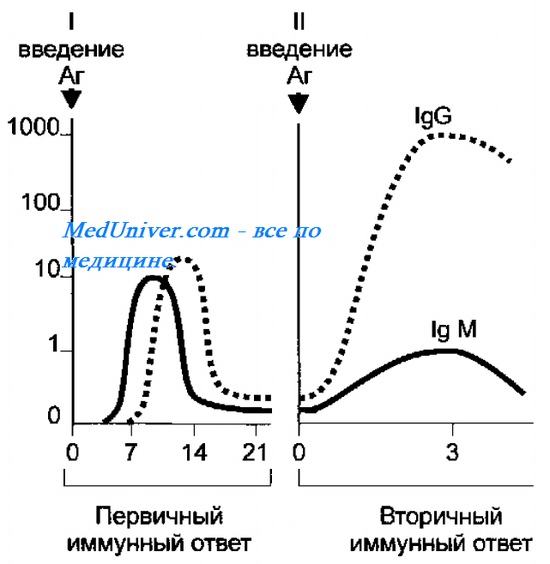
Вторичный иммунный ответ
После антигенной стимуляции часть В- и Т-лимфоцитов циркулирует в виде клеток памяти. Особенности вторичного иммунного ответа — высокая скорость антителообразования, появление максимальных титров антител ( АТ ) и длительное (иногда многолетнее) их циркулирование.
Основные характеристики вторичного имунного ответа:
• образование антител ( АТ ) индуцируется значительно меньшими дозами Аг;
• индуктивная фаза сокращается до 5-6 ч;
• среди антител ( АТ ) доминируют IgG с большой аффинностью, пик их образования наступает раньше (3-5 сут);
• Антитела ( АТ ) образуются в более высоких титрах и циркулируют в организме длительное время.
— Вернуться в оглавление раздела «Микробиология.»
Несколько вопросов про иммунитет
Иммунитет (лат. immunitas — освобождение) – способ защиты организма путем распознавания «чужих» с последующим их удалением. «Чужих» принято называть антигенами.
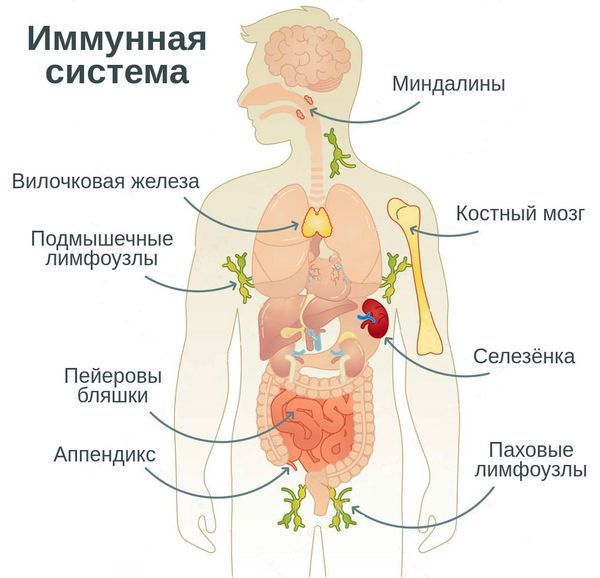
Иммунная система – совокупность лимфоидных органов, тканей и клеток, обеспечивающих защитную реакцию иммунитета для поддержания целостности организма. Иммунная система защищает нас от различных инфекций, позволяет эффективно противостоять болезням и быстрее выздоравливать, поддерживая организм в хорошей форме.
Первая линия защиты организма — это кожа и слизистые оболочки, а также секреты слизистых, слюна и желудочный сок. На этом уровне основная задача — не пропустить врага внутрь. Если же антиген проник во внутреннюю среду организма, сразу включается воспалительный ответ.
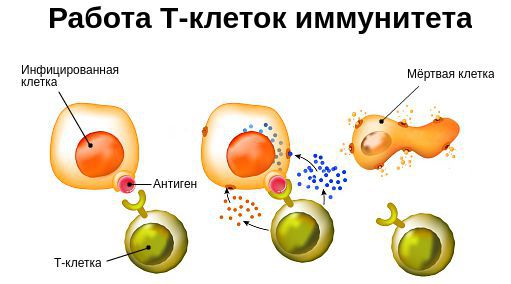
Клеточный иммунитет – не связан с образованием белков (антител), а связан с образованием специализированных клеток, реагирующих с антигенами (чужеродными веществами) посредством его связывания и последующего разрушения.
Иммунологическая память – способность организма сохранять информацию об антигене («чужих»), с которым он ранее встречался. Для нее характерно, что вторичный иммунный ответ возникает быстрее и находится на более высоком уровне.
Выделяют 4 стадии первичного иммунного ответа. На первой стадии (первые 3-4 сут.), белки (антитела) к соответствующему антигену («чужому») в сыворотке отсутствуют. На второй стадии появляются IgM (иммуноглобулины М), а спустя 10—14 сут. после контакта с антигеном появляются IgG (иммуноглобулины G ). На третьей стадии уровень белков (антител) остается постоянным. Четвертая стадия первичного иммунного ответа обычно растягивается на месяцы. Она характеризуется постепенным снижением уровня белков (антител). Такая картина характерна для коронавирусной инфекции.
Вторичный иммунный ответ развивается при повторном контакте с антигеном. Антитела, главным образом IgG, появляются быстрее и в более высоком титре, чем при первичном иммунном ответе.
Врождённый иммунитет — способность организма обезвреживать чужеродные агенты с самого рождения. Это система защиты, которую мы получаем с рождением. Он существует изначально, не требует предварительного воздействия антигена (т. е. иммунологической памяти). Таким образом, он немедленно отвечает на чужеродные вещества. Он реагирует не на конкретные специфические антигены, а на определённые классы антигенов, характерные для патогенных организмов. (неспецифичный)
Приобретенный иммунитет – способность организма обезвреживать чужеродные вещества, которые уже попадали в организм ранее, т. е. ему требуется время для развития после первичной встречи с новым чужеродным веществом. Далее следует быстрый ответ. Система запоминает предшествующие контакты и является антиген-специфичной.
Так почему у нас нет иммунитета, например, к ОРВИ? На самом деле он есть, просто эти вирусы очень быстро мутируют, поэтому помнящие вирус В-лимфоциты совершенно бесполезны. Организму приходится запускать процесс заново при контакте с новым подвидом вируса. Зато мы редко болеем дважды одним и тем же конкретным подвидом вируса именно благодаря лимфоцитам с правильными антителами.
Активный может возникать после перенесения инфекционного заболевания или введения в организм вакцины. Образуется через 1-2 недели и сохраняется годами или десятками лет. Пассивно приобретённый возникает при передаче готовых антител от матери к плоду через плаценту или с грудным молоком, обеспечивая в течение нескольких месяцев невосприимчивость новорожденных к некоторым инфекционным заболеваниям. Такой иммунитет можно создать и искусственно, вводя в организм иммунные сыворотки, содержащие антитела против соответствующих микробов или токсинов
Коллективный иммунитет – это ситуация, при которой большинство людей устойчивы к вирусу: либо они переболели, либо были привиты вакциной. Для каждой инфекции он достигается по-разному. Для коронавирусной инфекции достигается путем иммунизации населения.
Вакцина — медицинский препарат, содержащий ослабленные или убитые микроорганизмы. Вакцина вводится абсолютно здоровому человеку для предотвращения заболевания в будущем.
Сыворотка — медицинский препарат плазмы крови, содержащий готовые антитела к определённому патогену (заражающему микроорганизму). Сыворотку получают из крови заражённого данным заболеванием животного (коровы, лошади и т. п.) или человека. Сыворотка с чужими антителами вводится заболевшему человеку в случае, когда организм не способен произвести достаточное количество антител. Из сывороток получают иммуноглобулины путем очистки и концентрации.
Все хотят волшебных препаратов, однако стоит понять, что нужно создать условия, чтобы иммунитет мог спокойно работать, не стоит вмешиваться в его работу. Условия, при которых иммунной системе будет комфортно выполнять свою функцию, достаточно просты: здоровый образ жизни. Необходимо спать по ночам и высыпаться, потому что именно ночью во сне образуются клетки иммунной системы. Так же необходимо полноценное питание, которое становится строительным материалом для клеток иммунной системы. Кроме того, обязательно должна быть физическая активность для нормальной циркуляции клеток иммунной системы по организму. И, конечно, стараться избегать стрессов, потому что это — один из факторов подавления иммунитета.
Сила (эффективность) иммунитета зависит от состояния врожденного (неспецифического) и приобретенного (специфического) иммунитета.
Врожденный иммунитет отвечает за общую сопротивляемость организма, за защиту организма от возбудителей инфекции, с которыми мы сталкиваемся ежедневно. Врожденный иммунитет не зависит от прививок, а зависит от наследственности, то есть здоровья родителей, окружающей среды, условий жизни, воспитания, психологический климат в семье, дохода родителей, питания и здорового образа жизни. Общая сопротивляемость организма должна быть очень высокой, чтобы ежедневно защищать себя от различных болезней и инфекций, а также выполнять физические нагрузки и справляться со стрессами. Например, ребенок, получивший полный набор прививок может часто болеть ангиной, бронхитом, пневмонией, отитом и прочими болезнями, возбудителями которых являются обычные микробы, против которых не ставят прививок. С этими болезнями можно бороться, укрепляя иммунную систему, формируя и соблюдая здоровый образ жизни.
Приобретенный иммунитет вырабатывается после вакцинации (например, привитые от дифтерии), а также вырабатывается после перенесенной болезни, (например, ребенок переболевший ветрянкой не заболеет ею повторно).
Цель медицины – профилактика заболеваний, а цель вакцинации – предотвратить заболевание и её распространение, защитить человеческий организм от инфекционных заболеваний. Своевременный охват населения профилактическими прививками, в последующем формирует высокую напряженность иммунитета, от различных заболеваний (гепатита В, туберкулеза, дифтерии, полиомиелита, столбняка, коклюша, кори, эпидемического паротита и краснухи, менингитов, гриппа, пневмоний, отитов и др.) и позволяет значительно уменьшить количество тяжелых осложнений и летальных исходов.
Врач-интерн О.В. Константинова
Читайте также
Телефон горячей линии работает в будние дни с 8.30 до 17.00 (обед с 12.00 до 13.00)
801716-7-45-57
Что такое вторичный иммунодефицит? Причины возникновения, диагностику и методы лечения разберем в статье доктора Бычковой Е.Ю., остеопата со стажем в 22 года.
Определение болезни. Причины заболевания
Вторичный иммунодефицит формируется у людей старше 6 лет с исходно нормальным иммунитетом. До этого возраста происходит созревание иммунной системы, особенно полноценных механизмов противоинфекционной защиты, поэтому частое развитие инфекционных заболеваний у детей младше 6 лет не является признаком патологии.
Появление вторичного иммунодефицита обычно связано с воздействием окружающей среды или каких-либо других факторов, но у многих из пациентов можно выявить генетическую предрасположенность к нарушению иммунитета.
Иммунологически здоровый организм способен контролировать и предотвращать развитие инфекций и опухолевых процессов, то есть осуществлять иммунологический контроль внутренней среды.
Когда можно заподозрить вторичный иммунодефицит
Причины развития вторичных иммунодефицитных состояний:
Иммунодефицитные состояния у детей
Развитию иммунодефицита у детей, как и у взрослых, способствуют:
Дисбактериоз у матери является причиной дисбактериоза у ребёнка с последующим замедлением и неполноценным созреванием иммунной системы. Каждый курс антибиотикотерапии может усугубить это состояние.
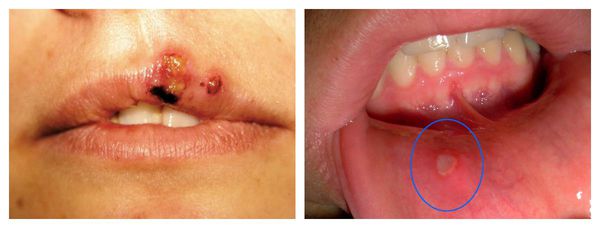
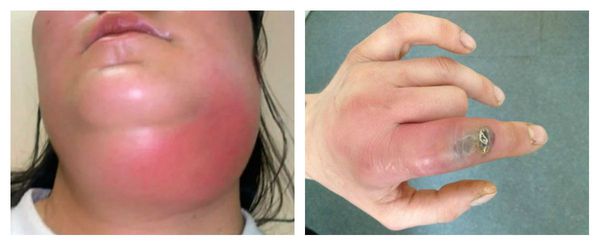
Проявления иммунодефицита зависят от степени его выраженности, они сопровождаются частыми ОРВИ с инфекционными осложнениями, эпизодами лихорадки, болезненностью, увеличением лимфоузлов, болью в животе, рвотой и нарушением стула.
Симптомы вторичного иммунодефицита
Как проявляется вторичный иммунодефицит
Клинические проявления вторичного иммунодефицита разнообразны. Очень часто на первый план выходят симптомы основного заболевания, которое привело к развитию иммунодефицита. Но основные проявления проблем с иммунитетом, которые указывают на необходимость иммунологического обследования, всё же присутствуют. К ним относятся:
Все хронические инфекции и воспаления протекают на фоне ослабленной иммунной защиты. Поэтому любая хронизация инфекции будет указывать на несостоятельность иммунитета, который не может справиться с болезнью в ходе острого воспалительного процесса.
Патогенез вторичного иммунодефицита
В течение жизни организм подвергается воздействию различных повреждающих факторов, вызывающих вторичный иммунодефицит. Они приводят к угнетению реакций клеточного иммунитета, снижению лейкоцитов и интерферонов — белков иммунной системы, которые вырабатываются лейкоцитами и иммунными клетками и блокируют распространение вируса. Вследствие этого появляются хронические инфекционно-воспалительные процессы, часто рецидивирующие.
Опухоли, возникающие в организме с ослабленной иммунной защитой, истощают иммунитет по мере своего роста, а проводимое лечение (операция, лучевая и химиотерапия) усугубляют возникший иммунодефицит. В этом случае страдает клеточное звено иммунитета:
Классификация и стадии развития вторичного иммунодефицита
По причине возникновения выделяют:
По форме вторичный иммунодефицит может быть:
По продолжительности выделяют два типа вторичного иммунодефицита:
По локализации основного дефекта различают:
Установить локализацию повреждения иммунной системы, основываясь только на симптомах, без лабораторного исследования иммунного статуса, практически невозможно: сходная клиническая картина может наблюдаться при разных типах вторичного дефицита. Например, склонность к вирусным инфекциям может встречаться как при Т-клеточном дефиците, так и при дефиците системы интерферонов.
Осложнения вторичного иммунодефицита
Вторичный иммунодефицит, развивающийся на фоне инфекции и/или воспаления, становится причиной тяжёлых жизнеугрожающих состояний. Без своевременной коррекции иммунитета патологический круг замыкается: течение основной болезни ухудшается.
Наиболее частыми осложнениями вторичного иммунодефицита являются тяжёлые инфекционные заболевания: пневмония, сепсис, абсцесс и флегмона. Их основные проявления: высокая температура и признаки воспаления. При пневмонии наблюдается одышка, кашель и боль в грудной клетке. Сепсис является жизнеугрожающим состоянием, он развивается при попадании в кровь инфекции, сопровождается системной воспалительной реакцией и полиорганной недостаточностью. При абсцессах и флегмоне в организме присутствует очаг гнойного воспаления с выраженной болью, отёком и гиперемией (покраснением).
Диагностика вторичного иммунодефицита
Диагноз «вторичный иммунодефицит» ставится на основании истории болезни, физикального обследования и оценки статуса иммунной системы.
Чтобы назначить эффективных мер по коррекции иммунитета, важно выявить факторы, которые поспособствовали развитию иммунодефицита. Поэтому на консультацию к врачу-иммунологу стоит принести все имеющиеся обследования, а врач будет очень подробно расспрашивать о перенесённых заболеваниях, проведённом лечении, операциях и образе жизни пациента.
Как распознать вторичный иммунодефицит
При подозрении на вторичный иммунодефицит врач назначает анализ крови и иммунограмму — иммунологические тесты, которые оценивают компоненты иммунной системы с точки зрения количества и качества.
Схема обследования различных звеньев иммунной системы (иммунограмма):
На вторичный иммунодефицит могут указывать как пониженные, так и повышенные показатели иммунограммы.
При подозрении на дисбаланс ключевых нутриентов (витаминов, микроэлементов и т. д.) врач-иммунолог может назначить исследования:
В своём заключении врач-иммунолог может указать «вторичный иммунодефицит» как основной или сопутствующий диагноз. Всё зависит от клинической картины.
Лечение вторичного иммунодефицита
Лечение пациента с вторичным иммунодефицитом проводится совместно с врачом, который курирует пациента по поводу основного заболевания. Задача врача-иммунолога заключается в подборе иммунокорригирующей терапии.
«Коррекция иммунитета» в данном случае подразумевает восстановление ослабленной иммунной защиты, исправление дисбаланса её компонентов и иммунных реакций, ослабление патологических иммунных процессов и подавление аутоиммунных реакций.
Лечение вторичного иммунодефицита начинают с определения и устранения его причины. Например, при нарушении иммунитета, вызванном инфекционно-воспалительным процессом, устраняются очаги хронического воспаления.
Если вторичный иммунодефицит возник в результате витаминно-минеральной недостаточности, то назначаются комплексы, содержащие дефицитные компоненты. Например, при истощении лимфоузлов и старении вилочковой железы назначают витамины В6. При обострении или начале аутоиммунных и лимфопролиферативных заболеваний показаны витамины Е.
Важными минералами для иммунной системы являются цинк, йод, литий, медь, кобальт, хром, молибден, селен, марганец и железо. Эти микроэлементы помогают активировать ферменты, которые участвуют в иммунных реакциях. К примеру, цинк предотвращает гибель клеток иммунной системы.
Заместительное лечение вторичного иммунодефицита
Заместительная терапия помогает предотвратить инфекции. Для этого применяют:
Иммунотропное лечение вторичного иммунодефицита
При остром инфекционном воспалении иммуностимуляторы позволяют:
При хроническом инфекционном воспалении иммуномодуляторы:
На степень эффективности иммунокоррекции влияет кратность приёма и стадия заболевания. Срок действия иммуномодуляторов зависит от характера препарата, показателей иммунного статуса и вида заболевания, вызвавшего вторичный иммунодефицит.
Устранение дефицита одного звена иммунитета может привести к компенсации другого звена, так как иммунная система работает по принципу взаимосвязанных модулей.
Может быть назначен как один иммуномодулятор, так и несколько, то есть их комбинация. При комбинированной иммунокоррекцией последовательно или одновременно принимают несколько модуляторов, обладающих разными механизмами действия. Таких иммуномодулирующих препаратов сейчас довольно много.
Показаниями для комбинированной иммунотерапии являются:
ВАЖНО: Самостоятельно назначать себе иммунокорректоры нельзя, так как их бесконтрольное применение может спровоцировать развитие вторичного иммунодефицита.
Прогноз. Профилактика
При вторичном иммунодефиците работа иммунной системы нарушена слабее, чем при первичном. В большинстве случаев выявляется несколько факторов, подавляющих иммунный ответ.
Прогноз определяется тяжестью основного заболевания. Например, если иммунодефицит возник из-за нехватки витаминов или нарушения режима труда и отдыха, он намного легче компенсируется, чем иммунодефицит, спровоцированный опухолевым процессом, сахарным диабетом или ВИЧ-инфекцией.
У детского организма отдельные звенья иммунной системы ещё незрелы: Т-лимфоциты только начинают «знакомиться» с различными инфекциями, поэтому ребёнок часто болеет ОРВИ. Со временем нарабатываются «клетки памяти». По мере взросления формируется широкий «репертуар» Т-лимфоцитов, способных распознавать и быстро запустить иммунный ответ, в связи с чем заболеваемость снижается.
С возрастом иммунная система стареет: в ответ на новые антигены участвует меньше Т-клеток, ухудшается кооперация между клетками иммунной системы, фагоциты хуже поглощают вирусы и мёртвые клетки. Поэтому многие инфекционно-воспалительные заболевания у пожилых людей протекают значительно тяжелее и чаще дают осложнения.
Первичная профилактика вторичного иммунодефицита заключается в ведении здорового образа жизни, сбалансированном питании, отказе от курения. Всё это позволяет предупредить развитие различных заболеваний.
Вторичная профилактика направлена на своевременное лечение инфекционных и общесоматических заболеваний.
Людям с вторичным иммунодефицитом нужны «особые условия», которые не позволят усугубить нарушение иммунитета. Пациентам следует:
Вакцинотерапия
Вакцинация проводится в соответствии с национальным календарем прививок. Перед введением вакцины нужно скомпенсировать иммунодефицит: пропить курс витаминов, минералов и иммуномодуляторов по назначению врача. Это позволит сформировать иммунный ответ на прививку и снизить риск осложнений.
Как работает иммунитет. Основные понятия
Механизм иммунного ответа и иммунные клетки. Основные понятия.

(краткий обзорный материал)
СОДЕРЖАНИЕ:
Цитокины
«Азбука Морзе» организма
Подробнее о цитокинах см. по кнопке-ссылке:
Упомянутая выше условность классификации означает, что цитокин, входящий в одну из перечисленных групп, при определенных условиях в организме может сыграть диаметрально противоположную роль — например, из провоспалительного превратиться в противовоспалительный.
Без налаженной связи между видами войск любая хитроумная военная операция обречена на провал, поэтому клеткам иммунной системы очень важно, принимая и отдавая приказы в виде цитокинов, правильно их интерпретировать и слаженно действовать. Если цитокиновые сигналы начинают вырабатываться в очень большом количестве, то в клеточных рядах наступает паника, что может привести к повреждению собственного организма. Это называется цитокиновым штормом: в ответ на поступающие цитокиновые сигналы клетки иммунной системы начинают продуцировать всё больше и больше собственных цитокинов, которые, в свою очередь, действуют на клетки и усиливают секрецию самих себя. Формируется замкнутый круг, который приводит к разрушению окружающих клеток, а позже и соседних тканей.
Иммунные клетки
По порядку расчитайсь!
Все клетки, относящиеся к иммунной системе и привлекаемые ею для обеспечения эффекторных реакций, в функциональном отношении условно разделяют на четыре группы.
Врожденный иммунитет
Клетки врожденного иммунитета распознают патоген по специфичным для него молекулярным маркерам — так называемым образам патогенности [4]. Эти маркеры не позволяют точно определить принадлежность патогена к тому или иному виду, а лишь сигнализируют о том, что иммунитет столкнулся с чужаками. Для нашего организма подобными маркерами могут служить фрагменты клеточной стенки и жгутиков бактерий, двухцепочечная РНК и одноцепочечная ДНК вирусов, и т.д. При помощи специальных рецепторов врожденного иммунитета, таких как TLR (Toll-like receptors, Толл-подобные рецепторы) и NLR (Nod-like receptors, Nod-подобные рецепторы), клетки взаимодействуют с образами патогенности и приступают к реализации своей защитной стратегии.
Теперь подробнее рассмотрим некоторые клетки врожденного иммунитета.
Адаптивный иммунитет
«спецподразделения вооруженных сил организма»
Видео 2. Кратковременные взаимодействия Т-клеток с дендритной клеткой ( ДК ) (обозначена зеленым ). Видео снято при помощи прижизненной двухфотонной микроскопии. →
T-лимфоциты
Видео 3. Движение Т-хелперов ( красные ) и Т-киллеров ( зеленые ) в лимфоузле. Видео снято при помощи прижизненной двухфотонной микроскопии. →
Всё вышесказанное относится к αβ-Т-лимфоцитам, однако существует еще один тип Т-клеток — γδ-T-лимфоциты (название определяет состав белковых молекул, образующих TCR) [7]. Они относительно малочисленны и в основном заселяют слизистую оболочку кишечника и другие барьерные ткани, играя важнейшую роль в регуляции состава обитающих там микробов. У γδ-T-клеток механизм распознавания антигенов отличается от αβ-Т-лимфоцитарного и не зависит от TCR [8].
B-лимфоциты
Схема иммунного ответа
Когда организм атакуют патогены, в бой в первую очередь вступают клетки врожденного иммунитета — нейтрофилы, базофилы и эозинофилы. Они выделяют вовне содержимое своих гранул, способное повредить клеточную стенку бактерий, а также, например, усилить кровоток, чтобы как можно больше клеток поспешило в очаг инфекции.
Одновременно с этим дендритная клетка, поглотившая патоген, спешит в ближайший лимфоузел, где передает информацию о нём находящимся там Т- и В-лимфоцитам. Те активируются и путешествуют до местонахождения патогена (рис. 2). Битва разгорается: Т-киллеры при контакте с зараженной клеткой убивают ее, Т-хелперы помогают макрофагам и В-лимфоцитам осуществлять их механизмы защиты. В итоге патоген гибнет, а победившие клетки отправляются на покой. Бόльшая их часть погибает, но некоторые становятся клетками памяти, которые поселяются в костном мозге и ждут, когда их помощь снова понадобится организму.
Так выглядит схема любого иммунного ответа, однако она может заметно видоизменяться в зависимости от того, какой именно патоген проник в организм. Если мы имеем дело с внеклеточными бактериями, грибами или, скажем, глистами, то основными вооруженными силами в этом случае будут эозинофилы, В-клетки, продуцирующие антитела, и Th2-лимфоциты, помогающие им в этом. Если же в организме поселились внутриклеточные бактерии, то на помощь в первую очередь спешат макрофаги, которые могут поглотить инфицированную клетку, и Th1-лимфоциты, помогающие им в этом. Ну а в случае вирусной инфекции в бой вступают NK-клетки и Т-киллеры, которые уничтожают зараженные клетки методом контактного киллинга.
Как мы видим, многообразие типов иммунный клеток и механизмов их действия неслучайно: на каждую разновидность патогена у организма припасен свой эффективный способ борьбы (рис. 3).
Рисунок 3. Основные типы патогенов и клетки, принимающие участие в их уничтожении.
А теперь все вышеописанные иммунные перипетии — в коротком видео.
Видео 5. Механизм иммунного ответа. →
Аутоиммунитет
громыхает «гражданская война».
К сожалению, ни одна война не обходится без потерь среди гражданского населения. Долгая и интенсивная защита может дорого стоить организму, если агрессивные высокоспециализированные войска выйдут из-под контроля. Повреждение собственных органов и тканей организма иммунной системой называется аутоиммунным процессом [2]. Заболеваниями этого типа страдает около 5% человечества.
Селекция Т-лимфоцитов в тимусе, а также удаление аутореактивных клеток на периферии (центральная и периферическая иммунологическая толерантность), о которых мы говорили ранее, не могут полностью избавить организм от аутореактивных Т-лимфоцитов. Что же касается В-лимфоцитов, вопрос о том, насколько строго осуществляется их селекция, до сих пор остается открытым. Поэтому в организме каждого человека обязательно присутствует множество аутореактивных лимфоцитов, которые в случае развития аутоиммунной реакции могут повреждать собственные органы и ткани в соответствии со своей специфичностью.
За аутоиммунные поражения организма могут быть ответственны как Т-, так и В-клетки. Первые осуществляют непосредственное убийство безвинных клеток, несущих на себе соответствующий антиген, а также помогают аутореактивным В-клеткам в продукции антител. Т-клеточный аутоиммунитет хорошо изучен при ревматоидном артрите, сахарном диабете первого типа, рассеянном склерозе и многих других болезнях.
В-лимфоциты действуют куда более изощренно. Во-первых, аутоантитела могут вызывать гибель клеток, активируя на их поверхности систему комплемента или же привлекая макрофаги. Во-вторых, мишенями для антител могут стать рецепторы на поверхности клетки. При связывании такого антитела с рецептором тот может или блокироваться, или же активироваться без реального гормонального сигнала. Так происходит при болезни Грейвса : В-лимфоциты производят антитела против рецептора к ТТГ (тиреотропному гормону), мимикрируя действие гормона и, соответственно, усиливая продукцию тиреоидных гормонов. При миастении гравис антитела против рецептора к ацетилхолину блокируют его действие, что приводит к нарушению нейромышечной проводимости. В-третьих, аутоантитела вместе с растворимыми антигенами могут образовывать иммунные комплексы, которые оседают в различных органах и тканях (например, в почечных клубочках, суставах, на эндотелии сосудов), нарушая их работу и вызывая воспалительные процессы.
Как правило, аутоиммунное заболевание возникает внезапно, и невозможно точно определить, что стало его причиной. Считается, что триггером для запуска может послужить практически любая стрессовая ситуация, будь то перенесенная инфекция, травма или переохлаждение. Значительный вклад в вероятность возникновения аутоиммунного заболевания вносит как образ жизни человека, так и генетическая предрасположенность — наличие определенного варианта какого-либо гена.
Кроме того, на развитие болезни может влиять уровень экспрессии аутоантигена в тимусе. Например, продукция инсулина и, соответственно, частота презентации его антигенов Т-клеткам различается от человека к человеку. Чем она выше, тем ниже риск развития сахарного диабета первого типа, так как это позволяет удалить специфичные к инсулину Т-лимфоциты.
Заключение
Как мы уже убедились, иммунитет — это сложнейшая сеть взаимодействий как на клеточном, так и на молекулярном уровнях. Создать идеальную систему, надежно защищающую организм от атак патогенов и одновременно ни при каких условиях не повреждающую собственные органы, не смогла даже природа. Аутоиммунные заболевания — побочный эффект высокой специфичности работы системы адаптивного иммунитета, те издержки, которыми нам приходится платить за возможность успешно существовать в мире, кишащем бактериями, вирусами и другими патогенами.
Гемопоэтическая стволовая клетка
Кем быть? Как гемопоэтическая стволовая клетка «выбирает профессию «
Часть ГСК находится в состоянии покоя: такие клетки неактивны и не участвуют в клеточном цикле. Но проснувшись, гемопоэтическая стволовая клетка делает очень важный выбор. Уникальным свойством всех стволовых клеток является способность к самообновлению — так называют симметричное деление с образованием идентичных копий материнской клетки. Так гемопоэтическая стволовая клетка может практически бесконечно продлять свое детство.
* — По современным данным, гемопоэтическая стволовая клетка «взрослеет», постепенно теряя способность к самообновлению и приобретая способность к дифференцировке. А решение выбрать «рабочую специальность», то есть мегакариоцитарное и эритроцитарное направление дифференцировки, клетка принимает еще до того, как рассмотрит варианты с «учебой» и «армией» (миелоидным или лимфоидным ростками) [11].
Общие лимфоидные предшественники дают начало клеткам иммунной системы — NK-клеткам, T- и B-лимфоцитам, — которые защищают организм от вторжения. NK-клетки (большие гранулярные лимфоциты) убивают чужаков, T-лимфоциты могут распознавать эпитоп (участок антигена ) врага и организовывать наступление (T-хелперы) или атаковать самостоятельно (цитотоксические лимфоциты), а B-лимфоциты, тоже после знакомства с антигеном, могут превращаться в плазматические клетки, вырабатывать специфические антитела и поражать ими врага на расстоянии.
Каким же образом гемопоэтическая стволовая клетка решает, оставаться ей вечно юной или встать на путь дифференцировки и превратиться в зрелую клетку крови? И как она выбирает свою будущую профессию? Результаты большого количества исследований доказывают, что важную роль играет окружение гемопоэтической стволовой клетки*. В первую очередь, это различные виды клеток, формирующие гемопоэтическую нишу костного мозга.
Однако выбор профессии — непростой процесс. И огромную роль в нём, помимо внешнего воздействия, играют личные предпочтения и склонности. Как и у человека, у гемопоэтической стволовой клетки богатый и сложный внутренний мир, который представлен транскрипционными факторами. Именно их взаимодействия приводят в конечном итоге к принятию решения, кем же ей быть [17, 18].
Конечно, представление работы транскрипционных факторов в виде механических блоков — чрезвычайное упрощение. Кроме того, описанные взаимодействия — лишь малая часть огромной сети транскрипционных факторов. В настоящее время ведутся масштабные исследования, чтобы составить представление о внутренних факторах, участвующих в регуляции дифференцировки гемопоэтической стволовой клетки, и об их взаимосвязи с внешними факторами, такими как влияние других клеток и растворимых факторов. Все эти знания помогут лучше понять процессы, лежащие в основе кроветворения в норме и при различных заболеваниях, разработать подходы к лечению этих заболеваний, а также научиться управлять судьбой гемопоэтических стволовых клеток in vitro и in vivo.
Дополнительная информация:
К разделу:
Дополнительно см.:
Источник (по материалам): А. Боголюбова. Иммунитет: борьба с чужими и… своими. / Спецпроект: аутоиммунные заболевания / biomolecula 26.01.2017
Литература:
Будьте здоровы!
ССЫЛКИ К РАЗДЕЛУ О ПРЕПАРАТАХ ПРОБИОТИКАХ