Что такое впр по химии
ВПР по химии 11 класс
Общая информация
ВПР по химии для 11 класса состоит из пятнадцати заданий. 11 из них относятся к базовому уровню сложности, и только 4 – к повышенному. Задания разделяются на 4 блока:
| Блок | Номера заданий |
| Теоретические основы химии | 1-4 |
| Неорганическая химия | 5-10 |
| Органическая химия | 11-14 |
| Методы познания и экспериментальные основы химии; химия и жизнь | 15 |
Для того чтобы написать работу, учащимся дается 90 минут, то есть 2 урока. Во время проведения ВПР по химии одиннадцатиклассникам разрешается иметь при себе следующие вещи:
Система оценок
Всего за работу можно набрать 33 балла. Четко определенной шкалы их перевода в оценки не предусмотрено – это осуществляется на усмотрение руководства образовательного учреждения.
Примеры заданий с разбалловкой и пояснениями
Задание 1
Первое задание открывает блок номеров, проверяющих знания учеников в области теоретических основ химии. В начале задается тема задания – например, способы разделения смесей либо методы сбора газа (они перечисляются). Приводится 3 рисунка (без подписей), иллюстрирующих то, о чем идет речь в тексте – к примеру, три способа разделения смесей. Далее нужно соотнести номер рисунка с указанными в задании положениями таблицы, а также – указать то, что иллюстрирует данный рисунок (например, способ или метод). Таблица может выглядеть так:
| Смесь | № рисунка | Способ разделения |
|---|---|---|
| Хлопья ржавчины и водопроводная вода | ||
| Растворимые природные примеси и дождевая вода |
Если вся таблица заполнена верно, ученик получает 2 балла за это задание. Если же в одном из ее элементов есть ошибка – 1 балл, а при наличии 2 и более ошибок – 0 баллов.
Задание 2
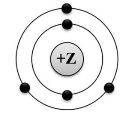
Во втором задании проверяются познания одиннадцатиклассников в таких аспектах химии, как состав атома и строение его электронной оболочки. В условии приводится рисунок, на котором изображена модель строения либо схема распределения электронов по уровням какого-либо элемента – например, вот так:
Необходимо дать ответы на три вопроса: написать порядковый номер элемента, номер периода и группы, в которых он располагается, а также определить, к чему относится образуемое элементом простое вещество – к металлам или неметаллам.
Если весь ответ верный – ставится 2 балла, при одной ошибке – 1 балл, при двух и более – 0.
Задание 3
Этот номер предполагает работу с периодической системой Д. И. Менделеева, знание ее закономерностей и свойств элементов. Дается перечень из 4 элементов – например, Si, O, N, P или Si, Al, S, Cl. Нужно расположить их согласно условию – для данных примеров это уменьшение радиусов атомов и усиление кислотных свойств высших оксидов – и записать в ответе в правильном порядке. За верный ответ ученик получает 1 балл, за неверный – 0.
Задание 4
Четвертое задание ВПР по химии связано со строением химических веществ и их свойствами. Приводится таблица, в которой отображены основные свойства веществ молекулярного и ионного строения. Далее необходимо определить, какое строение имеют два приведенных вещества – к примеру, йод и угарный газ или питьевая сода и ацетилен. Если строение обоих веществ определено верно – одиннадцатиклассник получает 2 балла за это задание, если же только одного – 1 балл, и если весь ответ неверен – 0 баллов.
Задание 5
Пятым заданием открывается блок номеров, относящихся к неорганической химии. Оно связано с классификацией неорганических соединений. Приводится таблица; в первых двух ее графах записаны формулы веществ, но пропущены классы, к которым они относятся, а в следующих двух – наоборот. Она может выглядеть таким образом:
Нужно дополнить таблицу пропущенными элементами. Если это сделано верно – ответ оценивается в 2 балла, если допущена одна ошибка – 1 баллом, если две и больше – 0 баллами.
Далее в тексте работы приводится текст о каком-либо химическом веществе – например, сульфате алюминия или аммиаке. В тексте говорится о способах его получения, внешнем виде, использовании в жизни и промышленности, основных свойствах и реакциях. Задания 6-8, включающие в себя по два вопроса, выполняются с опорой на данный текст. За каждое из заданий 6, 7 и 8 можно получить максимум 2 балла – в случае, если ответ полностью верный. При наличии 1 ошибки ставится 1 балл, и если ответ неверный – 0 баллов.
Задания 6-8
Все эти задания построены по одному принципу – в первой части нужно составить уравнение какой-либо реакции с участием того вещества (или производных от него), о котором говорится в тексте. Все компоненты реакции указаны, также упомянуты другие детали ответа – например, что уравнение должно быть сокращенным либо что оно должно отображать реакцию, происходящую до образования осадка.
К примеру, если текст о сульфате алюминия, первые части вопросов выглядят так:
Во второй части задаются вопросы, связанные с записанным уравнением – о типе реакции, о ее признаках, о свойствах полученного вещества. Для нашего примера они выглядят так:
Задание 9
Девятый номер ВПР по химии, относящийся к повышенному уровню сложности, проверяет умение учащихся работать с окислительно-восстановительными реакциями – составлять их электронные балансы, расставлять коэффициенты и указывать, какое вещество является окислителем, а какое выступает в роли восстановителя. Дается схема реакции – например:
Fe(OH)2 + NaBrO + H2O → Fe(OH)3 + NaBr
CH4 + NO2 → CO2 + NO + H2O
Задание состоит из 3 частей. В первой нужно составить электронный баланс, во второй – указать восстановитель/окислитель, а в третьей – расставить коэффициенты. Если все это сделано верно, ответ оценивается в 3 балла, если ученик совершил ошибку в одной части ответа – в 2 балла, в двух частях – 1 балл, и если весь ответ неверен – в 0 баллов.
Задание 10
Десятое задание несколько легче предыдущего, хотя оно также является заданием повышенной трудности. В нем приводится химическая цепочка, обычно включающая в себя три уравнения – к примеру:
K2CO3 → CaCO3 → CO2 → NaHCO3
Na2O → NaOH → Na2CO3 → Na2SO4
Требуется составить уравнения реакций. Если все три из них записаны верно – одиннадцатиклассник получает 3 балла, если правильны только два – 2 балла, если только одно – 1 балл, и если все неправильно – 0.
Задание 11
Одиннадцатое задание открывает блок заданий по органической химии. В нем нужно установить соответствие между формулой вещества и его названием, либо между названием вещества и классом/группой, к которой оно относится. Дается три названия либо три формулы, обозначенные буквами, а вот позиций, которые нужно подобрать в соответствие – четыре, поэтому просто подобрать ответ будет сложнее. Ответ записывается в таблицу; если в нем нет ошибок, ставится 2 балла, если одна ошибка – 1 балл, если две-три – 0 баллов.
Задание 12
В условии данного задания приводится две схемы реакций, в которых пропущено по одному веществу. Нужно вставить пропущенные вещества, и, если нужно – расставить коэффициенты. Примеры задания:
. + HBr → CH3–CH2–Br + H2O
Если пропущенные элементы записаны верно – ответ оценивается 2 баллами, при одной ошибке – 1 баллом. За неверный ответ либо его отсутствие ученик не получает баллы за это задание.
Задание 13
Тринадцатое задание представляет собой задачу, причем не самую простую – оно относится к повышенному уровню сложности. Чаще всего требуется рассчитать массу какого-либо вещества, иногда дается практический и теоретический выход и недостаток/избыток. Нужно написать уравнение описанной в условии реакции и подробное решение. Приводим примеры условия:
Если все сделано правильно – ставится 3 балла, если есть одна ошибка – 2 балла, две ошибки – 1 балл, три и больше – 0.
Задание 14
В предпоследнем задании ВПР по химии, сложность которого также считается повышенной, нужно составить 3 уравнения реакций с органическим веществом. В отличии от задания под номером 10, здесь дается не результат реакций, а оба их компоненты.
Условие выглядит, например, так:
Задание 15
Пятнадцатое задание предполагает решение задачи. Чаще всего требуется рассчитать массу или массовую долю. Эта задача легче, чем та, которую надо решать в 13 номере. Примеры:
ХИМИЯ−11
2020—2021 УЧЕБНЫЙ ГОД
Демонстрационная версия ВПР по химии 11 класс 2021 года с решениями.
ВПР по химии для 11 класса. Вариант 1.
ВПР по химии для 11 класса. Вариант 2.
ВПР по химии для 11 класса. Вариант 3.
ВПР по химии для 11 класса. Вариант 4.
ВПР по химии для 11 класса. Вариант 5.
ВПР по химии для 11 класса. Вариант 6.
ВПР по химии для 11 класса. Вариант 7.
ВПР по химии для 11 класса. Вариант 8.
ВПР по химии для 11 класса. Вариант 9.
ВПР по химии для 11 класса. Вариант 10.
ВПР по химии для 11 класса. Вариант 11.
ВПР по химии для 11 класса. Вариант 12.
ВПР по химии для 11 класса. Вариант 13.
ВПР по химии для 11 класса. Вариант 14.
ВПР по химии для 11 класса. Вариант 15.
ВПР по химии для 11 класса. Вариант 16.
ВПР по химии для 11 класса. Вариант 17.
ВПР по химии для 11 класса. Вариант 18.
ВПР по химии для 11 класса. Вариант 19.
ВПР по химии для 11 класса. Вариант 20.
2019—2020 УЧЕБНЫЙ ГОД
ВПР по химии для 11 класса. Вариант 1.
ВПР по химии для 11 класса. Вариант 2.
ВПР по химии для 11 класса. Вариант 3.
ВПР по химии для 11 класса. Вариант 4.
ВПР по химии для 11 класса. Вариант 5.
ВПР по химии для 11 класса. Вариант 6.
ВПР по химии для 11 класса. Вариант 7.
ВПР по химии для 11 класса. Вариант 8.
ВПР по химии для 11 класса. Вариант 9.
ВПР по химии для 11 класса. Вариант 10.
ВПР по химии для 11 класса. Вариант 11.
ВПР по химии для 11 класса. Вариант 12.
ВПР по химии для 11 класса. Вариант 13.
2018—2019 УЧЕБНЫЙ ГОД
ВПР по химии для 11 класса 18.04.2019. Вариант 3.
ВПР по химии для 11 класса 18.04.2019. Вариант 4.
ВПР по химии для 11 класса 18.04.2019. Вариант 5.
ВПР по химии для 11 класса 18.04.2019. Вариант 6.
ВПР по химии для 11 класса 18.04.2019. Вариант 7.
ВПР по химии для 11 класса 18.04.2019. Вариант 8.
ВПР по химии для 11 класса 18.04.2019. Вариант 9.
ВПР по химии для 11 класса 18.04.2019. Вариант 10.
ВПР по химии для 11 класса 18.04.2019. Вариант 11.
ВПР по химии для 11 класса 18.04.2019. Вариант 12.
ВПР по химии для 11 класса 18.04.2019. Вариант 13.
ВПР по химии для 11 класса 18.04.2019. Вариант 14.
ВПР по химии для 11 класса 18.04.2019. Вариант 15.
ВПР по химии для 11 класса 18.04.2019. Вариант 16.
ВПР по химии для 11 класса 18.04.2019. Вариант 17.
ВПР по химии для 11 класса 18.04.2019. Вариант 18.
ВПР по химии для 11 класса 18.04.2019. Вариант 19.
ВПР по химии для 11 класса 18.04.2019. Вариант 20.
2017—2018 УЧЕБНЫЙ ГОД
ВПР по химии для 11 класса 05.04.2018. Вариант 1.
ВПР по химии для 11 класса 05.04.2018. Вариант 2.
ВПР по химии для 11 класса 05.04.2018. Вариант 3.
ВПР по химии для 11 класса 05.04.2018. Вариант 4.
ВПР по химии для 11 класса 05.04.2018. Вариант 5.
ВПР по химии для 11 класса 05.04.2018. Вариант 6.
ВПР по химии для 11 класса 05.04.2018. Вариант 7.
ВПР по химии для 11 класса 05.04.2018. Вариант 8.
ВПР по химии для 11 класса 05.04.2018. Вариант 9.
ВПР по химии для 11 класса 05.04.2018. Вариант 10.
ВПР по химии для 11 класса 05.04.2018. Вариант 11.
ВПР по химии для 11 класса 05.04.2018. Вариант 12.
ВПР по химии для 11 класса 05.04.2018. Вариант 13.
ВПР по химии для 11 класса 05.04.2018. Вариант 15.
ВПР по химии для 11 класса 05.04.2018. Вариант 16.
ВПР по химии для 11 класса 05.04.2018. Вариант 17.
ВПР по химии для 11 класса 05.04.2018. Вариант 18.
ВПР по химии для 11 класса 05.04.2018. Вариант 19.
ВПР по химии для 11 класса 05.04.2018. Вариант 20.
2016—2017 УЧЕБНЫЙ ГОД
ВПР по химии для 11 класса 27.04.2018. Вариант 13.
ВПР по химии 8 класс 2021 Варианты с ответами
В период с 15 марта по 21 мая 2021 года в очередной раз состоялись всероссийские проверочные работы по химии в 8 классах.
После проведения ВПР в школах стали доступны реальные варианты и критерии оценки.
Для каждой школы варианты формировались индивидуально из банка заданий ВПР.
ВПР 2021 по химии для 8 класса с ответами
| Комплект заданий 1 | |
| Вариант 1 | Скачать ответы |
| Вариант 2 | Скачать ответы |
| Комплект заданий 2 | |
| Вариант 1 | Ответы + критерии |
| Вариант 2 | Ответы + критерии |
| Комплект заданий 3 | |
| Вариант 1 | Ответы + критерии |
| Вариант 2 | Ответы + критерии |
| Комплект заданий 4 | |
| Вариант 1 | Ответы + критерии |
| Вариант 2 | Ответы + критерии |
| Комплект заданий 5 | |
| Вариант 1 | Ответы + критерии |
| Вариант 2 | Ответы + критерии |
| Комплект заданий 6 | |
| variant 1 | otvet |
| variant 2 | otvet |
| Комплект заданий 7 | |
| variant 1 | otvet |
| variant 2 | otvet |
| Комплект заданий 8 | |
| variant 1 | otvet |
| variant 2 | otvet |
| Комплект заданий 9 | |
| variant 1 | otvet |
| variant 2 | otvet |
| Комплект заданий 10 | |
| variant 1 | otvet |
| variant 2 | otvet |
Структура проверочной работы ВПР 2021 по химии 8 класс
Вариант проверочной работы состоит из 9 заданий, которые различаются по содержанию и проверяемым требованиям.
Задания 1, 2, 7.3 основаны на изображениях конкретных объектов и процессов, требуют анализа этих изображений и применения химических знаний при решении практических задач.
Задание 5 построено на основе справочной информации и предполагает анализ реальной жизненной ситуации.
Задания 1, 3.1, 4, 6.2, 6.3, 8 и 9 требуют краткого ответа.
Остальные задания проверочной работы предполагают развернутый ответ.
КИМ ВПР 8 класса направлены на проверку у обучающихся предметных требований:
1) формирование первоначальных систематизированных представлений о веществах, их превращениях и практическом применении; овладение понятийным аппаратом и символическим языком химии;
2) осознание объективной значимости основ химической науки как области современного естествознания, химических превращений неорганических и органических веществ как основы многих явлений живой и неживой природы; углубление представлений о материальном единстве мира;
3) овладение основами химической грамотности: способностью анализировать и объективно оценивать жизненные ситуации, связанные с химией, навыками безопасного обращения с веществами, используемыми в повседневной жизни; умением анализировать и планировать экологически безопасное поведение в целях сохранения здоровья и окружающей среды;
4) формирование умений устанавливать связи между реально наблюдаемыми химическими явлениями и процессами, происходящими в микромире, объяснять причины многообразия веществ, зависимость их свойств от состава и строения, а также зависимость применения веществ от их свойств;
5) приобретение опыта использования различных методов изучения веществ: наблюдения за их превращениями при проведении несложных химических экспериментов с использованием лабораторного оборудования и приборов;
6) формирование представлений о значении химической науки в решении современных экологических проблем, в том числе в предотвращении техногенных и экологических катастроф.
Тексты заданий в КИМ ВПР 8 класса в целом соответствуют формулировкам, принятым в учебниках, включенных в Федеральный перечень учебников, допущенных к использованию при реализации имеющих государственную аккредитацию образовательных программ основного общего образования
Что такое впр по химии
Сложные неорганические вещества условно можно распределить, то есть классифицировать, по четырём группам, как показано на схеме. В эту схему для каждой из четырёх групп впишите по одной химической формуле веществ, упоминаемых в приведённом выше тексте.
| оксид | основание | кислота | соль |
Химические формулы запишите в таблицу в следующем формате: Al2(SO4)3.
Прочитайте следующий текст и выполните задания 5—7.
Оксид серы (IV) используют в пищевой промышленности в качестве консерванта (пищевая добавка Е220). Поскольку этот газ убивает микроорганизмы, им окуривают овощехранилища и склады. Это вещество также используют для отбеливания соломы, шёлка и шерсти, то есть материалов, которые нельзя отбеливать хлором.
Промышленный способ получения этого вещества заключается в сжигании серы или сульфидов. В лабораторных условиях его получают воздействием сильных кислот на сульфиты, например взаимодействием серной кислоты с сульфитом натрия.
При взаимодействии оксида серы (IV) с гидроксидом кальция образуется соль сульфит кальция. Это вещество применяется в промышленности как пищевая добавка Е226, консервант, для приготовления желе, мармелада, мороженого, напитков и фруктовых соков.
1. Составьте молекулярное уравнение реакции сжигания серы, о которой говорилось в тексте.
2. Укажите, с каким тепловым эффектом (с поглощением или выделением теплоты) протекает эта реакция.
1)
2) реакция протекает с выделением энергии (экзотермическая), так как большинство реакций присоединения являются экзотермическими.
1. Составьте молекулярное уравнение упомянутой в тексте реакции между оксидом серы(IV) и гидроксидом кальция.
2. Опишите признаки протекающей реакции между оксидом серы(IV) и раствором гидроксида кальция.
1)
2) в результате реакции образуется нерастворимое вещество – сульфит кальция; наблюдается помутнение исходного раствора (выпадение осадка)
1) — оксид.
2) — основание.
3) — кислота.
4) или
— соль.
Сложные неорганические вещества можно классифицировать по четырём группам, как показано на схеме. В эту схему для каждой из четырёх групп впишите по одной химической формуле веществ из числа тех, о которых говорится в приведённом тексте.
Химические формулы запишите в таблицу в следующем формате: Al2(SO4)3.
| оксид | основание | кислота | соль |
Прочитайте следующий текст и выполните задания 5—7.
Сульфит натрия — это синтетически созданный консервант, применяющийся в пищевой, фармацевтической и лёгкой промышленности. На этикетках пищевых продуктов сульфит натрия обозначается как Е221. Ещё одно распространённое название этого вещества — Sodium Sulphite. Е221 незаменим в производстве мармелада, зефира, варенья, пастилы, повидла, джема, соков и пюре из фруктов и ягод, ягодных полуфабрикатов, овощного пюре.
Получить сульфит натрия можно в результате реакции сернистого газа с раствором карбоната натрия
или гидроксида натрия
. При действии на сульфит натрия раствора хлороводорода
выделяется сернистый газ, который относят к веществах третьего класса опасности.
1) Составьте одно из молекулярных уравнений реакций получения сульфита натрия;
2) Укажите, к какому типу (соединения, разложения, замещения, обмена) относится эта реакция.
1.
2. Данная реакция относится к реакциям замещения.
1) Составьте молекулярное уравнение реакции сульфита натрия с соляной кислотой, о которой говорилось в тексте;
2) Укажите признак, который наблюдается при протекании этой реакции.
1.
2. Признаком протекания данной химической реакции является выделение бесцветного газа с характерным резким запахом.
1. — бинарное соединение, в котором один из атомов является кислородом, что говорит о его принадлежности к классу оксидов.
2. — является основанием, так как это основный гидроксид.
3. Кислота должна иметь ион водорода, примером может служить соляная кислота
4. Соль состоит из иона металла и иона кислотного остатка, известным примером является карбонат натрия
Ответ: оксид — основание —
кислота —
соль —
Для графы «соль» возможен также и другой вариант ответа —
Сложные неорганические вещества можно классифицировать по четырём группам, как показано на схеме. В эту схему для каждой из четырёх групп впишите по одной химической формуле веществ из числа тех, о которых говорится в приведённом тексте.
| оксид | основание | кислота | соль |
Химические формулы запишите в таблицу в следующем формате: Al2(SO4)3.
Прочитайте следующий текст и выполните задания 5—7.
Сульфат меди(II) — важнейшая из солей меди. Кристаллогидрат сульфата меди(II) называют медным купоросом. В сельском хозяйстве медный купорос применяется как антисептик, фунгицид и медно-серное удобрение. В промышленности эту соль применяют в производстве ацетатного волокна, а также используют в качестве фиксатора окраски и консерванта. Сульфат меди(II) в промышленности получают различными способами, например растворением оксида меди(II)
в серной кислоте
Эта соль часто служит исходным сырьём для получения других соединений, например гидроксида меди(II)
Для водного раствора сульфата меди(II) возможна реакция с металлами активнее меди, например с цинком. Сульфат меди(II) является соединением с умеренной токсичностью. Однако работать с порошком или пудрой сульфата меди(II) следует осторожно, не допуская их пыления.
1) Составьте молекулярное уравнение реакции цинка с раствором сульфата меди(II);
2) Укажите, к какому типу (соединения, разложения, замещения, обмена) относится эта реакция.
1.
2. Данная реакция относится к реакциям замещения.
1) Составьте молекулярное уравнение реакции серной кислоты с оксидом меди(II), о которой говорилось в тексте;
2) Укажите признак(и), который(-е) наблюдается(-ются) при протекании этой реакции.
1.
2. Признаками протекания данной химической реакции являются растворение осадка оксида меди(II) и приобретение раствором голубого оттенка (за счёт образования сульфата меди(II)).
1. — бинарное соединение, в котором один из атомов является кислородом, что говорит о его принадлежности к классу оксидов.
2. — является основанием, так как это основный гидроксид.
3. Кислота должна иметь ион водорода, примером может служить серная кислота
4. Соль состоит из иона металла и иона кислотного остатка, известным примером является сульфат меди (II)
Ответ: Оксид — основание —
кислота —
соль —
Сложные неорганические вещества можно классифицировать по четырём группам, как показано на схеме. В эту схему для каждой из четырёх групп впишите по одной химической формуле веществ из числа тех, о которых говорится в приведённом тексте.
| оксид | основание | кислота | соль |
Химические формулы запишите в таблицу в следующем формате: Al2(SO4)3.
Прочитайте следующий текст и выполните задания 5—7.
Железо это блестящий, серебристо-белый, мягкий металл, с давних пор широко применяемый человеком. Известно большое количество руд и минералов, содержащих железо. Наибольшее практическое значение имеют красный железняк магнитный железняк
сидерит
мелантерит
вивианит
Свойства соединений железа в значительной степени зависят от степени окисления железа. Так, в степени окисления +2 железо образует оксид
который проявляет основные свойства, ему соответствует гидроксид
Эти соединения способны реагировать с растворами сильных кислот, например с соляной кислотой (
) с образование хлорида железа (II)
Железо один из самых используемых металлов, на него приходится до 95% мирового металлургического производства. Железо является основным компонентом сталей и чугунов важнейших конструкционных материалов.