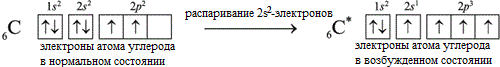Что такое возбужденный углерод
Что такое возбужденный углерод
Гибридизация – это смешение атомных орбиталей (электронных облаков) разной формы, обладающих различной энергией; в результате образуются гибридные орбитали (облака) одинаковые по форме и энергии. Число образующихся гибридных орбиталей равно числу орбиталей, участвующих в гибридизации.
Гибридизация атомных орбиталей — гипотетический процесс смешения разных (s, p, d, f) орбиталей центрального атома многоатомной молекулы с возникновением одинаковых орбиталей, эквивалентных по своим характеристикам.
Объяснение этого факта впервые дал американский химик Лайнус Полинг.
Ввиду относительной близости значений энергии 2s- и 2р-электронов, эти электроны могут взаимодействовать между собой в ходе образования химической связи с электронами другого атома, давая четыре новых равноценных гибридных электронных облака.
Атом С в органических соединениях может находиться в трех валентных состояниях. Этим валентным состояниям соответствуют различные типы гибридизации электронных орбиталей атома углерода.
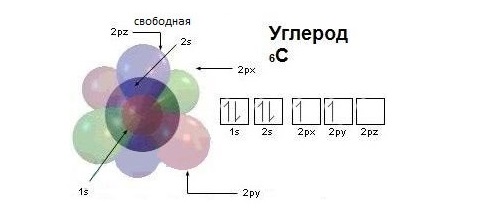
Модель атома углерода
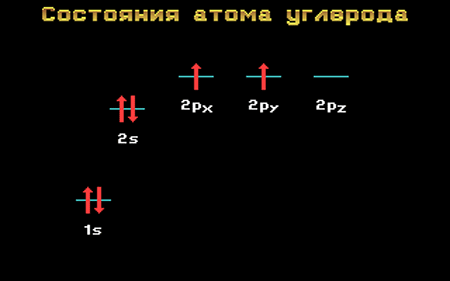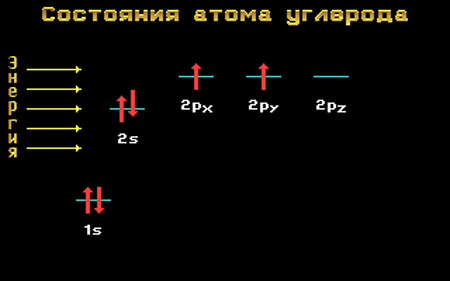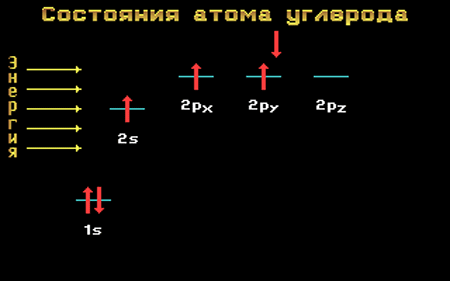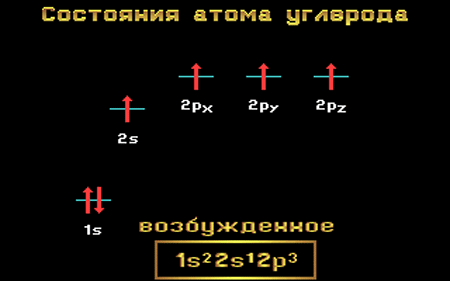
Валентные электроны атома углерода располагаются на одной 2s-орбитали и двух 2р-орбиталях.
Электронная формула атома углерода в основном (стационарном) состоянии 1s 2 2s 2 2p 2 указывает на то, что внешние электроны углерода неодинаковы: s-электрон имеет орбиталь в виде шара, р-электроны – в виде объемных восьмерок, расположенных под углом 90 0 друг к другу.
Если бы такое различие существовало, то у четырехвалентного углерода должна была бы наблюдаться неравноценностей связей. На самом же деле все четыре связи равноценны.
Да и сама четырехвалентность углерода не согласуется с приведенной выше электронной формулой: ведь валентность равна числу неспаренных внешних электронов, которых в приведенной формуле только два.
Переход атома углерода из основного состояния в возбужденное.
Электронная конфигурация атома углерода в основном и возбужденном состоянии
Основное и возбужденное состояния атома углерода
Образовавшиеся электронные облака четырех неспаренных электронов гибридизируются — смешиваются.
Углерод. Химия углерода и его соединений
Углерод
Положение в периодической системе химических элементов
Углерод расположен в главной подгруппе IV группы (или в 14 группе в современной форме ПСХЭ) и во втором периоде периодической системы химических элементов Д.И. Менделеева.
Электронное строение углерода
Электронная конфигурация углерода в основном состоянии :
+6С 1s 2 2s 2 2p 2 1s 

Электронная конфигурация углерода в возбужденном состоянии :
+6С * 1s 2 2s 1 2p 3 1s 

Атом углерода содержит на внешнем энергетическом уровне 2 неспаренных электрона и 1 неподеленную электронную пару в основном энергетическом состоянии и 4 неспаренных электрона в возбужденном энергетическом состоянии.
Физические свойства
Углерод в природе существует в виде нескольких аллотропных модификаций: алмаз, графит, карбин, фуллерен.
Графит — мягкое вещество серо-стального цвета, с металлическим блеском. Хорошо проводит электрический ток. Жирный на ощупь.
Карбин — вещество, в составе которого атомы углерода находятся в sp-гибридизации. Состоит из цепочек и циклов, в которых атомы углерода соединены двойными и тройными связями. Карбин — мелкокристаллический порошок серого цвета.
[=C=C=C=C=C=C=]n или [–C≡C–C≡C–C≡C–]n
Фуллерен — это искусственно полученная модифицикация углерода. Молекулы фуллерена — выпуклые многогранники С60, С70 и др. Многогранники образованы пяти- и шестиугольниками, в вершинах которых расположены атомы углерода.
Фуллерены — черные вещества с металлическим блеском, обладающие свойствами полупроводников.
В природе углерод встречается как в виде простых веществ (алмаз, графит), так и в виде сложных соединений (органические вещества — нефть, природные газ, каменный уголь, карбонаты).
Качественные реакции
Видеоопыт взаимодействия карбоната кальция с соляной кислотой можно посмотреть здесь.
Качественная реакция на углекислый газ CO2 – помутнение известковой воды при пропускании через нее углекислого газа:
При дальнейшем пропускании углекислого газа осадок растворяется, т.к. карбонат кальция под действием избытка углекислого газа переходит в растворимый гидрокарбонат кальция:
Видеоопыт взаимодействия гидроксида кальция с углекислым газом (качественная реакция на углекислый газ) можно посмотреть здесь.
Соединения углерода
Наиболее типичные соединения углерода:
| Степень окисления | Типичные соединения |
| +4 | оксид углерода (IV) CO2 гидрокарбонаты MeHCO3 |
| +2 | оксид углерода (II) СО муравьиная кислота HCOOH |
| -4 | метан CH4 карбиды металлов (карбид алюминия Al4C3) бинарные соединения с неметаллами (карбид кремния SiC) |
Химические свойства
При нормальных условиях углерод существует, как правило, в виде атомных кристаллов (алмаз, графит), поэтому химическая активность углерода — невысокая.
1.1. Из галогенов углерод при комнатной температуре реагирует с фтором с образованием фторида углерода:
1.2. При сильном нагревании углерод реагирует с серой и кремнием с образованием бинарного соединения сероуглерода и карбида кремния соответственно:
C + 2S → CS2
C + Si → SiC
При взаимодействии углерода с водородом образуется метан. Реакция идет в присутствии катализатора (никель) и при нагревании:
1.4. С азотом углерод реагирует при действии электрического разряда, образуя дициан:
2С + N2 → N≡C–C≡N
1.5. В реакциях с активными металлами углерод проявляет свойства окислителя. При этом образуются карбиды:
2C + Ca → CaC2
при недостатке кислорода образуется угарный газ СО:
2C + O2 → 2CO
Алмаз горит при высоких температурах:
Горение алмаза в жидком кислороде:
Графит также горит:
Графит также горит, например, в жидком кислороде:
Графитовые стержни под напряжением:
2. Углерод взаимодействует со сложными веществами:
2.1. Раскаленный уголь взаимодействует с водяным паром с образованием угарного газа и водорода:
C 0 + H2 + O → C +2 O + H2 0
ZnO + C → Zn + CO
Также углерод восстанавливает железо из железной окалины:
4С + Fe3O4 → 3Fe + 4CO
При взаимодействии с оксидами активных металлов углерод образует карбиды.
3С + СаО → СаС2 + СО
2.3. Концентрированная серная кислота окисляет углерод при нагревании. При этом образуются оксид серы (IV), оксид углерода (IV) и вода:
2.4. Концентрированная азотная кислотой окисляет углерод также при нагревании. При этом образуются оксид азота (IV), оксид углерода (IV) и вода:
Карбиды
| Ковалентные карбиды | Ионные карбиды | ||
| Метаниды | Ацетилениды | Пропиниды | |
| Это соединения углерода с неметаллами Например : Например : Например : Это соединения с металлами, при гидролизе которых образуется пропин Например : Mg2C3 | |||
| Частицы связаны ковалентными связями и образуют атомные кристаллы. Поэтому ковалентные карбиды химически стойкие. Окисляются только сильными окислителями | Метаниды разлагаются водой или кислотами с образованием метана и гидроксида или соли: Например : Al4C3 + 12H2O → 4Al(OH)3 + 3CH4 | Ацетилениды разлагаются водой или кислотами с образованием ацетилена и гидроксида или соли: Например: СаС2+ 2Н2O → Са(OH)2 + С2Н2 | |

При этом получаются гибридные атомные орбитали, электроны
на которых обладают усредненной энергией.


Молекула этана СН3 – СН3, соответственно будет иметь следующее пространственное строение:
С sp2-гибридизацией мы встречаемся в соединениях с двойной связью, атомы образующие двойную связь и будет находиться в sp2-гибридизации.
Рассмотрим пространственное строение молекулы этена СН2 = СН2, в которой атомы углерода находятся в состоянии sp2-гибридизации. Волнистой линией на рисунке показано перекрывание негибридных р-орбиталей (π-связь).

Итак, атомы углерода участвующие в образовании простых, одинарных σ-связей находятся в состоянии sp3-гибридизации, атомы углерода участвующие в образовании двойных связей находятся в состоянии sp2-гибридизации, атомы углерода участвующие в образовании тройных связей находятся в состоянии sp-гибридизации. Любая кратная связь всегда будет иметь одну σ-связь, все остальные будут π-связями. Например, в молекуле СН2 = СН2, между атомами углерода, одна связь σ-, другая π-связь. В молекуле СН≡СН между атомами углерода, одна связь σ-, и две π-связи.
Проверьте себя, как Вы поняли тему, для этого выполните тестовое задание:
2.Сколько атомов углерода в молекуле пентина-2 (СН3 – С ≡ С – СН2 – СН3) находится в состоянии sp3 гибридизации:
а) все 5 атомов углерода, б) 2, в) 1, г) 3.
3.Какова ожидаемая равновесная конфигурация молекулы СН2 = СН2:
а) линейная, б) угловая, в) плоский равносторонний треугольник, г) тетраэдр.
4. Выберите соединения, для которых характерна ковалентная полярная связь:
5.Определите тип гибридизации атомных орбиталей по следующим данным: