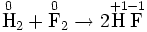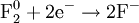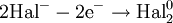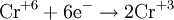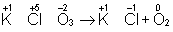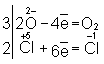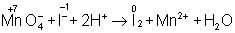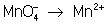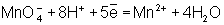Что такое восстановление в химии определение
Восстановление (химия)
Окисли́тельно-восстанови́тельные реа́кции — это химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.
Содержание
Описание
В процессе окислительно-восстановительной реакции восстановитель отдаёт электроны, то есть окисляется; окислитель присоединяет электроны, то есть восстанавливается. Причём любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений — окисления и восстановления, происходящих одновременно и без отрыва одного от другого.
Окисление
При окисле́нии вещества в результате отдачи электронов увеличивается его степень окисления. Атомы окисляемого вещества, называются донорами электронов, а атомы окислителя — акцепторами электронов.
В некоторых случаях при окислении молекула исходного вещества может стать нестабильной и распасться на более стабильные и более мелкие составные части. При этом некоторые из атомов получившихся молекул имеют более высокую степень окисления, чем те же атомы в исходной молекуле.
Окислитель, принимая электроны, приобретает восстановительные свойства, превращаясь в сопряжённый восстановитель:
окислитель + e − ↔ сопряжённый восстановитель.
Восстановление
Восстановле́нием называется процесс присоединения электронов атомом вещества, при этом его степень окисления понижается.
При восстановлении атомы или ионы присоединяют электроны. При этом происходит понижение степени окисления элемента. Примеры: восстановление оксидов металлов до свободных металлов при помощи водорода, углерода, других веществ; восстановление органических кислот в альдегиды и спирты; гидрогенизация жиров и др.
Восстановитель, отдавая электроны, приобретает окислительные свойства, превращаясь в сопряжённый окислитель:
Виды окислительно-восстановительных реакций
Примеры
Окислительно-востановительная реакция между водородом и фтором
Разделяется на две полуреакции:Ы
Окисление, восстановление
В окислительно-восстановительных реакциях электроны от одних атомов, молекул или ионов переходят к другим. Процесс отдачи электронов — окисление. При окислении степень окисления повышается:
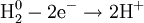

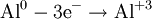
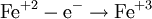
Процесс присоединения электронов — восстановление. При восстановлении степень окисления понижается:
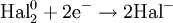
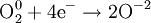

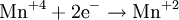
Атомы или ионы, которые в данной реакции присоединяют электроны являются окислителями, а которые отдают электроны — восстановителями.
Мнемонические правила
Для запоминания процессов окисления-восстановления, а также свойств окислителей и восстановителей существует несколько мнемонических правил:
См. также
Ссылки
Полезное
Смотреть что такое «Восстановление (химия)» в других словарях:
Восстановление конструкций — – комплекс мероприятий, ликвидирующих дефекты и повреждения конструкций и восстанавливающих их проектные показатели. [Терминологический словарь по бетону и железобетону. ФГУП «НИЦ «Строительство» НИИЖБ им. А. А. Гвоздева, Москва, 2007 г.… … Энциклопедия терминов, определений и пояснений строительных материалов
Восстановление — – комплекс мероприятий, обеспечивающих повышение эксплуатационных качеств конструкций, пришедших в ограниченно работоспособное состояние, до уровня их первоначального состояния. [СП 13 102 2003] Рубрика термина: Отклонения при испытаниях… … Энциклопедия терминов, определений и пояснений строительных материалов
Химия — У этого термина существуют и другие значения, см. Химия (значения). Химия (от араб. کيمياء, произошедшего, предположительно, от египетского слова km.t (чёрный), откуда возникло также название Египта, чернозёма и свинца «черная… … Википедия
Восстановление металлов — процесс получения металлов из руд при помощи восстановительных реакций. Под В. м. первоначально понимались реакции получения металлов из их окислов путём применения веществ, отличающихся более высоким сродством к кислороду, чем металл.… … Большая советская энциклопедия
Аналитическая химия — Содержание … Википедия
Российский научный центр «Прикладная химия» — (ФГУП РНЦ «Прикладная химия») … Википедия
Окисление-восстановление — окислительно восстановительные реакции, химические реакции, сопровождающиеся изменением окислительных чисел (См. Окислительное число) атомов. Первоначально (со времени введения в химию кислородной теории горения А. Лавуазье, конец 18 в.)… … Большая советская энциклопедия
Восстановитель
Окисли́тельно-восстанови́тельные реа́кции — это химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем.
Содержание
Описание
В процессе окислительно-восстановительной реакции восстановитель отдаёт электроны, то есть окисляется; окислитель присоединяет электроны, то есть восстанавливается. Причём любая окислительно-восстановительная реакция представляет собой единство двух противоположных превращений — окисления и восстановления, происходящих одновременно и без отрыва одного от другого.
Окисление
При окисле́нии вещества в результате отдачи электронов увеличивается его степень окисления. Атомы окисляемого вещества, называются донорами электронов, а атомы окислителя — акцепторами электронов.
В некоторых случаях при окислении молекула исходного вещества может стать нестабильной и распасться на более стабильные и более мелкие составные части. При этом некоторые из атомов получившихся молекул имеют более высокую степень окисления, чем те же атомы в исходной молекуле.
Окислитель, принимая электроны, приобретает восстановительные свойства, превращаясь в сопряжённый восстановитель:
окислитель + e − ↔ сопряжённый восстановитель.
Восстановление
Восстановле́нием называется процесс присоединения электронов атомом вещества, при этом его степень окисления понижается.
При восстановлении атомы или ионы присоединяют электроны. При этом происходит понижение степени окисления элемента. Примеры: восстановление оксидов металлов до свободных металлов при помощи водорода, углерода, других веществ; восстановление органических кислот в альдегиды и спирты; гидрогенизация жиров и др.
Восстановитель, отдавая электроны, приобретает окислительные свойства, превращаясь в сопряжённый окислитель:
Виды окислительно-восстановительных реакций
Примеры
Окислительно-востановительная реакция между водородом и фтором
Разделяется на две полуреакции:Ы
Окисление, восстановление
В окислительно-восстановительных реакциях электроны от одних атомов, молекул или ионов переходят к другим. Процесс отдачи электронов — окисление. При окислении степень окисления повышается:
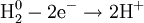

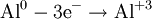
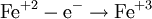
Процесс присоединения электронов — восстановление. При восстановлении степень окисления понижается:
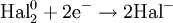
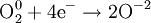

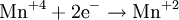
Атомы или ионы, которые в данной реакции присоединяют электроны являются окислителями, а которые отдают электроны — восстановителями.
Мнемонические правила
Для запоминания процессов окисления-восстановления, а также свойств окислителей и восстановителей существует несколько мнемонических правил:
См. также
Ссылки
Полезное
Смотреть что такое «Восстановитель» в других словарях:
восстановитель — воскреситель, восстановщик, воззидатель, регенератор, фосфит, реставратор Словарь русских синонимов. восстановитель сущ., кол во синонимов: 7 • воззидатель (2) • … Словарь синонимов
восстановитель — – реагент (атом, молекула, ион), который в окислительно восстановительной реакции отдает электроны, т.е. окисляется. Общая химия : учебник / А. В. Жолнин [1] Восстановитель – реагент, отдающий электроны в ходе окислительно восстановительной… … Химические термины
ВОССТАНОВИТЕЛЬ — ВОССТАНОВИТЕЛЬ, вещество, которое вызывает реакции ВОССТАНОВЛЕНИЯ. Восстановлении кислорода для образования воды (2Н2+О2>2Н2О) водород является восстановителем. В биологических системах некоторые САХАРА являются восстановителями. см. также… … Научно-технический энциклопедический словарь
ВОССТАНОВИТЕЛЬ — ВОССТАНОВИТЕЛЬ, я, муж. 1. Работник, специалист, ведущий восстановительные работы. Восстановители городов. 2. Вещество, с помощью к рого производится реакция восстановления. В. для волос (средство для восстановления прежнего цвета). Толковый… … Толковый словарь Ожегова
восстановитель — 1. Вещ во, способное отдавать эл ны в ходе окислит. восстановит. реакций. 2. В металлургии реагент (напр., Н2, СО и др.), имеющий более высокое сродство к кислороду, чем у оксида металла, и способный обеспечить реакцию: МеО + В = Me + SO, где ВО… … Справочник технического переводчика
ВОССТАНОВИТЕЛЬ — (в косметике) средство для окраски седых волос; выпускается в продажу в виде жидкости. Волосы 8 10 дней подряд смачивают восстановителем, затем моют голову. После мытья возобновляют смачивание волос восстановителем в течение 5 7 дней. В… … Краткая энциклопедия домашнего хозяйства
восстановитель — reduktorius statusas T sritis chemija apibrėžtis Dalelė, atiduodanti elektronus. atitikmenys: angl. reducer; reducing agent; reductant rus. восстановитель … Chemijos terminų aiškinamasis žodynas
восстановитель — reduktorius statusas T sritis chemija apibrėžtis Redukuojančioji medžiaga. atitikmenys: angl. reducer; reducing agent; reductant rus. восстановитель … Chemijos terminų aiškinamasis žodynas
Восстановитель — I м. Тот, кто ведёт работу по восстановлению чего либо. II м. Вещество, с помощью которого протекает процесс восстановления чего либо. Толковый словарь Ефремовой. Т. Ф. Ефремова. 2000 … Современный толковый словарь русского языка Ефремовой
═ В химии окислительно-восстановительные реакции принадлежат к числу наиболее распространённых. Например, на них, как правило, основано получение простых веществ (металлов и неметаллов)
CuO + H 2 =Cu + H 2 O,
2КВг + Cl 2 = Br 2 + 2KCl.
═ Дыхание, усвоение растениями углекислого газа с выделением кислорода (см. Фотосинтез ), обмен веществ и др. биологически важные явления представляют собой реакции О.-в. (см. Окисление биологическое ).
═ Восстановителями являются почти все металлы в свободном состоянии, отрицательно заряженные ионы неметаллов (S 2√ √ 2 = S°), положительно заряженные ионы металлов в низшей степени окисления (), сложные ионы и молекулы, содержащие атомы в промежуточной степени окисления (, ). В промышленности и технике широко используются такие восстановители, как углерод и окись углерода (восстановление металлов из окислов)
═ сульфит натрия Na 2 SO 3 и гидросульфит натрия NaHSO 3 ≈ в фотографии и красильном деле, металлический натрий и свободный водород ≈ для получения чистых металлов
TiCl 4 + 4Na = Ti + 4NaCI,
GeO 2 +2Н 2 = Ge + 2H 2 O.
═ Окислителями могут быть нейтральные атомы неметаллов (в особенности галогенов и кислорода), положительно заряженные ионы металлов в высшей степени окисления (Sn 4+ + 2 = Sn 2+ ), сложные ионы и молекулы, содержащие атомы элементов в более высокой степени окисления (,,). Промышленное значение как окислители имеют: кислород (особенно в металлургии), озон, хромовая и двухромовая кислоты и их соли, азотная кислота, перекись водорода, перманганат калия, хлорная известь и др. Самый сильный окислитель ≈ электрический ток (окисление происходит на аноде).
═ Для подбора коэффициентов в уравнениях реакций О.-в. служит общее правило: число электронов, отданных восстановителем, должно равняться числу электронов, принятых окислителем. Применяют обычно два метода подбора коэффициентов: метод электронного баланса и электронно-ионный метод.
═ В методе электронного баланса подсчёт числа принятых и отданных электронов производят на основании значений степеней окисления элементов до и после реакции. Например,
═ Таким образом, ═является окислителем, а ═≈ восстановителем. Составляют частные реакции окисления и восстановления:
═ В соответствии с приведённым выше правилом числа отданных и принятых электронов уравнивают. Полученные величины подставляют в исходное уравнение:
═ В электронно-ионном методе схему реакции записывают в соответствии с общими правилами составления ионных реакций, т. е. сильные электролиты записывают в виде ионов, а неэлектролиты, слабые электролиты, газы и осадки ≈ в виде молекул. Не изменяющиеся в результате реакции ионы в такую схему не входят. Например,
KMnO 4 + KI + H 2 SO 4 ® K 2 SO 4 + I 2 + MnSO 4 + H 2 O,
═ Рассчитав степени окисления, определяют окислитель и восстановитель и составляют частные реакции окисления и восстановления:
═ Далее, как и в первом методе, находят коэффициенты-множители к частным уравнениям для достижения электронного баланса (в приведённом примере 5 и 2 соответственно). Окончательное уравнение имеет вид:
═ Полученные коэффициенты подставляют в исходное уравнение:
═ 2KMnO 4 + 10KI + 8H 2 SO 4 = 6K 2 SO 4 + 5I 2 + 2MnSO 4 + 8H 2 O.
═ Лит.: Кудрявцев А. А., Составление химических уравнений, М., 1968; Химия. Курс для средней школы, пер. с англ., 2 изд., М., 1972, гл. 12; Химия. Пособие для преподавателей средней школы, пер. с англ., ч. 1, М., 1973, гл. 12.
Полезное
Окисление — Окисление. В области научной терминологии широко и наглядно сказалась огромная словообразующая роль словарного фонда. Из слов, принадлежащих к основному словарному фонду и выражающих очень конкретные бытовые значения, создавались новые… … История слов
окисление — – окисление масла – в работающем двигателе горячее масло постоянно циркулирует и контактирует с воздухом, продуктами полного и неполного сгорания топлива. Кислород воздуха ускоряет окисление масла. EdwART. Словарь автомобильного жаргона, 2009 … Автомобильный словарь
ОКИСЛЕНИЕ — ОКИСЛЕНИЕ, химическая реакция, включающая потерю атомом или молекулой одного или более ЭЛЕКТРОНОВ (всегда является частью реакции ОКИСЛЕНИЯ ВОССТАНОВЛЕНИЯ, при которой эти электроны приобретаются другим атомом или молекулой). Раньше этот термин… … Научно-технический энциклопедический словарь
окисление — оксидировка, оксидация, окисание, оксидирование, фотолиз Словарь русских синонимов. окисление сущ., кол во синонимов: 9 • автоокисление (2) • … Словарь синонимов
ОКИСЛЕНИЕ — в химии см. Окислительно восстановительные реакции … Большой Энциклопедический словарь
ОКИСЛЕНИЕ — ОКИСЛЕНИЕ, окисления, мн. нет, ср. (хим.). Химический процесс, при котором происходит соединение какого нибудь тела с кислородом. Толковый словарь Ушакова. Д.Н. Ушаков. 1935 1940 … Толковый словарь Ушакова
ОКИСЛЕНИЕ — ОКИСЛЕНИЕ, я, ср. (спец.). Химическая реакция соединения вещества с кислородом или с другим веществом, способным принимать электроны. Толковый словарь Ожегова. С.И. Ожегов, Н.Ю. Шведова. 1949 1992 … Толковый словарь Ожегова
окисление — Ндп. пережог рубашка Дефект в виде окисленного слоя металла с поверхности отливки, получившийся после отжига отливок из белого чугуна на ковкий чугун. [ГОСТ 19200 80] Недопустимые, нерекомендуемые пережогрубашка Тематики отливки из чугуна и стали … Справочник технического переводчика
окисление — Одна из разновидностей химического выветривания, особенно в горных породах, содержащих железо, в результате которого скальная поверхность приобретает коричневатый или желтоватый цвет и соответственно разрушается … Словарь по географии
окисление — – 1. Процесс взаимодействия с кислородом. 2. Процесс передачи электронов восстановителем в ходе окислительно восстановительной реакции. Словарь по аналитической химии [3] … Химические термины
Окисление — – процесс образования окислов металлов. [Блюм Э. Э. Словарь основных металловедческих терминов. Екатеринбург, 2002 г.] Рубрика термина: Общие термины Рубрики энциклопедии: Абразивное оборудование, Абразивы, Автодороги … Энциклопедия терминов, определений и пояснений строительных материалов
Окислителями называется нейтральный атом, молекула или ион, принимающие электроны (во втором примере молекула хлора Cl2), восстановителями — нейтральный атом, молекула или ион, отдающие электроны (в первом примере — атом Zn). Окисление и восстановление — взаимосвязанные процессы, которые всегда протекают одновременно. Когда одно вещество окисляется, то другое восстанавливается, и наоборот. Так, приведённые выше частные реакции окисления и восстановления составляют единый процесс окисления-восстановления: Zn + Cl2 = ZnCl2.
В химии окислительно-восстановительные реакции принадлежат к числу наиболее распространённых. Например, на них, как правило, основано получение простых веществ (металлов и неметаллов)
В основе технического производства таких важнейших химических продуктов, как аммиак, азотная кислота, серная кислота, процессов сжигания топлива и горения также лежат реакции окисления-восстановления. В гальванических элементах (см. Химические источники тока) возникновение электродвижущей силы обусловлено протеканием реакции окисления-восстановления. При проведении электролиза на аноде происходит электрохимическое окисление, на катоде — электрохимическое восстановление. Например, при производстве хлора электролизом раствора NaCl на аноде идёт реакция Cl – – 1 

Дыхание, усвоение растениями углекислого газа с выделением кислорода (см. Фотосинтез), обмен веществ и др. биологически важные явления представляют собой реакции окисления-восстановления (см. Окисление биологическое).
При составлении уравнений реакций окисления-восстановления основная трудность заключается в подборе коэффициентов, особенно для реакций с участием соединений, в которых химическая связь носит не ионный, а ковалентный характер. В этом случае полезны понятия электроотрицательности и окислительного числа (степени окисления). Электроотрицательность — способность атома в молекуле притягивать и удерживать около себя электроны. Степень окисления — такой заряд, который возник бы на атоме в молекуле, если бы каждая пара электронов, связывающая его с др. атомами, была полностью смещена к более электроотрицательному атому (см. Валентность). Нахождение степени окисления атома в молекуле основано на том, что молекула в целом должна быть электрически нейтральной. При этом учитывается, что степень окисления атомов некоторых элементов в соединениях всегда постоянна (щелочные металлы +1, щёлочноземельные металлы и цинк +2, алюминий +3, кислород, кроме перекисей, –2 и т.д.). Степень окисления атома в простых веществах равна нулю, а одноатомного иона в ионном соединении равна заряду этого иона. Например, рассчитаем степень окисления атома Cr в соединении K2Cr2O7. Пользуясь постоянными значениями степеней окисления для К и О, имеем 2·(+1) + 7·(–2) = –12. Следовательно, степень окисления одного атома Cr (чтобы сохранить электронейтральность молекулы) равна +6. На основе введённых понятий можно дать другое определение окисления-восстановления: окислением называется увеличение степени окисления, восстановлением называется понижение степени окисления.
Восстановителями являются почти все металлы в свободном состоянии, отрицательно заряженные ионы неметаллов (S 2– – 2 
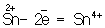
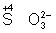
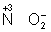
ZnO + С = Zn + СО, FeO +СО = Fe + СО2.
сульфит натрия Na2SO3 и гидросульфит натрия NaHSO3 — в фотографии и красильном деле, металлический натрий и свободный водород — для получения чистых металлов
TiCl4 + 4Na = Ti + 4NaCI,
Окислителями могут быть нейтральные атомы неметаллов (в особенности галогенов и кислорода), положительно заряженные ионы металлов в высшей степени окисления (Sn 4+ + 2 
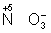
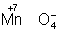
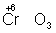
Для подбора коэффициентов в уравнениях реакций окисления-восстановления служит общее правило: число электронов, отданных восстановителем, должно равняться числу электронов, принятых окислителем. Применяют обычно два метода подбора коэффициентов: метод электронного баланса и электронно-ионный метод.
В методе электронного баланса подсчёт числа принятых и отданных электронов производят на основании значений степеней окисления элементов до и после реакции. Например,
Таким образом, 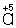
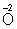
В соответствии с приведённым выше правилом числа отданных и принятых электронов уравнивают. Полученные величины подставляют в исходное уравнение:
В электронно-ионном методе схему реакции записывают в соответствии с общими правилами составления ионных реакций, т. е. сильные электролиты записывают в виде ионов, а неэлектролиты, слабые электролиты, газы и осадки — в виде молекул. Не изменяющиеся в результате реакции ионы в такую схему не входят. Например,
2I – – 2 
Далее, как и в первом методе, находят коэффициенты-множители к частным уравнениям для достижения электронного баланса (в приведённом примере 5 и 2 соответственно). Окончательное уравнение имеет вид:
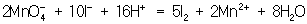
Полученные коэффициенты подставляют в исходное уравнение:
Лит.: Кудрявцев А. А., Составление химических уравнений, М., 1968; Химия. Курс для средней школы, пер. с англ., 2 изд., М., 1972, гл. 12; Химия. Пособие для преподавателей средней школы, пер. с англ., ч. 1, М., 1973, гл. 12.