Что такое восстановительные эквиваленты
Что такое восстановительные эквиваленты
Эквивалент элементов, образующих однозарядные ионы, равен атомному весу этих элементов. Элементы, обладающие различной валентностью, соответственно этому имеют и несколько эквивалентов. Так, например, эквивалент 




Между атомным весом (А), эквивалентом (Э) и валентностью (В) существуют следующие соотношения:
Грамм-эквивалентом элемента называется количество вещества (выраженное в граммах), численно равное эквивалентному весу данного элемента. Например, эквивалент двухвалентного железа равен 
Эквивалент соли, кислоты или основания равен сумме эквивалентов положительно и отрицательно валентных частей молекулы этих соединений. Так, например, эквивалент сульфата алюминия равен сумме эквивалентов алюминия 

Для расчета эквивалентного веса соли, кислоты или основания молекулярный вес данного вещества делят на общее количество единиц валентности положительно или отрицательно валентной части молекулы.
Для нахождения окислительно-восстановительных грамм-эквивалентов необходимо грамм-молекулярный вес соединения разделить на число электронов, теряемых или приобретаемых восстановителем или окислителем (учитывая при этом среду). Например, перманганат калия 

Семивалентный марганец, входящий в 
Поэтому в концентрированном щелочном растворе окислительно-восстановительный грамм-эквивалент равен:
В нейтральном и слабощелочном растворе семивалентный марганец (в соединении 

Грамм-эквивалент хромовокислого калия
Грамм-эквивалент бромата калия
Грамм-эквивалент иодида калия в кислой среде
При окислении тиосульфата натрия 





Тот же тиосульфат натрия, окисляясь бромом, теряет 8 электронов — грамм-эквивалентный вес его в этой реакции равен:
При реакции двойной соли сульфата железа (II) и сульфата аммония 

Оксалат натрия, окисляясь перманганатом калия в кислой среде, отдает 2 электрона:
Поэтому грамм-эквивалент оксалата натрия равен
Из приведенных примеров ясно, как нужно вычислять окисли-тельно-восстановительные эквиваленты. В большинстве случаев для этого даже нет необходимости составлять полные уравнения реакций — достаточно знать, сколько электронов в данной реакции теряет восстановитель или принимает окислитель.
Следует заметить, что одно и то же вещество может участвовать в реакциях как обменных, так и окислительно-восстановительных.
Приведем еще несколько примеров вычисления окислительновосстановительных эквивалентов для некоторых соединений.
Вычислить окислительный эквивалент перманганата калия на основании реакции:


Определить эквивалент нитрата натрия на основании реакции:
Задача 1. Вычислить окислительный грамм-эквивалент перхлората калия, если он в результате окислительно-восстановительного процесса восстанавливается: 1) до двуокиси хлора, 2) до свободного хлора, 3) до хлористого калия.
Задача 2. Вычислить окислительный эквивалент: 1) азотистой кислоты при восстановлении ее до окиси азота, 2) хлорноватой кислоты при восстановлении ее до хлористого водорода, 3) серной кислоты при восстановлении ее до сернистого газа.
3адача 3. Вычислить, какое количество грамм-молекул KI теоретически необходимо для восстановления в кислой среде 1 грамм-молекулы 1)

3адача 4. Вычислить, сколько граммов сероводорода окисляется 1 г иода.
Эквивалент. Закон эквивалентов
Материалы портала onx.distant.ru
Эквивалент. Закон эквивалентов
Эквивалент – реальная или условная частица вещества Х, которая в данной кислотно-основной реакции или реакции обмена эквивалентна одному иону водорода Н + (одному иону ОН — или единичному заряду), а в данной окислительно- восстановительной реакции эквивалентна одному электрону.
Фактор эквивалентности fэкв(X) – число, показывающее, какая доля реальной или условной частицы вещества Х эквивалентна одному иону водорода или одному электрону в данной реакции, т.е. доля, которую составляет эквивалент от молекулы, иона, атома или формульной единицы вещества.
Наряду с понятием “количество вещества”, соответствующее числу его моль, используется также понятие количество эквивалентов вещества.
Закон эквивалентов: вещества реагируют в количествах, пропорциональных их эквивалентам. Если взято n(экв1) моль эквивалентов одного вещества, то столько же моль эквивалентов другого вещества n(экв2) потребуется в данной реакции, т.е.
При проведении расчетов необходимо использовать следующие соотношения:
1. Молярная масса эквивалента вещества X равна его молярной массе, умноженной на фактор эквивалентности:
2. Количество эквивалентов вещества X определяется делением его массы на молярную массу эквивалента:
3. Объём моль-эквивалента газа Х при н.у. равен молярному объёму газа, умноженному на фактор эквивалентности:
4. Молярная масса эквивалента сложного вещества равна сумме молярных масс эквивалентов составляющих это вещество атомов (ионов).
5. Молярная масса эквивалента оксида равна молярной массе эквивалента элемента плюс молярная масса эквивалента кислорода.
6. Молярная масса эквивалента гидроксида металла равна молярной массе эквивалента металла плюс молярная масса эквивалента гидроксила, например:
М[½Са(ОН)2] = 20 + 17 = 37 г/моль.
М(½ СаSO4) = 20 + 48 = 68 г/моль.
Эквивалент в кислотно-основных реакциях
На примере взаимодействия ортофосфорной кислоты со щелочью с образованием дигидро-, гидро- и среднего фосфата рассмотрим эквивалент вещества H3PO4.
Эквивалент NaOH соответствует формульной единице этого вещества, так как фактор эквивалентности NaOH равен единице. В первом уравнении реакции молярное соотношение реагентов равно 1:1, следовательно, фактор эквивалентности H3PO4 в этой реакции равен 1, а эквивалентом является формульная единица вещества H3PO4.
В третьем уравнении реакции количество веществ реагентов относятся друг к другу как 1:3. Следовательно, фактор эквивалентности H3PO4 равен 1/3, а её эквивалентом является 1/3 часть формульной единицы вещества H3PO4.
Таким образом, эквивалент вещества зависит от вида химического превращения, в котором принимает участие рассматриваемое вещество.
Следует обратить внимание на эффективность применения закона эквивалентов: стехиометрические расчёты упрощаются при использовании закона эквивалентов, в частности, при проведении этих расчётов отпадает необходимость записывать полное уравнение химической реакции и учитывать стехиометрические коэффициенты. Например, на взаимодействие без остатка 0,25 моль-экв ортофосфата натрия потребуется равное количество эквивалентов вещества хлорида кальция, т.е. n(1/2CaCl2) = 0,25 моль.
Эквивалент в окислительно-восстановительных реакциях
Фактор эквивалентности соединений в окислительно-восстановительных реакциях равен:
где n – число отданных или присоединенных электронов.
Для определения фактора эквивалентности рассмотрим три уравнения реакций с участием перманганата калия:
В результате получаем следующую схему превращения KMnO4.
в кислой среде: Mn +7 + 5e = Mn +2
в нейтральной среде: Mn +7 + 3e = Mn +4
в щелочной среде: Mn +7 + 1e = Mn +6
Схема превращений KMnO4 в различных средах
Таким образом, в первой реакции fэкв(KMnO4) = 1/5, во второй – fэкв(KMnO4) = 1/3, в третьей – fэкв(KMnO4) = 1.
Следует подчеркнуть, что фактор эквивалентности дихромата калия, реагирующего в качестве окислителя в кислой среде, равен 1/6:
Примеры решения задач
Задача 1. Определить фактор эквивалентности сульфата алюминия, который взаимодействует со щелочью.
Решение. В данном случае возможно несколько вариантов ответа:
Задача 2. Определить факторы эквивалентности Fe3О4 и KCr(SO4)2 в реакциях взаимодействия оксида железа с избытком хлороводородной кислоты и взаимодействия двойной соли KCr(SO4)2 со стехиометрическим количеством щёлочи КОН с образованием гидроксида хрома (III).
Задача 3. Определить факторы эквивалентности и молярные массы эквивалентов оксидов CrО, Cr2О3 и CrО3 в кислотно-основных реакциях.
CrО3 – кислотный оксид. Он взаимодействует со щёлочью:
Молярные массы эквивалентов рассматриваемых оксидов равны:
Мэкв(CrО) = 68(1/2) = 34 г/моль,
Задача 4. Определить объём 1 моль-экв О2, NH3 и H2S при н.у. в реакциях:
Vэкв(NH3) = 22,4× 1/3 = 7,47 л – в первой реакции.
Vэкв(NH3) = 22,4× 1/5 = 4,48 л – во второй реакции.
В третьей реакции для сероводорода Vэкв(H2S)=22,4 1/6 = 3,73 л.
Задача 5. 0,45 г металла вытесняют из кислоты 0,56 л (н.у.) водорода. Определить молярную массу эквивалента металла, его оксида, гидроксида и сульфата.
Задача 6. Рассчитать массу перманганата калия, необходимую для окисления 7,9 г сульфита калия в кислой и нейтральной средах.
fэкв(K2SО3) = 1/2 (в кислой и нейтральной среде).
В кислой среде Мэкв(KMnO4) = 158·1/5 = 31,6 г/моль, m(KMnO4) = 0,1·31,6 = 3,16 г.
В нейтральной среде Мэкв (KMnO4) = 158·1/3 = 52,7 г/моль, m(KMnO4) = 0,1·52,7 =5,27 г.
Задача 7. Рассчитать молярную массу эквивалента металла, если оксид этого металла содержит 47 мас.% кислорода.
Выбираем для расчётов образец оксида металла массой 100 г. Тогда масса кислорода в оксиде составляет 47 г, а масса металла – 53 г.
В оксиде: nэкв (металла) = nэкв(кислорода). Следовательно:
53:Мэкв(Ме) = 47:(32·1/4). В результате получаем Мэкв(Ме) = 9 г/моль.
Задачи для самостоятельного решения
2.1. Молярная масса эквивалента металла равна 9 г/моль. Рассчитать молярную массу эквивалента его нитрата и сульфата.
Ответ: 71 г/моль; 57 г/моль.
2.2. Молярная масса эквивалента карбоната некоторого металла составляет 74 г/моль. Определить молярные массы эквивалентов этого металла и его оксида.
Ответ: 44 г/моль; 52 г/моль.
2.3. Рассчитать объём 1 моля эквивалента сероводорода (н.у.), который окисляется до оксида серы (IV).
Ответ: 3,73 л.
2.4. Определить молярную массу эквивалента Ni(OH)Cl в реакциях:
Ni(OH)Cl + NaOH = Ni(OH)2 + NaCl.
Ответ: 55,6 г/моль; 111,2 г/моль.
2.5. При взаимодействии 4,8 г неизвестного металла и 13 г цинка с соляной кислотой выделяется одинаковый объём водорода. Вычислить молярные массы эквивалентов металла, его оксида и его хлорида.
Ответ: МЭ(металла)=12 г/моль; МЭ(оксида)=20 г/моль, МЭ(хлорида)=47,5 г/моль.
2.6. Рассчитать молярные массы эквивалентов металла и его гидроксида, если хлорид этого металла содержит 79,7 мас.% хлора, а молярная масса эквивалента хлора равна 35,5 г/моль.
Ответ: МЭ(металла)=9 г/моль; МЭ(оксида)=26 г/моль.
2.7. Какой объём 0,6 М раствора H2O2 пойдёт на окисление 150 мл 2н. раствора FeSO4 в реакции:
Ответ: 250 мл.
2.8. Определить объём хлора (н.у), необходимый для окисления 100 мл 0,5н раствора K2MnO4.
Ответ: 0,56 л.
2.9. 0,66 г кислоты требуются для нейтрализации 10 мл 1М раствора КОН. Найти молярные массы эквивалентов кислоты и ее кальциевой соли в обменной реакции.
Ответ: МЭ(кислоты)=66 г/моль; МЭ(соли)=85 г/моль.
2.10. Бромид металла в результате обменной реакции полностью переведен в сульфат, при этом масса уменьшилась в 1,47 раз. Найти молярную массу эквивалента металла. Определить какой это металл.
Ответ: МЭ(металла)=20 г/моль; Са.
Переносчики восстановительных эквивалентов



Под восстановительными эквивалентами подразумевают обычно атомы водорода, электроны или гидрид-ионы. Поскольку их перенос осуществляется в ходе окислительно-восстановительных реакций, соответствующие переносчики называют окислительно-восстановительными кофакторами. Среди них присутствуют как коферменты, так и простетические группы. Наибольшее значение и распространение имеют никотинамидные (NAD и NADP) и флавиновые (FAD и FMN) кофакторы.
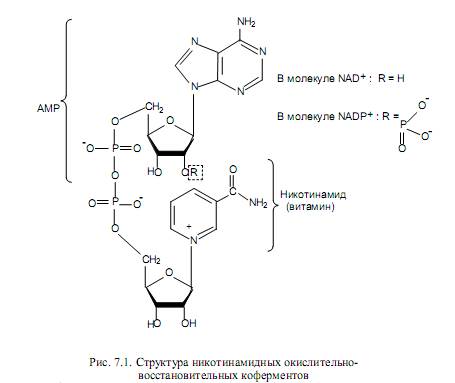
Никотинамидные переносчики восстановительных эквивалентов. Известно порядка 270 ферментов, использующих никотинамидные окислительно-восстановительные коферменты в ходе катализа. Этими коферментами являются никотинамидадениндинуклеотид (НАД, или NAD) и никотинамидадениндинуклеотидфосфат (НАДФ, или NADP). Структурные формулы NAD и NADP представлены на рис. 7.1, и можно видеть, что два кофермента очень сходны по строению.
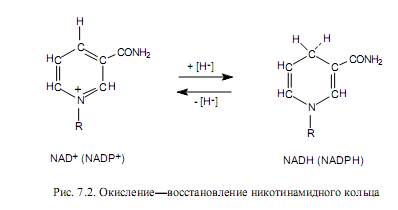
Функциональной группой никотинамидных переносчиков восстановительных эквивалентов служит никотинамидное кольцо, входящее в состав никотинамида — одной из форм витамина В5 (РР). При ферментативном окислении субстрата с участием NAD + (NADP + ) никотинамидное кольцо восстанавливается в ходе присоединения гидрид-иона, который представляет собой протон и два электрона (рис. 7.2). При этом дегидрирование субстрата в большинстве случаев сопровождается отщеплением двух атомов водорода, в ходе которого протон выделяется в окружающую среду.
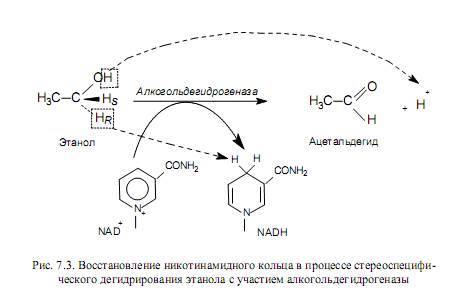
Примером работы никотинамидных переносчиков восстановительных эквивалентов может служить окисление этанола в уксусный альдегид, катализируемое алкогольдегидрогеназой (рис. 7.3). Этот фермент осуществляет стереоспецифическое отщепление двух атомов водорода от молекулы этанола, причем к NAD + переносится водород, связанный с углеродом спиртовой группы, а водород, присоединенный к кислороду гидроксила, высвобождается в среду в виде протона.
Два пиримидиновых кофермента участвуют в разных окислительно-восстановительных реакциях при различных окислительно-восстановительных потенциалах: NAD + чаще выступает в роли окислительного агента в катаболитных путях, а NADP + восстанавливается до NADPH и выполняет функцию восстановителя в биосинтетических процессах.
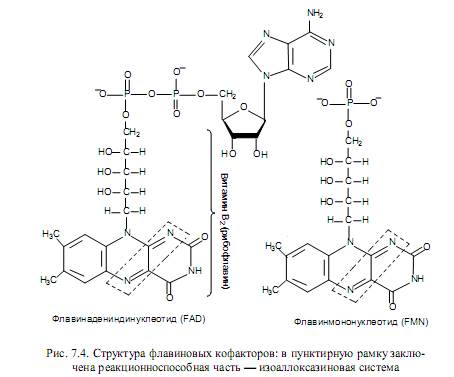
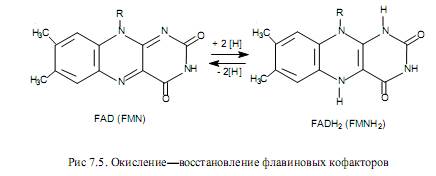
Флавиновые переносчики восстановительных эквивалентов.Существует не менее 80 флавинсодержащих ферментов, которые в качестве простетической группы используют либо флавинадениндинуклеотид (ФАД, или FAD), либо флавинмононуклеотид (ФМН, или FMN). Оба этих кофактора построены на основе витамина рибофлавина (В2) (рис. 7.4).
Флавиновые кофакторы являются более сильными окислителями, чем никотинамидные, а восстановленные формы никотинамидных коферментов служат более сильными восстановителями, чем восстановленные флавины.
В качестве других переносчиков восстановительных эквивалентов известны цитохромы, хиноны, липоевая и аскорбиновая кислота, глутатион.
Окислительно–восстановительный эквивалент
Различают три типа окислительно–восстановительных реакций: межмолекулярные, внутримолекулярные и реакции самоокисления–самовосстановления.
A. Межмолекулярные – это такие реакции, в которых молекулы, атомы или ионы элементов, входящие в состав одного вещества и являющиеся окислителем, взаимодействуют с молекулами, ионами, атомами, входящих в состав другого вещества (восстановителя): например:
Mn+4O2 + 4HCl-1 = Mn2+Cl2 + Cl20 + 2H2O.
B. Во внутримолекулярных реакциях изменяется СО элементов одного и того же вещества таким образом, что одни из них окисляются, а другие — восстанавливаются. К таким реакциям относится, например, разложение бертолетовой соли и оксида ртути (II):
2KCl+5O3-2 = 2KCl-1 + 3O20;
C. В реакциях самоокисления–самовосстановления (диспропорционирования) атомы одного и того же вещества так взаимодействуют друг с другом, что одни отдают электроны (окисляются), а другие их присоединяют (восстанавливаются). Например, растворение хлора в воде:
Cl20 + H2O = HCl+1O + HCl-1 или
(Cl0Cl0 + H2O = HCl+1O + HCl-1).
В обиход химиков, изучающих рассматриваемые процессы, наряду с химическими эквивалентами вошли окислительный и восстановительный эквиваленты. Это частное от деления молярной массы вещества на число приобретаемых (или теряемых) электронов. Так, в реакции
5H2S + 2KMnO4 + 3H3SO4 = 5S + 2MnSO4 + K2SO4 + 8H2O
для KMnO4 окислительный эквивалент равен 158,15/5, а для сероводорода восстановительный эквивалент – половине его молярной массы.