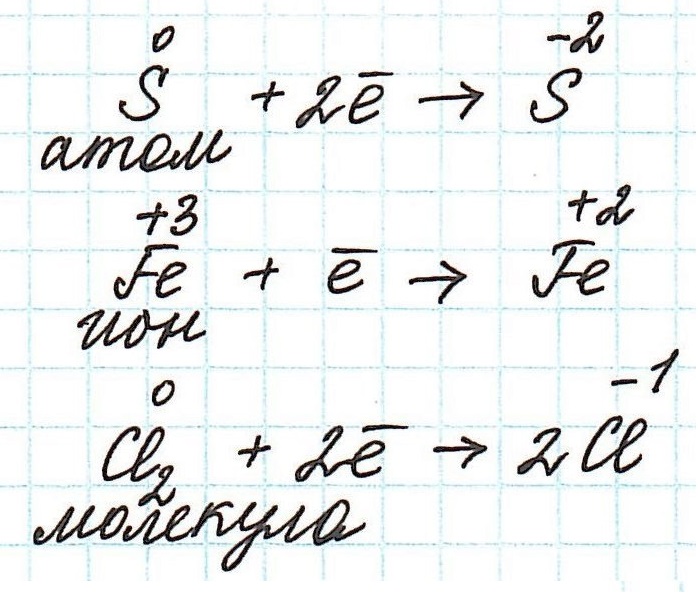Что такое восстановительная способность
ОКИСЛИТЕЛИ И ВОССТАНОВИТЕЛИ В ХИМИЧЕСКИХ РЕАКЦИЯХ
Окислители и восстановители в химии — интересный, но очень часто вызывающий затруднения, вопрос.
К примеру, превращение с помощью нитрифицирующих бактерий атмосферного азота в легко усваиваемую растениями форму, фотосинтез, дыхание живых организмов (от бактерий до высших растений и животных) — это ОВР в природе.
А вот выплавка стали, промышленное получение аммиака из азота и водорода, гальванические процессы, электролиз – эти и огромное количество других процессов являются примерами ОВР в технике.
Так что же такое окислительно-восстановительные реакции (процессы)?
Понятие окислительно-восстановительной реакции
Окислительно-восстановительные реакции (ОВР) – это процессы, в ходе которых изменяются степени окисления атомов химических элементов.
Окисление и восстановление сопровождают друг друга. Один процесс без другого просто не существует. Почему?
Изменение степени окисления всегда означает переход электронов от одних частиц к другим. То есть одни частицы отдают электроны в ходе химического или электрохимического взаимодействия, а другие частицы принимают. Здесь срабатывает закон сохранения материи.
Окислители, восстановители. Окисление, восстановление
Итак, окисление – это процесс, в ходе которого частица передает свои электроны другой частице. В качестве таких частиц могут выступать отдельные атомы или ионы, а также молекулы.
Переход электронов принято показывать с помощью полуреакций:
Как не сложно заметить из представленных полуреакций, окислительный процесс приводит к увеличению степени окисления.
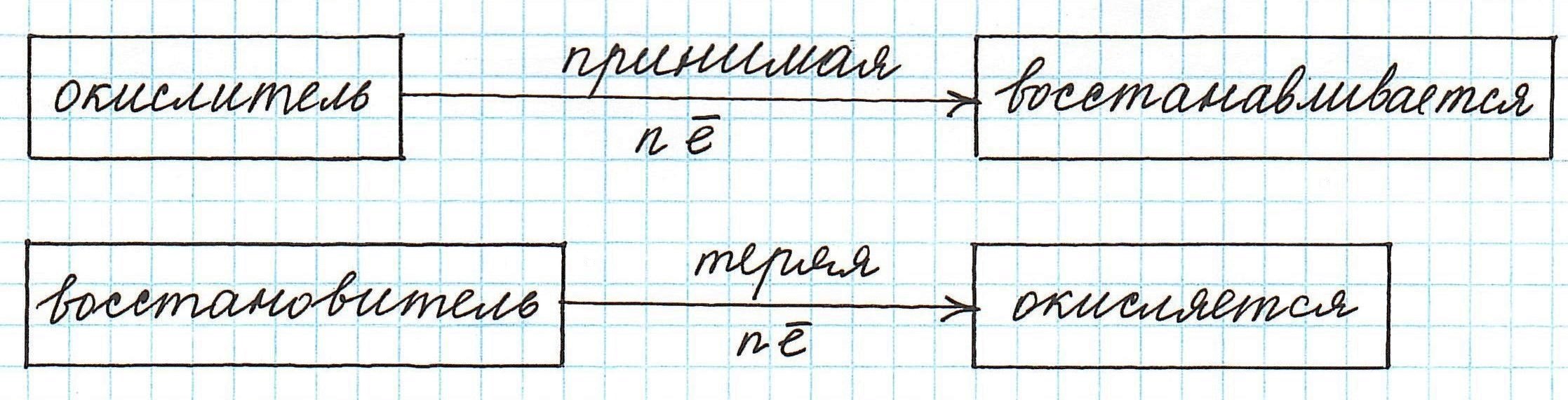
Частица, принимающая электроны, является окислителем.
Восстановление всегда сопровождается уменьшением степени окисления!
Способность к окислению и восстановлению: как определить
Существует несколько закономерностей, которые помогают определить наличие у частицы (атома, иона, молекулы) способности окисляться или восстанавливаться. Обратимся к периодической таблице химических элементов.
1) В периодах слева направо (т.е. с повышением порядкового номера элемента) восстановительные свойства простых веществ уменьшаются, а окислительные увеличиваются:
То есть в начале периода находятся явные восстановители, а в конце – окислители. Например, в III периоде активным восстановителем является натрий, а активным окислителем – хлор.
А причина данной закономерности кроется в строении атомов элементов.
У атомов элементов одного периода:
В связи с этим растет и сила притяжения электронов к ядру. В результате радиус атома уменьшается.
У элементов конца периода эта сила велика. Поэтому атомы очень трудно отдают свои электроны в химических взаимодействиях и легче принимают их от других атомов, стремясь завершить внешний энергетический уровень. Так проявляются их окислительные свойства.
Атомам элементов начала периода для завершения внешнего уровня до устойчивого 8-электронного состояния легче отдать свои немногочисленные электроны, проявив тем самым восстановительные свойства.
2) Элементы побочных подгрупп (это металлы четных рядов больших периодов) на внешнем уровне имеют 2 или 3 (реже 1 в случае «провала») электрона, поэтому легко могут их отдавать, являясь, таким образом, восстановителями:
3) Элементы одной главной подгруппы имеют одинаковое число электронов на внешнем энергетическом уровне (например, элементы VI группы – шесть электронов). Число же энергетических уровней увеличивается и, соответственно, радиусы атомов тоже увеличиваются. Это приводит к тому, что электроны внешних уровней удаляются от ядра и притяжение их к нему ослабевает.
Вот именно поэтому, восстановительная способность (способность отдавать электроны) у элементов главных подгрупп сверху вниз растет, а окислительная способность (способность принимать электроны) снижается:
Так, среди элементов главной подгруппы VI группы окислительная способность сильнее всего проявляется у кислорода, а теллур в некоторых взаимодействиях способен проявлять восстановительные свойства.
4) Определить, чем будет являться частица (или вещество, в состав которого она входит) в окислительно-восстановительном процессе, можно по значению степени окисления (с.о.).
Если атомы имеют самую наименьшую с.о., то проявят они восстановительные свойства. Если самую высокую – то окислительные. А если с.о. является промежуточной по значению, то проявят как те, так и другие свойства (в зависимости от конкретных условий химической реакции). Например:
Сильные или слабые окислители и восстановители: как определить
Часто говорят: сильный окислитель, слабый окислитель, сильный восстановитель, слабый восстановитель. А что это значит? И как определить эту самую силу?
Мерой окислительно-восстановительной способности вещества служит значение стандартного электродного потенциала: чем оно больше, тем и окислительные свойства проявляются сильнее.
Обратимся к таблице стандартных электродных потенциалов. В ней значения потенциалов расположены в порядке уменьшения:
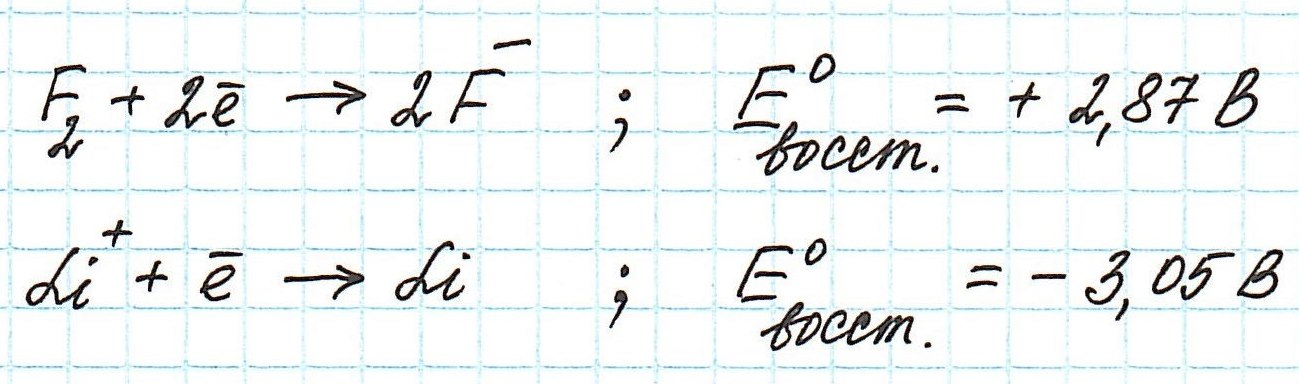
Окислительные потенциалы фтора и лития будут иметь противоположные значения.
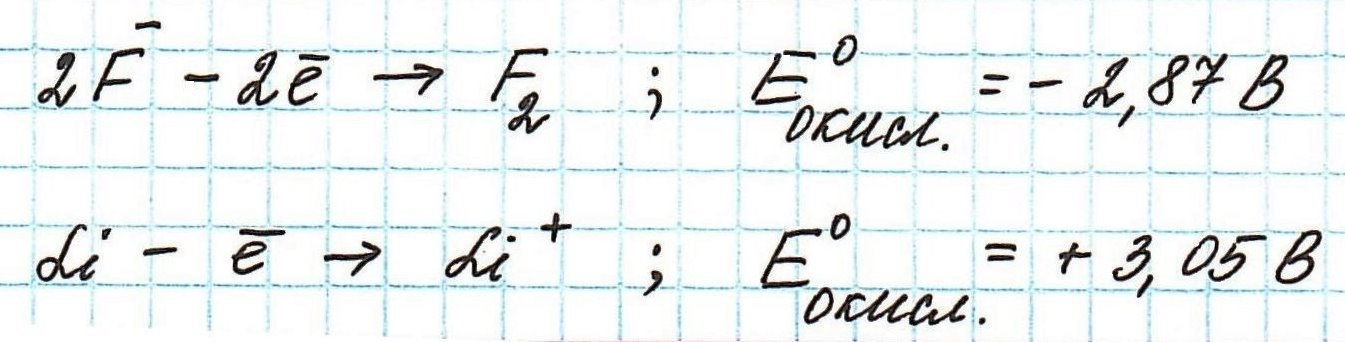
Пример . Используя таблицу стандартных электродных потенциалов, определите, какая из частиц проявляет более сильные окислительные свойства:
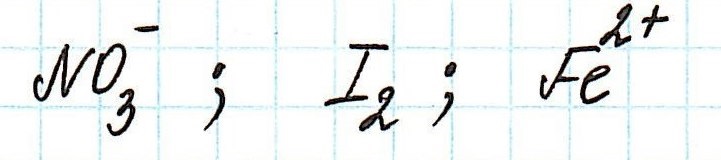
Наиболее сильным окислителем будет та частица, которая лучше всего восстанавливается, а, значит, имеет более высокий восстановительный электродный потенциал.
Сравним значения восстановительных потенциалов:
Таким образом, наиболее сильным окислителем из представленных является нитрат-ион.
Основные окислители и восстановители в химии
В технике применяется огромное количество окислителей и восстановителей с разной окислительной и восстановительной способностью.
Важнейшие из них представлены в таблице:
Итак, окисление и восстановление – два взаимосвязанных процесса. Они широко представлены в природе и играют огромную роль в промышленных производствах. Окислители и восстановители очень разнообразны. Чем будет являться частица (или вещество, в состав которого она входит): окислителем или восстановителем, – можно определить, используя некоторые закономерности.
Ряд активности металлов
Что же из себя представляет ряд активности металлов давайте разбираться. Металлы — группа химических элементов, обладающих сходными свойствами. Среди них — электропроводность, пластичность, температурная зависимость сопротивления. По виду металлы можно отличить по характерному блеску, который так и назвали — металлический. Но химические свойства элементов отличаются в зависимости от строения их молекул и кристаллической решетки. Особенно ярко отличия проявляются по отношению взаимодействия с кислотами и щелочами. Всего на данный момент насчитывается 96 металлов. Общие свойства металлов показаны в таблице:
Все металлы в той или иной степени являются восстановителями, то есть, отдают электроны при течении окислительно-восстановительных реакций. Таблица электроотрицательности металлов показывает, какой металл является наиболее активным восстановителем. Если цифра напротив элемента больше 2, то это окислитель с характерными свойствами и выходит из ряда металлов, проявляя типичные свойства неметалла.
Электрохимический ряд активности металлов показывает, какие из металлов более активные, какие менее. Расположение элементов в горизонтальном ряду слева направо показывает направление снижения восстановительной способности и возрастание окислительной.
Восстановительная способность — свойство отдавать электроны в химических реакциях с водными растворами солей и щелочей.
Окислительная способность — свойство присоединять электроны в реакциях с теми же веществами.
Металлы в правой стороне более слабые восстановители, они вытесняются при реакциях с солевыми растворами металлами, расположенными левее. Пример реакции — Zn + Cu 2+ → Zn 2+ + Cu, которая протекает только в одном направлении. Цинк вытесняет медь, реагируя с водным раствором любой соли меди. Цинковая пластинка, при этом, растворяется, а медная восстанавливается.
Такую последовательность элементов еще называют ряд напряженности металлов, или ряд Бекетова. На всех вариантах записи ряда можно заметить, что последовательность металлов разделена знаком водорода (гидрогена), который металлом никак не является. Это своеобразный маркер, показывающий, что стоящие левее металлы вытесняют водород из водных растворов кислот, не обладающих окислительными свойствами. Некоторые металлы, например, литий, кальций, барий и остальные, стоящи до алюминия, вытесняют водород и при реакции с водой.
2Al +3H2SO4 = Al2(SO4)3 + 3H2↑
Fe + 2HCl = FeCl2 + H2↑
Стоящие правее знака водорода металлы с кислотами-неокислителями не взаимодействуют при нормальных условиях.
Шкала активности металлов широко используется для практических целей, например, в гальванике. Если электроды сделаны из разных металлов, то разрушаться будет тот, который стоит левее. Чем больше промежуток между металлами в ряду, тем активнее проходит процесс коррозии.
Например, метод оцинковки позволяет защитить железо именно потому, что цинк находится левее железа в ряду активности. Пока он не разрушится, то ржавчина на железе не появится. При электролизе, расположенные за водородом металлы осаживаются на катоде, а самые активные, занимающее места до алюминия, выделить из солевых растворов в не получится при нормальных температуре и давлении.
Малоактивные металлы, так называемые переходные элементы с электроотрицательностью в пределах 1,5 – 2. Это:
К металлам средней активности относятся элементы с числом электроотрицательности от 1 до 1,5. В эту группу входят такие известные элементы, как магний, плутоний, неодим, кальций. Остальные элементы обладают высокой химической активностью. Лидирует в этом списке Франций, который практически не встречается в чистом виде. Из более известных можно назвать калий и натрий, которые приходится хранить в керосине, чтобы они не взаимодействовали с водой и воздухом. Если извлечь их из керосина, то металлы практически мгновенно сгорают.
Реакции кальция и натрия с водой при комнатной температуре выглядят так:
2Na + 2H2O = 2NaOH + H2↑
Сa + 2H2O = Сa(OH)2 + H2↑Стоящие в ряду электронапряжения металлов правее элементы тоже взаимодействуют с водой, но реакция протекает при более высокой температуре с образованием оксида и водорода.
3Fe + 4H2O = Fe3O4 + 4H2↑
Если вступает в реакцию металл и неметалл, то электрический ряд напряжений металлов тоже дает возможность заранее узнать, в каком направлении будет протекать реакция. Скорость реакции зависит как от восстановительной активности металла, так и от окислительных свойств неметалла. Стоящие до водорода металлы реагируют с кислородом уже при комнатной температуре, некоторые — достаточно бурно, например, литий и кальций.
4Li + O2 = 2Li2O
2Ca + O2 = 2CaO.
При таком взаимодействии образуются оксиды. Менее активные металлы, например железо, реагируют с кислородом спокойнее, а некоторые, например, золото и серебро, платина не окисляются вовсе, благодаря чему получили определение благородных.
С хлором реагируют практически все активные металлы с выделением теплоты.
2Fe + 3Cl2 = 2FeCl3
Также выделяется теплота при реакции активных металлов с серой, но начинается она при нагревании. После начала реакции нагрев не нужен — образовавшегося тепла достаточно для поддержания реакции.
2Al + 3S = Al2S3
Внимательно изучив ряд металлов, несложно определить тип реакции при контакте с другими элементами в зависимости от места в последовательности. Также легко назвать основные характеристики металла, как химического элемента, и возможность его использования на практике.