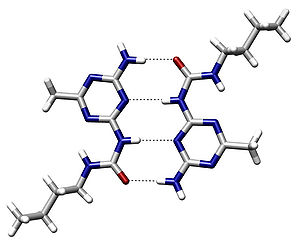
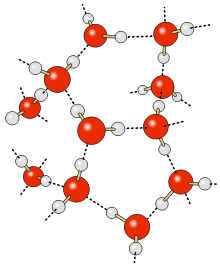
Что такое водородная связь
Водородная связь
Межмолекулярные взаимодействия
Ориентационные силы притяжения возникают между полярными молекулами (диполь-диполь взаимодействие). Эти силы возникают между полярными молекулами. Индукционные взаимодействия — это взаимодействие между полярной молекулой и неполярной. Неполярная молекула поляризуется из-за действия полярной, что и порождает дополнительное электростатическое притяжение.
Особый вид межмолекулярного взаимодействия — водородные связи.
Водородные связи — это межмолекулярные (или внутримолекулярные) химические связи, возникающие между молекулами, в которых есть сильно полярные ковалентные связи — H-F, H-O или H-N. Если в молекуле есть такие связи, то между молекулами будут возникать дополнительные силы притяжения.
Механизм образования водородной связи частично электростатический, а частично — донорно–акцепторный. При этом донором электронной пары выступают атом сильно электроотрицательного элемента (F, O, N), а акцептором — атомы водорода, соединенные с этими атомами. Для водородной связи характерны направленность в пространстве и насыщаемость.
Водородные связи возникают между следующими веществами:
Водородная связь оказывает влияние на физические и химические свойства веществ. Так, дополнительное притяжение между молекулами затрудняет кипение веществ. У веществ с водородными связями наблюдается аномальное повышение тепературы кипения.
Водородная связь
Водородная связь — форма ассоциации между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом. В качестве электроотрицательных атомов могут выступать N, O или F. Водородные связи могут быть межмолекулярными или внутримолекулярными. [1]
Содержание
Природа
Часто водородную связь рассматривают как электростатическое взаимодействие, усиленное небольшим размером водорода, которое разрешает близость взаимодействующих диполей. Тогда об этом говорят как о разновидности донорно-акцепторной связи, невалентном взаимодействии между атомом водорода H, ковалентно связанным с атомом A группы A-H молекулы RA-H и электроотрицательным атомом B другой молекулы (или функциональной группы той же молекулы) BR’. Результатом таких взаимодействий являются комплексы RA-H•••BR’ различной степени стабильности, в которых атом водорода выступает в роли «моста», связывающего фрагменты RA и BR’.
История
Свойства
Энергия водородной связи значительно меньше энергии обычной ковалентной связи (не превышает 40 кДж/моль). Однако этой энергии достаточно, чтобы вызвать ассоциацию молекул, то есть их объединение в димеры или полимеры. Именно ассоциация молекул служит причиной аномально высоких температур плавления и кипения таких веществ, как фтороводород, вода, аммиак.
Связь этого типа, хотя и слабее ионной и ковалентной связей, тем не менее играет очень важную роль во внутри- и межмолекулярных взаимодействиях. Водородные связи во многом обусловливают физические свойства воды и многих органических жидкостей (спирты, карбоновые кислоты, амиды карбоновых кислот, сложные эфиры).
Прочность водородной связи (энтальпия образования комплекса) зависит от полярности комплекса и колеблется от
6 кДж/моль для комплексов молекул галогеноводородов с инертными газами до 160 кДж/моль для ион-молекулярных комплексов (AHB) ± ; так, для комплекса (H2O•H•OH2) + образованного H2O и H3O + — 132 кДж/моль в газовой фазе.
В воде
Механизм Гротгуса
Аномально высокая теплоёмкость воды, а также теплопроводность многоатомных спиртов обеспечивается многочисленными водородными связями. Одна молекула воды может образовать до четырёх классических водородных связей с соседями (с учётом бифуркатных Н-связей до 5-6).
Водородные связи повышают температуру кипения, вязкость и поверхностное натяжение жидкостей. Водородные связи ответственны за многие другие уникальные свойства воды.
Водные кластеры
Согласно современным представлениям, наличие водородных связей между молекулами воды приводит к возникновению так называемых водных кластеров или комплексов. Простейшим примером такого кластера может служить димер воды:
В нуклеиновых кислотах и белках
Водородная связь в значительной мере определяет свойства и таких биологически важных веществ, как белки и нуклеиновые кислоты. В частности, элементы вторичной структуры (например, α-спирали, β-складки) и третичной структуры в молекулах белков, РНК и ДНК стабилизированы водородными связями. В этих макромолекулах, водородные связи сцепляют части той же самой макромолекулы, заставляя её сворачиваться в определенную форму. Например, двойная спиральная структура ДНК, определяется в значительной степени наличием водородных связей, сцепляющих пары нуклеотидов, которые связывают одну комплементарную нить с другой.
В полимерах
Много полимеров усилены водородными связями в их главных цепях. Среди синтетических полимеров самый известный пример — нейлон, где водородные связи играют главную роль в кристаллизации материала. Водородные связи также важны в структуре полученных искусственно полимеров (например, целлюлозы) и в многих различных формах в природе, таких как древесина, хлопок и лён.
См. также
Примечания
Литература
Полезное
Смотреть что такое «Водородная связь» в других словарях:
ВОДОРОДНАЯ СВЯЗЬ — ВОДОРОДНАЯ СВЯЗЬ, ХИМИЧЕСКАЯ связь, образующаяся между некоторыми молекулами, содержащими водород. Атом водорода должен быть связан с электроотрицательным (отталкивающим электроны) атомом; связь возникает между положительным зарядом атома… … Научно-технический энциклопедический словарь
ВОДОРОДНАЯ СВЯЗЬ — тип связи, промежуточный между ковалентной химической связью и невалентным межат. вз ствием и осуществляющийся с участием атома водорода, расположенного либо между молекулами, либо между атомами внутри молекулы. Примером межмолекулярной В. с. явл … Физическая энциклопедия
ВОДОРОДНАЯ СВЯЗЬ — вид химической связи типа А Н. А ; образуется в результате взаимодействия атома водорода, связанного ковалентной связью с электроотрицательным атомом А (N, O, S и др.), и неподеленной парой электронов другого атома А (обычно O, N). Атомы А и А… … Большой Энциклопедический словарь
водородная связь — – особый вид трехцентровой химической связи X H. Y, в которой центральный атом водорода, соединенный ковалентной связью с электроотрицательным атомом X (C, N, O, S) образует дополнительную связь с атомом Y (N, O, S), имеющим направленную вдоль… … Химические термины
водородная связь — — [http://www.dunwoodypress.com/148/PDF/Biotech Eng Rus.pdf] Тематики биотехнологии EN hydrogen bond … Справочник технического переводчика
водородная связь — Термин водородная связь Термин на английском hydrogen bond Синонимы Аббревиатуры H bond Связанные термины клатрат, когезия, протеомика, супрамолекулярная химия, нанодиапазон, межмолекулярное взаимодействие Определение притяжение между ковалентно… … Энциклопедический словарь нанотехнологий
водородная связь — вид химической связи типа А Н. А ; образуется в результате взаимодействия атома водорода, связанного ковалентной связью с электроотрицательным атомом A (N, O, S и др.), и неподелённой парой электронов другого атома А (обычно О, N). Атомы А и А… … Энциклопедический словарь
Водородная связь — вид химического взаимодействия атомов в молекулах, отличающийся тем, что существенное участие в нём принимает атом водорода (Н), уже связанный ковалентной связью с другим атомом (А). Группа А Н выступает донором протона (акцептором… … Большая советская энциклопедия
ВОДОРОДНАЯ СВЯЗЬ — невалентное взаимод. между группой АН одной молекулы (RAH) и атомом В другой (BR ). В результате этого взаимод. образуется устойчивый комплекс RAH. BR с межмолекулярной B.C., в к ром атом водорода играет роль мостика, соединяющего фрагменты RA и … Химическая энциклопедия
водородная связь — hydrogen bond водородная связь. Cлабое электростатическое взаимодействие между атомами водорода, связанными с атомами кислорода либо азота; В.с. слабее ковалентной связи; В.с. играет важную роль в образовании структур высшего порядка у… … Молекулярная биология и генетика. Толковый словарь.
Водородная связь
Водородная связь весьма распространена и играет важную роль в биологических объектах. Рассмотрим ее образование подробнее.
Образование водородной связи
При возникновении подходящих условий водородная связь возникает самопроизвольно.
Какие же условия приводят к возникновению водородной связи?
Можно предположить, что в любом ряду веществ с молекулами одинаковой формы и полярности температуры плавления и кипения должны повышаться прямо пропорционально возрастанию молекулярной массы, однако существуют некоторые несоответствия.
На следующем рисунке приведены кривые зависимости температуры кипения гидридов элементов 6 группы от молекулярной массы.
Так, для гидридов элементов 6 группы наблюдается последовательное увеличение температур кипения и плавления с увеличением молекулярной массы (номера периода), но из этой закономерности выпадает вода.
В 5 группе аномально высокие температуры кипения и плавления наблюдаются у аммиака NH3, а в 7 группе – у HF, по сравнению с гидридами элементов соответствующих групп.
Почему вода, аммиак и фтороводород имеют аномально высокие температуры кипения и плавления?
Это связано с присутствием в воде, аммиаке и фтороводороде водородных связей.
Водородная связь — это внутри- или межмолекулярная связь, которая образуется с соединениях между атомами водорода и атомами, имеющими большую электроотрицательность (N, O, F).
Механизм образования водородной связи, вследствие электростатического притяжения атомов — электростатический. Но частично он также носит донорно–акцепторный характер.
Образуемые соединения имеют большую полярность, возникает диполь. Атом водорода находится на положительном конце диполя. Этот диполь может взаимодействовать с неподеленной электронной парой кислорода (и азота, и фтора), который принадлежит другой или этой же молекуле. Таким образом, донором электронной пары являются атомы F, O или N, а акцептором — атомы водорода.
Графически, на рисунках, водородная связь обозначается тремя точками:
Виды водородной связи
Характеристика водородной связи
Водородная связь характеризуется
N-H···Y ˂ O-H···Y ˂ F-H···Y
Т.е., связь тем прочнее, чем меньше размер атома с неподеленными парами — N, O, F и больше его электроотрицательность. Среди них более прочную водородную связь образует тот, неподеленная электронная пара которого менее сильно притягивается к своему ядру.
Водородная связь.
Водородная связь – связь между положительно заряженным атомом водорода одной молекулы и отрицательно заряженным атомом другой молекулы.
Механизм возникновения водородной связи – частично электростатический и частично донорно-акцепторный.
Характерной чертой водородной связи является расстояние между атомом водорода и другим атомом, её образующим. Оно должно быть меньше, чем сумма радиусов этих атомов.
Водородная связь подразделяется:
1. Межмолекулярная водородная связь образуется между молекулами веществ, в состав которых входят водород и сильно электроотрицательный элемент – фтор, кислород, азот, хлор, сера. Сильно смещенная общая электронная пара от водорода к атому отрицательно заряженного элемента, при этом положительный заряд водорода сконцентрирован в малом объеме, приводит взаимодействие протона с неподеленной электронной парой другого атома или иона, обобществляя её.
Водородную связь обозначают точками, указывая, что она намного слабее ковалентной связи (примерно в 15-20 раз).
Межмолекулярная водородная связь: две молекулы воды и две молекулы уксусной кислоты с образованием циклической структуры
2. Внутримолекулярная водородная связь присутствует в многоатомных спиртах, углеводах, белках и других органических веществах.
Молекула салициловой кислоты.
Вещества с водородной связь имеют молекулярные кристаллические решетки, в узлах которой находятся молекулы.
Примеры: вода в виде льда, йод, хлор, бром, «сухой лёд» (твердый диоксид углерода), твёрдый аммиак, а также твёрдые органические вещества (метан, бензол, фенол, нафталин, белки и т.д.).
Физические свойства веществ с водородной связью.
Водородная связь обеспечивает низкомолекулярным веществам способность быть при обычных условиях в жидком агрегатном состоянии (этанол, метанол, вода) или сжижающимися газами (аммиак, фтороводород).
Более высокая температура кипения воды (100 о С) по сравнению с водородными соединениями элементов подгруппы кислорода (Н2S, Н2Sе, Н2Те), так как затрачивается дополнительная энергия на разрушение водородных связей.
Также при плавлении воды её плотность возрастает. Это объясняется тем, что в структуре льда каждый атом кислорода связан через атомы водорода с четырьмя другими атомами кислорода других молекул воды. В результате образуется рыхлая «ажурная» структура.